瑞华麦523 PPO活性及1BL/1RS易位相关基因的分子检测
王歆,金彦刚,夏中华,钱禄巧,郑甲成


摘要:【目的】了解小麦品种瑞华麦523及其亲本郑麦9023和烟1604的PPO和1BL/1RS易位相关基因的遗传信息,旨在提高优质小麦品种选育的效率。【方法】利用小麦PPO活性基因的分子标记PPO18、PP0-B5、PPO16和PPO29及1BL/1RS易位的分子标记H20,检测小麦品种瑞华麦523及其亲本相关基因的等位变异及来源。【结果】小麦品种瑞华麦523在2AL染色体上PPO等位基因为PPO-A1a基因型,与亲本郑麦9023一样,为高活性PPO,不含亲本烟1604的低活性PPO;在2BL染色体上PPO等位基因为A型,与亲本一致,是高活性PPO;在2DL染色体上PPO等位基因为PPO-D1b基因型,与亲本郑麦9023一样,是一个高活性PPO,不含亲本烟1604的低活性PPO;利用分子标记H20检测表明,瑞华麦523和亲本郑麦9023一样,是一个非1BL/1RS易位系。【结论】瑞华麦523是一个具有高活性PPO、非1BL/1RS易位系的小麦品种,其小麦PPO和1BL/1RS易位相关基因主要来自母本郑麦9023,为该品种的推广应用和培育优质小麦新品种提供理论参考。
关键词: 瑞华麦523;多酚氧化酶;易位系;分子标记
中图分类号: S512.1 文獻标志码: A 文章编号:2095-1191(2021)09-2369-06
Molecular detection of PPO activity and 1BL/1RS translocation related genes in wheat cultivar Ruihuamai 523
WANG Xin1, JIN Yan-gang1,2, XIA Zhong-hua2, QIAN Lu-qiao1, ZHENG Jia-cheng1
(1College of Agronomy, Anhui Science and Technology University,Fengyang, Anhui 233100, China; 2Jiangsu Ruihua Agricultural Technology Co., Ltd./Engineering & Technology Research Center for Wheat Commercial
Improvement in Jiangsu, Suqian, Jiangsu 223800, China)
Abstract:【Objective】To understand the genetic information of PPO and 1BL/1RS translocation related genes of wheat cultivars Ruihuamai 523 and its parents Zhengmai 9023 and Yan 1604 for the efficiency of high quality wheat breeding. 【Method】The allelic variation and origin of the wheat cultivar Ruihuamai 523 and its parent-related genes were detected using the molecular markers PPO18, PP0-B5, PPO16 and PPO29 and 1BL/1RS translocations of wheat PPO activity gene. 【Result】The PPO allele of wheat Ruihuamai 523 on chromosome 2AL was the PPO-A1a genotype, like the parent Zhengmai 9023. It was a highly active PPO, lowactive PPO without parent Yan 1604. The PPO allele on chromosome 2BL chromosome was type A, consistent with both parents. It was a highly active PPO. The PPO allele on chromosome 2DL was the PPO-D1b genotype, like the parent Zhengmai 9023, it was a highly active PPO, lowactive PPO without pa-rent Yan 1604. Using the molecular marker H20 detection indicated that, Ruihuamai 523 was the same as the parent Zhengmai 9023, it was a non-1BL/1RS translocation line. 【Conclusion】The wheat cultivar Ruihuamai 523 is a non 1B/1R translocation line with high activity of PPO.Its genes associated with PPO and 1BL/1RS translocation are mainly derived from female Zhengmai 9023. It provides some references for the variety application and the cultivation of new high quality wheat varieties.
Key words: Ruihuamai 523; polyphenoloxidase; translocation line; molecular marker
Foundation item: National Key Research and Development Program of China(2017YFD0100702);Major New Variety Creation Project of Agriculture in Jiangsu (PZCZ201706);Jiangsu Project for Transformation of Scientific and Technological Achievements(BA2017138)
0 引言
【研究意义】小麦多酚氧化酶(Polyphenol oxidase,PPO)活性受多基因控制,其影响小麦品质等性状。随着小麦基因组学的深入研究和分子生物学技术的应用,小麦品质性状相关基因的定位、克隆及分子标记开发,为利用分子育种技术培育农作物新品种产生了一种重要的育种策略(何中虎等,2006;万建民,2006;薛勇彪等,2007),因此,从分子水平上分析小麦品质相关基因及遗传机制,可为小麦遗传育种和品种改良提供理论依据。【前人研究进展】国内外相关研究表明,小麥籽粒或面粉的多酚氧化酶活性、小麦—黑麦易位系1BL/1RS与小麦加工品质密切相关(马红勃等,2015;高华利等,2016)。小麦籽粒或面粉的多酚氧化酶活性与面制品颜色相关,多酚氧化酶活性在不同小麦品种间存在较大差异(杨子博等,2016),控制小麦多酚氧化酶活性的主效基因位于小麦第2同源染色体上,其相关基因被定位并开发相应的分子标记:在2A染色体长臂上的分子标记PPO18能检测出控制高、低多酚氧化酶活性的等位基因PPO-A1a和PPO-A1b(Sun et al.,2005);在2B染色体长臂上的分子标记PPO-B5能精确区分不同多酚氧化酶活性的小麦品种(祝梓博,2017);在2D染色体长臂上的分子标记PPO16和PPO29分别与较低或较高多酚氧化酶活性相关,其对应等位基因分别是PPO-D1a和PPO-D1b(He et al.,2007)。1BL/1RS小麦—黑麦易位系携带抗锈病、白粉病等基因,在抗病性及产量等方面有一定的优势(周阳等,2004)。目前,检测小麦品种1BL/1RS易位系的方法较多,其中PCR方法具有简单、快速的特点(王晓军等,2008;张勇等,2012)。瑞华麦523是江苏瑞华农业科技有限公司用母本郑麦9023和父本烟1604杂交,连续定向系统选择育成的小麦新品种,2014和2017年分别通过江苏省和国家审定,该品种属弱春性中熟小麦品种,产量潜力和综合性状良好,适宜在黄淮海麦区南部冬麦区中、晚茬种植(金彦刚等,2019)。【本研究切入点】有关小麦品种瑞华麦523的选育、品种特性和栽培措施研究报道较多,但与其品质性状相关基因及遗传分析不多。【拟解决的关键问题】对小麦品种瑞华麦523及其亲本郑麦9023和烟1604的多酚氧化酶、1BL/1RS易位系等品质性状基因进行分子检测和分析,明确相关基因在小麦品种瑞华麦523中的分布状况,为小麦品种改良和亲本选择提供理论依据。
1 材料与方法
1. 1 试验材料
供试的小麦品种为瑞华麦523及其亲本郑麦9023和烟1604,由江苏瑞华农业科技有限公司提供,种植于江苏瑞华农业科技有限公司淮北基地江苏省宿迁市塘湖农场,常规管理,幼苗期间采取其叶片。
1. 2 基因组DNA提取
在田间采取小麦幼嫩的叶片,按Murray和Thompson(1980)的CTAB法提取小麦基因组总DNA,利用1%的琼脂糖凝胶电泳检测DNA含量,并稀释最终浓度50 ng/μL备用,试验材料重复2次确保试验结果的准确性。
1. 3 品质性状相关基因特异性分子标记及检测
按照Sun等(2005)、祝梓博(2017)和He等(2007)开发的特异性分子标记PPO18、PP0-B5、PPO16和PPO29,检测小麦品种瑞华麦523及其亲本在2A、2B和2D染色体上PPO活性的等位变异。利用Liu等(2008)开发的分子标记H20检测小麦1BL/1RS易位系,其相关引物序列由生工生物工程(上海)有限公司合成,引物信息见表1。15 μL PCR反应体系:小麦基因组50 ng/μL DNA 2.0 μL,10 μmol/L上、下游引物各0.5 μL,1×PCR Mix(上海近岸蛋白质科技有限公司)12 μL(含Taq酶、dNTPs、MgCl2、反应缓冲液),在EDC-810基因扩增仪(东胜国际贸易有限公司)上扩增。
PPO18扩增程序:95 ℃预变性4 min;94 ℃变性40 s,65 ℃退火40 s,72 ℃延伸1 min,37个循环;72 ℃延伸10 min。PPO-B5扩增程序:95 ℃预变性3 min;95 ℃变性45 s,57 ℃退火40 s,72 ℃延伸45 s,35个循环;72 ℃延伸10 min。PPO16扩增程序:95 ℃预变性4 min;94 ℃变性1 min,退火温度由68 ℃开始,其后每个循环降低0.3 ℃,退火1 min,72 ℃延伸45 s,40个循环;72 ℃延伸10 min。PPO29扩增程序:95 ℃预变性4 min;94 ℃变性1 min,65 ℃退火1 min,72 ℃延伸2 min,38个循环;72 ℃延伸10 min。H20扩增程序:94 ℃预变性5 min;94 ℃变性1 min ,64 ℃退火1 min,72 ℃延伸2 min,25个循环;72 ℃延伸10 min。
PCR扩增产物用1.2%琼脂糖凝胶(含0.1%的4S Green核酸染色剂)电泳分离检测,缓冲液为0.5×TBE溶液,120 V电压电泳50 min,在凝胶成像仪下观察、拍照、保存、记录,试验重复2次。
2 结果与分析
2. 1 瑞华麦523 PPO-2A位点等位变异
利用分子标记PPO18对小麦品种瑞华麦523及亲本郑麦9023和烟1604在PPO-2A位点进行检测,产生了2种大小不同的带型,即685 bp和876 bp带(图1)。瑞华麦523和亲本郑麦9023在PPO-A1a等位变异类型中可扩增出685 bp带,表明其含有较高的PPO活性;而亲本烟1604在PPO-A1b等位变异类型中可扩增出876 bp带,表明其含有较低的PPO活性。初步表明瑞华麦523在PPO-2A位点上的PPO活性,与亲本郑麦9023一样,基因型为PPO-A1a,是一个高活性PPO位点,而亲本烟1604中的低活性多酚氧化酶特征带在瑞华麦523中没有检测到。
2. 2 瑞华麦523 PPO-2B位点等位变异
分子标记PPO-B5在PPO-2B位点上可产生450 bp、230 bp和190 bp 3种带型,其中,含有450 bp、230 bp和190 bp带的为A型,含有450 bp和230 bp带的为B型含有230 bp和190 bp带的为C型,只含有190 bp带的为D型,A型和C型为高PPO,B型和D型为低PPO(祝梓博,2017)。本研究中利用分子标记PPO-B5对小麦品种瑞华麦523及其亲本郑麦9023和烟1604在PPO-2B位点进行检测,均产生450 bp、230 bp和190 bp 3种带型,是A型带(图2),初步表明瑞华麦523与亲本郑麦9023和烟1604在PPO-2B位点上基因型均为A型。可见,瑞华麦523在PPO-2B位点上的PPO活性,与亲本郑麦9023和烟1604一样,均含有较高活性PPO等位基因。
2. 3 瑞华麦523 PPO-2D位点等位变异
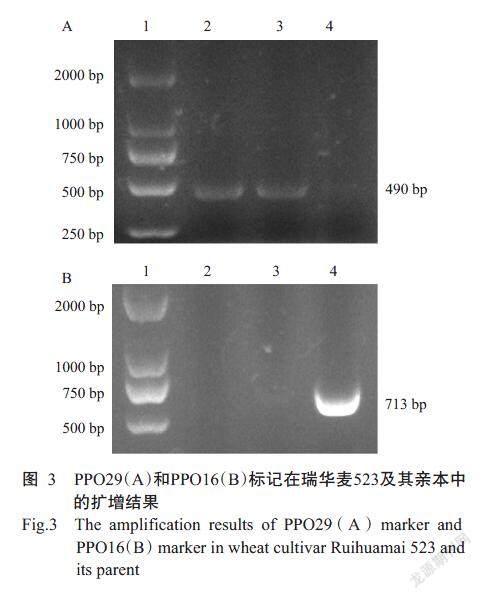
利用分子标记PPO16和PPO29对小麦品种瑞华麦523及其亲本郑麦9023和烟1604在PPO-2D位点进行检测,产生了2种不同的带型PPO-D1a和PPO-D1b。瑞华麦523和亲本郑麦9023能在PPOD1b位点扩增出490 bp带(图3-A),表明其含有较高的PPO活性;亲本烟1604在PPO-D1a位点扩增出713 bp带(图3-B),表明其含有较低的PPO活性。初步表明瑞华麦523在PPO-2D位点上的PPO活性,与亲本郑麦9023一样,具有高活性PPO,而亲本烟1604中的低活性PPO特征带在瑞华麦523没有检测到。
2. 4 瑞华麦523 1BL/1RS易位系的检测
利用与1BL/1RS易位系紧密连锁的分子标记H20,在含有1BL/1RS易位系的小麦品种中能扩增出1598 bp带,反之则无(Liu et al.,2008)。本研究中用分子标记H20对瑞华麦523及亲本郑麦9023和烟1604小麦品种进行1BL/1RS易位系的检测,扩增结果(图4)显示,亲本烟1604能扩增出1598 bp带,表明亲本烟1604是1BL/1RS易位系;而瑞华麦523和亲本郑麦9023中无相应的扩增条带,说明瑞华麦523与亲本郑麦9023一样,不携带1BL/1RS易位系,也表明亲本烟1604所携带的1BL/1RS易位系没有遗传给小麦品种瑞华麦523,初步表明瑞华麦523是一个非1BL/1RS易位系。
3 讨论
本研究利用相关分子标记对小麦品种瑞华麦523在小麦第2同源连锁群的PPO变异位点进行分子检测与分析,结果表明,瑞华麦523是一个具有较高PPO活性的小麦品种,其高活性PPO主要来自亲本郑麦9023小麦品种。小麦是面制品的主要原料,小麦籽粒中的PPO影响面制品色泽,利用控制小麦的PPO活性的相关分子标记PPO16、PPO18和PPO29可辅助选择低PPO活性的小麦品种(晏权等,2020)。杨子博等(2016)利用有关标记对黄淮麦区254份小麦品种中PPO-2A和PPO-2D位点的等位变异检测,筛选出低PPO活性组合PPO-A1b和PPO-D1a组合;王黎明等(2017)利用相关功能标记,分析379份来自7个不同生态麦区的小麦种质PPO活性基因等位变异的差异与分布状况;在小麦第2同源连锁群上也定位、克隆多酚氧化酶的有关基因,相应分子标记可有效地区分小麦品种多酚氧化酶活性的高低(祝梓博,2017)。因此,利用PPO18、PPO16与PPO29等分子标记能快速鉴定小麦种质中PPO活性的高低,本研究将这些分子标记综合利用检测瑞华麦523及其亲本PPO活性,研究结果与前人基本一致。随着现代分子遗传学、基因组学技术成果及研究理论在植物育种学中的应用,产生了分子育种技术(王红梅等,2020)。目前,以转基因育种、分子标记辅助育种和基因编辑技术等为代表的作物分子育种技术已成为作物遗传改良的重要手段(黎裕等,2010),利用小麦分子育种技术能快速地鉴定和分析小麦种质资源的重要基因。
本研究利用与小麦1BL/1RS易位基因相关分子标记,检测瑞华麦523及其亲本郑麦9023和烟1604,结果表明瑞华麦523是一个非1BL/1RS易位系小麦品种。国内相关研究表明,小麦1BL/1RS易位系因携带抗小麦叶锈病、秆锈病、条锈病和白粉病等基因,其作为重要的小麦资源已被广泛利用(董冬等,2011)。在1BL/1RS易位系中,醇溶蛋白和麦谷蛋白被黑麦碱蛋白所替代。与醇溶蛋白和麦谷蛋白相比,黑麦碱蛋白含有更多的谷氨酰胺,使得面粉形成较少的网状结构,面筋强度下降,最后导致面包的加工品质降低和食用品质下降(马小乐等,2015);董冬等(2011)研究表明,來自同一遗传背景下小麦1BL/1RS品系的平均产量显著低于非1BL/1RS品系,说明小麦1BL/1RS对产量没有显著的正向作用,同时,因易位系1R短臂上的相关抗病基因已丧失抗性,因此,小麦1BL/1RS易位系在特定的遗传背景和生态条件下已不具备可继续利用的价值。也有研究表明,在黄淮海麦区,非1BL/1RS易位系小麦品种(系)占55%以上,强筋小麦品种绝大多数为非1BL/1RS易位系,推广面积较大的郑麦9023是一个非1BL/1RS易位系的强筋小麦(王晓军等,2008)。本研究结果表明瑞华麦523与郑麦9023一样,是一个非1BL/1RS易位系,因此,利用小麦1BL/1RS易位基因相关分子标记能准确地区分小麦1BL/1RS易位系,提高优质抗病小麦新品种选育的效果。
4 结论
利用相关分子标记检测瑞华麦523及其亲本郑麦9023和烟1604中小麦PPO活性基因和1BL/1RS易位基因的遗传信息,瑞华麦523是一个具有高活性PPO、非1BL/1RS易位系的小麦品种,其小麦PPO和1BL/1RS易位相关基因主要来自母本郑麦9023。
参考文献:
董冬,韦胜利,徐云峰,李洪杰,周阳. 2011. 1BL/1RS易位染色体在小麦育种中的应用效果分析[J]. 作物杂志,(4):109-112. [Dong D,Wei S L,Xu Y F,Li H J,Zhou Y. 2011. Study on effects of 1BL/1RS on wheat breeding[J]. Crops,(4):109-112.] doi:10.16035/j.issn.1001-7283.2011. 04.032.
高华利,王黎明,柴军琳,董普辉,王春平,李兴锋. 2016. 小麦籽粒品质性状基因功能标记的开发及应用[J]. 中国粮油学报,31(8):152-157. [Gao H L,Wang L M,Chai J L,Dong P H,Wang C P,Li X F. 2016. Development and application of functional markers linked to wheat grain quality traits genes[J]. Journal of the Chinese Cereals and Oils Association,31(8):152-157.] doi:10.3969/j.issn.1003- 0174.2016.08.028.
何中虎,晏月明,庄巧生,张艳,夏先春,张勇,王德森,夏兰芹,胡英考,蔡民华,陈新民,闫俊,周阳. 2006. 中国小麦品种品质评价体系建立与分子改良技术研究[J]. 中国农业科学,39(6):1091-1101. [He Z H,Yan Y M,Zhuang Q S,Zhang Y,Xia X C,Zhang Y,Wang D S,Xia L Q,Hu Y K,Cai M H,Chen X M,Yan J,Zhou Y. 2006. Establishment of quality evaluation system and utilization of molecular methods for the improvement of Chinese wheat quality[J]. Scientia Agricultura Sinica,39(6):1091-1101.] doi:10.3321/j.issn:0578-1752.2006.06. 002.
金彦刚,王歆,夏中华,杨永乐,任仰涛,常东伟. 2019. 高产抗病小麦品种瑞华麦523产量形成分析[J]. 种子,38(10):132-135. [Jin Y G,Wang X,Xia Z H,Yang Y L,Ren Y T,Chang D W. 2019. Yield formation analysis of high yield and disease resistant wheat variety “Ruihuamai523”[J]. Seed,38(10):132-135.] doi:10.16590/j.cnki.1001-4705.2019.10.132.
黎裕,王建康,邱麗娟,马有志,李新海,万建民. 2010. 中国作物分子育种现状与发展前景[J]. 作物学报,36(9):1425-1430. [Li Y,Wang J K,Qiu L J,Ma Y Z,Li X H,Wan J M. 2010. Crop molecular breeding in China: Current status and perspectives[J]. Acta Agronomica Sinica,36(9):1425-1430.] doi:10.3724/SP.J.1006.2010.01425.
马红勃,刘东涛,冯国华,陈荣振,张会云,王静,贾辉辉. 2015. 部分小麦品种(系)品质相关基因的分子检测[J].麦类作物学报,35(6):768-776. [Ma H B,Liu D T,Feng G H,Chen R Z,Zhang H Y,Wang J,Jia H H. 2015. Identification of major quality genes in some wheat cultivars from Yellow and Huai River Valley wheat region[J]. Journal of Triticeae Crops,35(6):768-776.] doi:10.7606/j.issn.1009-1041.2015.06.06.
马小乐,李葆春,孟亚雄,杨轲,师桂英,王化俊,尚勋武. 2015. 甘肃小麦品种1BL/1RS易位系鉴定及面筋熟制特性分析[J]. 农业生物技术学报,23(6):747-754. [Ma X L,Li B C,Meng Y X,Yang K,Shi G Y,Wang H J,Shang X W. 2015. Identification of 1BL/1RS translocation lines and analysis of gluten cooking features of wheat(Triticum aestivum) germplasms in Gansu Province[J]. Journal of Agricultural Biotechnology,23(6):747-754.] doi:10.3969/j.issn.1674-7968.2015.06.006.
万建民. 2006. 作物分子设计育种[J]. 作物学报,32(3):455-462. [Wan J M. 2006. Perspectives of molecular design breeding in crops[J]. Acta Agronomica Sinica,32(3):455-462.] doi:10.3321/j.issn:0496-3490.2006.03.023.
王红梅,陈玉梁,石有太,李静雯,王立光. 2020. 中国作物分子育种现状与展望[J]. 分子植物育种,18(2):507-513. [Wang H M,Chen Y L,Shi Y T,Li J W,Wang L G. 2020. The current status and expectation of crop molecular breeding in China[J]. Molecular Plant Breeding,18(2):507-513.] doi:10.13271/j.mpb.018.000507.
王黎明,高华利,李永霞,董普辉,王春平,李兴锋. 2017. 小麦PPO活性基因等位变异的区域分布研究[J]. 西北植物学报,37(12):2370-2377. [Wang L M,Gao H L,Li Y X,Dong P H,Wang C P,Li X F. 2017. Geographic distribution of allelic variation of Polyphenol oxidase(PPO) gene in wheat cultivars from different ecological regions[J]. Acta Botanica Boreali-Occidentalia Sinica,37(12):2370-2377.] doi:10.7606/j.issn.1000-4025.2017.12.2370.
王晓军,冯国华,刘东涛,王静,张会云,赵军海,陈荣振. 2008. 黄淮麦区部分小麦品种(系)1BL/1RS易位的分子检测[J]. 麦类作物学报,(3):381-386. [Wang X J,Feng G H,Liu D T,Wang J,Zhang H Y,Zhao J H,Chen R Z. 2008. Molecular detection of 1BL/1RS translocation in partial wheat cultivars(lines) from Huang-Huai wheat region of China[J]. Journal of Triticeae Crops,(3):381-386.] doi:10.7606/j.issn.1009-1041.2008.03.090.
薛勇彪,王道文,段子渊. 2007. 分子设计育种研究进展[J]. 中国科学院院刊,22(6):486-490. [Xue Y B,Wang D W,Duan Z Y. 2007. Progress of research on crop breeding with molecular design[J]. Bulletin of Chinese Academy of Sciences,22(6):486-490.] doi:10.16418/j.issn. 1000-3045.2007.06.006.
晏權,任明见,李振华,徐如宏. 2020. 贵州小麦品种(系)籽粒低PPO活性种质资源筛选[J]. 南方农业学报,51(3):512-519. [Yan Q,Ren M J,Li Z H,Xu R H. 2020. Screening of the low PPO activity germplasm resources in seeds of wheat variety(line) in Guizhou[J]. Journal of Southern Agriculture,51(3):512-519.] doi:10.3969/j.issn.2095-1191.2020.03.004.
杨子博,顾正中,周羊梅,王安邦,罗伯祥,沈业松. 2016. 黄淮麦区小麦品种PPO活性基因等位变异的检测及分布[J]. 扬州大学学报(农业与生命科学版),37(3):95-100. [Yang Z B,Gu Z Z,Zhou Y M,Wang A B,Luo B X,Shen Y S. 2016. Molecular detection and distribution of polyphenol oxidase genes in wheat cultivars from Yellow-Huai valley wheat region[J]. Journal of Yangzhou University(Agricultural and Life Science Edition),37(3):95-100.] doi:10.16872/j.cnki.1671-4652.2016.03.017.
张勇,申小勇,张文祥,陈新民,阎俊,张艳,王德森,王忠伟,刘悦芳,田宇兵,夏先春,何中虎. 2012. 高分子量谷蛋白5+10亚基和1B/1R易位分子标记辅助选择在小麦品质育种中的应用[J]. 作物学报,38(10):1743-1751. [Zhang Y,Shen X Y,Zhang W X,Chen X M,Yan J,Zhang Y,Wang D S,Wang Z W,Liu Y F,Tian Y B,Xia X C,He Z H. 2012. Marker-assisted selection of HMW-Glutenin 1Dx5+1Dy10 gene and 1B/1R translocation for improving industry quality in common wheat[J]. Acta Agronomica Sinica,38(10):1743-1751.] doi:10.3724/SP.J.1006.2012. 01743.
周阳,何中虎,张改生,夏兰琴,陈新民,高永超,井赵斌,于广军. 2004. 1BL/1RS易位系在我国小麦育种中的应用[J]. 作物学报,30(6):531-535. [Zhou Y,He Z H,Zhang G S,Xia L Q,Chen X M,Gao Y C,Jing Z B,Yu G J. 2004. Utilization of 1BL/1RS translocation in wheat breeding in China[J]. Acta Agronomica Sinica,30(6):531-535.] doi:10.3321/j.issn:0496-3490.2004.06.003.
祝梓博. 2017. 小麦多酚氧化酶基因克隆分析及其分子标记开发[D]. 郑州:河南农业大学. [Zhu Z B. 2017. Cloning and analysis of polyphenol oxidase gene and molecular marker development in wheat[D]. Zhengzhou:Henan Agricultural University.]
He X Y,He Z H,Zhang L P,Sun D J,Morris C F,Fuerst E P,Xia X C. 2007. Allelic variation of polyphenol oxidase(PPO) genes located on chromosomes 2A and 2D and development of functional markers for the PPO genes in common wheat[J]. Theoretical and Applied Genetics,115(1):47-58. doi:10.1007/s00122-007-0539-8.
Liu C,Yang Z J,Li G R,Zeng Z X,Zhang Y,Zhou J P,Liu Z H,Ren Z L. 2008. Isolation of a new repetitive DNA sequence from Secale africanum enables targeting of Secale chromatin in wheat background[J]. Euphytica,159: 249-258. doi:10.1007/s10681-007-9484-5.
Murray M G,Thompson W F. 1980. Rapid isolation of high molecular weight plant DNA[J]. Nucleic Acids Research,8(19):4321-4326. doi:10.1093/nar/8.19.4321.
Sun D J,He Z H,Xia X C,Zhang L P,Morris C F,Appels R,Ma W J,Wang H. 2005. A novel STS marker for polyphenol oxidase activity in bread wheat[J]. Molecular Bree-ding,16(3):209-218. doi:10.1007/s11032-005-6618-0.
Zeng D L,Tian Z X,Rao Y C,Dong G J,Yang Y L,Huang L C,Leng Y J,Xu J,Sun C,Zhang G H,Hu J,Zhu L,Gao Z Y,Hu X M,Guo L B,Xiong G S,Wang Y H,Li J Y,Qian Q. 2017. Rational design of high-yield and superior-quality rice[J]. Nature Plants,3(4):17031. doi:10.1038/nplants.2017.31.
(責任编辑 邓慧灵)

