猪TNF-α高效表达及其多克隆抗体的制备
黄茂发,梁晶晶,赵祥秀,唐榕泽,高跃美,张文,罗廷荣,李晓宁


摘要:【目的】明确猪源肿瘤坏死因子α(TNF-α)多克隆抗体的特异性和反应性,并探索猪瘟病毒(CSFV)感染对PK-15细胞分泌TNF-α的影响,为揭示CSFV的致病机理打下基础。【方法】提取CSFV病料基因组RNA,通过RT-PCR扩增TNF-α基因,构建原核表达载体pGEX-4T-1-TNF-α并转化BL21感受态细胞诱导表达融合蛋白,经纯化和浓缩后免疫SPF级昆明小鼠制备TNF-α多克隆抗体;同时构建真核表达载体pcDNA3.0-TNF-α,分别转染HEK-293T细胞和PK-15细胞表达融合蛋白,通过Western blotting、ELISA和间接免疫荧光分析等方法检测TNF-α多克隆抗体效价、反应性及特异性。【结果】以原核表达载体pGEX-4T-1-TNF-α转化BL21感受态细胞,经IPTG诱导后能表达出约43 kD的融合蛋白,且主要以包涵体形式进行表达。以真核表达载体pcDNA3.0-TNF-α转染HEK-293T细胞可表达出25 kD的融合蛋白,主要在细胞质中表达,且均匀分布。制备获得的TNF-α多克隆抗体能与转染HEK-293T细胞表达的融合蛋白TNF-α及PK-15细胞的内源蛋白TNF-α发生良好反应,即具有较好的反应特异性,其抗体效价高达1∶8000。CSFV能刺激PK-15细胞分泌蛋白TNF-α上調表达,且TNF-α与其下游因子(TRAF1)的表达变化趋势基本一致,即二者间存在一定关联性。【结论】制备获得的TNF-α蛋白抗体具有效价高、反应性好及特异性强的特点,可用于检测CSFV感染后真核细胞中过表达的TNF-α水平。TNF-α可刺激TRAF1产生,参与TRAF1相关信号通路而发挥其生物学功能,CSFV感染PK-15细胞后TNF-α和TRAF1的表达变化趋势基本一致,说明CSFV能刺激TNF-α和TRAF1信号通路,使机体产生炎症反应。
关键词: 猪;肿瘤坏死因子α(TNF-α);多克隆抗体;猪瘟病毒(CSFV)
中图分类号: S852.651 文献标志码: A 文章编号:2095-1191(2021)09-2572-10
Porcine TNF-α high level expression and preparation
of its polyclonal antibody
HUANG Mao-fa1,2, LIANG Jing-jing1,2, ZHAO Xiang-xiu1,2, TANG Rong-ze1,2,
GAO Yue-mei1,2, ZHANG Wen1,2, LUO Ting-rong1,2*, LI Xiao-ning1,2*
(1College of Animal Science and Veterinary Medicine,Guangxi University, Nanning 530004, China; 2State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Nanning 530004, China)
Abstract:【Objective】To determine the specificity and reactivity of porcine tumor necrosisfactor α(TNF-α) polyclonal antibody,and the effects of CSFV infection on TNF-α secretion of PK-15 cells were investigated,to lay a foundation for revealing the pathogenic mechanism of classical swine fever virus(CSFV). 【Method】The TNF-α gene was amplified by RT-PCR using RNA template extracted from CSFV infected PK-15 cells,to construct prokaryotic expression vector pGEX-4T-1-TNF-α and transform BL21 competent cells to induce the expression of fusion protein. Purified and concentrated SPF level Kunming mice were immunized with TNF-α polyclonal antibody. At the same time,eukaryotic expression vector pcDNA3.0-TNF-α was constructed and transfected into HEK-293T cell and PK-15 cell to express TNF-α. Titer,reactivity and specificity of TNF-α polyclonal antibody was detected by Western blotting,ELISA andindirect immunofluorescence methods. 【Result】Prokaryotic expression vector pGEX-4T-1-TNF-α transformed BL21 competent cells could express about 43 kD fusion protein induced by IPTG,and it was mainly expressed in the form of inclusion body. The eukaryotic expression vector pcDNA3.0-TNF-α transfected HEK-293T cells could express 25 kD fusion protein,which was mainly expressed in cytoplasm and evenly distributed. The prepared TNF-α polyclonal antibody could react well with the fusion protein TNF-α expressed in HEK-293T cells and the endogenous protein TNF-α in PK-15 cells,and had a good reaction specificity and the antibody titer was as high as 1∶8000. CSFV could up-regulate the expression of TNF-α secreted by PK-15 cells. The expression trend of TNF-α and its downstream factor (TRAF1) was basically consistent,therewas certain correlation between them. 【Conclusion】The TNF-α protein antibody has the characteristics of high effective valence,good reactivity and strong specificity,it can be used to detect the overexpression of TNF-α level in eukaryotic cells after CSFV infection. TNF-α can stimulate TRAF1 production and participate in TRAF1-related signaling pathway to play its biological function. The expression of TNF-α and TRAF1 is similar after CSFV infected PK-15 cells. These results suggest that CSFV can stimulate TNF-α and TRAF1 signaling pathways,and leads to the inflammatory reaction.
Key words: porcine; tumor necrosis factor α(TNF-α); polyclonal antibody; classical swine fever virus(CSFV)
Foundation item: National Key Research and Development Program of China(2018YFD0500104); Guangxi Natural Science Foundation(2018GXNSFBA281170)
0 引言
【研究意义】肿瘤坏死因子是由活化的巨噬或单核细胞产生的炎症因子,对肿瘤细胞具有很强的抑制作用,能促进中性粒细胞吞噬,抵抗细菌和病毒感染,参与自身免疫性疾病的病理损伤,从而引起发热症状(吕志敢和郭政,2006;Kalliolias and Ivashkiv,2016)。肿瘤坏死因子分为TNF-α和TNF-β,二者均有致热性,小剂量分泌呈单峰热,大剂量则产生双峰热,不耐热,70 ℃作用30 min即失去活性。TNF-α是由巨噬细胞产生的小分子蛋白,对于肿瘤细胞具有很强杀伤作用,而对正常细胞无毒性,是至今为止医学界发现抗肿瘤活性最强的细胞因子(李蕊蕊等,2018;苏韫等,2018)。TNF-α又称恶液素,可诱发机体发生恶液质(Amber et al.,2015),少量TNF-α具有杀灭癌细胞的作用,过量则无效或造成机体器官坏死。TNF-α还参与机体的炎症反应,是多种信号通路的关键因子。因此,开展TNF-α与猪瘟病毒(Classical swine fever virus,CSFV)感染的相关性研究,对揭示CSFV的致病机理具有重要意义。【前人研究进展】TNF-α存在2种生物活性形式,即跨膜TNF-α(tmTNF-α)和可溶性TNF-α(sTNF-α),最初作为一种25 kD的跨膜蛋白,可被TNF-α转换酶分裂,释放出1个17 kD的可溶性分子(Cruceriu et al.,2020)。tmTNF-α和sTNF-α需通过对应的受体——肿瘤坏死因子受体(TNFR1和TNFR2)才能发挥生物活性作用,其中TNFR1在几乎所有的细胞类型上均有表达,被认为是机体内经典TNF-α功能的主要介质,而TNFR2的表达仅限于免疫细胞(Ba et al.,2017)。sTNF-α的传导主要通过结合TNFR1发挥作用,而tmTNF-α主要连接TNFR2发生效应,均能诱导多种信号通路的激活,包括核因子NF-κB和MAPK及细胞凋亡相关通路(Sade-Feldman et al.,2013)。TNF-α的生物学作用在种属间无明显差异,已有研究证实人类TNF-α与小鼠TNF-α的氨基酸序列相似性为79%,而功能和作用暂未发现差异性(Caminero et al.,2011)。还有研究表明,通过基因工程技术修饰TNF-α,在N端缺失2个氨基酸残基(1Val和2Arg)后,其生物学活性和抗肿瘤效应更佳(Solmaza et al.,2011)。此外,Solmaza等(2011)研究发现,将TNF-α的8Pro、9Ser、10Asp和157Leu分别替换为8Arg、 9Lys、10Arg和157Phe,合成TNF-α较天然TNF-α在体外杀伤L929细胞的活性约增强1000倍。在炎性感染过程中,TNF-α水平的升高能促进白三烯和氧自由基的生成,进一步损伤肠黏膜,加剧黏膜充血、水肿及坏死,导致机体皮肤发紫和肠道糜烂等症状(杨季云等,2007)。von Rosen等(2013)研究發现CSFV感染猪体后,其血清TNF-α水平均有所升高,且表现为弱毒株较强毒株的TNF-α水平延迟2~3 d到达峰值。Li等(2016)研究表明,在猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)的感染过程中,整合素—金属蛋白酶17(A disintegrin and metalloproteinase-17,ADAM-17)参与TNF-α的产生。Bercier和Grenier(2019)研究发现,一些病原微生物入侵猪体时,可诱导其气管上皮细胞分泌TNF-α,进而破坏上皮屏障的完整性,使连接蛋白受损。【本研究切入点】TNF-α是一个关键的细胞调节因子,在针对细菌或病毒感染的免疫反应和炎症反应中发挥重要作用(Ting and Bertrand,2016)。至今,有关人类及鼠等生物的TNF-α已得到深入研究(Caminero et al.,2011),但针对猪TNF-α的研究相对较少。此外,研究病毒感染过程中猪体内TNF-α的变化规律及其作用机制需应用猪源TNF-α抗体,但目前生物制品市场尚缺乏此类抗体。【拟解决的关键问题】克隆猪TNF-α基因并进行原核表达及纯化,免疫昆明小鼠制备TNF-α多克隆抗体,采用Western blotting、ELISA及间接免疫荧光分析等方法验证猪源TNF-α多克隆抗体的特异性和反应性,并探索CSFV感染对PK-15细胞分泌TNF-α的影响,为揭示CSFV的致病机理打下基础。
1 材料与方法
1. 1 试验材料
His标签鼠单克隆抗体、Flag标签鼠单克隆抗体、表达载体pGEX-4T-1和pcDNA3.0、PK-15细胞系、HEK-293T细胞系、脂质体2000转染试剂盒及CSFV石门株均由亚热带农业生物资源与利用国家重点实验室保存提供;4周龄SPF级昆明小鼠(平均体重18 g/只)购自广西医科大学实验动物中心;大肠杆菌TOP10和BL21(DE3)感受态细胞购自天根生化科技(北京)有限公司。
1. 2 引物设计与合成
在GenBank上搜索猪TNF-α基因序列(登录号JF831365.1)的完整编码区(CDS)序列,根据试验需求设计特异性引物(表1),并委托华大基因生物科技(深圳)有限公司合成。
1. 3 猪源TNF-α多克隆抗体制备
1. 3. 1 原核表达载体构建 提取CSFV病料基因组RNA,反转录合成cDNA作为PCR扩增模板,采用TNF-α-F/TNF-α-R引物对扩增TNF-α基因,并克隆至pMD18-T载体上获得重组质粒pMD18-T-TNF-α,然后与原核载体pGEX-4T-1分别进行双酶切,酶切产物经胶回收后以T4 DNA连接酶连接过夜,连接产物转化TOP10感受态细胞,经PCR鉴定阳性克隆送至生工生物工程(上海)股份有限公司测序,以鉴定原核表达载体pGEX-4T-1-TNF-α是否构建成功。
1. 3. 2 融合蛋白TNF-α表达及纯化 以原核表达载体pGEX-4T-1-TNF-α转化BL21感受态细胞,阳性菌落在37 ℃下摇床(200 r/min)培养至OD600达0.6~0.8,加入终浓度为0.05或0.50 mmol/L的IPTG,30 ℃诱导6 h。取诱导菌液进行超声波破碎,4 ℃下12000 r/min离心10 min,分别收集上清液、沉淀和总菌进行SDS-PAGE分析和Western blotting检测,以确定融合蛋白诱导表达的最佳条件及其表达形式;并对IPTG诱导浓度及诱导时间等条件进一步优化,确定大量表达融合蛋白的最佳条件。最后,对蛋白样品进行SDS-PAGE分析,经KCl染色后取相应位置的凝胶进行切胶,PBS反复冻融,最后稀释出的液体即为纯化融合蛋白。
1. 3. 3 免疫小鼠及收集血清 將纯化融合蛋白与弗氏佐剂乳化成混合物,采用背部皮下多点注射对SPF级昆明小鼠进行免疫,免疫周期按1、7、21和35 d进行4次免疫,每只小鼠每次注射的融合蛋白免疫剂量约500 μg,4次免疫后第7 d摘除小鼠眼球采血,收集血清,-80 ℃保存备用。
1. 4 猪源TNF-α真核表达载体构建及诱导表达
重组质粒pMD18-T-TNF-α经F-TNF1/F-TNF2引物对扩增TNF-α基因,然后克隆至真核载体pcDNA3.0上,通过PCR挑选阳性克隆送至生工生物工程(上海)股份有限公司测序,以鉴定真核表达载体pcDNA3.0-TNF-α是否构建成功。HEK-293T细胞培养至70%~80%融合时,参考脂质体2000转染试剂盒说明,按脂质体∶质粒为2 μL∶0.8 μg的比例,以真核表达载体pcDNA3.0-TNF-α转染HEK-293T细胞,转染24 h后收集细胞总蛋白,采用Flag标签鼠单克隆抗体(1∶1000)进行Western blotting检测。
1. 5 TNF-α多克隆抗体反应性及特异性鉴定
采用12孔板培养PK-15细胞至70%~80%融合时,弃上清液后感染1 MOI的CSFV,于感染后0、12、24、36、48和72 h分别收集细胞总蛋白,同时收集1.4中真核表达载体pcDNA3.0-TNF-α转染的HEK-293T细胞样品,进行Western blotting检测。一抗为制备的TNF-α多克隆抗体,用PBS或牛奶封闭液稀释1000、2000、4000、8000和16000倍;二抗为HRP标记马抗小鼠IgG。此外,将PK-15细胞培养至70%~80%融合时,以真核表达载体pcDNA3.0-TNF-α进行转染,转染12 h后进行间接免疫荧光分析,观察TNF-α在PK-15细胞内的表达情况。
1. 6 TNF-α多克隆抗体效价测定
以真核表达载体pcDNA3.0-TNF-α转染的HEK-293T细胞样品为抗原,用抗原包被液进行稀释并包被ELISA酶标板底,然后以制备的TNF-α多克隆抗体为一抗、HRP标记马抗小鼠IgG为二抗,以未免疫的小鼠血清为阴性对照,利用间接ELISA测定TNF-α多克隆抗效价。
1. 7 TNF-α真核表达检测
以真核表达载体pcDNA3.0-TNF-α转染PK-15细胞,分别在转染0、6、9、12、24、36和48 h后收集细胞样品,去除培养基,加入800 μL的RNA细胞裂解液,常温裂解5 min,吹打若干次后收集于1.5 mL EP管中,-80 ℃保存备用。用PBS洗涤细胞3次,每孔加入200 μL RIPA裂解液及2 μL蛋白酶抑制剂,冰浴10 min,转移至EP管中,分别进行实时荧光定量PCR鉴定及Western blotting检测。
2 结果与分析
2. 1 猪TNF-α基因片段测序分析结果
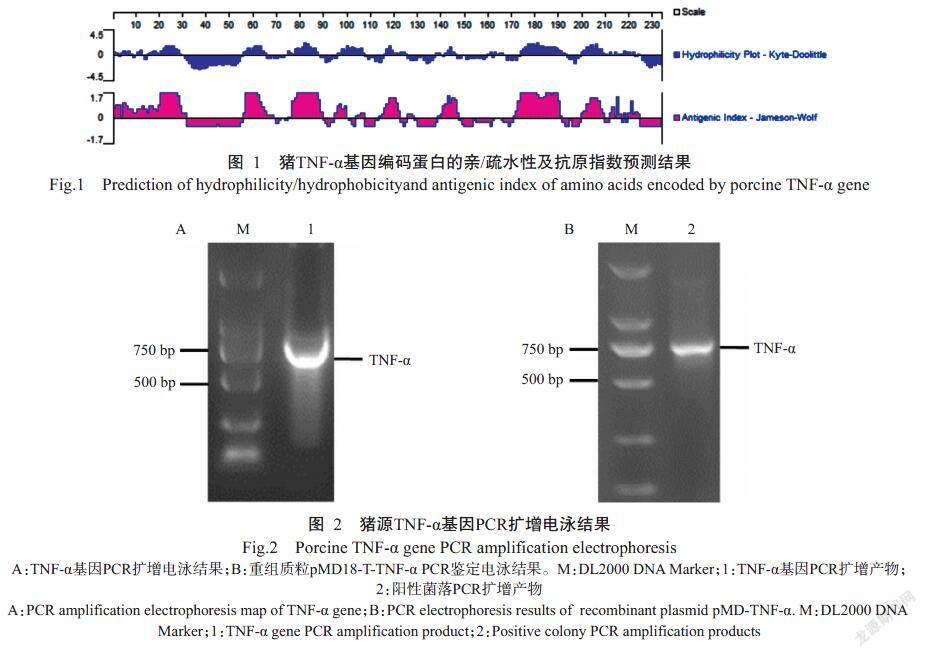
GenBank已收录的猪TNF-α基因序列(登录号JF831365.1)全长699 bp,共编码232个氨基酸残基;编码蛋白分子量为25 kD,其亲/疏水性预测结果如图1所示,抗原表位平均峰值均大于1.55,说明具有良好的抗原表位,可对基因全长进行原核表达。
2. 2 猪源TNF-α基因扩增结果
采用特异性引物TNF-α-F/TNF-α-R进行PCR扩增,获得699 bp的TNF-α基因目的条带(图2-A)。胶回收目的片段后与载体pMD18-T连接,并转化TOP10感受态细胞,菌液PCR鉴定结果如图2-B所示;对阳性菌进行质粒抽提,并送至生工生物工程(上海)股份有限公司测序,测序结果表明重组质粒pMD18-T-TNF-α构建成功。
2. 3 猪源TNF-α基因原核/真核表达载体构建情况
对构建获得的原核表达载体pGEX-4T-1-TNF-α和真核表达载体pcDNA3.0-TNF-α分别进行双酶切鉴定,鉴定结果如图3所示。送至生工生物工程(上海)股份有限公司的测序结果也均表明,原核表达载体pGEX-4T-1-TNF-α和真核表达载体pcDNA3.0-TNF-α构建成功。
2. 4 融合蛋白TNF-α诱导及其表达形式鉴定结果
以原核表达载体pGEX-4T-1-TNF-α转化BL21感受态细胞,采用终浓度为0.05或0.50 mmol/L的IPTG进行诱导表达6 h,SDS-PAGE分析(图4-A)和Western blotting检测(图4-B)结果显示,重组菌体经IPTG诱导后能表达出约43 kD的融合蛋白,融合蛋白主要以包涵体形式进行表达,且以终浓度为0.05 mmol/L IPTG的诱导效果较优。
2. 5 融合蛋白TNF-α的纯化鉴定结果
由于融合蛋白TNF-α主要以包涵体形式进行表达,且载体设计时人工添加His标签序列,与Ni-NTA亲和层析柱结合较差,因此使用切胶纯化方法进行纯化。对融合蛋白TNF-α进行SDS-PAGE分析,以KCl染色后取目的蛋白条带进行切胶纯化,纯化的融合蛋白TNF-α再进行SDS-PAGE分析和Western blotting检测,结果显示在43 kD处有1条清晰的目的条带(图5),说明成功获得较高纯度的融合蛋白TNF-α。
2. 6 真核表达蛋白TNF-α鉴定结果
使用12孔板培养HEK-293T细胞至70%~80%融合时,分别转染表达载体pcDNA3.0及携带Flag标签的真核表达载体pcDNA3.0-TNF-α,转染24 h后收集细胞总蛋白,以Western blotting检测HEK-293T细胞中融合蛋白TNF-α的表达情况,结果(图6)显示,除了在25 kD处观察到融合蛋白TNF-α外,在17 kD的位置还有少量的可溶性TNF-α。
2. 7 TNF-α多克隆抗体与真核表达蛋白的反应性
TNF-α多克隆抗体按1∶1000、1∶2000、1∶4000和1∶8000的比例进行稀释,通过Western blotting检测TNF-α多克隆抗体与真核表达蛋白的反应性,结果(图7)显示,1∶8000倍稀释TNF-α多克隆抗体时仍可检测到HEK-293T细胞转染表达的融合蛋白TNF-α,表明制备获得的TNF-α多克隆抗体具有良好的反应性。
2. 8 TNF-α多克隆抗體与CSFV感染PK-15细胞分泌蛋白TNF-α的反应性
采用12孔板培养PK-15细胞至70%~80%融合时,弃上清液后感染1 MOI的CSFV,于感染后0、12、24、36、48和72 h收集细胞总蛋白进行Western blotting检测,结果(图8)显示,CSFV感染后24 h其病毒蛋白开始表达,且呈上调趋势;而PK-15细胞分泌蛋白TNF-α从感染后36 h开始上调表达,于感染72 h时达峰值,其变化趋势与病毒蛋白基本一致,即CSFV能刺激PK-15细胞分泌蛋白TNF-α上调表达。
2. 9 TNF-α多克隆抗体特异性检测结果
以真核表达载体pcDNA3.0-TNF-α转染PK-15细胞,真核载体pcDNA3.0转染为阴性对照,转染12 h后分别用Flag标签单克隆抗体(1∶500)和制备的TNF-α多克隆抗体(1∶300)为一抗孵育转染的PK-15细胞,以FITC荧光标记马抗鼠IgG抗体为二抗,荧光倒置显微镜下观察荧光信号并拍照分析。结果(图9)显示,真核载体pcDNA3.0转染的PK-15细胞未检测到荧光信号,而经真核表达载体pcDNA3.0-TNF-α转染后其细胞荧光强度增强,可清楚观察到细胞形态,细胞核荧光较细胞质稍暗,说明融合蛋白TNF-α主要在细胞质中表达,且均匀分布,也表明TNF-α多克隆抗体与真核细胞表达TNF-α具有较好的反应特异性,可用于间接免疫荧光分析。
2. 10 TNF-α多克隆抗体效价测定结果
收集真核表达载体pcDNA3.0-TNF-α转染的HEK-293T细胞样品为抗原,以制备的TNF-α多克隆抗体和未免疫小鼠血清为一抗,利用间接ELISA测定抗体效价。结果判定标准为TNF-α多克隆抗体孔的OD450 nm与未免疫小鼠阴性血清对照孔的OD450 nm比值差异显著(P/N)>2.1,鉴定为阳性的最高稀释度即为其抗体效价。由图10可知,当TNF-α多克隆抗体1∶8000稀释时,P为0.276,N为0.107,P/N=2.579>2.1;当TNF-α多克隆抗体1∶16000稀释时,P为0.230,N为0.119,P/N=1.932<2.1,因此确定TNF-α多克隆抗体效价为1∶8000。
2. 11 真核表达TNF-α及其下游因子(TRAF1)的变化
使用12孔板培养PK-15细胞至70%~80%融合时,分别转染真核表达载体pcDNA3.0-TNF-α和真核载体pcDNA3.0,在转染0、6、9、12、24、36和48 h后收集PK-15细胞总蛋白和RNA样品,对TNF-α基因及TRAF1的表达变化进行分析。实时荧光定量PCR检测结果显示,PK-15细胞转染真核表达载体pcDNA3.0-TNF-α后,TNF-α基因表达变化倍数在转染6 h时达74.8倍,转染12 h时达峰值(354.4倍),随后逐渐下降,至转染48 h时降至51.9倍;而真核载体pcDNA3.0转染组只有2.0~4.0倍的上升幅度(图11-A)。在TNF-α存在的条件下,PK-15细胞中的TRAF1表达受到影响,TRAF1表达变化倍数在转染12 h时可达3.4倍,变化趋势与TNF-α基因基本一致,但变化幅度不明显(图11-B)。Western blotting检测结果(图11-C)表明,TNF-α从转染12 h时开始表达,至转染24 h时表达量达峰值;随着TNF-α的表达,TRAF1的水平从转染12 h时开始上调,于转染24 h时达峰值后逐渐下调。可见,TNF-α与TRAF1的变化趋势基本一致,即二者间存在一定关联性。
3 讨论
CSFV感染能引起宿主皮肤、脾脏、肾脏及淋巴结等器官组织广泛性出血和淤血。CSFV进入血液循环系统后,最早侵害的是血管内皮细胞并诱导细胞分泌IL-1、IL-6和IL-8等促炎因子,由于入侵的数量相对较少,引起的炎症反应不强烈(范学政等,2013)。当CSFV在细胞内大量复制并释放到细胞外感染其他细胞时,则再次启动新一轮的促炎因子分泌,随着感染细胞数量的不断增加,炎症反应也愈加强烈,血管内皮细胞出现肿胀、变性、坏死,甚至脱落,而导致出血(Bensaude et al.,2004)。von Rosen等(2013)研究证实,CSFV感染猪只后其体内的TNF-α、INF-α和IL-8等促炎因子水平明显升高。本研究的Western blotting检测结果也表明,CSFV感染可引起PK-15细胞的TNF-α表达水平上调。此外,CSFV感染后能刺激核转录因子NF-κB产生,从而引起肠道炎症反应,致使结肠黏膜损伤(Hiscott et al.,2001)。NF-κB是一类与某些基因启动子区特定核苷酸序列结合的蛋白,进而调控基因的转录过程(Dong et al.,2013)。NF-κB广泛表达于多种组织细胞中,在多条信号通路中发挥转录调节作用,且激活后可与不同基因一起调控转录过程,尤其在肿瘤的形成和发展中扮演着重要角色(刘金辉等,2008)。TRAF1是肿瘤坏死因子受体相关因子家族的重要成员之一,也是TNF-α下游的重要因子,在TNF-α诱导NF-κB的过程中发挥重要作用。TNF-α和TRAF1均属于NF-κB通路相关蛋白,但其具体作用机制尚未明确。
由于猪TNF-α基因编码蛋白亲水性较好,抗原表位平均峰值均大于1.55,全长都具有良好的抗原表位,无信号肽,因此本研究以猪TNF-α基因全长进行原核表达。融合蛋白在大肠杆菌中的高效表达,会导致包涵体形成,但包涵体在纯化时需使用变性剂将其溶解,充分暴露出His标签,以便与Ni-NTA层析柱结合而达到纯化蛋白的目的(李延生等,2014;陈东荣等,2021)。虽然Ni-NTA层析法具有操作简单的优点,但其电泳、透析及染色等过程耗时较长,致使蛋白纯化效率降低,纯化成本增高。本研究选用KCl染色切胶纯化蛋白的方法,在保证不改变原有蛋白生物活性的前提下,参考NaAc染色切胶纯化法,以KCl取代NaAc染色蛋白及反复冻融后,并通过快速离心等步骤取代原来的电泳后过夜透析等步骤,结果显示,KCl染色切胶纯化获得的融合蛋白TNF-α经SDS-PAGE分析和Western blotting检测,证实其纯度和浓度均满足免疫要求,将融合蛋白TNF-α与弗氏佐剂乳化后对SPF级昆明小鼠进行4次免疫,制备获得的TNF-α多克隆抗体具有良好的反应性,其效价为1∶8000。
为了验证TNF-α多克隆抗体的反应性,本研究利用真核载体pcDNA3.0成功构建真核表达载体pcDNA3.0-TNF-α,分别转染HEK-293T细胞和PK-15细胞后均可表达出接近于天然结构的融合蛋白,且具有完整的空间结构,与真核细胞表达蛋白呈高度亲和性。间接免疫荧光分析结果也证实TNF-α多克隆抗体可检测在PK-15细胞中过表达的TNF-α,且有较强的特异性荧光;通过Western blotting还能检测到CSFV感染PK-15细胞后产生的内源性TNF-α。可见,本研究制备获得的TNF-α多克隆抗体具有良好的反应性和特异性。此外,PK-15细胞感染CSFV后,TNF-α的表达呈明显上调趋势;在PK-15细胞中过表达TNF-α时,其下游因子TRAF1的mRNA和蛋白水平均呈上调趋势,即TNF-α能上调TRAF1的表达。TNF-α和TRAF1均能刺激NF-κB产生,而NF-κB普遍存在于多种组织细胞中,具有多向转录调节作用,并发挥多种生物学功能(Devergne et al.,1996)。CSFV感染PK-15细胞后,TNF-α和TRAF1的表达变化趋势基本一致,说明CSFV入侵动物机体后同时刺激TNF-α和TRAF信号通路,使机体产生炎症反应。
4 结论
制备获得的TNF-α蛋白抗体具有效价高、反应性好及特异性强的特点,可用于检测CSFV感染后真核细胞中过表达的TNF-α水平。TNF-α可刺激TRAF1產生,参与TRAF1相关信号通路而发挥其生物学功能,CSFV感染PK-15细胞后TNF-α和TRAF1的表达变化趋势基本一致,说明CSFV能同时刺激TNF-α和TRAF1信号通路,使机体产生炎症反应。
参考文献:
陈东荣,黄星晨,张俊俊,杨维菡,张明,付强. 2021. 水牛Tle6基因表达模式分析及其多克隆抗体制备[J]. 南方农业学报,52(6):1692-1700. [Chen D R,Huang X C,Zhang J J,Yang W H,Zhang M,Fu Q. 2021. Expression pattern of Tle6 gene in buffalo and preparation of polyclonal antibody[J]. Journal of Southern Agriculture,52(6):1692-1700.] doi:10.3969/j.issn.2095-1191.2021.06.030.
范学政,陈锴,徐璐,朱长康,张正兴,赵燕,史兰广,郑然,宁宜宝,王琴. 2013. 猪瘟病毒感染对猪外周血细胞因子转录的影响[J]. 中国兽医杂志,49(6):3-6. [Fan X Z,Chen K,Xu L,Zhu C K,Zhang Z X,Zhao Y,Shi L G,Zheng R,Ning Y B,Wang Q. 2013. Studies on cytokine mRNA expressions in the PBMC of CSFV-infected pigs[J]. Chinese Journal of Veterinary Medicine,49(6):3-6.] doi:10.3969/j.issn.0529-6005.2013.06.001.
李蕊蕊,陈媛媛,董志昊,高三思,黄宝银,刘润琪,何平,郭寒,李铭,常仁旭,葛靖昕,杨威,徐闯. 2018. 成纤维细胞生长因子21(FGF21)对非酒精性脂肪肝小鼠血液 TNF-α及IL-1β的影响[J]. 中国兽医学报,38(11):2163-2167. [Li R R,Chen Y Y,Dong Z H,Gao S S,Huang B Y,Liu R Q,He P,Guo H,Li M,Chang R X,Ge J X,Yang W,Xu C. 2018. Effects of fibroblast growth factor 21(FGF21) on TNF-α and IL-1β in blood of non-alcoholic liver mice[J]. Chinese Journal of Veterinary Science,38(11):2163-2167.] doi:10.16303/j.cnki.1005-4545.2018. 11.23.
李延生,刘诚,张珂,李晓宁,李晓泉,尹珊,谢琳娟,何晓霞,罗扬,钟桃珍,罗廷荣. 2014. 猪STAT-1α基因的原核表达及其多克隆抗体制备[J]. 南方农业学报,45(1):118-122. [Li Y S,Liu C,Zhang K,Li X N,Li X Q,Yin S,Xie L J,He X X,Luo Y,Zhong T Z,Luo T R. 2014. Prokaryotic expression of porcine STAT-1α gene and preparation of polyclonal antibody against STAT-1α[J]. Journal of Southern Agriculture,45(1):118-122.] doi:10.3969/j:issn.2095-1191.2014.1.118.
劉金辉,杨芬,罗闳丹,陈志平,谢小梅. 2008. NF-κB启动的炎症反应在小鼠侵袭性肺曲霉病肺损伤中的作用[J]. 微生物学通报,35(11):1769-1773. [Liu J H,Yang F,Luo H D,Chen Z P,Xie X M. 2008. The effect of inflammation-mediated by NF-κB on lung injury of mice with invasive pulmonary aspergillosis[J]. Microbiology,35(11):1769-1773.] doi:10.3969/j.issn.0253-2654.2008. 11.017.
吕志敢,郭政. 2006. 肿瘤坏死因子的研究进展[J]. 山西医科大学学报,37(3):311-314. [Lü Z G,Guo Z. 2006. Research progress of tumor necrosis factor[J]. Journal of Shanxi Medical University,37(3):311-314.] doi:10.3969/j.issn. 1007-6611.2006.03.034.
苏韫,刘永琦,颜春鲁,龚红霞,李春波,薛轩,张广智. 2018. 马铃薯糖苷生物碱对化疗性静脉炎家兔促炎细胞因子表达的影响[J]. 甘肃农业大学学报,53(6):19-23. [Su Y,Liu Y Q,Yan C L,Gong H X,Li C B,Xue X,Zhang G Z. 2018. Effect of potato glycosidic alkaloid on the inflammatory cytokines of chemotherapy phlebitis rabbit[J]. Journal of Gansu Agricultural University,53(6):19-23.] doi:10.13432/j.cnki.jgsau.2018.06.003.
杨季云,张思仲,郭红,曾祥元,马布仁. 2007. 肿瘤坏死因子α通过激活NF-κB信号通路加快肝细胞周期进程[J]. 生物化学与生物物理进展,34(6):604-610. [Yang J Y,Zhang S Z,Guo H,Zeng X Y,Ma B R. 2007. TNF-α promotes cell cycle progression by activating NF-κB signal pathway in hepatic cell line L-02[J]. Progress in Biochemistry and Biophysics,34(6):604-610.] doi:10.3321/j.issn:1000-3282.2007.06.008.
Amber K T,Bloom R,Mrowietz U,Hertl M. 2015. TNF-α:A treatment target or cause of sarcoidosis?[J]. Journal of the European Academy of Dermatology & Venereology Jeadv,29(11):2104-2111. doi:10.1111/jdv.13246.
Ba H P,Li B H,Li X Y,Li C,Feng A L,Zhu Y Z,Wang J,Li Z Y,Yin B J. 2017. Transmembrane tumor necrosis factor-α promotes the recruitment of MDSCs to tumor tissue by upregulating CXCR4 expression via TNFR2[J]. International Immunopharmacology,44:143-152. doi:10. 1016/j.intimp.2016.12.028.
Bensaude E,Turner J L E,Wakeley P R,Sweetman D A,Pardieu C,Drew T W,Wileman T,Powell P P. 2004. Classical swine fever virus induces proinflammatory cytokines and tissue factor expression and inhibits apoptosis and interferon synthesis during the establishment of long-term infection of porcine vascular endothelial cells[J]. Journal of General Virology,85(4):1029-1037. doi:10. 1099/vir.0.19637-0.
Bercier P,Grenier D. 2019. TNF-α disrupts the integrity of the porcine respiratory epithelial barrier[J]. Research in Veterinary Science,124:13-17. doi:10.1016/j.rvsc.2019. 01.029.
Caminero A,Comabella M,Montalban X. 2011. Tumor necrosis factor alpha (TNF-α),anti-TNF-α and demyelination revisited:An ongoing story[J]. Journal of Neuroimmunology,234(1-2):1-6. doi:10.1016/j.jneuroim.2011.03. 004.
Cruceriu D,Baldasici O,Balacescu O,Berindan-Neagoe I. 2020. The dual role of tumor necrosis factor-alpha(TNF-α) in breast cancer:Molecular insights and therapeutic approaches[J]. Cellular Oncology,43(1):1-18. doi:10. 1007/s13402-019-00489-1.
Devergne O,Hatzivassiliou E,Izumi K M,Kaye K M,Kleijnen M F,Kieff E,Mosialos G. 1996. Association of TRAF1,TRAF2,and TRAF3 with an Epstein-Barr virus LMP1 domain important for B-lymphocyte transformation:Role in NF-kappa B activation[J]. Molecular and Cellular Biology,16(12):7098-7108. doi:10.1128/MCB. 16.12.7098.
Dong X Y,Liu W J,Zhao M Q,Wang J Y,Pei J J,Luo Y W,Ju C M,Chen J D. 2013. Classical swine fever virus triggers RIG-I and MDA5-dependent signaling pathway to IRF-3 and NF-κB activation to promote secretion of interferon and inflammatory cytokines in porcine alveolar macrophages[J]. Virology Journal,10:286. doi:10.1186/1743-422X-10-286.
Hiscott J,Kwon H,Génin P. 2001. Hostile takeovers:Viral appropriation of the NF-kappaB pathway[J]. Journal of Cli-nical Investigation,107(2):143-151. doi:10.1172/JCI11 918.
Kalliolias G D,Ivashkiv L B. 2016. TNF biology,pathogenic mechanisms and emerging therapeutic strategies[J]. Nature Reviews. Rheumatology,12(1):49-62. doi:10.1038/nrrheum.2015.169.
Li R,Guo L J,Gu W H,Luo X L,Zhang J,Xu Y F,Tian Z J,Feng L,Wang Y. 2016. Production of porcine TNFα by ADAM17-mediated cleavage negatively regulates porcine reproductive and respiratory syndrome virus infection[J]. Immunologic Research,64(3):711-720. doi:10.1007/s12026-015-8772-8.
Sade-Feldman M,Kanterman J,Ish-Shalom E,Elnekave M,Horwitz E,Baniyash M. 2013. Tumor necrosis factor-α blocks differentiation and enhances suppressive activity of immature myeloid cells during chronic inflammation[J]. Immunity,38(3):541-554. doi:10.1016/j.immuni. 2013.02.007.
Solmaza R,Altunba? E,Karda? G. 2011. Investigation of adsorption and corrosion inhibition effect of 1,1'-thiocarbonyldiimidazole on mild steel in hydrochloric acid solution[J]. Protection of Metals & Physical Chemistry of Surfaces,47:264. doi:10.1134/S2070205111020183.
Ting A T,Bertrand M J M. 2016. More to life than NF-kappa B in TNFR1 signaling[J]. Trends in Immunology,37(8):535-545. doi:10.1016/j.it.2016.06.002.
von Rosen T,Lohse L,Nielsen J,Uttenthal ?. 2013. Classical swine fever virus infection modulates serum levels of INF-α,IL-8 and TNF-α in 6-month-old pigs[J]. Research in Veterinary Science,95(3):1262-1267. doi:10.1016/j.rvsc.2013.09.011.
(責任编辑 兰宗宝)

