Ⅱ型鲤疱疹病毒ORF6多克隆抗体的制备与鉴定
南星羽,冯梓钊,费越越,余路,罗扬,许丹


摘要:【目的】制備Ⅱ型鲤疱疹病毒(CyHV-2)ORF6多克隆抗体,为深入探究ORF6在CyHV-2急性感染或潜伏感染过程中的作用机制提供技术支持。【方法】利用MEGA 6.0、Adobe Illustrator CS6及BepiPred-2.0等在线软件分析CyHV-2的ORF6基因序列信息,采用PCR从CyHV-2基因组中扩增ORF6基因片段,将其连接至原核表达载体pET-28a后转化大肠杆菌BL21(DE3)感受态细胞,经IPTG诱导和尿素洗涤纯化获得融合蛋白。以纯化的融合蛋白ORF6免疫健康Babl/c小鼠制备ORF6多克隆抗体,并通过Western blotting和间接免疫荧光技术鉴定ORF6多克隆抗体的特异性。【结果】CyHV-2的ORF6基因全长3003 bp,与CyHV-3和CyHV-1的ORF6氨基酸序列相似性均高于30.00%,其中与CyHV-3的相似性高达39.36%;其抗原表位最可能存在于第1~300位氨基酸序列中。将PCR扩增获得的ORF6基因片段连接至原核表达载体pET-28a可成功构建重组质粒pET-28a-ORF6,转化BL21(DE3)感受态细胞后经IPTG诱导4 h即获得融合蛋白ORF6;原核表达的融合蛋白ORF6主要以包涵体形式进行表达,其分子量为17.13 kD,经6 mol/L尿素洗涤纯化后的浓度为0.1 mg/mL。以纯化融合蛋白ORF6免疫Babl/c小鼠制备获得的ORF6多克隆抗体能特异性识别融合蛋白ORF6及CyHV-2感染的异育银鲫尾鳍细胞(GiCF);利用制备的ORF6多克隆抗体对CyHV-2感染GiCF细胞进行间接免疫荧光分析,结果在CyHV-2感染GiCF细胞周围能观察到特异性绿色荧光,而在未感染CyHV-2的GiCF细胞周围未观察到特异性绿色荧光,进一步说明ORF6多克隆抗体可特异性识别CyHV-2。【结论】制备获得的ORF6多克隆抗体能与CyHV-2感染GiCF细胞发生特异性免疫反应,即可用于鉴定CyHV-2感染,为探究ORF6蛋白功能是否与CyHV-2潜伏感染相关打下了基础。
关键词: Ⅱ型鲤疱疹病毒(CyHV-2);ORF6蛋白;潜伏感染;多克隆抗体;间接免疫荧光
中图分类号: S941.41 文献标志码: A 文章编号:2095-1191(2021)09-2562-10
Preparation and identification of polyclonal antibody
against cyprinid herpesvirus-2 ORF6
NAN Xing-yu, FENG Zi-zhao, FEI Yue-yue, YU Lu, LUO Yang, XU Dan*
(National Pathogen Collection Center for Aquatic Animals/Key Laboratory of Freshwater Aquatic Genetic Resources Aquaculture, Ministry of Agriculture and Rural Affairs/National Experimental Teaching Demonstration Center
for Fishery Sciences/Shanghai Ocean University, Shanghai 201306, China)
Abstract:【Objective】The polyclonal antibody of ORF6 of cyprinid herpesvirus-2(CyHV-2) was prepared to provide a technical means for further investigation of the function of ORF6 in CyHV-2 acute infection or a latent infection process.【Method】The ORF6 gene sequenceof CyHV-2 was analyzed by online softwares such as MEGA 6.0, Adobe Illustrator CS6 and BepiPred-2.0. The ORF6 gene was amplified from the CyHV-2 genome by PCR and cloned into the prokaryotic expression vector PET-28a. The recombinant expression plasmid was transformed into Escherichia coli BL21(DE3), after that, expression was induced by IPTG. The recombinant protein was purified by urea method, Babl/chealthy mice were immunized with purified recombinant ORF6 protein, serum was collected to prepare polyclonal antibody against ORF6 protein. Finally, the specificity of antibody was identified by Western blotting and indirect immunofluorescence technique(IFA). 【Result】The full-length ORF6 gene of CyHV-2 was 3003 bp, and the amino acid sequence similarity with CyHV-3 and ORF6 of CyHV-1 was higher than 30.00%, and the similarity with CyHV-3 was 39.36%. Its antigenic epitope was most likely to exist in amino acid sequences 1-300. ORF6 gene fragment obtained by PCR was ligated to the prokaryotic expression vector pET-28a to construct the recombinant plasmid pET-28a-ORF6, which was transformed into BL21(DE3) competent cells and induced by IPTG for 4 h to obtain the fusion protein ORF6, it was mainly expressed in the form of inclusion bodies, and its molecular weight was 17.13 kD. The concentration of ORF6 purified by 6 mol/L urea washing was 0.1 mg/mL. The ORF6 polyclonal antibody prepared by immunizing Babl/c mice with purified fusion protein ORF6 could specifically recognize the fusion protein ORF6 and the Carassius auratus gibelio caudal fin cell(GiCF) infected by CyHV-2. The prepared ORF6 polyclonal antibody was used for indirect immunofluorescence analysis of GiCF infected with CyHV-2. The results showed that specific green fluorescence could be observed around GiCF infected with CyHV-2, while no specific green fluorescence was observed around GiCF cells not infected with CyHV-2, which further indicated that ORF6 polyclonal antibody could specifically recognize CyHV-2. 【Conclusion】The prepared ORF6 polyclonal antibody can specifically react with CyHV-2 infected GiCF, which can be used to identify CyHV-2 infection, and lay a foundation for later exploration of whether ORF6 protein function is related to CyHV-2 latent infection.
Key words: cyprinid herpesvirus-2(CyHV-2); ORF6 protein; latent infection; polyclonal antibody; indirect immunofluorescence
Foundation item: “Blue Granary Science and Technology Innovation” of the National Key Research and Development Program of China(2019YFD0900101)
0 引言
【研究意义】Ⅱ型鲤疱疹病毒(Cyprinid herpesvirus 2,CyHV-2)隶属于鱼疱疹病毒科(Alloherpesviridae)鲤疱疹病毒属(Cyprinivirus),呈椭圆形,具有囊膜(徐进等,2013;赵欣,2016),是引起鲫鱼(Carassius auratus)和金鱼造血器官坏死病(Herpesviral haematopoietic necrosis,HVHN)的病原体,具有高传染性及高死亡率的特点(余琳等,2019)。HVHN自1992年首次在日本金鱼体内发现后(Jung and Miyazaki,2010),于1995年由进口金鱼传入我国台湾地区(Chang et al.,2009),2011—2013年在我国江苏、湖北和广东等鲫鱼主要养殖区大规模暴发,给我国的鲫鱼养殖业造成巨大经济损失(Doszpoly et al.,2011)。在人工感染过程中发现,CyHV-2感染模型分为急性感染和潜伏感染,后者能在鲫鱼体内长期存在且不发病。自然养殖过程中也存在潜伏感染状态,当外界环境尤其是气温改变时,携带有病毒的潜伏感染转变为急性感染而暴发HVHN。因此,亟待开展CyHV-2潜伏感染相关基因的研究,解决前期判断是否为潜伏感染并进行预防,或采取措施改变其潜伏感染状态,以降低HVHN暴发的风险。【前人研究进展】CyHV-2的颗粒直径在100~110 nm,其基因组全长约290304 bp,共编码156个开放阅读框(ORF)(Podok et al.,2014;袁锐等,2019)。王璐(2012)对江苏地区的CyHV-2进行分类鉴定;晏文岩等(2017)研究发现CyHV-2的非结构蛋白ORF4可能参与病毒复制,是病毒复制感染周期的特征性指示蛋白之一;叶元士等(2017)进行CyHV-2全基因组测序和注释分析,发现CyHV-2感染对异育银鲫的肠道黏膜组织基因表达产生影响,尤其对胆固醇与胆汁酸的合成代谢途径及胆汁酸肠肝循环途径的基因表达产生明显影响;高娃等(2020)通过分析CyHV-2的重要免疫原性蛋白,获得ORF92、ORF115、ORF25、ORF57、ORF66、ORF72、ORF131和ORF132等8种主要免疫原性蛋白;周瑶佳等(2020)对CyHV-2感染的病理学进行研究;王姝等(2020)、闻金萱等(2020)分别建立了针对CyHV-2的快速检测法。目前,有关CyHV-2重要功能基因及病毒致病和潜伏机制的研究鲜见报道,但国际上对锦鲤疱疹病毒(Koi herpesvirus,KHV/CyHV-3)的研究已证实CyHV-3可在锦鲤中发生潜伏感染,且通常潜伏在锦鲤的白细胞中。Reed等(2014,2017)研究表明,CyHV-3的ORF6基因是参与病毒编码潜伏相关的基因,且在CyHV-3感染锦鲤的IgM和B细胞中均能检测到ORF6基因,经RNA测序分析证实是潜伏期表达的主要转录物。在国内,刘世超(2012)基于ORF26基因建立了快速检CyHV-3的Nested-PCR,陈俊杰等(2017)建立了快速鉴别CyHV-3急性感染和潜伏感染的实时荧光定量PCR。CyHV-3的相關研究对开展CyHV-2研究具有重要启示作用。【本研究切入点】CyHV-2与CyHV-3的基因组序列相似性达81.55%,其中ORF6基因序列的相似性达39.36%,但ORF6基因与CyHV-2感染模型的相关性尚未明确,因此开展CyHV-2 ORF6基因生物信息学分析并制备ORF6多克隆抗体对揭示CyHV-2潜伏感染特征及其与宿主的作用机制具有重要意义。【拟解决的关键问题】通过构建原核表达载体诱导表达融合蛋白及免疫小鼠制备ORF6多克隆抗体,并采用Western blotting和间接免疫荧光检验其特异性,为深入探究ORF6在CyHV-2急性感染或潜伏感染过程中的作用机制提供技术支持。
1 材料与方法
1. 1 试验材料
CyHV-2由国家水生动物病原库(上海海洋大学)保存提供(鲁建飞,2018)。异育银鲫尾鳍细胞(GiCF)由农业农村部淡水种质资源重点实验室构建获得(Lu et al.,2018),采用M199完全培养基(含10% FBS)在27 ℃下进行传代培养;原核表达载体pET-28a由农业农村部淡水种质资源重点实验室保存提供;病毒提取试剂盒、质粒抽提试剂盒及大肠杆菌BL21(DE3)感受态细胞购自天根生化科技(北京)有限公司;弗氏不完全佐剂、弗氏完全佐剂及His标签抗体购自Sigma-Aldrich公司。
1. 2 生物信息学分析
根据GenBank已公布CyHV-2的ORF6基因序列(AKC01966.1),采用MEGA 6.0和Adobe Illustrator CS6对CyHV-1、CyHV-2和CyHV-3的ORF6基因进行同源比对分析,并以BepiPred-2.0(http://www.cbs.dtu.dk/services/BepiPred/)对其抗原决定簇(抗原表位)进行预测。
1. 3 ORF6基因扩增
根据ORF6基因序列设计特异性扩增引物(F:5'-CGGGATCCCGTTTCTACGTGCACAGCGCGA G-3';R:5'-GCGAAGCTTGCACATGTTTTCTGAAG GGCAC-3'),并在上、下游引物序列中分别插入BamH I和Hind III酶切位点,委托生工生物工程(上海)股份有限公司合成。以CyHV-2感染7 d的GiCF细胞DNA为模板,进行ORF6基因PCR扩增。PCR反应体系25.0 μL,其中2×PrimeSTAR Max Premix 12.5 μL,上、下游引物(10 nmol/L)各1.0 μL,cDNA模板(CyHV-2感染GiCF细胞的cDNA模板)1.0 μL,ddH2O 9.5 μL。扩增程序:98 ℃预变性3 min;98 ℃ 10 s,55 ℃ 5 s,72 ℃ 5 s,进行35个循环。采用1.5%琼脂糖凝胶电泳检测PCR扩增产物并进行纯化回收。
1. 4 重组质粒pET-28a-ORF6构建及测序分析
将纯化的PCR扩增产物和原核表达载体pET-28a分别进行双酶切及连接转化,最后提取重组质粒送至生工生物工程(上海)股份有限公司进行测序,测序鉴定正确的重组质粒命名为pET-28a-ORF6。
1. 5 重组质粒pET-28a-ORF6诱导表达
将含重组质粒pET-28a-ORF6的菌液涂布至培养基上,挑取单个阳性菌落,接种至现配的LB液体培养基(Kana+)中,在37 ℃恒温摇床中(150 r/min)培养3~4 h,加入IPTG至终浓度为0.2 mmol/L,37 ℃诱导5 h;4 ℃下8500 r/min离心20 min收集菌体沉淀;PBS清洗2次并重悬,超声波破碎处理至溶液变澄清,4 ℃下12000 r/min离心20 min收集沉淀和上清液。
1. 5. 1 优化诱导表达条件 以重组质粒pET-28a-ORF6转化BL21(DE3)感受态细胞,然后涂布至LB/Kana培养基上进行培养。筛选阳性克隆,将其接种至LB液体培养基中,室温摇床过夜培养。培养的阳性细菌液按1∶100比例转移到配好的LB液体培养基(Kana+)中,在37 ℃恒温摇床(180 r/min)培养4 h后,分别加入终浓度为0.1、0.2、0.5和1.0 mmol/L的IPTG诱导5 h。采用SDS-PAGE分析融合蛋白的表达情况,筛选出最佳的IPTG诱导浓度。
1. 5. 2 纯化融合蛋白 在最佳诱导条件下,大量诱导表达融合蛋白;分别以2、4、6、8 mol/L尿素处理沉淀,每步均在4 ℃下8500 r/min离心20 min。然后将融合蛋白依次放入含 6、4、2和0 mol/L尿素的PBS中进行透析,每个浓度透析处理4 h;最后采用试剂盒测量融合蛋白浓度,确定其纯化程度,-80 ℃保存备用。
1. 6 ORF6多克隆抗体制备
选取20只健康且大小相近的8周龄Babl/c小鼠,以纯化的融合蛋白ORF6免疫小鼠(100 μg/只)。首次免疫以弗氏完全佐剂与融合蛋白ORF6等比例乳化;二次免疫在首免20 d后进行,以弗氏不完全佐剂与融合蛋白ORF6等比乳化;第三次免疫为纯抗原(融合蛋白ORF6)免疫。第三次免疫1周后摘除小鼠眼球取血,37 ℃静置1 h,4 ℃冰箱保存过夜。次日4 ℃下5000 r/min离心10 min,收集血清,-80 ℃保存备用。
1. 7 ORF6多克隆抗体特异性评价
以纯化后的抗原(融合蛋白ORF6)、CyHV-2(蔗糖梯度离心提取纯病毒)和CyHV-2处理的GiCF细胞样品进行SDS-PAGE分析及Western blotting检测。采用电转膜法(100 V,75 min)将样品转印至聚偏二氟乙烯膜上,20 mL 5%脱脂牛奶37 ℃封闭2 h;经一抗(His标签)室温孵育1 h后,置于4 ℃冰箱过夜,其中一抗稀释度为1∶1000。1×PBST清洗6次,每次5 min。以辣根过氧化物酶(HRP)标记兔抗鼠IgG为二抗,稀释度为1∶5000,室温封闭2 h,1×PBST清洗6次,每次5 min。将PVDF膜置于二氨基联苯胺显色液中进行显色,直至目的条带清晰即可。
1. 8 间接免疫荧光分析
传代培养GiCF细胞至融合度为90%时进行病毒感染(病毒提取自CyHV-2感染7 d的GiCF细胞),感染2 h后移除CyHV-2并加入完全培养基(含2% FBS),出现细胞病变(CPE)后以PBS清洗除去病毒;4%多聚甲醛固定10 min,移除固定液,采用0.4% Triton X-100进行透化处理,并以PBS清洗除去甲醛;5%脱脂牛奶封闭3 h,PBS清洗除去脱脂牛奶,ORF6多克隆抗体孵育2 h,PBS清洗;加入FITC标记兔抗鼠IgG(二抗),PBS清洗后加入DAPI熒光染料,室温下染色10 min,倒置荧光显微镜观察并拍照记录。以未感染病毒的GiCF细胞为对照。
2 结果与分析
2. 1 ORF6基因测序分析结果
CyHV-2的ORF6基因全长3003 bp,其编码蛋白分子量为110.00 kD。依据ORF6基因核苷酸序列及NCBI数据库的比对分析发现,CyHV-2的ORF6蛋白与CyHV-3及CyHV-1的ORF6蛋白相比,均具有一段保守氨基酸结构域(图1),其氨基酸序列相似性均高于30.00%,其中与CyHV-3的相似性高达39.36%。
蛋白表面能使免疫系统产生抗体的部位被称为抗原决定簇(B细胞表位),通常是由5~8个氨基酸残基组成。由于ORF6蛋白全长抗原表位分布不均,因此有必要对其抗原决定簇表位进行预测分析,采用BepiPred-2.0在线预测CyHV-2的ORF6蛋白抗原决定簇(Jespersen et al.,2017),结果表明分值最高为0.63,在第1~300位氨基酸的峰值普遍较高(图2),即ORF6蛋白的抗原表位最可能存在于第1~300位氨基酸序列中。
2. 2 ORF6基因扩增结果
根据GenBank已公布CyHV-2的ORF6基因序列设计引物,并以CyHV-2感染7 d的GiCF细胞DNA为模板,PCR扩增产物采用1.5%琼脂糖凝胶电泳进行检测分析,结果(图3)表明,扩增获得的目的条带大小为300 bp,与预期结果一致。
2. 3 重组质粒pET-28a-ORF6构建结果
将PCR扩增产物纯化后与原核表达载体pET-28a进行双酶切处理,然后通过T4 DNA连接酶将连接好的重组质粒转化至BL21(DE3)感受态细胞中,最后提取质粒送至生工生物工程(上海)股份有限公司进行测序验证,结果显示重组质粒pET-28a-ORF6构建成功。以重组质粒pET-28a-ORF6转化BL21(DE3)感受态细胞,用于后续诱导融合蛋白表达分析。
2. 4 融合蛋白可溶性分析结果
转化重组质粒pET-28a-ORF6的BL21(DE3)感受态细胞经0.2 mmol/L IPTG诱导4 h后,采用超声波破碎菌体,离心后分别收集上清液及沉淀样品进行SDS-PAGE分析。结果显示,IPTG诱导菌体沉淀在17.13 kD处出现目的条带(图4),而在未经IPTG诱导的对照菌体中没有对应的目的条带,由此可认定目标蛋白主要以包涵体的形式存在于沉淀中。
2. 5 融合蛋白最佳诱导表达条件
为了最大量诱导表达获得融合蛋白ORF6,分别以终浓度为0.1、0.2、0.5和1.0 mmol/L的IPTG诱导5 h,SDS-PAGE分析结果(图5)显示IPTG的最佳诱导浓度为0.5 mmol/L。
2. 6 融合蛋白纯化效果
诱导表达获得的融合蛋白ORF6分别以2、4、6和8 mol/L的尿素进行溶解,然后采用Solarbio MD44透析袋进行纯化处理,SDS-PAGE分析结果(图6)显示,以6 mol/L尿素的洗涤纯化效果最佳。采用该浓度尿素进行纯化,结果(图7)显示,ORF6中杂带较少,特异性较好,其浓度为0.1 mg/mL。
2. 7 ORF6多克隆抗体制备及鉴定结果
以纯化融合蛋白ORF6免疫Babl/c小鼠,在免疫后收集小鼠血清制备ORF6多克隆抗体。为鉴定ORF6多克隆抗体能否特异性识别ORF6蛋白,采用未感染CyHV-2的GiCF细胞样品和纯化融合蛋白ORF6样品检测其特异性,SDS-PAGE分析结果(图8)显示ORF6多克隆抗体可特异性识别抗原。Western blotting检测结果(图9)也显示,ORF6多克隆抗体可与融合蛋白ORF6发生特异性免疫反应,同时能与CyHV-2感染GiCF细胞发生特异性免疫反应,即制备获得的ORF6多克隆抗体可用于鉴定CyHV-2感染。
2. 8 间接免疫荧光分析结果
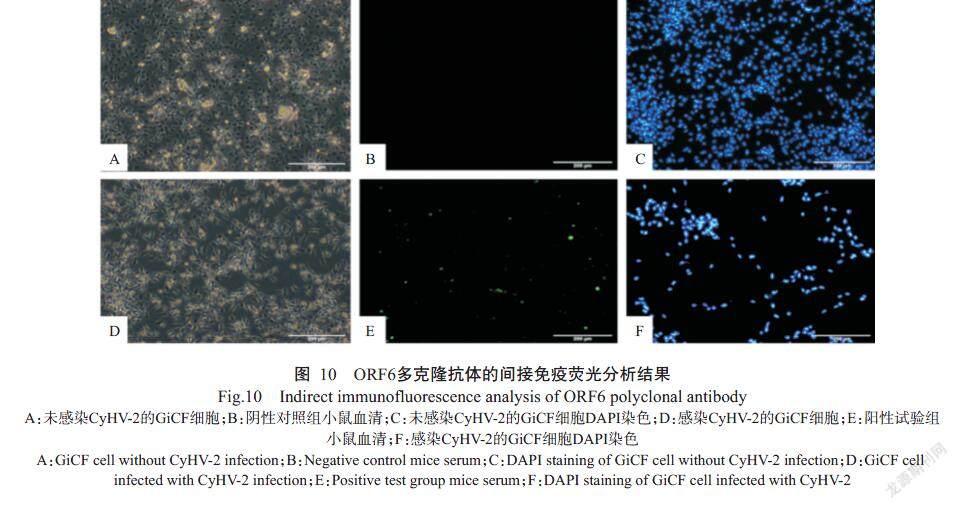
利用制备的ORF6多克隆抗体对CyHV-2感染GiCF细胞进行间接免疫荧光分析,显微镜观察结果显示,未感染CyHV-2的对照组GiCF细胞未发现CPE现象(图10-A),而CyHV-2感染组GiCF细胞出现明显的CPE现象(图10-D)。DAPI染色结果显示,与对照组GiCF细胞(图10-C)相比,感染组GiCF细胞出现大批量细胞死亡现象(图10-F);对照组GiCF细胞未能观察到特异性绿色荧光(图10-B),而在感染组GiCF细胞周围能观察到特异性绿色荧光(图10-E),进一步说明ORF6多克隆抗体可特异性识别CyHV-2。
3 讨论
在许多脊椎动物及某些无脊椎动物中均发现有疱疹病毒存在,疱疹病毒感染的独特特征是潜伏感染(潜伏期)。潜伏期是疱疹病毒最显著的特性,可确保在未发生急性感染的情况下在宿主中长期保存其遗传信息(Whitley and Roizman,2001)。至今,已知CyHV-2的主要免疫原性蛋白有ORF92、ORF115、ORF25、ORF57、ORF66、ORF72、ORF131和ORF132(高娃等,2020),并证实ORF66作为衣壳蛋白能激发细胞免疫和体液免疫,具有良好的免疫原性,但是否与潜伏感染相关尚有待进一步探究。本研究通过PCR扩增CyHV-2的ORF6基因,并成功构建重组质粒pET-28a-ORF6,在BL21(DE3)感受态细胞中经IPTG诱导表达,获得约17.13 kD的融合蛋白,且发现融合蛋白ORF6以包涵体形式进行表达,利用尿素洗涤纯化可得到纯度较高的融合蛋白;以纯化融合蛋白ORF6免疫小鼠获得的ORF6多克隆抗体能与CyHV-2发生特异性反应,能在CyHV-2感染3~5 d有效识别病毒颗粒,为后期探究ORF6蛋白功能是否与CyHV-2潜伏感染相关打下了基础。
许多疱疹病毒在潜伏感染过程中表达潜伏期相关蛋白。在鼠丙种疱疹病毒68(MHV68)中,与潜伏期相关的M2蛋白在潜伏期建立和再激活中发挥关键作用(Siegel et al.,2008),但在建立潜伏期方面表现出剂量依赖性缺陷(Jacoby et al.,2002)。在Epstein-Barr virus(EBV)潜伏期可检测到9种潜在蛋白(Kang and Kieff,2015)。其中,EBNA-1在潜伏期建立和再激活中具有多种作用(Sivachandran et al.,2012);膜蛋白1(LMP1)可阻断细胞凋亡,并在感染宿主细胞中提供生长信号(Ndour et al.,2012;Brocqueville et al.,2013);EBNA-2可保护EBV感染细胞免受特定凋亡刺激(Farrell et al.,2004)。疱疹病毒感染后,机体表达多种基因并产生抗体,但在潜伏期间相关基因和mRNA是否表达或沉默,以及受何种机制调控尚未明确。卡波西氏肉瘤疱疹病毒(KSHV)包含1个潜伏期位点,在潜伏期内表达许多基因和miRNA(Ye et al.,2011;Purushothaman et al.,2016)。在KSHV的复制过程中,潜伏期相关核抗原会促进病毒阴体与子细胞的染色体结合,从而确保其感染持久性(Barbera et al.,2004;Ballestas and Kaye,2011)。同样,LANA2是一种潜伏蛋白,多存在于B细胞中,在潜伏期转化过程中发挥有效的p53抑制剂作用(Rivas et al.,2001)。在人巨细胞病毒(HCMV)潜伏感染期间,需要潜在独特的天然抗原(LUNA)重新激活并进行免疫抑制(Keyes et al.,2012;Mason et al.,2013)。可见,潜伏感染与急性感染在基因转录过程中依然存在某些关联,为揭示CyHV-2的潜伏感染机制提供了新思路。
CyHV-2与许多其他疱疹病毒一样,在原发感染后的宿主中具有疑似潜伏感染状态,但CyHV-2在潜伏感染方面尚缺乏足够的证据。CyHV-2 ORF6与CyHV-3 ORF6的氨基酸序列具有较高的相似性。Reed等(2017)研究表明,KHV(CyHV-3)在潜伏状态下表达部分蛋白,其中ORF6是CyHV-3潜伏期产生的主要蛋白,且ORF6基因是在CyHV-3潜伏期检测到的主要转录本。CyHV-3 ORF6蛋白既存在于体外感染,也存在于体内潜伏性感染。ORF6蛋白可能在不同感染阶段具有翻译后修饰作用(黄锋涛等,2010;刘玉林等,2011),且ORF6蛋白是了解疱疹病毒潜伏感染机制的关键蛋白(Reed et al.,2017),预示着ORF6蛋白在功能上对CyHV-2复制具有潜在的作用。本研究结果表明,制备获得的ORF6多克隆抗体能特异性识别CyHV-2,为深入探究ORF6蛋白在CyHV-2感染過程中的潜在功能提供了研究基础。当CyHV-3为潜伏感染时,病毒仅以非整合基因组的形式存在宿主细胞核内,在某些条件的刺激下CyHV-3能被重新激活,导致宿主表现出临床症状并引起死亡(陈俊杰,2017)。此外,各种环境因子和应急反应均会重新诱发潜伏感染的疱疹病毒再激活。小鼠单纯疱疹病毒重新被激活与白介素6(IL-6)的升高及机体免疫能力下降有关(李平等,2004);大鼠单纯疱疹病毒1型(HSV-1)神经节的潜伏感染也呈现相同特征,且得到比刺激前更强烈的疼痛阈值(刘润泽等,2020)。在CyHV-2的潜伏感染中是否存在某一因子或某些因子协同作用而促使潜伏感染被诱发,也是目前值得考虑的问题之一。
关于CyHV-2感染时病毒滴度及感染时间是否对鱼体成功感染造成相应影响,本课题组已成功建立CyHV-2实验室感染模型(Goodwin et al.,2009),发现以病毒滴度为106/mL的CyHV-2感染鲫鱼72 h后,部分鲫鱼开始出现病发和死亡现象,而部分鲫鱼可携带病毒并依然存活,推测其携带病毒但并未发病,即存在潜伏感染的可能性。目前,尚无足够证据佐证CyHV-2在急性感染和潜伏感染中复制或调控途径的差异性,也未找到潜伏感染时依旧进行转录的基因,因此进一步探究ORF6在不同感染模式中的表达及其调控方式,可为解析CyHV-2感染的潜伏性及其分子机制提供理论依据。
4 结论
制备获得的ORF6多克隆抗体能与CyHV-2感染GiCF细胞发生特异性免疫反应,即可用于鉴定CyHV-2感染,为探究ORF6蛋白功能是否与CyHV-2潜伏感染相关打下了基础。
参考文献:
陈俊杰,李媛媛,阳瑞雪,古晶晶,汪开毓,耿毅,欧阳萍. 2017. 锦鲤疱疹病毒潜伏感染实时荧光定量PCR检测方法的建立[J]. 湖南农业大学学报(自然科学版),43(3):310-314. [Chen J J,Li Y Y,Yang R X,Gu J J,Wang K Y,Geng Y,Ouyang P. 2017. Method of real-time PCR for the detecting latent infection of Koi herpesvirus[J]. Journal of Hunan Agricultural University(Natural Sciences),43(3):310-314.] doi:10.13331/j.cnki.jhau.2017.03.016.
陈俊杰. 2017. 锦鲤疱疹病毒的分离鉴定及急性和潜伏感染检测方法的建立[D]. 成都:四川农业大学. [Chen J J. 2017. Isolation and identification of a Koi herpesvirus and development of method for detection of Koi herpesvirus in lytic and latent infection[D]. Chengdu:Sichuan Agricultural University.]
高娃,温虹,王浩,陆佳荃,吕利群,姜有声. 2020. 鲤疱疹病毒Ⅱ型主要免疫原性蛋白的鉴定[J]. 水产学报,44(9):1441-1447. [Gao W,Wen H,Wang H,Lu J Q,Lü L Q,Jiang Y S. 2020. Identification of major immunogenic proteins from Cyprinid herpesvirus 2[J]. Journal of Fishe-ries of China,44(9):1441-1447.] doi:10.11964/jfc.2019 0611828.
黄锋涛,熊海林,曹胜波,熊传喜,王敏,王卫民,吴兵,刘玉林,刘学芹. 2010. 斑点叉尾鮰病毒囊膜蛋白ORF6在昆蟲细胞中的表达[J]. 水产学报,34(7):1034-1039. [Huang F T,Xiong H L,Cao S B,Xiong C X,Wang M,Wang W M,Wu B,Liu Y L,Liu X Q. 2010. Expression of channel catfish virus ORF6 gene in insect cell[J]. Journal of Fisheries of China,34(7):1034-1039.] doi:10.3724/ SP.J.1231.2010.06854.
李平,谢鹏,赵高年. 2004. 小鼠单纯疱疹病毒I型潜伏感染模型的建立[J]. 中国比较医学杂志,14(5):290-293. [Li P,Xie P,Zhao G N. 2004. The establishment of latent infection of herpes simplex virus type-1 in murine model[J]. Chinese Journal of Comparative Medicine,14(5):290-293.]
刘润泽,杨艳玲,方卓然,薛进朗,王云,邓超,陈传俊. 2020. 1型单纯疱疹病毒三叉神经节潜伏感染再激活对大鼠三叉神经痛阈的影响[J]. 中国口腔颌面外科杂志,18(3):214-218. [Liu R Z,Yang Y L,Fang Z R,Xue J L,Wang Y,Deng C,Chen C J. 2020. Decrease of pain threshold of trigeminal nerve induced by reactivation of latent trigeminal ganglia infection of herpes simplex virus type 1 in SD rats[J]. China Journal of Oral and Maxillofacial Surgery,18(3):214-218.] doi:10.19438/j.cjoms.2020. 03.005.
刘世超. 2012. 锦鲤疱疹病毒Nested-PCR检测方法的建立及初步应用[D]. 南京:南京农业大学. [Liu S C. 2012. Establishment and preliminary application of Koi herpesvirus nested-PCR detection methods[D]. Nanjing:Nanjing Agricultural University.] doi:10.7666/d.Y2361012.
刘玉林,王卫民,王敏,李莉娟. 2011. 斑点叉尾鮰病毒ORF6基因的高效可溶表达及抗原性分析[J]. 湖北农业科学,50(5):1001-1003. [Liu Y L,Wang W M,Wang M,Li L J. 2011. High soluble expression and antigenicity of ORF6 gene of channel catfish virus[J]. Hubei Agricultu-ral Sciences,50(5):1001-1003.] doi:10.14088/j.cnki.issn 0439-8114.2011.05.052.
鲁建飞. 2018. 基于RNA-Seq技术鉴定鲤疱疹病毒Ⅱ型编码的功能miRNA及miR-C12调控细胞凋亡研究[D]. 上海:上海海洋大学. [Lu J F. 2018. Identification of cyprinid herpesvirus 2-encoded miRNA based on RNA-Seq and the regulation of apoptosis by miR-C12[D]. Shanghai:Shanghai Ocean University.]
王璐. 2012. 江苏地区鲫出血病病原的分离、鉴定及检测方法研究[D]. 南京:南京农业大学. [Wang L. 2012. The research of isolation and identification of pathogeny from the hermorrage disease of prussian carp(Carassius gibelio) in Jiangsu China and its detection method[D]. Nanjing:Nanjing Agricultural University.] doi:10.7666/d.Y2361708.
王姝,吕晓楠,徐立蒲,张文,王静波,王小亮,曹欢. 2020. 鲤疱疹病毒Ⅱ型RAA-LFD检测方法的建立[J]. 检验检疫学刊,30(3):1-4. [Wang S,Lü X N,Xu L P,Zhang W,Wang J B,Wang X L,Cao H. 2020. Development of recombinase-aid amplification assay combined with lateral flow dipstick for detection[J]. Journal of Inspection and Quarantine,30(3):1-4.]
闻金萱,杨倩玲,陈燕,孙萌,王浩. 2020. 实时荧光重组酶聚合酶扩增技术(RPA)快速检测Ⅱ型鲤疱疹病毒[J]. 微生物学通报,48(2):676-685. [Wen J X,Yang Q L,Chen Y,Sun M,Wang H. 2020. A real-time recombinase polymerase amplification (RPA) assay for the rapid detection of CyHV2[J]. Microbiology China,48(2):676-685.] doi: 10.13344/j.microbiol.china.200260.
徐進,曾令兵,杨德国,张辉,马杰,江南,范玉顶. 2013. 鲤疱疹病毒2型武汉株的分离与鉴定[J]. 中国水产科学,20(6):1303-1309. [Xu J,Zeng L B,Yang D G,Zhang H,Ma J,Jiang N,Fan Y D. 2013. Isolation and characterization of Cyprinid herpesvirus 2 WH strain[J]. Journal of Fishery Sciences of China,20(6):1303-1309.] doi:10. 3724/SP.J.1118.2013.01303.
晏文岩,鲁建飞,孔善云,沈兆媛,杨雨清,吕利群,许丹. 2017. Ⅱ型鲤疱疹病毒ORF4的多克隆抗体制备及其组织分布[J]. 微生物学通报,44(8):1938-1946. [Yan W Y,Lu J F,Kong S Y,Shen Z Y,Yang Y Q,Lü L Q,Xu D. 2017. Prokaryotic expression,polyclonal antibody pre-paration and tissue-tropism analysis of Cyprinid herpesvirus II non-structural protein ORF4[J]. Microbiology China,44(8):1938-1946.] doi:10.13344/j.microbiol.china.17 0043.
叶元土,吴萍,蔡春芳,林秀秀,吴代武,何杰,张宝彤,萧培珍. 2017. 在患CyHV-2病的异育银鲫肠道黏膜中胆固醇、胆汁酸代谢通路基因的差异表达[J]. 水生生物学报,41(5):956-962. [Ye Y T,Wu P,Cai C F,Lin X X,Wu D W,He J,Zhang B T,Xiao P Z. 2017. Gene diffe-rence expression of cholesterol and bile acid metabolism pathway in intestinal mucosa with the CyHV-2 disease Carassius auratus gibelio[J]. Acta Hydrobiologica Sinica,41(5):956-962.] doi:10.7541/2017.119.
余琳,呂利群,王浩. 2019. Ⅱ型鲤疱疹病毒ORF121蛋白的多克隆抗体制备及鉴定[J]. 水产学报,43(6):1463-1471. [Yu L,Lü L Q,Wang H. 2019. Preparation and characte-rization of polyclonal antibody against Cyprinid herpesvirus 2 ORF121[J]. Journal of Fisheries of China,43(6):1463-1471.] doi:10.11964/jfc.20180911458.
袁锐,陈静,刘训猛,吴亚锋,王晶晶,方苹. 2019. 鲤疱疹病毒2型研究进展[J]. 水产学杂志,32(1):38-45. [Yuan R,Chen J, Liu X M, Wu Y F, Wang J J, Fang P. 2019. A review:Research progress on Cyprinid herpesvirus 2[J]. Chinese Journal of Fisheries,32(1):38-45.] doi:10.3969/j.issn.1005-3832.2019.01.008.
赵欣. 2016. 鲤疱疹病毒2型ddPCR检测方法的建立及其抗体库的筛选[D]. 武汉:华中农业大学. [Zhao X. 2016. Development and evaluation of droplet digital PCR assay for the detection of CyHV-2 and selection single-chain recombinant antibodies against CyHV-2[D]. Wuhan:Huazhong Agricultural University.]
周瑶佳,田思璐,许佳雪,李尹麒,杨悦,耿毅,黄小丽,陈德芳,汪开毓,欧阳萍. 2020. 四川地区养殖鲫鲤疱疹病毒II型的鉴定及病理学研究[J]. 水产学报,44(9):1397-1407. [Zhou Y J,Tian S L,Xu J X,Li Y Q,Yang Y,Geng Y,Huang X L,Chen D F,Wang K Y,Ouyang P. 2020. Identification and pathological study of Cyprinid herpesvirusⅡin Sichuan[J]. Journal of Fisheries of China,44(9):1397-1407.] doi:10.11964/jfc.20190711875.
Ballestas M E,Kaye K M. 2011. The latency-associated nu-clear antigen,a multifunctional protein central to Kaposis sarcoma-associated herpesvirus latency[J]. Future Microbiology,6(12):1399-1413. doi:10.2217/fmb.11.137.
Barbera A J,Ballestas M E,Kaye K M. 2004. The Kaposi?s sarcoma-associated herpesvirus latency-associated nuclear antigen 1 N terminus is essential for chromosome associa-tion,DNA replication,and episome persistence[J]. Journal of Virology,78(1):294-301. doi:10.1128/JVI.78.1.294-301.2004.
Brocqueville G,Ndour P A,Ouk T S,Goff A L,de Witte C,Mougel A,Coll J,Fafeur V,Bourhis X L,Adriaenssens E. 2013. LMP1-induced cell death may contribute to the emergency of its oncogenic property[J]. PLoS One,8(4):e60743. doi:10.1371/journal.pone.0060743.
Chang P H,Lee S H,Chiang H C,Jong M H. 2009. Epizoo-tic of herpes-like virus infection in goldfish,Carassius auratus in Taiwan[J]. Fish Pathology,34(4):209-210. doi:10.3147/jsfp.34.209.
Doszpoly A,Benk? M,Csaba G,Dán A,Lang M,Harrach B. 2011. Introduction of the family Alloherpesviridae:The first molecular detection of herpesviruses of cyprinid fish in Hungary[J]. Magyar Allatorvosok Lapja,133(3):174-181.
Farrell C J, Lee J M, Shin E C, Cebrat M, Cole P A, Hayward S D. 2004. Inhibition of Epstein-Barr virus-induced growth proliferation by a nuclear antigen EBNA2-TAT peptide[J]. Proceedings of the National Academy of Scien-ces of the United States of America,101(13):4625-4630. doi:10.1073/pnas.0306482101.
Goodwin A E,Sadler J,Merry G E,Marecaux E N. 2009. Herpesviral haematopoietic necrosis virus (CyHV-2) infection case studies from commercial goldfish farms[J]. Journal of Fish Diseases,32(3):271-278. doi:10.1111/j. 1365-2761.2008.00988.x.
Jacoby M A,Virgin V H W,Speck S H. 2002. Disruption of the M2 gene of murine gammaherpesvirus 68 alters splenic latency following intranasal,but not intraperito-neal,inoculation[J]. Journal of Virology,76(4):1790-1801. doi:10.1128/jvi.76.4. 1790-1801.2002.
Jespersen M C,Peters B,Nielsen M,Marcatili P. 2017. BepiPred-2.0:Improving sequence-based B-cell epitope prediction using conformational epitopes[J]. Nucleic Acids Research,45(W1):W24-W29. doi:10.1093/nar/gkx346.
Jung S J,Miyazaki T. 2010. Herpesviral haematopoietic necrosis of goldfish,Carassius auratus(L.)[J]. Journal of Fish Diseases,18(3):211-220. doi:10.1111/j.1365-2761.1995.tb00296.x.
Kang M S,Kieff E. 2015. Epstein-Barr virus latent genes[J]. Experimental & Molecular Medicine,47(1):e131. doi:10.1038/emm.2014.84.
Keyes L R,Hargett D,Soland M,Bego M G,Rossetto C C,Almeida-Porada G,Jeor S S. 2012. HCMV protein LUNA is required for viral reactivation from latently infec-ted primary CD14+ cells[J]. PLoS One,7(12):e52827. doi:10.1371/journal.pone.0052827.
Lu J F,Xu D,Lu L Q. 2018. A novel cell line established from caudal fin tissue of Carassius auratus gibelio is susceptible to Cyprinid herpesvirus 2 infection with the induction of apoptosis[J]. Virus Research,258:19-27. doi:10.1016/j.virusres.2018.09.010.
Mason G M,Jackson S,Okecha G,Poole E,Sissons J G P,Sinclair J,Wills M R. 2013. Human cytomegalovirus latency-associated proteins elicit immune-suppressive IL-10 producing CD4+ T cells[J]. PLoS Pathogens,9(10):e1003635. doi:10.1371/journal.ppat.1003635.
Ndour P A,Brocqueville G,Ouk T S,Goormachtigh G,Morales O,Mougel A,Bertout J,Melnyk O,Fafeur V,Feuillard J,Coll J,Adriaenssens E. 2012. Inhibition of latent membrane protein 1 impairs the growth and tumorigenesis of latency II Epstein-Barr virus-transformed T cells[J]. Journal of Virology,86(7):3934-3943. doi:10.1128/JVI.05747-11.
Podok P,Wang H,Xu L J,Xu D,Lu L Q. 2014. Characterization of myeloid-specific peroxidase,keratin 8,and dual specificity phosphatase 1 as innate immune genes involved in the resistance of crucian carp(Carassius auratus gibelio) to Cyprinid herpesvirus 2 infection[J]. Fish & Shellfish Immunology,241(2):531-540. doi:10.1016/j.fsi.2014.10.001.
Purushothaman P,Dabral P,Gupta N,Sarkar R,Verma S C. 2016. KSHV genome replication and maintenance[J]. Frontiers in Microbiology,7:54. doi:10.3389/fmicb.2016.00054.
Reed A N,Lin L S,Ostertag-Hill C,Wang Q,Wu Z X,Miller-Morgan T,Jin L. 2017. Detection of ORF6 protein associated with latent KHV infection[J]. Virology,500:82-90. doi:10.1016/j.virol.2016.09.030.
Reed A N,Satoko I,Dolan B P,LaPatra S,Kent M,Dong J,Jin L. 2014. Identification of B cells as a major site for Cyprinid herpesvirus 3 latency[J]. Journal of Virology,88(16):9297-9309. doi:10.1128/JVI.00990-14.
Rivas C,Thlick A E,Parravicini C,Moore P S,Chang Y. 2001. Kaposi?s sarcoma-associated herpesvirus LANA2 is a B-cell-specific latent viral protein that inhibits p53[J]. Journal of Virology,75(1):429-438. doi:10.1128/JVI.75.1.429-438.2001.
Siegel A M,Herskowitz J H,Speck S H. 2008. The MHV68 M2 protein drives IL-10 dependent B cell proliferation and differentiation[J]. PLoS Pathogens,4(4):e1000039. doi:10.1371/journal.ppat.1000039.
Sivachandran N,Wang X Q,Frappier L. 2012. Functions of the Epstein-Barr virus EBNA1 protein in viral reactivation and lytic infection[J]. Journal of Virology,86(11):6146-6158. doi:10.1128/JVI.00013-12.
Whitley R J,Roizman B. 2001. Herpes simplex virus infections[J]. Lancet,357(9267):1513-1518. doi:10.1016/S0140-6736(00)04638-9.
Ye F C,Lei XCF,Gao S J. 2011. Mechanisms of Kaposi?s sarcoma-associated herpesvirus latency and reactivation[J]. Advances in Virology. doi:10.1155/2011/193860.
(責任编辑 兰宗宝)
——一道江苏高考题的奥秘解读和拓展

