外源褪黑素对盐胁迫下紫花苜蓿幼苗抗氧化能力以及光合作用效率的影响
赵丽娟,麻冬梅,王文静,马巧利,李嘉文,苏立娜
(宁夏大学 西北土地退化与生态系统恢复省部共建国家重点实验室培育基地/西北退化生态系统恢复与重建教育部重点实验室 银川 750021)
非生物胁迫,特别是盐、碱、重金属、干旱和极端温度正成为植物充分发挥遗传潜力的阻碍,限制了世界范围内的作物产量[1-2]。其中,盐分是作物生产力最严重的障碍之一,植物中过量的盐分表现为渗透胁迫和离子毒性的结合,造成活性氧的积累而导致氧化胁迫[3]。植物有各种各样的策略来应对这些胁迫,包括通过根系吸收和运输到叶片来调节离子平衡,积累相容的溶质,如碳水化合物和脯氨酸,以及通过增加抗氧化物酶活性来清除活性氧,主要包括过氧化物酶、超氧化物歧化酶等[4]。中国盐碱地的面积总量达9913万 hm2,主要分布在东北、华北、西北,盐碱地的开发利用具有重大价值[5],因此,通过培育耐盐碱品种来对土壤进行改良是当前研究者密切关注的问题之一。
紫花苜蓿(MedicagosativaL.)是一种优良的多年生豆科牧草,在中国种植广泛,是最重要的饲用作物之一。因其蛋白质含量高、营养价值丰富、生物产量高,被誉为“牧草之王”,对畜牧业发展有着十分重要的作用[6,1]。紫花苜蓿对所处生长环境的土壤质量要求不高,可以在轻度盐碱地生长,是中等耐盐植物,为改良盐碱地做出了很大贡献。但是高浓度盐胁迫对苜蓿生长、根瘤形成和共生固氮能力产生不利影响,严重限制了高盐环境下苜蓿的生物量[7]。目前,中国苜蓿种植区土壤盐碱化问题严重,导致其产量下降严重,提高苜蓿品种的耐盐性是提高苜蓿产量的重要方法[8]。
褪黑素(Melatonin,MT)是一种生物刺激因子,属于吲哚杂环类化合物,最初在维管植物中发现,其主要作用是作为一种抗氧化分子,通过降低活性氧(ROS)、活性氮 (RNS)和调节相关基因来应对氧化胁迫,增强植物抗逆性[8-9]。迄今,已有许多文献报道,褪黑素浸种能有效提高植物的抗逆性,引发改善植物水分状况,提高玉米幼苗抗旱性[10],并显著缓解高盐胁迫下紫花苜蓿种子发芽率的下降[8]以及钠钾离子失衡造成的损伤[11]。而在农业耕作中,种子适宜干播的作物只能采用叶面喷施和根灌的方法进行相关处理,其中根灌法对植物来说是最有效的、最易获取营养的方法。采用根灌法研究褪黑素对植物在逆境环境下的影响甚少,为了研究不同浓度褪黑素对盐胁迫下紫花苜蓿幼苗生长和生理指标的影响,本试验以紫花苜蓿品种‘中苜1号’为材料,采用水培根灌褪黑素的方法来考察褪黑素对盐胁迫的缓解作用,为利用褪黑素提高紫花苜蓿耐盐性和盐碱地的改良提供了理论依据。
1 材料和方法
1.1 材料来源
参试紫花苜蓿(MedicagosativaL.)品种为 ‘中苜1号’,种子由曹致中老师馈赠。选取饱满种子适量,用2%的次氯酸钠溶液消毒7 min,期间不断摇晃,无菌水冲洗4-5次后,备用。
1.2 盐和褪黑素浓度筛选
首先,选取40粒种子放置于有3层滤纸的培养皿中,滤纸用不同浓度的氯化钠(100、125、150、200、250 mmol/L)和褪黑素(5、30、50、80、100、200 μmol/L)分别浸湿,并以去离子水作为对照,共12个处理,每个处理3次重复。种子先在25 ℃暗培养2 d,然后转至23 ℃/25 ℃、光周期为16 h/8 h条件下进行光培养,5 d后,测量根长,计算萌发率。
其次,选取40粒种子置于有3层滤纸的培养皿中,滤纸用不同浓度(0、5、30、50、80、100、200 μmol/L)的褪黑素和150 mmol/L NaCl共同(v/v=1∶1)浸湿复合处理,共7个处理,各处理3次重复。培养条件同上,5 d后测量根长,计算萌发率。
1.3 盐和褪黑素复合处理
试验设置8个处理:CK(对照,去离子水)、NaCl(150 mmol/L氯化钠)、MT1(30 μmol/L褪黑素)、MT2(50 μmol/L褪黑素)、 MT3(80 μmol/L褪黑素)、NaCl+MT1(150 mmol/L 氯化钠+30 μmol/L褪黑素)、NaCl+ MT2(150 mmol/L 氯化钠+50 μmol/L褪黑素)、NaCl+MT3(150 mmol/L 氯化钠+80 μmol/L褪黑素),选取40粒种子置于3层滤纸的培养皿中,滤纸用相应褪黑素浓度和盐浓度配比(v∶v=1∶1)处理液浸湿,培养条件同上,每个处理3次重复,将萌发5 d后的幼苗移至水培盒(127 mm×87 mm×114 mm)进行培养,水培液为相应褪黑素浓度和盐浓度配比(v∶v=1∶1)处理液,以去离子水作对照(CK),每3 d更换1次水培液,取水培培养7 d的紫花苜蓿幼苗测定相关指标。
1.4 测定指标及方法
1.4.1 生长指标取水培盒中生长7 d后的紫花苜蓿幼苗,首先用卷尺测量幼苗根长和株高,分离根的样本,先测定鲜重,再放入105 ℃烘箱烘干至恒重,称取干重。分离叶片,采用剪纸称重法测定叶面积[12],叶面积=100×待测叶叶形纸重量/100 cm2纸重,每个处理3次重复。
1.4.2 丙二醛和相对电导率叶片丙二醛含量采用硫代巴比妥酸法测定[13],测定532、600、450 nm波长下的吸光度值OD532、OD600和OD450,依据公式计算丙二醛含量[6.45×(OD532-OD600)-0.56×OD450×提取液体积/植物组织鲜重(g),μmol/g],每个处理3次重复。另外,称取100 mg叶片浸入去离子水中,并在37 ℃下培养2 h,然后使用电导率仪(STARTER 3100C)测量溶液的电导率(E1);将样品抽真空15 min,冷却至室温后测量总电导率(E2);使用公式计算相对电导率(E1/E2×100)[14],每个处理测量3次重复。
1.4.3 相对含水量叶片称鲜重,然后将叶片浸入蒸馏水中24 h,随后吸干表面水分,并记录饱和重。在60 ℃的烘箱中干燥样品,记录干重。使用公式估算相对含水量(RWC),每个处理测量3次重复。
RWC(%)=[(鲜重-干重)/(饱和重-干重)]×100%
1.4.4 脯氨酸含量和抗氧化酶活性叶片脯氨酸含量测定采用磺基水杨酸提取,茚三酮比色法测定,过氧化物酶(POD)活性采用愈创木酚法测定,超氧化物歧化酶(SOD)活性采用氮蓝四唑法测定,过氧化氢酶(CAT)活性采用紫外吸收法测定,均采用陈建勋所描述的方法[15],每个处理测量3次重复。
1.4.5 光合指标在天气晴朗的中午9:00~11:00采用便携式光合作用仪 (Li-6400XT, 美国) 测定紫花苜蓿幼苗顶部完全张开的叶片的净光合速率、气孔导度和蒸腾速率,每个处理测量3次重复。
1.5 数据分析
统计分析用SPSS 22.0,用GraphPad绘图。
2 结果与分析
2.1 不同浓度盐和褪黑素处理下紫花苜蓿种子萌发及幼苗生长情况比较
褪黑素有益于植物的生长发育并且具有缓解各种非生物胁迫危害的功能,在进行褪黑素缓解盐胁迫实验前,需要先筛选出合适的盐和褪黑素浓度。与对照相比,各浓度盐处理紫花苜蓿幼苗根长均大幅下降,植株明显矮小,根长在100和200 mmol/L盐处理下分别显著降了75.15%和93.93%(图1,A、B);同时,就种子萌发率来看,紫花苜蓿种子在250 mmol/L盐处理下没有萌发(图中未显示),在100 mmol/L盐处理下萌发率无显著变化,在125、150、200 mmol/L盐处理下萌发率显著降低,分别达到85.5%、38.3% 和6.7%(图1,C)。由于200 mmol/L盐胁迫后紫花苜蓿幼苗趋近死亡状态,最终以150 mmol/L NaCl作为本试验盐胁迫的最佳浓度。
同时,为评价褪黑素对种子萌发和幼苗生长的影响,进一步对褪黑素处理浓度进行筛选。首先,在无盐胁迫条件下,紫花苜蓿种子经不同浓度的褪黑素(0、5、30、50、80、100、200 μmol/L)处理后,其根系较不处理时短粗(图1,D),种子萌发率无明显变化(图1,E)。其次,经150 mmol/L NaCl与不同浓度褪黑素(v∶v=1∶1)共同施加筛选出褪黑素对盐胁迫缓解的最佳浓度。其中,各浓度褪黑素处理紫花苜蓿幼苗生长情况均比单独盐胁迫处理明显好转,且30、50、80 μmol/L的褪黑素浓度处理的紫花苜蓿幼苗生长状况较好(图1,F);种子萌发率均比单独盐胁迫处理显著提高,但各浓度褪黑素处理间无显著差异(图1,G);幼苗根长随着褪黑素浓度的增加先升高后降低,但各浓度褪黑素处理均比单独盐胁迫处理不同程度提高,并以30、50、80 μmol/L褪黑素处理显著高于其余处理(图1,H、I)。因此,适宜浓度褪黑素处理能显著缓解盐胁迫对紫花苜蓿种子萌发、幼苗生长造成的伤害,并以30、50、80 μmol/L褪黑素的效果最好,最终选择这些浓度进行后续实验。
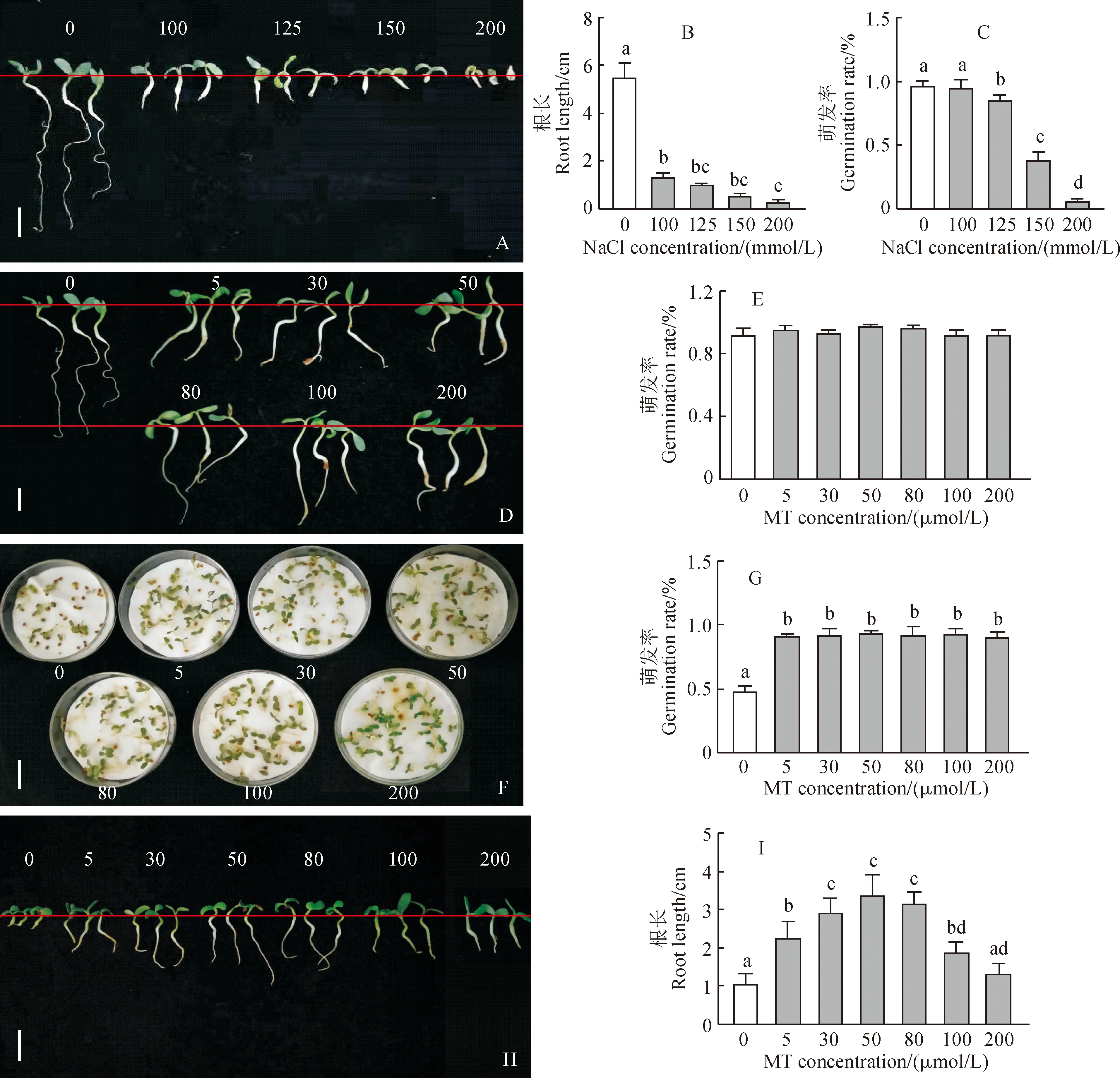
A-C.NaCl处理:A.根系形态;B.根长;C.萌发率;D-E.褪黑素处理:D.根系形态; E.萌发率; F-I. 盐(150 mmol/L的NaCl)和不同浓度褪黑素复合处理:F.生长状况;G.萌发率;H.根系形态;I.根长;不同的小写字母表示在处理之间在0.05水平存在显著性差异,下同图1 苜蓿种子在不同浓度NaCl、褪黑素及盐与褪黑素复合处理5 d 后的萌发状态A-C. NaCl treatment: A. root morphology; B. Root length; C. Germination rate; D-E. Melatonin treatment: D. Root morphology; E. Germination rate; F-I. Salt and melatonin combined treatment: F. Growth status; G. Germination rate; H. Root morphology; 1. Root length; Different normal letters showed significant differences at the level of 0.05; the same as belowFig.1 Germination state of alfalfa seeds under different concentrations of NaCl, melatonin and salt stress combined with melatonin for 5 days
2.2 褪黑素对盐胁迫下紫花苜蓿幼苗生长的影响
表1显示,紫花苜蓿幼苗所有生长指标(根长、株高、叶面积、根鲜重和根干重)在单独盐胁迫(150 mmol/L NaCl)下分别比对照(CK)显著下降了42.15%、12.4%、38.68%、45.45%和44.61%,而在单独褪黑素处理(MT1、MT2、MT3)下均无显著变化。与单独盐胁迫处理相比,各盐与褪黑素复合处理(NaCl+MT1、NaCl+MT2、NaCl+MT3)紫花苜蓿幼苗的根长、根鲜重和根干重均显著增加,并以NaCl+MT2处理增幅最大,分别达到34.52%、41.93%和19.61%,同时它们的株高和叶面积也有所提高,且仍以NaCl+MT2处理增幅最大,但增幅均未达到显著水平。可见,紫花苜蓿幼苗生长受到盐胁迫(150 mmol/L NaCl)的显著抑制,却未受到各浓度褪黑素的影响;各浓度褪黑素有效缓解了盐胁迫对紫花苜蓿生长造成的伤害,并以NaCl+MT2处理效果最佳。
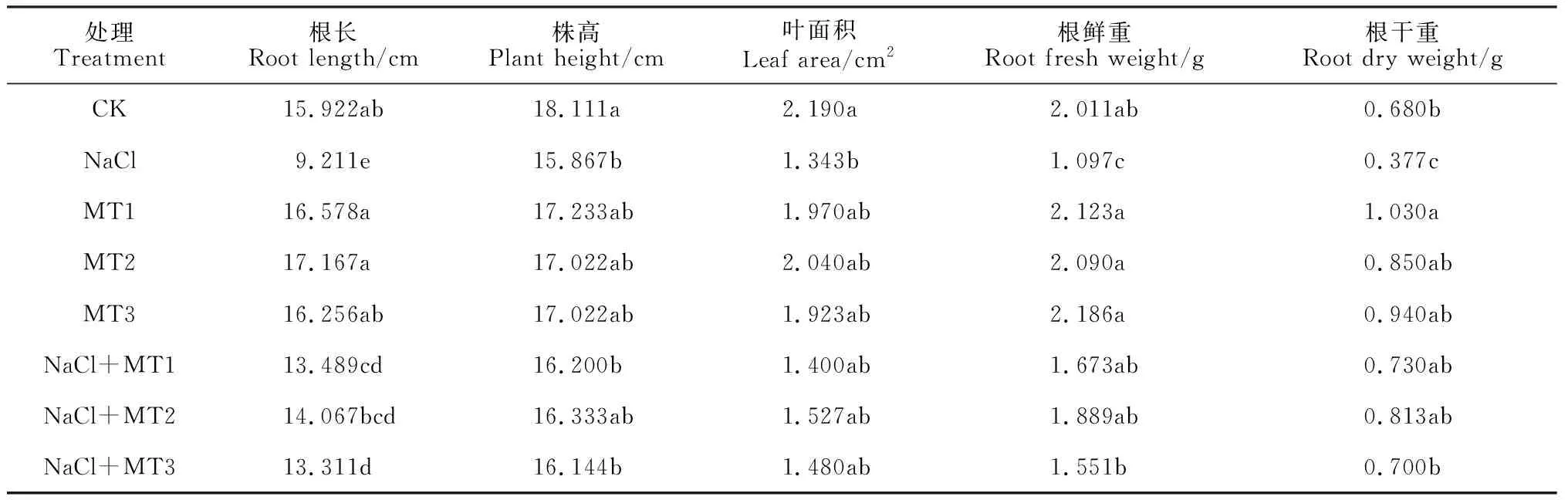
表1 不同浓度外源褪黑素对盐胁迫下紫花苜蓿幼苗生长相关参数的变化
2.3 褪黑素对盐胁迫下紫花苜蓿幼苗叶片膜透性的影响
电导率代表植物细胞的通透性,是衡量植物耐盐性的重要指标,而丙二醛(MDA)是脂质氧化的终产物,反映了膜脂过氧化的程度,这两指标可以间接反映植物膜系统的损伤程度和抗逆性[16]。由图2可知,与对照相比,紫花苜蓿幼苗叶片MDA和相对电导率在各浓度外源褪黑素单独处理下大多无显著变化,而在单独盐胁迫(150 mmol/L NaCl)下均大幅显著增加;与单独盐胁迫处理相比,盐和褪黑素复合处理紫花苜蓿叶片MDA含量和相对电导率均显著降低,并以NaCl+MT3处理的相对电导率和NaCl+MT2处理的MDA含量最低,它们分别比单独盐胁迫处理显著降低了31.84%和30.24%,但各复合处理间均无显著差异(图2,Ⅰ、Ⅱ)。以上结果表明,盐胁迫显著增加了紫花苜蓿细胞膜系统的透性和膜脂过氧化程度,而施加外源褪黑素可以有效缓解盐胁迫下细胞膜损伤的程度。
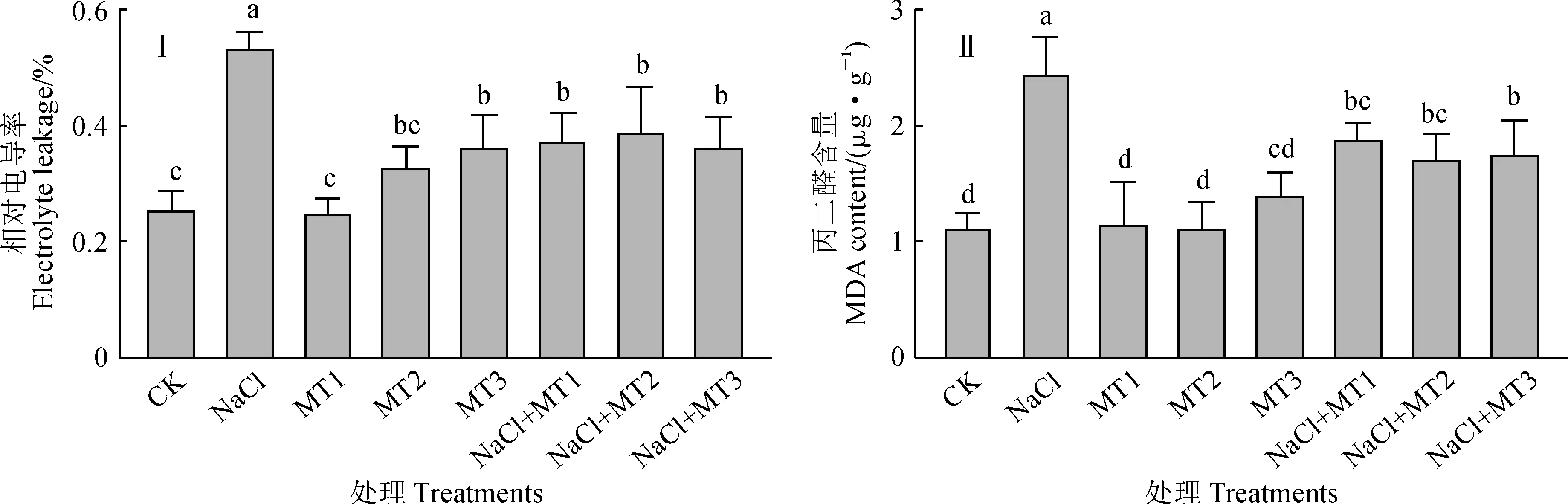
图2 外源褪黑素对盐胁迫下紫花苜蓿幼苗叶片相对电导率和丙二醛含量(MDA)的变化Fig.2 Effect of exogenous melatonin on relative electrolyte leakage and MDA content in leaves of alfalfa seedling under salt stress condition
2.4 褪黑素对盐胁迫下紫花苜蓿幼苗叶片相对含水量和脯氨酸的影响
叶片相对含水量反映了植物在胁迫条件下的叶片水分状况和存活能力。与对照相比,紫花苜蓿幼苗叶片相对含水量在单独盐胁迫处理下显著降低,而在单独褪黑素处理下均无显著变化;与单独盐胁迫处理相比,盐和褪黑素复合处理(NaCl+MT1、NaCl+MT2、NaCl+MT3)幼苗叶片的相对含水量均显著增加,增幅分别为17.05%、15.27%、11.85%,但仍显著低于对照(图3,Ⅰ);同时,紫花苜蓿幼苗叶片的脯氨酸含量在单独盐胁迫后比对照大幅度显著增加,而在单独褪黑素处理后较对照有一定程度的提高,但未达到显著水平;与单独盐胁迫处理相比,紫花苜蓿幼苗叶片的脯氨酸含量在盐和褪黑素复合处理下均显著大幅降低,NaCl+MT1、NaCl+MT2、NaCl+MT3处理分别显著降低了43.99%、48.35%、37.72%,但各复合处理间无显著差异(图3,Ⅱ)。可见,盐胁迫显著降低了紫花苜蓿幼苗叶片相对含水量,却显著提高了其脯氨酸含量;单独褪黑素处理对幼苗叶片相对含水量和脯氨酸含量均无显著影响;外源褪黑素处理可显著提高盐胁迫幼苗叶片的相对含水量,却显著降低其脯氨酸含量,表明褪黑素不仅可以有效缓解盐胁迫下细胞失水危害,也可缓解盐胁迫下细胞膜的过氧化程度。
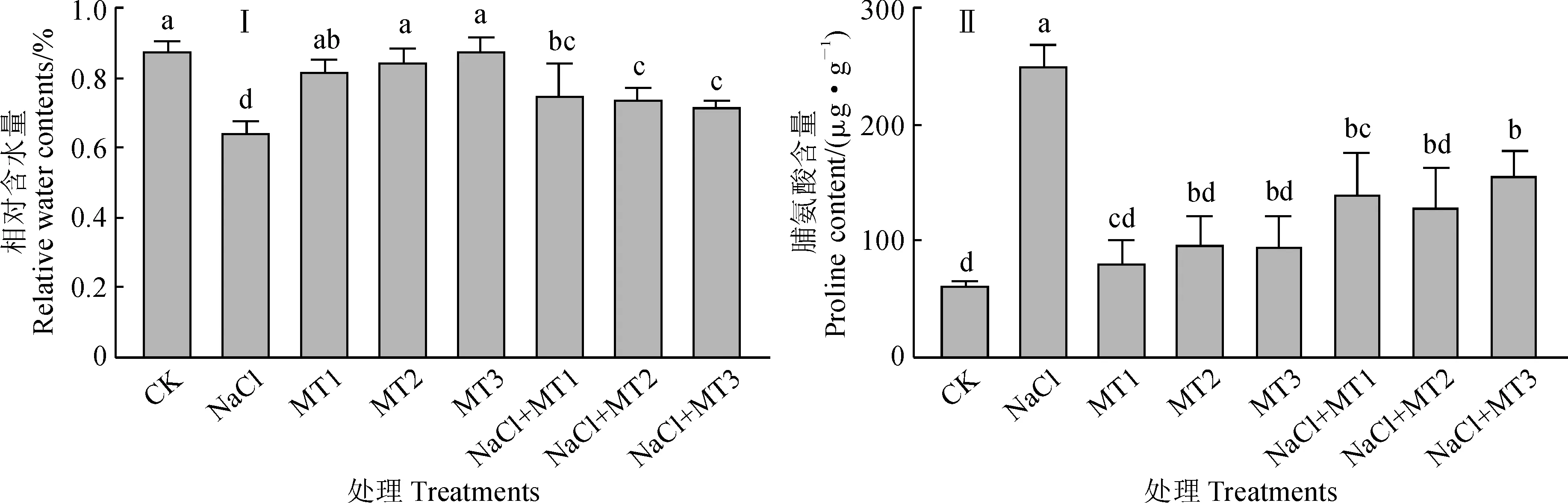
图3 外源褪黑素对盐胁迫下紫花苜蓿幼苗叶片相对含水量和脯氨酸含量的变化Fig.3 Effect of exogenous melatonin on relative water content and proline content in leaves of alfalfa seedling under salt stress condition
2.5 褪黑素对盐胁迫下紫花苜蓿幼苗叶片抗氧化物酶活性的影响
许多研究发现,与O2相比,部分还原或活化的氧衍生物具有高度的活性和毒性,并能导致细胞的氧化伤害,这是好氧生物发展出高效的活性氧(ROS)清除机制的必然结果[17-19],ROS的清除机制是植物耐盐机制的重要组成部分。图4显示,在单独盐胁迫处理(NaCl)和褪黑素处理(MT1、MT2、MT3)下,紫花苜蓿幼苗叶片过氧化物酶(POD)、抗氧化酶(SOD)、过氧化氢酶(CAT)的活性大多显著高于对照;与单独盐胁迫处理相比,盐和褪黑素复合处理(NaCl+MT1、NaCl+MT2、NaCl+MT3)幼苗叶片的POD活性分别显著提高25.66%、31.45%、30.47%,SOD活性分别显著提高38.04%、41.41%、39.74%,而它们的CAT活性也有增加的趋势,但均未达到显著水平。以上结果说明,在盐胁迫条件下,外源褪黑素可诱导紫花苜蓿幼苗叶片POD、SOD活性显著增强,提高其活性氧的清除能力,减轻盐胁迫诱导的过氧化伤害。
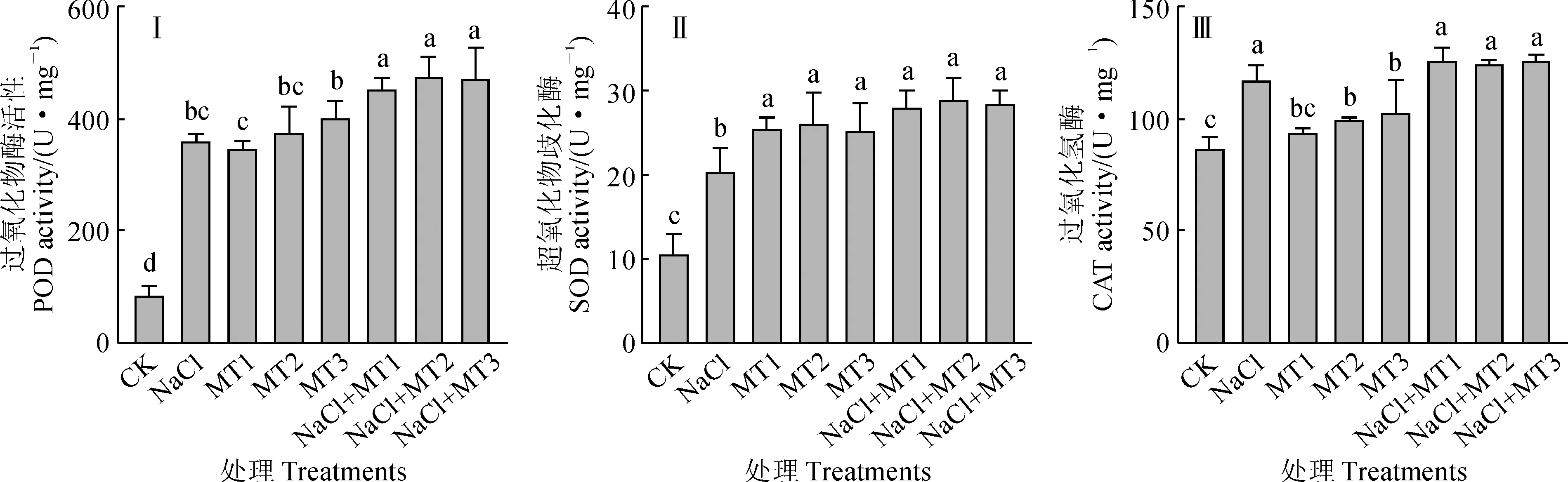
图4 外源褪黑素对盐胁迫下紫花苜蓿幼苗叶片抗氧化物酶活性的变化Fig.4 Effect of exogenous melatonin on antioxidant enzyme activities in leaves of alfalfa seedling under salt stress condition
2.6 褪黑素对盐胁迫下紫花苜蓿幼苗叶片光合作用指标的影响
与其他细胞器相比,叶绿体对盐胁迫更敏感[20],盐分对光合作用的影响主要表现在抑制CO2向叶绿体的扩散和叶片光化学的改变[21]。图5显示,在单独盐胁迫条件下,紫花苜蓿幼苗叶片净光合速率、气孔导度和蒸腾速率较对照分别显著下降了25.62%、36.25%和32.91%;MT2和MT3处理的净光合速率、MT2处理的气孔导度均显著高于对照,而MT1处理的蒸腾速率显著低于对照,其余单独褪黑素处理光合参数均与对照无显著差异;与单独盐胁迫处理相比较,盐和褪黑素复合处理叶片的各光合参数均显著提高,并均以NaCl+MT2处理增幅最高,增幅分别为30.27%、45.1%、42.15%,但各复合处理之间多无显著差异。以上结果表明,盐胁迫显著抑制了紫花苜蓿幼苗光合作用,施加外源褪黑素可有效缓解盐胁迫造成的危害,对提高盐胁迫环境下植株的光合作用起着至关重要的作用。
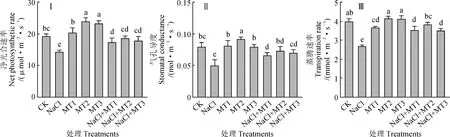
图5 外源褪黑素对盐胁迫下紫花苜蓿幼苗叶片净光合速率、气孔导度和蒸腾速率的变化Fig.5 Effect of exogenous melatonin on net photosynthetic rate, stomatal conductance and transpiration rate of alfalfa seedling under salt stress condition
3 讨论与结论
紫花苜蓿作为天然的优质牧草,盐分是限制其正常生长的非生物胁迫因子之一。王晓春等[22]研究表明,低浓度(0.2%)盐对多数苜蓿种子的萌发有一定的促进作用,但当盐浓度为 0.8% 时,畸形苗开始出现,且根长明显缩短,1.2%的盐浓度是紫花苜蓿耐盐的极限浓度;‘中苜1号’在150 mmol/L(约0.88%)盐处理后,根长迅速下降,且萌发率也大幅降低[23]。本研究也表明150 mmol/L NaCl可作为‘中苜1号’盐胁迫实验的最佳浓度。褪黑素是一种在植物进化过程中高度保守的胺类激素,其在植物中既是一种多效性的信号分子,又是一种有效的抗氧化分子[24],褪黑素具有剂量依赖性,最佳浓度的褪黑素具有抗环境胁迫的作用,但不同植物的最适浓度不同。Shakeel的研究发现,60 μmol/L的外源褪黑素显著提高了盐胁迫下玉米的生长、叶绿素含量、光合效率和抗氧化酶活性,降低了体内活性氧(ROS)水平[25]。施用外源褪黑素能有效促进金盏菊幼苗对盐胁迫的适应性,以 100 μmol/L 褪黑素处理效果最好[26]。本研究发现缓解紫花苜蓿幼苗盐胁迫危害的外源褪黑素最佳浓度为50 μmol/L。
已有研究表明,外源褪黑素能提高某些植物的耐盐性。本试验表明,褪黑素通过改善盐胁迫对幼苗生长特性的抑制作用,有效地提高了幼苗对盐胁迫的适应性。Ahmad[25]和Cen[11]研究发现,外源褪黑素都显著减弱了盐胁迫对玉米幼苗生长指标的抑制作用,本研究进一步证实了前人的研究结果。已有研究表明,褪黑素诱导根系生长受生长素调节生理过程的调控,影响根系对水分的吸收,启动细胞壁不可修复的延伸[27]。本研究结果与前人在盐胁迫条件下施用褪黑素增加油菜种子根长的研究结果一致[28]。本研究发现,在盐胁迫下施加外源褪黑素处理与单独盐胁迫处理相比,紫花苜蓿幼苗的根长和根鲜重分别显著增加了34.52%和41.93%,增加幅度明显比其他生长指标更大,这可能与本研究通过水培根灌法将褪黑素直接作用于紫花苜蓿幼苗根部相关。光合作用是植物一项重要的生理功能[29],在盐胁迫下植物的一个重要反应是关闭气孔以减少水分的损失,从而限制了光合作用,已有众多研究表明褪黑素可缓解盐胁迫对光合作用的抑制作用[25,30]。本研究结果也表明外源褪黑素使得紫花苜蓿幼苗叶片净光合速率、气孔导度和蒸腾速率较盐胁迫处理都显著增加,有效缓解了盐胁迫对光合作用的抑制程度。因此,适量施用外源褪黑素可以有效改善气孔的功能,使植物在盐胁迫下重新打开气孔,对气孔限制的缓解有助于盐胁迫下光合作用的增强。
本研究发现在盐胁迫处理下,紫花苜蓿幼苗叶片丙二醛和相对电导率都显著增加,而施加外源褪黑素可以显著降低这两个指标的增幅,有效缓解盐胁迫下膜损伤的程度,维持植物细胞膜结构的稳定。同样,外源褪黑素处理可显著降低盐胁迫下月季叶片的相对电导率和丙二醛含量[31]。前人研究表明,外源褪黑素也可以减轻盐胁迫条件下小麦幼苗的水分损失[32];本研究结果表明,盐胁迫下施加褪黑素提高了紫花苜蓿幼苗叶片相对含水量,减轻水分损失;并有效改善了盐胁迫下紫花苜蓿幼苗叶片脯氨酸含量,这与李红杰的研究结果相似[30]。有研究表明,褪黑素具有两亲性,能进入亚细胞部分,使其具有更强的抗氧化作用;除此之外,与褪黑素相关的代谢产物也具有抗氧化作用,能够减轻由非生物胁迫引起的活性氧的产生以及增加抗氧化物酶活性[33]。在本研究中,施加外源褪黑素显著增强了盐胁迫下紫花苜蓿幼苗叶片POD和SOD活性,而其CAT活性虽有增加趋势,但增幅未达到显著水平。在众多研究中,外源褪黑素处理都显著提高了以上3个抗氧化酶的活性,从而增强了植株活性氧的清除能力[11,25,30-31]。因此,应用褪黑素可以降低盐介导的活性氧对紫花苜蓿幼苗的有害影响,提高植物对逆境的抗性。
综上所述,在盐胁迫条件下,紫花苜蓿幼苗叶片抗氧化物酶活性显著降低,活性氧的积累增加,细胞膜质结构受到破坏,膜透性增加,植株光合作用效率以及生长受到显著抑制。外源褪黑素处理可显著提高盐胁迫下紫花苜蓿幼苗体内POD和SOD活性,从而减少ROS的积累,显著降低MDA含量和相对电导率,增强抗氧化防御系统活性,最终显著提高了紫花苜蓿幼苗的光合作用效率,促进植株生长,从而表现出一定的耐盐胁迫能力。在本研究的150 mmol/L NaCl胁迫条件下,施用50 μmol/L外源褪黑素最有利于缓解紫花苜蓿幼苗受到的盐胁迫伤害,显著增强其耐盐性,对植株生长产生积极影响。

