多酶催化体系在医药化学品合成中的应用
汤恒,韩鑫,邹树平,郑裕国
(浙江工业大学生物工程学院手性生物制造国家地方联合工程研究中心,浙江 杭州 310014)
1 多酶催化体系
多酶催化体系是指模拟体内代谢过程,在体外将几种不同功能的酶级联组装成一个结构和功能整体,催化一系列连续的生化反应,将简单底物转化为复杂产物的生物催化反应体系。同时多酶催化体系是一种可调控的系统,通过级联酶之间的紧密接触,形成“底物通道”,避免了细胞代谢中分子无规律运动导致的中间产物扩散损失[1]。在体外可以快速实现胞内的各种代谢反应,克服了传统发酵周期长、生产效率低、易受毒副产物抑制等缺点[2]。
天然的多酶催化体系在细胞内十分常见,如糖酵解途径、三羧酸循环等[3-5]。在代谢过程中,经常通过形成多酶级联的复合物,形成“底物通道效应”而实现特定代谢产物的高效合成。“底物通道效应”是多酶级联反应的一种现象,即一个酶将催化完成的产物转移到下一个邻近酶的催化位点,作为另一个酶的催化底物的过程,这种现象只有两个酶的距离足够近时才会发生[6]。譬如,上游酶活性中心释放的中间产物可被下游酶活性中心直接处理,从而避免中间产物的扩散,这种通过连接活性中心的蛋白质隧道被称为“直接底物通道”[图1(a)];另一种可能的通道机制被称为“邻近底物通道”,是指两种酶在没有实际通道的情况下,但活性中心相距足够近,使得上游酶产生的中间产物在扩散之前也可被下游酶捕获并催化[图1(b)];此外,将上游和下游酶的多个拷贝混合组装为功能簇,也可有效提高中间体产物被任意下游酶捕获的概率[图1(c)]。多酶复合物底物通道具有保护不稳定的中间产物,调节同一底物的竞争途径,消除有毒中间代谢物的抑制作用等功能[7]。由于细胞中代谢网络复杂,许多代谢调控还不成熟,产物形成对细胞生长产生抑制作用,致使胞内目标产物积累受到极大限制[8]。因此,近年来体外多酶催化体系越来越受到学者们的关注[9-10]。
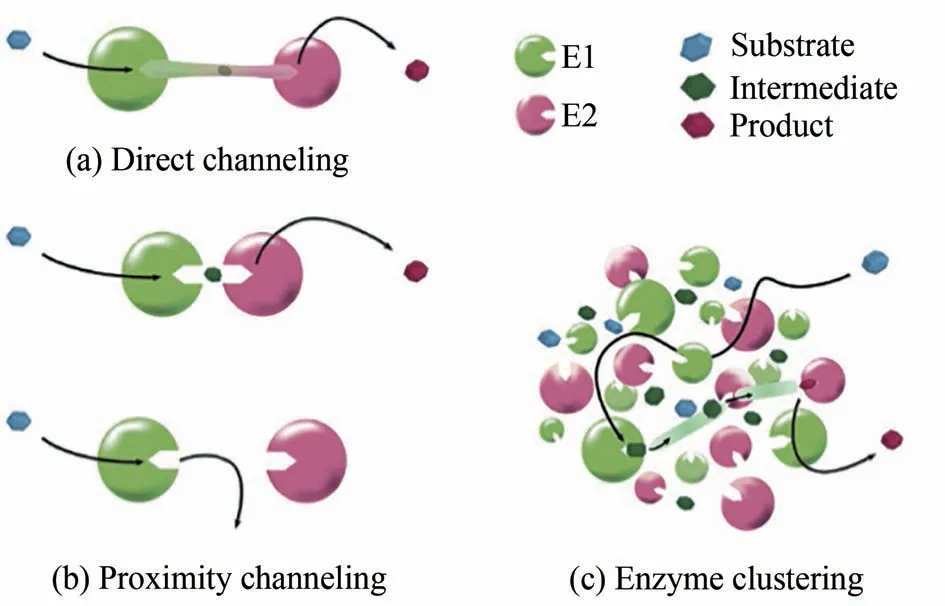
图1 底物通道效应[7]Fig.1 Substrate channel in a two-step metabolic pathway[7](Different types of intermediate channeling in a two-step metabolic pathway,where a substrate is processed by enzyme E1 and turned into intermediate,which is then processed by enzyme E2 and turned into product)
从单一酶催化反应到多酶催化体系,其发展过程不是一蹴而就的。多酶催化体系发展之初只是简单模拟天然的代谢过程,而如今可通过改造天然代谢途径甚至设计全新的人工途径[11-12]来构建更高效率的多酶催化体系。不仅可利用不同宿主来源的天然酶,而且能通过酶的人工进化从而获得催化特性和环境适应性大幅度提高的人工酶。随着越来越多的体内多酶复合体结构和催化机制被揭示与深入研究,巨量生物学数据的不断积累和计算机技术的飞速发展,越来越多的多酶催化体系正在被设计和组装,并应用于化学品的合成中。本文主要对多酶催化体系的构建及在医药化学品合成中的应用方面进行综述。
2 多酶催化体系的构建策略
多酶催化体系的设计通常需要对多个级联的反应过程和合成路径进行热力学和动力学分析,以满足多酶催化体系组装的基本要求[13]:级联的总体热力学参数是正向可行的(∆Gcascade<0),如最后一步催化为不可逆反应则可极大提高产品转化率;酶的催化反应具有高反应特异性和官能团正交性,以避免不同底物之间不必要的交叉反应;整个动力学反应参数由酶活性控制,以保证反应通量。多酶催化体系设计的另一个重要任务是对目标产物进行逆向合成分析[14],建立与产物合成有关的多酶工具箱,对级联酶的选择性、相容性及化合物耐受性进行筛选[15-16]。由于需要协调反应体系中多个酶的理化性质、动力学参数等,所以多酶的协同作用对于实现整个体系的催化效率和稳定性具有影响[17]。此外,多酶催化体系还需要着重考虑体外辅酶的循环与ATP 的供给,如通过建立一个辅酶再生循环[18]或生物电池[19]等来解决辅酶循环问题。
在完成多酶催化途径设计后,多酶的组合往往导致通量不平衡,其整体转化效率受到特定酶的限制。瓶颈效应可能导致某种中间产物的积累,降低了整体转化效率,还会对宿主细胞产生毒性作用。除了研究酶的内在性质以寻求更好的突变体外,设计合理的多酶组装策略也被证明是提高整体途径效率的有效途径,即将多个酶催化反应按照一定层次与空间结构组装起来,使催化连续反应的酶彼此相距更近。多酶催化体系组装策略不仅限于酶融合技术[20]与共固定化技术[21],还包括蛋白质和DNA 支架技术[22](图2),此外还有部分研究采用了RNA 支架和基于病毒结构蛋白的脂质支架[23-24]。各类支架技术已被广泛应用,但仍需要更多的研究优化其构型。
除了基于合成支架构建酶复合物的策略,酶的限域固定化策略是另一种将酶限制于亚细胞空间的方法[图2(d)],通过蛋白融合和超分子组装区室[17,25-27]形成不同层次和空间结构。例如,模拟微区室(mimicking bacterial microcompartment,bmc)是一种与壳亚基组装的大型蛋白质复合物[28],羧酶体是典型的bmc,它通过对代谢途径酶进行限域以提高易逃逸底物和有毒中间体的转化率[29],典型的例子包括二氧化碳固定和1,2-丙二醇降解催化体系[30-31]。部分其他类型的bmc可形成更小的多面体蛋白复合物以适应不同的多酶催化体系[28]。但对其组装和功能化机制的有限了解,如结构蛋白过表达的细胞负担、细胞内bmc 的物理空间挤占、中间体的选择性渗透以及外源酶和壳蛋白之间的相互作用等问题,阻碍了bmc 在生物合成中的应用。然而,酶的限域固定化具有很大的潜力,因为它提供了一个大且相对稳定的亚细胞空间,可容纳高浓度的局部代谢物,同时最大限度地减少对宿主细胞的破坏。
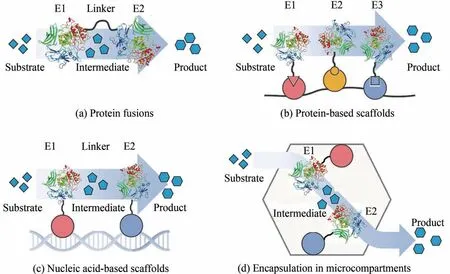
图2 多酶催化体系的组装技术[32]Fig.2 Assembly technology of multi-enzyme catalytic system[32]
现阶段组装复杂的多酶催化过程仍是一项具有挑战性的任务,目前化学品合成中应用较多的多酶催化体系大多采用多酶共反应或共固定化技术,如采用“一锅法”反应,将分离纯化的多酶经过载体结合或者直接于单个反应容器中与底物混合,优化协调各酶的反应条件,最终获得需要的高纯度或单一立体选择性的产品。相对于一般化学品,医药化学品对于立体选择性和对映选择性有着更高的要求,因此在多酶催化体系的构建和组装策略上其精准度和严密性要求远高于一般化学品[32]。同时鉴于医药化学品需进入人体或动物细胞内发挥作用,其在生产方面的安全性要求更高,多酶催化反应后的分离与提纯的要求也更为复杂。
在一种人工多酶级联反应中,酶可能不会共享相似的最佳温度,最佳pH 和其他条件,在相似浓度的试剂下可能不会具有相似的反应速率。因此,需要对多酶催化反应进行测试,并进行适配性优化[33]。如Wahl 等[34]在构建核苷酸糖多酶级联反应体系时,通过建立核苷酸糖的高通量的多重毛细管电泳分析方法(MP-CE),实现了6 个不同酶模块的产物的快速分析检测,解决了常规分析方法耗时、效率低的难题,提高了各酶促反应适配性优化效率。此外,可采用数学模型对每个反应的条件(例如介质、温度、pH 和催化剂稳定性)进行平衡与优化,并结合快速检测方法寻找最佳的控制条件[35]。
综上,各种方法已被开发用于酶固定化,包括酶融合、支架基络合和限域固定化,随着对这些方法的进一步理解,在构建多酶催化体系时,要综合考虑各酶促反应热力学和动力学特性,合理设计层次结构与空间结构,以便突破反应限速步骤与合成产率瓶颈,使更复杂的组装技术助力更多产物的生物合成。
3 多酶催化体系在医药化学品合成中的应用
3.1 多酶催化体系在抗生素类药物合成中的应用
头孢菌素类抗生素的品种数量是各类抗生素之首[36],约占全球抗感染类药物的50%市场份额[37]。脱酰基-7-氨基头孢烷酸(D-7-ACA)是一种重要的医药中间体,一般用于内酰胺类抗生素的合成[38-41]。如图3所示,Wei等[42]采用“两酶一锅法”替代传统的“三酶三锅法”,通过耦合固定化头孢菌素C 酰化酶(CPCA)和固定化头孢菌素C去乙酰化酶(CAH)进行反应,最终获得的D-7-ACA 产率为78.39%,比产率达到10.85 g/(g·h·L),比传统方法的比产率提高了约4倍。
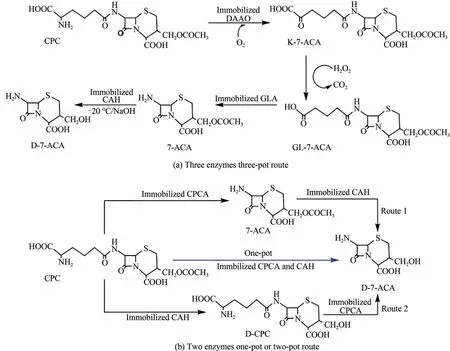
图3 脱酰基-7-氨基头孢烷酸新旧合成路线比较[42]Fig.3 Comparison of two deacetyl-7-aminocephalosporanic acid synthetic routes[42]
D-2-氨基丁酸(D-2-aminobutyric acid)是一种非天然氨基酸,在药物生产中起着重要的中间体的作用[43],能够合成抗生素[44-45]、基质金属蛋白酶抑制剂[46-49]和抗增殖药[50]等。目前对α-氨基酸外消旋体进行拆分是获得光学纯D-氨基酸的主要方法,由于原子经济性低和排放量大等问题,工业上迫切需要开发出一种原料较为便宜且副产物少的生产方法。Chen等[50]在体外构建了一种新的多酶催化体系(图4),由L-苏氨酸脱氨酶、D-氨基酸脱氢酶和甲酸酯脱氢酶组成,以容易获得的L-苏氨酸为底物,通过两步酶促反应,首先由L-苏氨酸脱氨酶催化生成2-氧代丁酸,然后结合辅因子被D-氨基酸脱氢酶还原胺化获得D-2-氨基丁酸,过程中无需额外添加氨,副产物只有水和二氧化碳,同时D-2-氨基丁酸的产率高于90%且纯度大于99%。该系统能通过易获得的L-α-氨基酸合成D-α-氨基酸,该方法原子经济性高,具有良好的发展前景。

图4 多酶催化合成D-2-氨基丁酸[50]Fig.4 Synthesis of D-2-aminobutyric acid catalyzed by multi-enzyme[50][L-threonine deaminase catalyzes production of 2-oxobutyric acid,which is combined with cofactors to be reductively amination by D-amino acid dehydrogenase to obtain D-2-aminobutyric acid,and at same time combined with formate dehydrogenase(FDH)to achieve NADPH of recycling]
聚酮化合物是临床上重要的天然产物[51],由于其复杂的化学结构,常常需要步骤烦琐的有机合成[52]。肠球菌素(enterococcin)作为一种关键的聚酮化合物,是由人或动物肠道中的肠球菌在代谢过程中合成并分泌的一类具有抑菌作用的细菌素[53]。Moore 课题组[54]首次在体外构建了Ⅱ型聚酮类化合物的酶促合成途径,该体系利用单个反应容器及苯甲酸及丙二酰CoA 作为反应底物,设计了由酮合成酶链延长因子的异源二聚体(EncA-EncB),酰基载体蛋白(ACP)和ACP 转酰基酶组成的聚酮化合物合酶,并耦联聚酮化合物生物合成必需的ACP 连接酶(EncN)和酮还原酶(EncD)、黄素蛋白(EncM)和甲基转移酶(EncK),通过外源补加ATP 及NADPH 及相应辅因子(SAM),最终抗生素肠球菌素的总收率达到了25%(图5)。
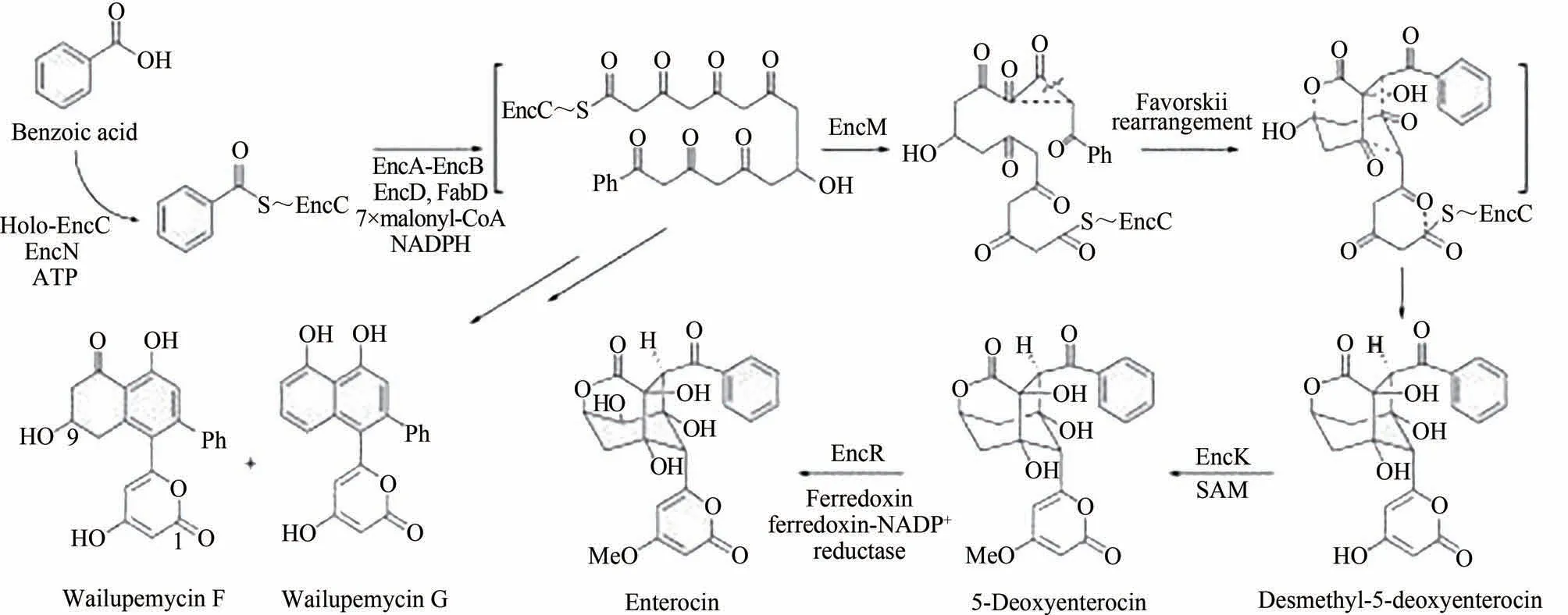
图5 肠球菌素的体外多酶催化合成途径[54]Fig.5 Multienzyme catalyzed synthesis pathway of enterococcin in vitro[54]
3.2 多酶催化体系在抗癌药物合成中的应用
L-酪氨酸(L-tyrosine)衍生物是一些生化标记物和抗癌药物的重要前体,同时还是合成生物学中重要的非标准氨基酸[55-63],特别是3-甲氧基-L-酪氨酸,不仅是左旋多巴的前体[64],还是人类L-氨基酸脱羧酶缺乏症的重要生化指标[57,65]。如果通过化学法从头合成酪氨酸衍生物,不仅需要多个步骤,而且还会产生外消旋物质,需要进行后续的分离。为了更高效地合成L-酪氨酸衍生物,Dennig 等[66]设计了一种通过一锅两步法进行合成的多酶级联反应(图6),利用了单加氧酶和C—C裂解酶的联合活性,以有取代基的苯、丙酮酸和氨气为起始底物,在级联过程中成功去除了抑制性酚类反应中间体,可以获得纯度大于97%的L-酪氨酸衍生物。以含甲苯的粗芳香族汽油共混物为底物,可制得3-甲基-L-酪氨酸2 g/L,产率为97%。时空产率达到0.19 g/(L·h)。
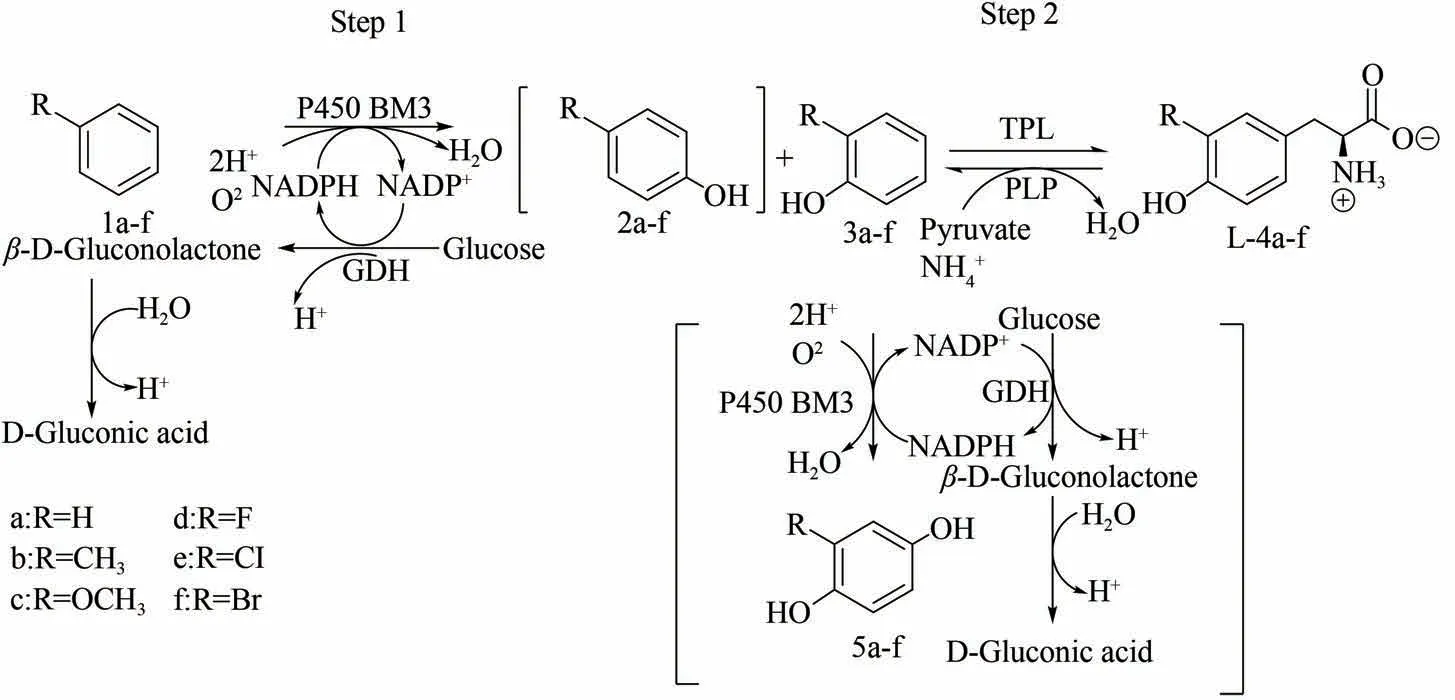
图6 一锅法多酶级联催化合成L-酪氨酸衍生物[66]Fig.6 Synthesis of L-tyrosine derivatives by one-pot multi-enzyme cascade catalysis[66][Regioselective and chemoselective hydroxylation of aromatics(1a-f)is catalyzed by highly selective P450 BM3 mutant to generate o-phenol intermediates(3a-f)and p-phenol intermediates(2a-f).In second step,under condition of consuming NH3,tyrosine phenol lyase(TPL)catalyzes C-C coupling of 3a-f to generate pyruvate to obtain L-4a-f]
2'-脱氧鸟苷酸(deoxyguanosine-2'-monophosphate,dGMP)是合成寡脱氧核苷酸等抗病毒、抗肿瘤核酸药物的重要原料,可直接用于制备组合脱氧核苷药物或者作为化学试剂用于生化研究[67-68]。同时又可作为中间体用于合成一些抗病毒核苷类药物以及分子标记物[69]。传统上,dGMP 是从DNA 降解产物分离出来的,这表示其是低产且耗时的。Li 等[70]研究了一种新型的一锅多酶级联反应以生产dGMP(图7)。该反应涉及来自大肠杆菌的嘌呤核苷磷酸化酶(PNPase)和乙酸激酶(ACKase),来自德氏乳杆菌的N-脱氧核糖转移酶Ⅱ(NDT-Ⅱ)和来自枯草芽孢杆菌的脱氧鸟苷激酶(dGKase)。最初的鸟苷底物首先被PNPase裂解为鸟嘌呤和1-磷酸核糖。随后NDT-Ⅱ催化鸟嘌呤和胸苷反应生成脱氧鸟苷(dGR)。最后,通过dGKase 和ACKase 利用乙酰磷酸的胞苷三磷酸(CTP)再生系统将中间体dGR 磷酸化为dGMP。在反应过程中,最初的鸟苷底物被PNPase切割成鸟嘌呤和核糖-1-磷酸。然后,dGR 随后由鸟嘌呤和胸苷之间的反应产生,NDT-Ⅱ催化反应进行。最后,中间体脱氧核糖核酸通过脱氧葡萄糖苷酶和CTP磷酸化生成dGMP。在反应过程中,添加了非常少量的CTP,因为CTP 再生可有效地将磷酸基团从乙酰磷酸酯转移至dGR。孵育12 h 后,基于添加5 mmol/L 鸟苷和5 mmol/L 胸苷,获得的最高dGMP产率高达76%。这是一种绿色高效生产dGMP的新型生物合成途径,选用了低成本的环保试剂并减少了中间产物的积累。
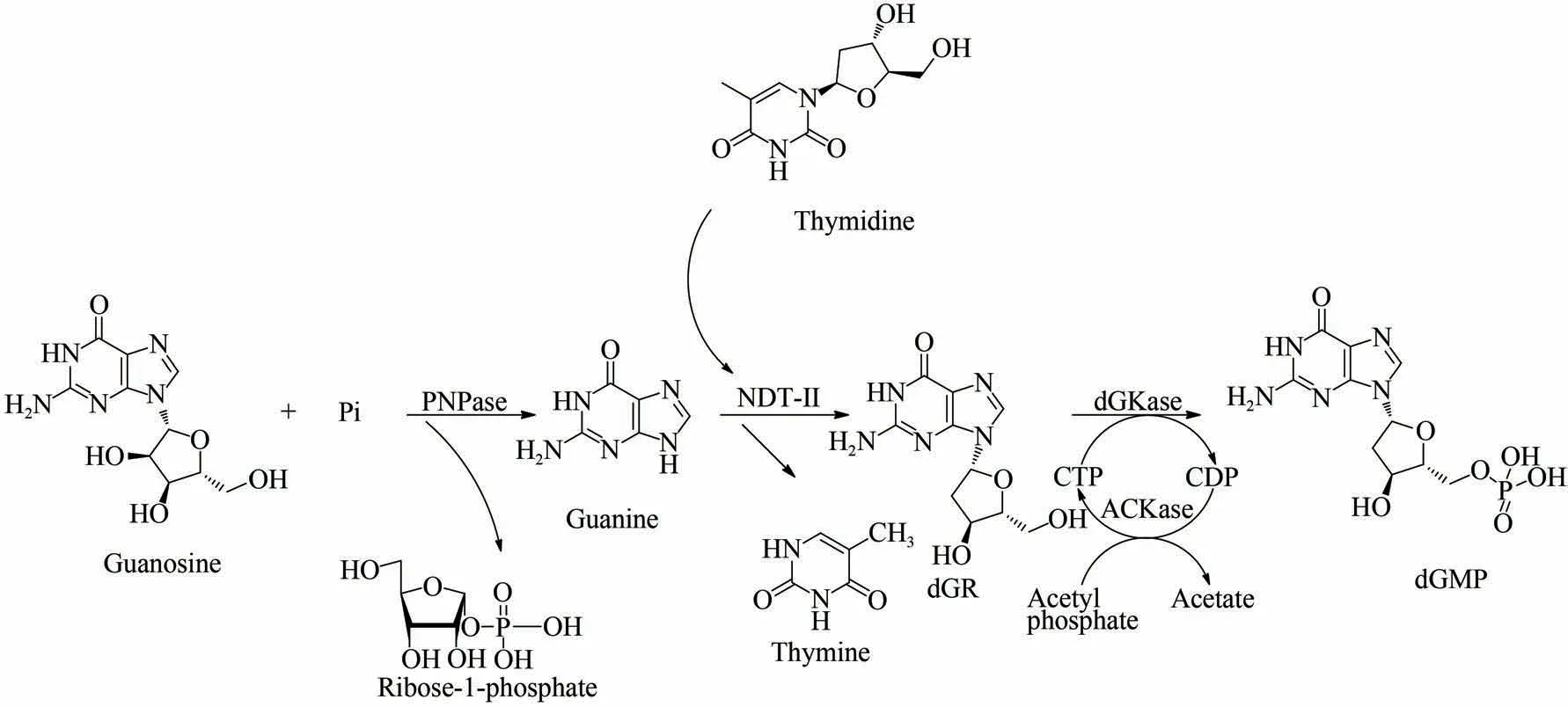
图7 一锅法多酶级联反应生产2'-脱氧鸟苷酸路线[70]Fig.7 One-pot multi-enzyme cascade production route of deoxyguanosine-2'-monophosphate[70][Original guanosine substrate is first cleaved by PNPase into guanine and 1-phosphate ribose.Subsequently,NDT-Ⅱcatalyzes reaction of guanine and thymidine to produce deoxyguanosine(dGR).Finally,dGKase and ACKase utilize cytidine triphosphate(CTP)regeneration system of acetyl phosphate to phosphorylate intermediate dGR into dGMP.During reaction,original guanosine substrate is cleaved by PNPase into guanine and ribose-1-phosphate.Then,dGR is subsequently produced by reaction between guanine and thymidine,and NDT-Ⅱcatalyzes reaction to proceed.Finally,intermediate deoxyribonucleic acid is phosphorylated by deoxyglucosidase and CTP to generate deoxyribonucleic acid polysaccharide]
3.3 多酶催化体系在心血管疾病、肝病和精神疾病药物合成中的应用
他汀类药物是合成降胆固醇药物的活性成分[71-72],阿托伐他汀与同类药物相比在降低胆固醇方面具有强大的效力,故被认为是超级他汀类药物[73-74]。Švarc 等[75]采用多酶2-脱氧核糖-5-磷酸醛缩酶(DERA)催化双醛醇加成生产阿托伐他汀侧链前体(图8),通过DERA 将乙醛连续双醛加成于苯乙酰胺的氨基保护丙醛上,经NADPH依赖型脱氢酶(KRED)脱氢,脂肪酶催化酰化,青霉素G-酰化酶脱氨基保护,最终获得目的产物,在补料式反应器中获得最高的最终产物浓度为124 g/L。
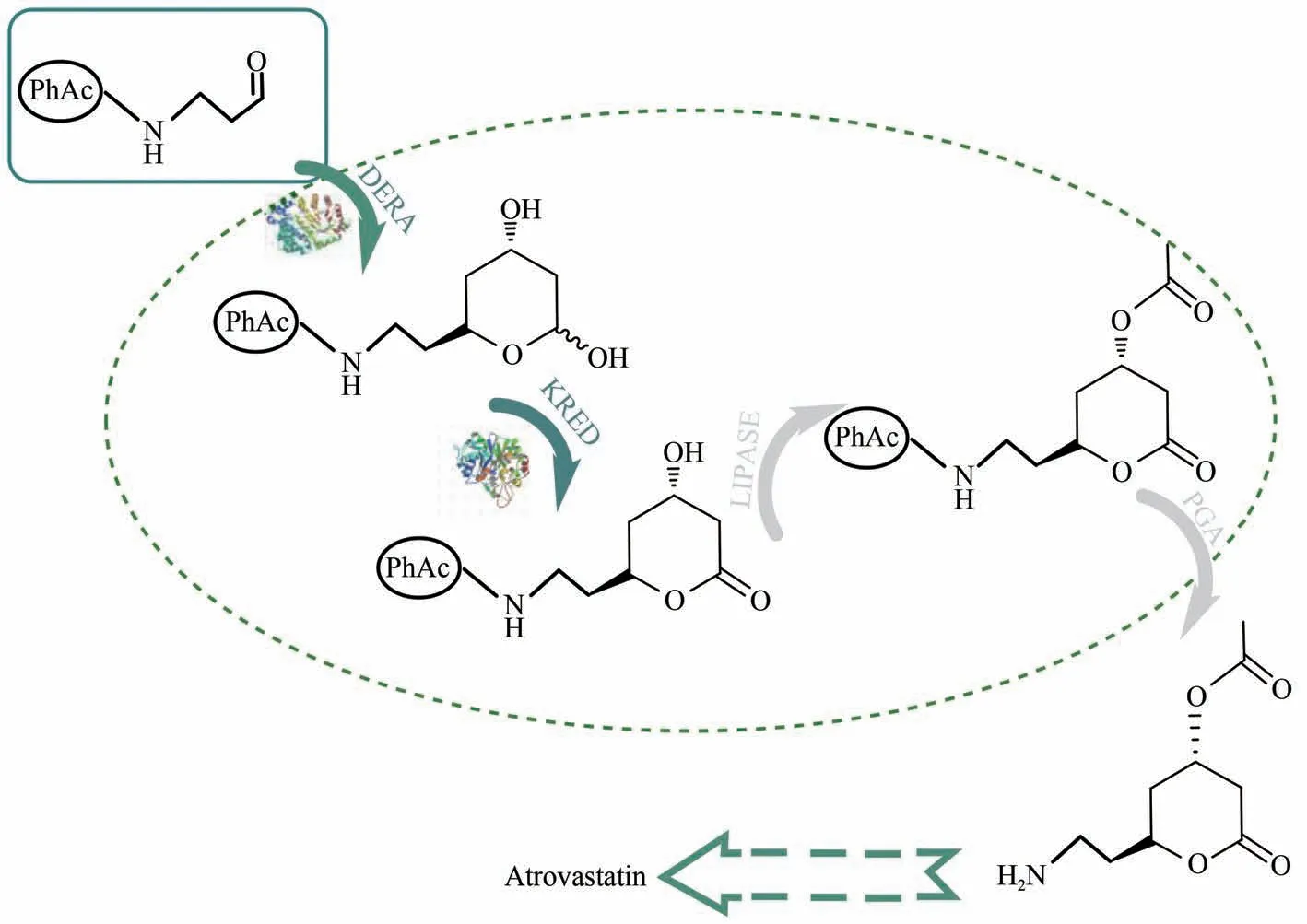
图8 阿托伐他汀侧链前体生产路线[75]Fig.8 Atorvastatin side chain precursor production route[75]DERA—2-deoxyribose-5-phosphate aldolase;KRED—NADPH-dependent dehydrogenases;PGA—penicillin G-acylase
熊去氧胆酸(ursodeoxycholic acid)常用于治疗各型肝类与眼部疾病等[76-80]。但是其化学合成方法多以动物胆酸为原料,存在步骤多、分离困难、收率低等问题[81]。Monti 等[82]首先筛选了酶的可用性(从商业来源或实验室生产),并通过动力学测量评估了它们的底物和辅酶的特异性,之后利用“一锅法”将细菌来源获得的各类羟基类固醇脱氢酶(HSDHs)与辅酶再生结合,交替进行氧化步骤和还原步骤,开发出耦合的原位再生系统,为作用在底物分子不同部位上的氧化反应和还原反应提供了必要的驱动力,催化胆酸合成熊去氧胆酸的关键中间体12-酮基熊去氧胆酸(12-ketoursodeoxycholic acid)。将6 种最终反应物混合,通过酸沉淀分离出关键中间体产物,转化率为73%。该混合反应存在3 种可能路径:第1 条路径胆酸先被NADPH 依赖型7α-HSDH 氧化为3α,12α-二羟基-7-氧代-5β-胆烷酸(3α,12α-dihydroxy-7-oxo-5β-cholanoic acid),再被12α-HSDH氧化为3α-羟基-7,12-二氧代-5β-胆烷酸(3α-hydroxy-7,12-dioxo-5β-cholanoic acid),最后通过7β-HSDH催化生成关键中间体12-酮基熊去氧胆酸;第2 条路径,胆酸7 号位羟基首先被7α-HSDH 氧化为酮基,但此后则被7β-HSDH 立体选择性还原生成熊果胆酸(ursocholic acid),最后通过12α-HSDH 氧化为关键中间体;第3 条路径胆酸先被12α-HSDH 氧化为12-酮基熊果胆酸(12-ketoursocholic acid),再被7α-HSDH 氧化为3α-羟基-7,12-二氧代-5β-胆烷酸,最后通过7β-HSDH 催化生成关键中间体12-酮基熊去氧胆酸(图9)。
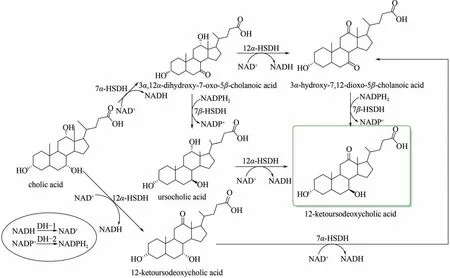
图9 合成熊去氧胆酸的关键中间体途径[82]Fig.9 Key intermediate synthesis pathway of ursodeoxycholic acid[82]
R-1-苯 基-1,2-乙二醇[(R)-1-phenyl-1,2-ethanediol]通常用于合成R-去甲氟西汀[83]、R-氟西汀[84]和β-内酰胺类抗生素[85],可以用来治疗精神疾病和相关的新陈代谢问题[86]。通过氧化还原反应去消旋化是获得对映体纯化合物的最具吸引力的方法之一,但目前可用的酶促系统均受限于去消旋化的效率。Li等[87]评估了20种具有立体选择性的氧化还原酶,筛选出了一种酮还原酶和一种立体特异性羰基还原酶,将这两种酶组合为多酶催化体系并与辅因子再生系统结合(图10)。外消旋PED 消旋为R-对映体,通过Enzyme 1,(S)-PED 被氧化成2-羟基磷灰石,同时NADP+被还原成NADPH。随后,通过Enzyme 2,2-羟基磷灰石被还原为(R)-PED,同时还将NADPH 氧化为NADP+。利用这种“一锅法”生产R-1-苯基-1,2-乙二醇,产率达到91.62%,光学纯度为95.50%,该系统为今后构建体外无细胞多酶催化去消旋化体系提供了策略。
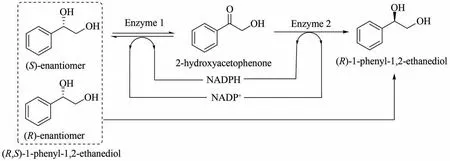
图10 体外多酶催化去消旋化体系生产(R)-1-苯基-1,2-乙二醇[87]Fig.10 (R)-1-Phenyl-1,2-ethanediol were produced by in vitro multi-enzyme catalytic de-racemization system[87][Racemic PED is reduced to(R)-enantiomer through selective oxidation and asymmetric reduction involving self-circulation of cofactor.Enzyme 1 oxidizes(S)-PED to 2-HAP and reduces NADP+to NADPH.Subsequently,by enzyme 2,2-HAP is reduced to(R)-PED,while NADPH is oxidized to NADP+]
3.4 多酶催化体系在其他活性成分合成中的应用
D-葡萄糖二酸(D-gluconic acid)是一种重要的增值化学品原料和添加剂,在制药行业中也有广阔的应用前景[88]。但是葡萄糖酸在生物体内由于代谢物竞争等原因,生产效率并不高,这促使人们寻求更高效、生产成本更低的途径。传统的葡萄糖酸的生产方法是离子交换法[89],树脂的再生、盐污染的处理都大大增加了生产成本,人们转而利用生物多酶催化的方法,Su 等[90]开发了一种新型的多酶级联反应,利用单个容器“一锅法”结合7种酶有效地将蔗糖转化为D-葡萄糖二酸,将50 mmol/L 的蔗糖转化为34.8 mmol/L 的D-葡萄糖二酸,达到了理论收率的75%。也有研究者通过非共价键将多种酶共固定在氧化石墨烯上,用于从淀粉中一锅生产葡萄糖酸[91]。此外,Petroll等[92-93]在体外构建了一种以葡萄糖为底物多酶催化生产D-葡萄糖酸的平台,整个过程一共有6种酶参与,其中NADH 氧化酶(Nox)用于NAD+的再生,将热稳定酶和嗜温酶融合提高稳定性(图11),并对途径中的酶进行固定化和回收利用,将途径分为两个反应(“两锅法”),生产率达到(0.170±0.004)g/(h·L),是迄今为止报道的最高生产率。

图11 多酶催化生产D-葡萄糖二酸[90]Fig.11 Production of D-gluconic acid by multi-enzyme catalysis from glucose[90][Conversion of G1P to GlucA was achieved by six enzymes:i)a phosphoglucomutase(PGM)which catalyses intermolecular phosphate transfer of G1P to G6P,ii)a myo-inositol-3-phosphate synthase(IPS)which catalyses multi-step oxidation,cyclisation and reduction of G6P to I1P,iii)a inositol-1-monophosphatase(IMP)which catalyses dephosphorylation of I1P to myo-inositol,iv)a myo-inositol oxygenase(MIOX)which mediates oxygen-catalysed oxidation of myo-inositol to GA,v)uronate dehydrogenase(Udh)which catalyses oxidation of GA to glucaro-1,4-lactone(GlucA lactone)under reduction of NAD+to NADH and vi)a NADH oxidase(Nox)for NAD+regeneration to minimise supply of expensive coenzyme for continuous GlucA production.GlucA lactone ring is mostly stable in neutral solutions and is hydrolysed to GlucA with heating in alkaline conditions]
萜类化合物(terpenoids)是与工业相关的天然产物中具有生物活性的最大类别之一,并被广泛应用于生物燃料、日用化学品、维生素、药物等相关产业中[94-98]。目前通过微生物发酵生产萜类化合物已经得到了应用,大肠杆菌和酿酒酵母均已成功工程化能够生产单萜、二萜等化合物[99-101]。但是大批量生产工业用的萜类化合物还尚未实现,产品或中间体的毒性、相互竞争的内源途径、难以分离产物等问题限制了工程菌的高产量生产。Korman 等[102]试图通过无细胞生产的方法来解决上述问题并成功提高了产量。首先使用CoPASI38 开发了计算机模型探索整个系统设计的基本特征。在获得合理模型的情况后,利用“一锅法”构建了一个含有27 种酶的系统可将葡萄糖转化为单萜(图12),转化率>95%,产物浓度>15 g/L,远高于细胞系统,表现了巨大的应用潜力。
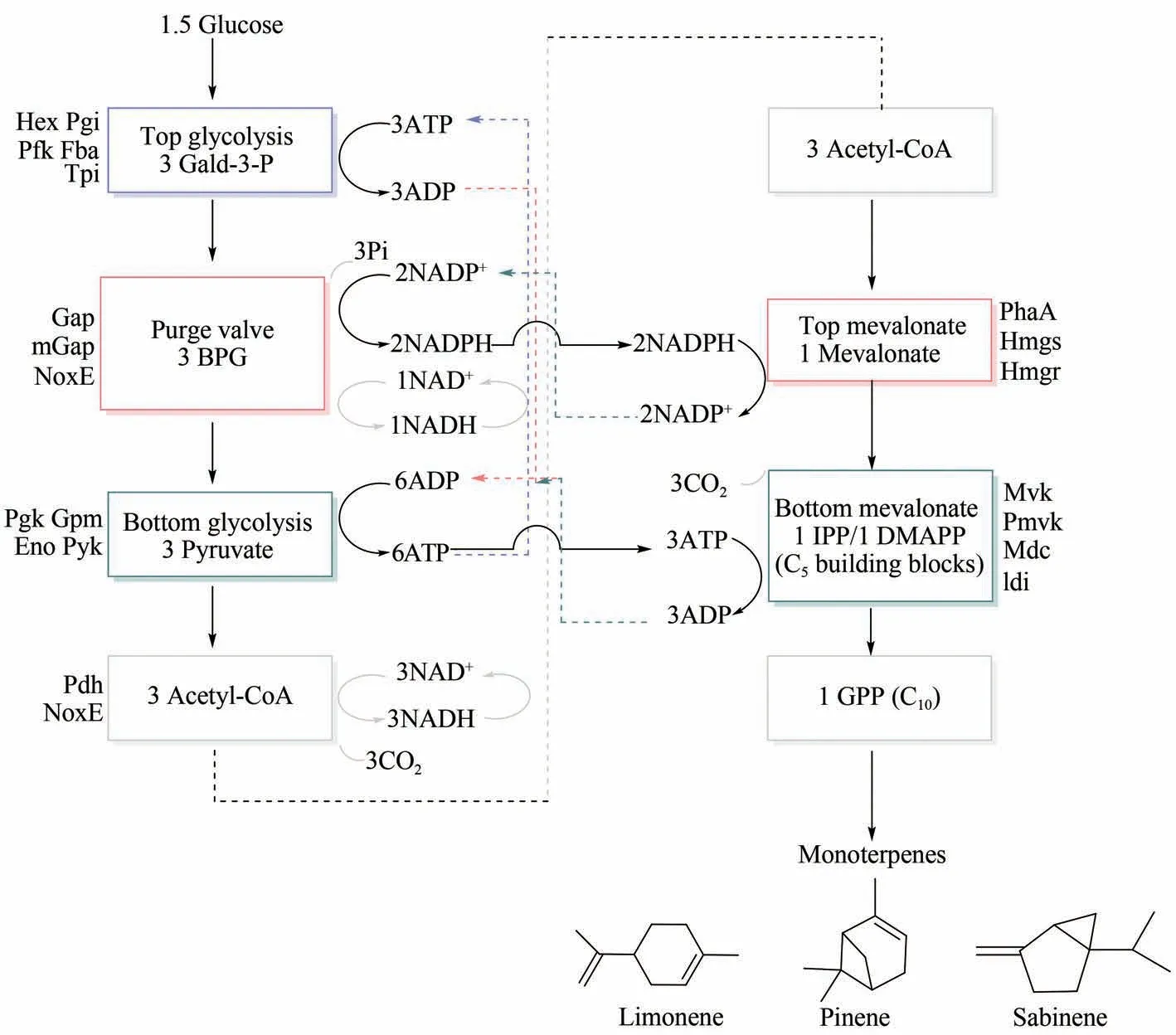
图12 多酶催化生产单萜[102]Fig.12 Production of monoterpenes from glucose by multi-enzyme catalysis[102](Enzymes in each sub-module are marked with colored boxes,and steps of consuming and generating ATP are shown in purple and blue respectively.Purge valve that produces NADPH is shown in red,while top of mevalonate pathway that consumes NADPH is shown in orange.Solid arrow represents flow of cofactor,and dotted arrow emphasizes cycle of each step in pathway)
5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)作为一种环境相容性及选择性很高的新型光活化农药[103],在农业领域应用非常广泛[104],其合成方法主要通过化学合成[105]和微生物发酵生产[106]。化学合成以乙酰丙酸为原料,但是3 位和5 位在溴代中选择性接近,致使5 位分离产率较低。Meng 等[107]使用热稳定酶开发无细胞多酶催化过程用于5-氨基乙酰丙酸的生产。以廉价的琥珀酸和甘氨酸为底物,开发了通过3 种酶,即来自糖醋杆菌的5-氨基乙酰丙酸合酶(LS-ALAS),来自大肠杆菌的琥珀酰CoA 合酶(Suc)和多磷酸盐激酶(Ppk)生产ALA 的无细胞催化过程。该过程中通过Ppk 再生ATP,而CoA 通过ALAS 和Suc 催化的两个反应进行再循环(图13)。琥珀酰CoA 的前体琥珀酸酯以分批补料的方式加入到反应体系中,避免其对Suc 的抑制作用。反应160 min 后,5-氨基乙酰丙酸浓度最终增加到5.4 mmol/L(0.7 g/L),这是生产5-氨基乙酰丙酸的首次无细胞研究,也是对未来高效经济生产5-氨基乙酰丙酸的一种尝试。
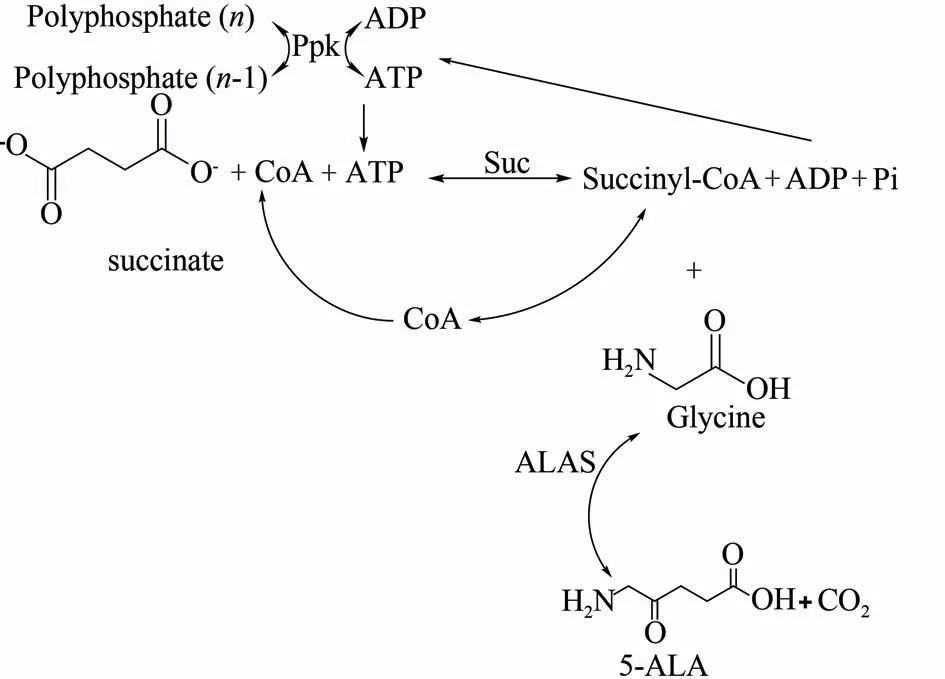
图13 无细胞多酶催化合成5-氨基乙酰丙酸[107]Fig.13 Synthesis of 5-aminolevulinic acid catalyzed by cell-free multi-enzyme[107][(Succinyl-CoA synthase catalyzes succinate to produce succinyl-CoA,and CoA can be catalyzed by two reactions catalyzed by 5-aminolevulinic acid synthase and succinyl-CoA synthase recycling is carried out,and another required substrate,ATP,provides required ATP from polyphosphate through polyphosphate kinase regenerationsystem)]
4 多酶催化体系存在的问题
虽然蛋白质模拟和设计的新兴技术已经取得长足进展,使得工艺设计定制特定的酶成为可能,但对酶动力学及其构效关系仍缺乏完整而深刻的认识。首先,从环境动力学角度出发,环境因素(例如特定的化学物质、pH、温度等)会显著影响多酶系统的相互作用,因此最佳的酶催化条件通常不适合多酶的组装[108]。同时由于大分子相互作用的复杂性,在分子水平上实时监测多酶体系的组装过程和探索组装机理是一个挑战,所以为了揭示多酶复合物受控组装的机理,可以开发更高级的动态模拟组装过程中涉及多级相互作用的构象变化的策略。如在Qiu 等[109]的研究中开发了基于量子点(QDs)的纳米探针(图14),它能够检测弯曲的毛细管内两种酶的相互作用,然后通过监测原始Cy5-LEVLVP-QD 复合物产生的峰和显著的荧光变化,对两种不同的酶进行了灵敏的分析。
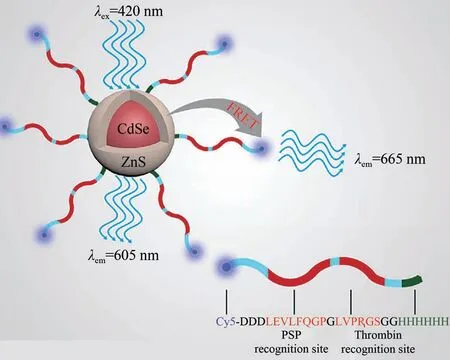
图14 Cy5-LEVLVP-QD纳米探针多酶检测原理[109]Fig.14 Schematic representation of multi-enzyme detection using Cy5-LEVLVP-QD nanoprobe[109]
同样在Xiang 等[110]的研究中使用多层酶逐层组装的单壁碳纳米管(SWCNT)复合标签技术放大检测的灵敏度,捕获抗体和次级信号抗CEA/酶-LBL/SWCNT生物缀合物之间的相互作用(图15)。
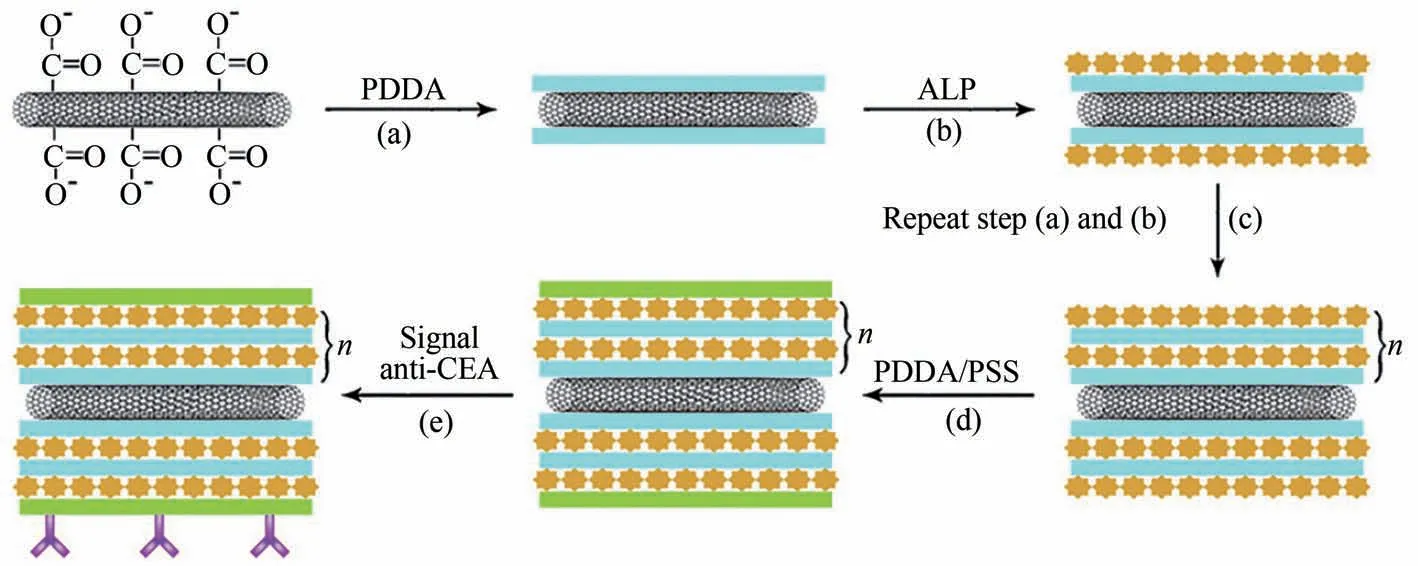
图15 SWCNT-(PDDA/ALP)n-PDDA-PSS-Ab2生物偶联物的制备[110]Fig.15 Illustration of preparation of SWCNT-(PDDA/ALP)n-PDDA-PSS-Ab2 bioconjugates[110]
其次,所谓的从头设计仍然停留在非常基础的阶段,基于此设计的酶活性差、稳定性低,因此,不得不使用天然的酶结构作为蛋白质进化研究的起点。随着分子生物学和高通量筛选技术的发展,相对从头设计而言,酶的结构改造已经较为成熟,获得具有更多特性不同的酶突变体,如提高工业酶底物活性和稳定性,已是生物制造行业较为常见的步骤。大量突变体的获得及改造思路的完善,使得生物催化剂库得到扩充,在体内和体外构建多酶催化体系也因此变得更为简单易行。在Lim 等[111]的研究中开发了一种通用的基于CRISPR/Cas 的策略,来构建可编程模式的多酶复合物(图16),催化无活性的dCas9 核酸酶与SpyCatcher-SpyTag 化学结合使用,以高度模块化的方式组装酶。
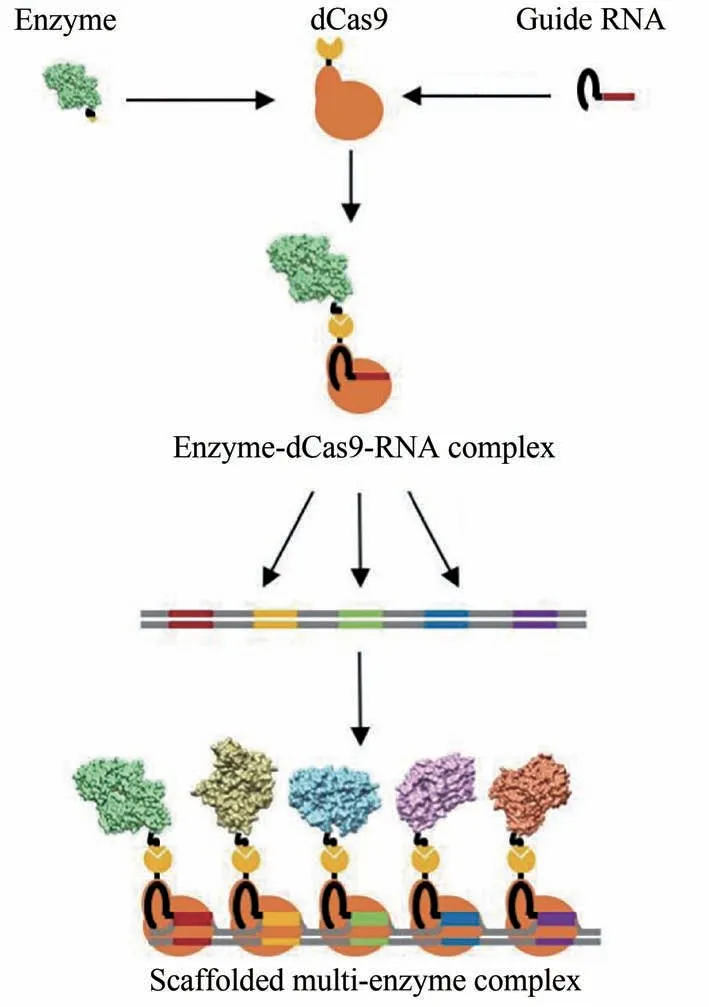
图16 DNA支架组装CRISPR/Cas定向多酶复合物[111]Fig.16 General scheme of CRISPR/Cas-directed programmable assembly of multienzyme complexes on a DNA scaffold[111]
5 结语
随着现代工业的发展,环保绿色等概念的提出,对化学品的生产要求也越来越高,而且手性化学品与结构复杂的化学品利用化学合成难度较大。酶被用来代替化学催化剂转化有机化合物,并具有更高的反应效率、区域选择性和立体选择性等优点。因此,生物催化剂现在被广泛用于生产有价值的商品化学品、药品和燃料。此外,生物催化反应通常在较温和的温度范围内进行,反应所需的能量较低,生物催化反应可以在水环境中进行,降低了溶剂的使用和处理/回收成本,而能源消耗和产物分离成本是影响产品最终价格的重要因素。
由于多酶催化体系高度可控,以及模式化工具箱的出现和人工多酶合成途径的增多,一般仅利用常见的起始原料,即可生产各类代谢中间体,并转化为更为复杂的目标化合物。与传统的微生物发酵生产相比,多酶催化系统具有许多优势,体外构建多酶催化体系复杂程度较低,反应条件易于控制,通常可以获得一些纯度更高的产物,甚至能够构建一些新型的多酶催化体系来完成一些生物体内本来不存在的反应[112]。随着不同生物催化剂的使用范围的不断扩大,这些多酶级联催化可能会变得更加普遍,但在构建多酶催化体系时,不仅要考虑到总体催化效率,还需要对体系中的介质和每种酶的催化活性进行评估和选择,从而避免竞争途径、毒性效应和宿主与工业条件的不相容等问题。
然而多酶催化体系仍有许多不足之处,如需要生产和纯化各个生物酶,并构建空间复合体系,导致时间和经济成本的提高,且没有类似于积木一样随取随用的模块酶,生产特定产物需要构建特定的体系,随着多酶体系的复杂程度提高,反应动力学的变化也不可忽视,此外产物抑制和酶催化剂的不稳定等问题,使多酶催化体系的构建技术仍不适用于工业化大规模生产。多酶催化体系虽然更易于控制,但需要对生物催化剂进行生产和纯化,并将其组装成空间结构的系统,这就又为工业应用增加了成本。未来多酶催化体系的构建应与计算机模拟和许多新兴技术与材料相结合,研究设计出可重复使用,耐受性强和实用方便的多酶反应系统,使其越来越多地应用于生物材料与化工产品的生产上。

