金丝桃素介导的光动力学疗法强化CIK对人乳腺癌细胞的抑制作用*
陈小梅,李慧玉,曲涛,高萌,徐向红
(1.甘肃省人民医院生物治疗中心,兰州 730000;2.华中科技大学同济医学院附属协和医院干细胞中心,武汉 430022)
乳腺癌是全球女性发病率占据第一位的恶性肿瘤[1]。近年来开发出更有效的治疗乳腺癌的疗法,如光动力疗法(photodynamic therapy,PDT),它通过光敏剂引发的氧化应激对目标细胞造成损伤,对一些失去手术机会或难治性的肿瘤具有良好疗效[2-4]。金丝桃素(Hypericum perforatum L,Hyp)是由金丝桃属植物分离得到的一种天然光敏剂,易被肿瘤细胞摄取,具有强大的光敏特性、低暗毒性和高单线态氧量子产量[5],可对多种实体肿瘤实施PDT[5-9]。金丝桃素介导的PDT可诱导肿瘤细胞免疫原性细胞死亡(immunogenic cell death,ICD)[10-12],其特点是分泌或暴露损伤相关分子模式(damaged associated molecular patterns,DAMPs)[5-6]。DAMPs是正常情况下存在于细胞内的具有免疫激活作用的分子,在损伤或应激的刺激下,表达在细胞表面或从细胞中释放出来[13-16]。高迁移率族蛋白B1(high mobility group protein B1,HMGB-1)、热休克蛋白70(heat shock protein 70,HSP70)和钙网蛋白(calreticulin,CRT)是3个主要的DAMPs[5-6,12]。虽然PDT并不能有效治疗播散性肿瘤[2],但可提高肿瘤细胞的免疫原性[17],因此,有必要与其他治疗模式结合,如PDT联合过继免疫细胞治疗[18-19],后者可治疗播散性肿瘤。细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)是抗肿瘤过继免疫细胞治疗的首选方案,是将外周血单个核细胞在体外经多种细胞因子培养诱导获得的免疫效应细胞,在培养过程中获得非特异性、自然杀伤类的抗肿瘤细胞毒性[20]。本研究在体外模拟PDT作用,用金丝桃素作为光敏剂诱导MCF7细胞ICD;同时,用所得上清液与CIK细胞共培养以模拟体内DAMPs对免疫细胞的作用,探讨Hyp-PDT诱导MCF7细胞ICD对CIK抗肿瘤活性的影响,并初步探讨其可能的分子机制。
1 材料与方法
1.1药品与试剂 金丝桃素(大连美仑生物技术有限公司,含量≥98%,批号:S0807AS);还原型谷胱甘肽(reduced L-glutathione,GSH,德国BioFroxx公司,含量:99.4%,批号:EZ1609A126);Annexin V-FITC/PI细胞凋亡检测试剂盒(美国BD公司,批号:8072965);Ficoll淋巴细胞分离液(美国GE公司,批号:10270607);CIK细胞培养试剂(北京康爱瑞浩生物科技股份有限公司,批号:20191020);异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的CD3(FITC-CD3)、藻红蛋白(phycoerythrin,PE)标记的CD8及CD16/56单克隆抗体(PE-CD8、PE-CD16/56)购自美国BD公司(批号:49979);1640培养基(批号:AE24464298)、胎牛血清(批号:RC35965)均购自美国Hyclone公司;CRT(批号:N21039163)、HMGB-1(批号:D01039219)和HSP70(批号:E25039218)酶联免疫吸附测定(ELISA)试剂盒均购自武汉华美生物科技有限公司,噻唑蓝(MTT,Sigma公司,批号:MKBF7875)。
1.2仪器与设备 LED光源(黄光)购自深圳奇异果光电有限公司,双通道光功率计型号2936-R(美国NEWPORT公司),流式细胞仪型号C6PLUS(美国BD公司),分光光度型号Epoch 2(美国Bio-Rad公司)。
1.3细胞株 人乳腺癌细胞株MCF7购自中国科学院上海生命科学院细胞库。
1.4实验方法
1.4.1流式细胞术检测Hyp-PDT诱导MCF7细胞凋亡 常规培养靶细胞MCF-7细胞,待细胞长至瓶底的80%,给予消化、悬浮、计数,向6孔板加入细胞,每孔1×106个,待贴壁生长至瓶底的80%,加入不同浓度的金丝桃素:0.15 μmol·L-1、0.20 μmol·L-1、0.25 μmol·L-1、0.25 μmol·L-1(+0.33 μmol·L-1GSH纠正),继续培养2 h,之后分别给予不同光剂量:2.05 J·(cm2)-1、4.05 J·(cm2)-1[5-6]。将未做任何药物及光照处理的MCF-7细胞作为对照。将Hyp-PDT处理后的细胞继续培养12 h。收集细胞,洗涤,用100 μL1×Binding buffer重悬细胞(1×106·mL-1),加Annexin V-FITC 5 μL,室温下避光反应15 min,上机前5 min再加入碘化丙啶(PI)5 μL。流式检测各组细胞凋亡率,1 h完成检测。实验重复3次。
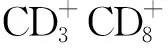
1.4.3ICD诱导CIK对MCF-7细胞的抑制率 参照文献[19]方法培养效应细胞CIK细胞。采用淋巴细胞分离液分离健康供者外周血单个核细胞,洗涤2次,用培养液培养,加入灭活的自体血清、γ-干扰素,置37 ℃、5%二氧化碳(CO2)培养24 h后,加白细胞介素(IL)-2、CD3mAb,以后每2~3 d适量添加含IL-2、自体血清的新鲜培养基扩增培养CIK细胞。将MCF-7细胞做PDT处理,处理方法同“1.4.2”项。收集上清液,加入24孔板内。将成熟的CIK细胞约2×106个加入含上清液的24孔板内,未做PDT处理的MCF-7培养上清液及同样数量的CIK细胞加入24孔板内作为对照。24 h后取出所有CIK细胞,洗涤。将对数生长期MCF-7细胞加入96孔板,每孔2×104个,培养12 h贴壁,将ICD诱导后并进行洗涤的CIK细胞加入96孔板内进行杀伤MCF-7实验,效靶比为20:1。24 h后结束杀伤,用MTT法检测靶细胞抑制率,酶标仪上读取波长490 nm处吸光度(A)值,计算各试验组和对照组的平均A值和抑制率。抑制率(%)=[1-(实验细胞孔A值-效应细胞孔A值)/靶细胞孔A值]×100%。实验重复3次。
1.4.4ELISA法检测Hyp-PDT诱导MCF7细胞ICD后培养上清中的DAMPs分子浓度 MCF7 细胞上清液中DAMPs分子常规培养MCF7细胞,待细胞生长至瓶底80%,给予消化、悬浮、计数,向24孔板每孔加入细胞 1×105个,待贴壁生长至瓶底80%,给予PDT处理,2 h后收集上清液,860×g离心20 min,上清液为待测样品。按照CRT、HMGB-1、HSP70的ELISA试剂盒说明书操作,将标准品稀释为要求的倍数,设标准孔8孔建立标准曲线,待测样品加入检测孔,将反应板置37 ℃、2 h。弃去孔内液体,不洗涤,每孔加入生物素标记抗体100 μL,将反应板置37 ℃、1 h。弃去孔内液体,用洗涤液将反应板充分洗涤3次,滤纸上印干,每孔加酶标试剂100 μL,将反应板充分混匀后置37 ℃、1 h。用洗涤液将反应板充分洗涤3次,滤纸上印干。每孔加底物溶液90 μL,将反应板置37 ℃、20 min,注意避光。每孔加入50 μL终止液混匀,5 min内用Epoch2分光光度计检测波长450 nm处A值。使用curve expert软件绘制标准曲线,标准品浓度为纵坐标,A值为横坐标,求回归方程,将样本A值代入方程计算出各样品的浓度。

2 结果
2.1流式细胞术检测Hyp-PDT诱导ICD细胞凋亡 MCF7细胞经Hyp-PDT处理后发生凋亡。流式细胞术检测早期(Annexin V+/PI-)和晚期(Annexin V+/PI+)凋亡细胞的百分率,数据以百分率表示。各组Hyp-PDT(包括GSH纠正组)诱导MCF7细胞早期凋亡和晚期凋亡的细胞的比例较对照组均明显上升(P<0.05,FAnnexin V+/PI-=1510.58,FAnnexin V+/PI+=962.42),且随着Hyp-PDT的增强凋亡细胞比例显著上升,而外源性抗氧化剂GSH可以部分阻止Hyp-PDT诱导的ICD,结果见图1,2。

图1 MCF7细胞经Hyp-PDT诱导后凋亡情况
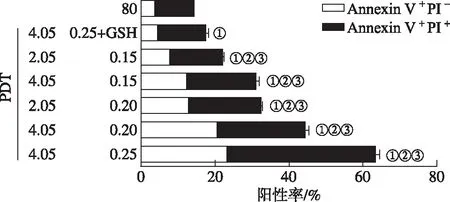
①与正常对照组比较,P<0.05;②与GSH纠正组比较,P<0.05;③与其他Hyp-PDT组比较,均P<0.05。
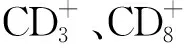
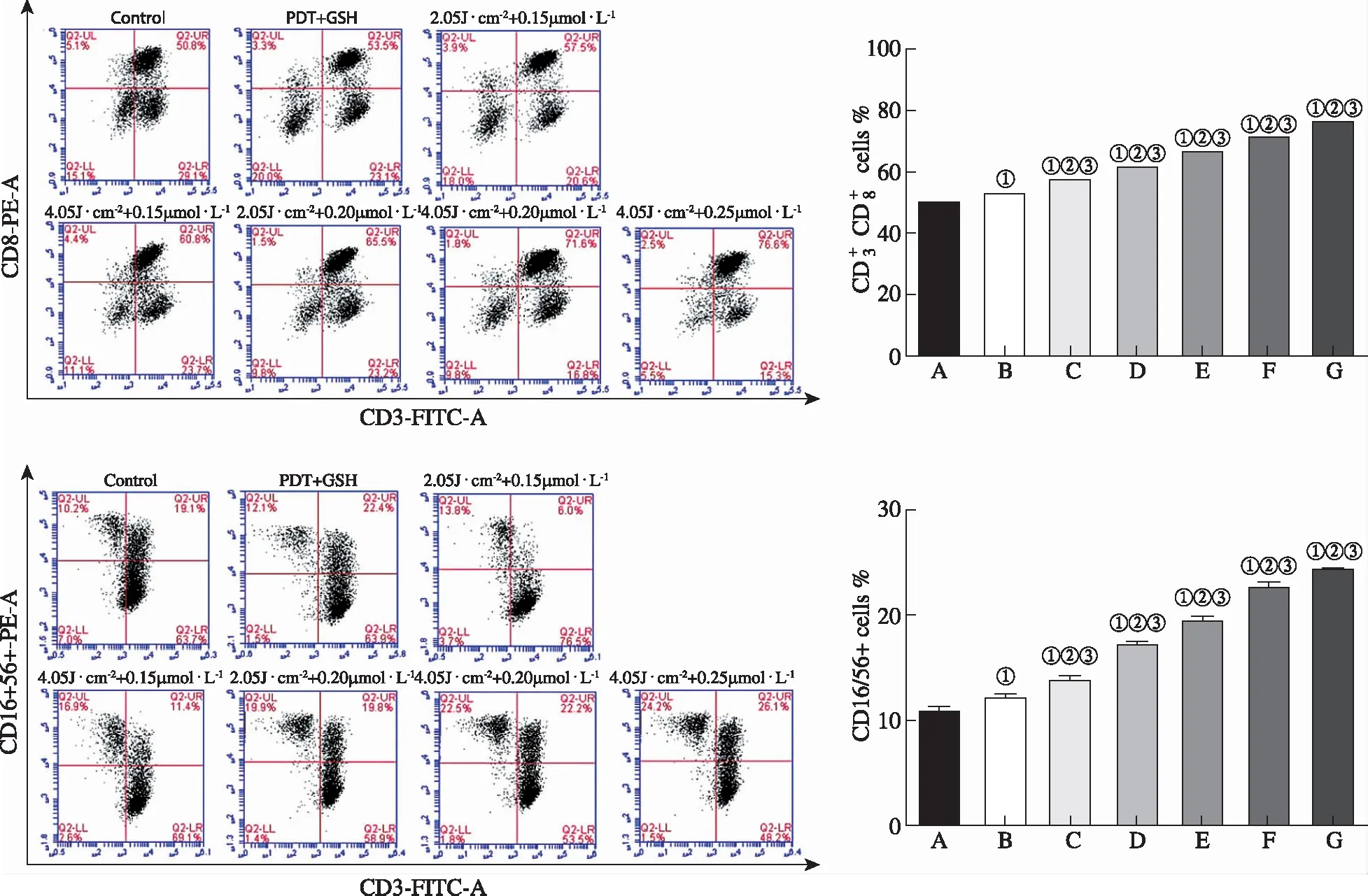
A.正常对照组;B.GSH纠正组;C.0.15 μmol·L-1Hyp+2.05 J·(cm2)-1光剂量组;D.0.15 μmol·L-1Hyp+4.05 J·(cm2)-1光剂量组;E.0.20 μmol·L-1Hyp+2.05 J·(cm2)-1光剂量组;F.0.20 μmol·L-1Hyp+4.05 J·(cm2)-1光剂量组;G.0.25 μmol·L-1Hyp+4.05 J·(cm2)-1光剂量组;①与正常对照组比较,P<0.05;②与GSH纠正组比较,P<0.05;③与其他Hyp-PDT组比较,均P<0.05。
2.3ICD诱导CIK对MCF-7细胞增殖的抑制 MTT实验结果见图4。与对照组比较,除GSH纠正组外,不同强度Hyp-PDT诱导ICD的MCF7细胞上清液诱导的CIK对MCF7细胞增殖的抑制率明显增高(F=111.49,P<0.05)。不同光剂量联合不同质量浓度Hyp诱导MCF7细胞ICD的上清液诱导CIK对MCF7细胞增殖的抑制率不同,抑制率随Hyp-PDT剂量的增加而升高。各Hyp-PDT组相互比较结果显示,0.15 μmol·L-1Hyp+2.05 J·(cm2)-1光剂量组、0.15 μmol·L-1Hyp+4.05 J·(cm2)-1光剂量组、0.20 μmol·L-1Hyp+2.05 J·(cm2)-1光剂量组这3组间差异无统计学意义(P>0.05)。以上结果表明,Hyp-PDT诱导ICD的MCF7细胞上清液能增强CIK细胞的抗肿瘤活性。
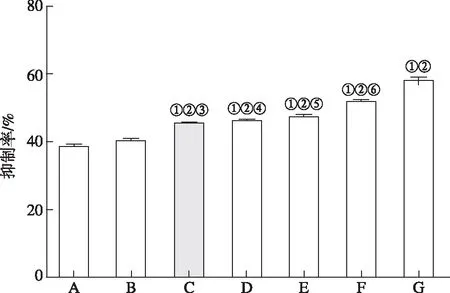
A.正常对照组;B.GSH纠正组;C.0.15 μmol·L-1Hyp+2.05 J·(cm2)-1光剂量组;D.0.15 μmol·L-1Hyp+4.05 J·(cm2)-1光剂量组;E.0.20 μmol·L-1Hyp+2.05 J·(cm2)-1光剂量组;F.0.20 μmol·L-1Hyp+4.05 J·(cm2)-1光剂量组;G.0.25 μmol·L-1Hyp+4.05 J·(cm2)-1光剂量组;①与正常对照组比较,P<0.05;②与GSH纠正组比较,P<0.05;③与E,F,G组比较,均P<0.05;④与F,G组比较,均P<0.05;⑤与F,G组比较,均P<0.05;⑥与G组比较,P<0.05。
2.4免疫原性死亡MCF7细胞上清液中HMGB-1、HSP70和CRT含量 ELISA实验结果见图5。与对照组比较,除GSH纠正组外,不同强度Hyp-PDT诱导MCF7细胞ICD的上清液中测得CRT、HMGB-1和HSP70浓度显著升高(P<0.05,FCRT=389.70,FHMGB-1=2907.96,FHSP70=1897.32),提示DAMPs是基于Hyp-PDT诱导的ICD增强CIK杀伤活性的关键因素。

A.正常对照组;B.GSH纠正组;C.0.15 μmol·L-1Hyp+2.05 J·(cm2)-1光剂量组;D.0.15 μmol·L-1Hyp+4.05 J·(cm2)-1光剂量组;E.0.20 μmol·L-1Hyp+2.05 J·(cm2)-1光剂量组;F.0.20 μmol·L-1Hyp+4.05 J·(cm2)-1光剂量组;G.0.25 μmol·L-1Hyp+4.05 J·(cm2)-1光剂量组;①与对照组比较,P<0.05;②与GSH纠正组比较,P<0.05;③与其他Hyp-PDT组比较,均P<0.05
3 讨论
肿瘤转移是乳腺癌治疗效果不佳和死亡的主要原因[21]。目前,乳腺癌的治疗主要以外科手术和药物为主[22],但外科手术和化疗药物会带来严重的副作用。因此,寻找安全有效、毒副作用低的治疗方法显得尤为重要。Hyp-PDT已被证实是在技术上可行的肿瘤治疗的新方法[7-9,23],Hyp-PDT治疗通过直接的细胞毒性作用、血管损伤和诱导免疫应答杀死肿瘤[12],尤其是对一些失去手术机会或难治性的肿瘤,均具有良好疗效且毒副作用小。本研究中,笔者将人乳腺癌MCF7细胞作为Hyp-PDT诱导乳腺癌细胞ICD的模型。为明确Hyp-PDT过程对MCF7细胞的损伤程度,分析细胞凋亡,结果显示Hyp-PDT组细胞凋亡比例均高于对照组和GSH纠正组,证明Hyp-PDT可引起乳腺癌细胞ICD。在此基础上进一步分析Hyp-PDT对MCF7细胞的损伤可知,凋亡细胞的比例随着Hyp-PDT剂量的增加而显著升高,而GSH可纠正0.25 μmol·L-1Hyp和4.05 J·(cm2)-1光剂量组引起的MCF7细胞ICD。这一结果与ZHENG等[5]研究报道一致,说明Hyp-PDT能够激活MCF7细胞氧化应激反应并诱导ICD,而GSH能减轻氧化应激对MCF7细胞的损伤。
在Hyp-PDT中,一些关键DAMPs的暴露或释放对ICD至关重要[17]。通过对Hyp-PDT诱导MCF7细胞ICD后的培养上清液中DAMPs的分析发现,Hyp-PDT组上清液中CRT、HMGB1、HSP70含量显著高于对照组和GSH纠正组;随着Hyp-PDT剂量的增加,ICD细胞上清液中DAMPs分子浓度亦升高,因此DAMPs可能是Hyp-PDT强化CIK杀伤肿瘤细胞活性的关键因素。由此可推测,经历ICD的肿瘤细胞通过DAMPs的释放增加肿瘤细胞的免疫原性,改善免疫抑制微环境,破坏免疫逃逸平衡,增强淋巴细胞的抗肿瘤活性。本研究结果初步支持ICD相关的DAMPs在增强CIK杀伤效能方面的关键作用,当然并不排除其他分子的作用。需要说明的是,本研究只针对一种特定的癌症类型和一种细胞系。即使在同一种癌症中,癌症本身也是异质性的,因此很难推断这种治疗方法对所有癌症都有效。
综上所述,本研究证明将Hyp-PDT与CIK治疗联合应用具有协同抗肿瘤作用,基于Hyp-PDT的ICD在CIK抗肿瘤免疫应答过程中具有重要作用,DAMPs是提高免疫应答关键分子,这为PDT和免疫细胞治疗的结合提供了体外试验证据,为播散性肿瘤的治疗提供了新的方法和思路。

