人参皂苷Rb1治疗性给药的抗癫痫作用及机制研究
陈 雪,张慧明,马 青,徐 梦,李 娟,柳钰书,刘 滢,王 茜,唐民科
(北京中医药大学中药学院,北京 102488)
癫痫是反复发作的慢性神经系统疾病,其发病机制复杂[1]。研究表明,中枢神经系统兴奋与抑制的失衡是癫痫发作的主要机制,而谷氨酸代谢异常是造成中枢神经系统兴奋与抑制失衡的重要原因[2-3]。谷氨酸(Glu)是中枢神经系统中最主要的兴奋性氨基酸类神经递质,由谷氨酸-谷氨酰胺(Glu-Gln)循环代谢调节[4]。由于细胞外缺少Glu代谢失活的途径,当Glu被释放至突触间隙后,主要由星形胶质细胞上的Glu转运体摄取进入星形胶质细胞,继而由细胞内谷氨酰胺合成酶(GS)转化为谷氨酰胺(Gln),再被转运回神经元内作为合成神经递质的原料,即Glu-Gln循环[5]。
人参皂苷Rb1是人参的主要活性成分之一。研究发现,将人参皂苷Rb1预防性给药,即边造模边给药,具有抗实验性癫痫作用[6-7]。因此,人参皂苷Rb1治疗性给药对癫痫的影响值得进一步探讨。本课题组前期研究发现,人参皂苷Rb1能上调Glu-Gln循环上谷氨酸转运体1(GLT-1)和GS的表达,并具有脑保护作用。本研究采用戊四唑(PTZ)点燃方法建立癫痫模型,造模成功后,给予人参皂苷Rb1干预,探讨人参皂苷Rb1治疗性给药的抗癫痫作用,并基于Glu-Gln循环关键酶,探讨其作用机制,为临床应用提供参考。
1 仪器与材料
1.1仪器 JA1103N型精密天平(上海民桥精密科学仪器有限公司);5811型低温高速离心机(Eppendorf公司);Epoch酶标仪(BioTek公司);TU-1901型双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);超微量紫外可见分光光度计(Thermo Scientific公司);StepOne Plus 实时定量 PCR 仪(Applied Biosystems公司);PowerPac稳压稳流电泳仪和734BR2920型凝胶成像仪,均购自Bio-Rad公司;正置荧光显微镜[尼康仪器(上海)有限公司]。
1.2试药 人参皂苷Rb1(成都曼思特生物科技有限公司,批号MUST-19060116,质量分数≥98%);丙戊酸钠(VPA,上海阿拉丁生化科技股份有限公司,批号S161023);戊四唑(PTZ,上海源叶生物科技有限公司,批号S48261);谷氨酸转运体2 (GLT-1) 兔抗鼠多克隆抗体(Abcam公司,批号ab205248);谷氨酰胺合成酶 (GS) 兔抗鼠多克隆抗体(Proteintech公司,批号11037-2-AP);SteadyPure通用型RNA提取试剂盒(批号AG21017)、SYBR Green Pro Tap HS预混型qPCR试剂盒(批号AG11701)和Evo M-MLV反转录试剂预混液(批号AG11706),均购自艾科瑞生物科技有限公司;谷氨酸 (Glu)试剂盒 (批号A074-1-1) 和谷氨酰胺合成酶 (GS) 测定试剂盒(批号A047-1-1),均购自南京建成生物工程研究所;BAC蛋白含量检测试剂盒(凯基生物科技有限公司,批号KGPBCA)。
1.3实验动物 ICR小鼠108只,雄性,体质量为18~22 g,购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK (京) 2016-0006。
1.4伦理审查 本研究由北京中医药大学医学与实验动物伦理委员会审核通过。动物实验方案设计合理,实验方法和目的符合人类的道德伦理标准和国际惯例,批准编号:BUCM-4-2020112004-4090。
2 方法
2.1癫痫小鼠模型的建立 采用PTZ点燃的方法 建立癫痫小鼠模型[8]。动物适应性饲养3 d,随机分为正常组(18只)和造模组(90只)。造模组以35 mg·kg-1腹腔注射PTZ,正常组腹腔注射同等剂量的生理盐水,2 d 1次,每次造模均于固定时间进行。根据Racine分级表评价每只小鼠的癫痫发作级别,连续3次注射PTZ后,小鼠癫痫发作为4~5级,则视为点燃成功。小鼠腹腔注射PTZ 共11次,剔除第11次注射后未达到点燃标准的小鼠,不参与后续实验,共造模成功85只小鼠。将造模成功的小鼠随机分为PTZ组、VPA(300 mg·kg-1)组、人参皂苷Rb1低(10 mg·kg-1)、中(20 mg·kg-1)和高(40 mg·kg-1)剂量组,每组17只。
Racine分级表:0级:无反应;1级:耳朵和面部抽动,包括眨眼,动须,节奏性咀嚼;2级:颈部肌肉抽动,表现为点头或甩尾;3级:肌阵挛,前肢抽动;4级:身体立起、双侧后肢强直以及全身阵挛性发作;5级:全身强直阵挛发作,失去平衡,跌倒。
2.2给药 各给药组每日固定时间腹腔注射相应剂量的药物,正常组和PTZ组腹腔注射同等剂量的生理盐水,每日1次,连续给药30 d。给药过程中,PTZ组和各给药组继续以35 mg·kg-1腹腔注射PTZ,正常组腹腔注射同等剂量的生理盐水,5 d 1次。
2.3行为学观察 注射PTZ后立即将小鼠置于透明箱中,连续观察30 min,记录小鼠的发作潜伏期和发作级别。发作潜伏期记录为PTZ注射完成后到2级发作的时间,若30 min内未发作,则潜伏期记为1 800 s;记录最高发作级别,行为学指标可能因为小鼠个体差异而导致各组指标数量不完全一致。
2.4Fluoro-Jade B(FJB)染色检测海马神经元损伤 最后1次给药后,每组随机选取6只小鼠,以50 mg·kg-1腹腔注射戊巴比妥钠麻醉各组小鼠,置于干净瓷盘中,打开胸腔、暴露心脏。用注射针自心尖插入主动脉,用止血钳固定针头。剪开右心耳,经注射针匀速推入4 ℃的生理盐水至右心耳流出无血色液体,且小鼠肝脏变黄、两肺及四肢变白。再用40 g·L-1多聚甲醛灌注,直至小鼠内脏颜色变白、颈部和四肢肌肉僵硬。灌注完成后迅速取脑,浸入40 g·L-1多聚甲醛中固定。石蜡切片脱蜡至水,依次将切片放入二甲苯Ⅰ15 min、二甲苯Ⅱ15 min、无水乙醇Ⅰ5 min、无水乙醇Ⅱ5 min、体积分数为85%的乙醇5 min、体积分数为75%的乙醇5 min,最后用蒸馏水洗。用现配的体积分数为50%的冰醋酸作为溶剂,按照1∶400 配制 FJB 工作液,在画好圈的组织上加入稀释好的 FJB 绿色荧光探针,4 ℃过夜。DAPI染核8 min,纯水冲洗,用吹风机吹干,二甲苯透明1 min,中性树脂封片,切片置于荧光显微镜下观察并采集图像。每张切片在海马CA1区随机取5个视野,用Image J软件计数FJB阳性神经元数量。
2.5生化法检测大脑皮层和海马中的Glu含量和GS活性 将剩余各组小鼠断头取脑,冰上去除嗅球、小脑及低位脑干后,分离大脑皮层和海马,精密称定质量后置于液氮中速冻,置于-80 ℃超低温冰箱内保存。取时按照体质量1∶9的比例加入提取液,以4 000 r·min-1离心10 min,取上清液,置于冰上待测。分别按照Glu和GS试剂盒说明书测定小鼠大脑皮层和海马中的Glu含量和GS活性。
2.6RT-PCR法检测大脑皮层和海马中GLT-1和GS mRNA表达 取大脑皮层和海马置于预冷的研钵中,加入液氮研磨成粉末状。按照SteadyPure通用型RNA提取试剂盒说明书操作提取RNA,按反转录试剂盒说明书反转录为cDNA,以cDNA为模板进行RT-PCR扩增。内参β-actin的引物序列为:F:5′-ACTCCTATGTGGGTGACGAGG-3′,R:5′-CACACGCAGCTCATTGTAGAAG-3′;GLT-1的引物序列为:F:5′-TAGATATGTCGGTTGCCGTTTG-3′,R:5′-AGCCCAGTCCACCAGTGAGG-3′;GS的引物序列为:F:5′-TATTACTGCGGTGTGGGAGC-3′,R:5′-CCCATTCGGATCCCCTCACA-3′。采用PCR方法对GLT-1和GS的mRNA水平进行检测,实验结果采用2-△△CT法进行分析。△CT=目的基因CT值-内参基因CT值。
2.7Western Blot法检测大脑皮层和海马中GLT-1和GS蛋白表达 预冷 RIPA 裂解液,加入蛋白酶抑制剂。将组织按照1∶10加入RIPA裂解液进行匀浆。冰上孵育 20 min 后,在4 ℃条件下以13 000 r·min-1离心 20 min。取上清液,分装后于-80 ℃保存,待测。按照 BCA 蛋白定量试剂盒说明书操作,用酶标仪测定各个样品吸光度值A,根据标准曲线计算各组蛋白质量浓度。以 RIPA 调整蛋白质量浓度,样品终质量浓度为 0.5 μg·μL-1,95 ℃,变性 5 min。将样品进行SDS-PAGE凝胶电泳,上样量为10 μL,转移至PVDF膜,用50 g·L-1脱脂奶粉室温封闭1.5 h。TBST洗膜后加入一抗稀释液(β-actin的稀释比例为1∶12 000;GLT-1稀释比例为1∶1 000;GS的稀释比例为1∶1 500),4 ℃孵育过夜。TBST洗膜,二抗(1∶5 000)室温孵育1 h。TBST洗膜,滴加ECL发光剂显影,ChemiDocTMMP系统采集图像,Image J软件进行分析,计算GLT-1和GS蛋白表达量。

3 结果
3.1人参皂苷Rb1对癫痫小鼠发作级别和发作潜伏期的影响 在造模过程中,PTZ组小鼠逐渐出现面部抽动、甩尾和双侧前肢抽动等症状,继而双侧后肢强直或全身抽搐、跌倒,随造模时间延长症状逐渐明显。在造模第22天,大多数造模小鼠癫痫发作达到4级或5级,小鼠发作潜伏期也显著降低(P<0.01),确定造模成功;在此期间,正常组小鼠未见任何发作,未出现上述症状。
造模成功后,小鼠重新分组并开始治疗性给药。结果显示,随着给药时间的延长,多数小鼠癫痫的发作级别由4~5级逐渐降低为2~3级。其中,VPA发挥药效较快,给药10 d后癫痫小鼠发作级别就开始出现明显变化;给药30 d后,癫痫小鼠后肢强直和全身抽搐症状均得到显著改善,且发作潜伏期显著延长。人参皂苷Rb1各剂量组小鼠在给药20 d后癫痫发作级别出现明显变化;给药30 d后,癫痫小鼠后肢强直和全身抽搐症状也得到显著改善,大部分小鼠发作级别降至2~3级,发作潜伏期显著延长,且人参皂苷Rb1能较好地改善癫痫小鼠后肢强直的情况。结果表明,人参皂苷Rb1治疗性给药,能显著改善由PTZ引起的小鼠癫痫症状。结果见表1和表2。

表1 人参皂苷Rb1对给药后不同时间点癫痫小鼠发作级别的影响
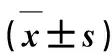
表2 人参皂苷Rb1对给药后不同时间点癫痫小鼠发作潜伏期的影响
3.2人参皂苷Rb1减轻癫痫小鼠海马CA1区神经细胞损伤 FJB染料可与变性的神经细胞结合发出绿色荧光,而不与正常神经细胞结合,FJB阳性细胞数量可用于评估神经细胞变性情况。与正常组相比,PTZ组小鼠海马CA1区FJB阳性细胞数量显著增多(P<0.01),提示PTZ诱发的癫痫会造成小鼠海马CA1区神经细胞变性损伤;与PTZ组相比,人参皂苷Rb1各给药组小鼠海马CA1区FJB阳性细胞数量显著减少(P<0.05),海马其他部位和大脑皮层FJB阳性细胞数量变化不明显。结果表明,人参皂苷Rb1能够改善PTZ癫痫小鼠海马CA1区神经细胞变性损伤。见表3。

表3 人参皂苷Rb1对癫痫小鼠海马CA1区神经元变性情况的影响
3.3人参皂苷Rb1对癫痫小鼠大脑皮层和海马Glu含量和GS活性的影响 与正常组相比,PTZ组小鼠大脑皮层和海马中Glu含量显著升高,提示癫痫发作会造成脑组织Glu含量积累。人参皂苷Rb1低、中、高剂量组小鼠大脑皮层和海马中的Glu含量均低于PTZ组,提示Rb1可改善癫痫状态下Glu含量蓄积。GS活性测定结果显示,PTZ小鼠大脑皮层和海马中GS活性降低,给予人参皂苷Rb1后GS活性较PTZ组升高,其中人参皂苷Rb1高剂量组作用最显著(P<0.05)。GS是促使Glu转化为Gln的关键酶,提示人参皂苷Rb1能促进癫痫小鼠脑组织Glu的转化。见表4。
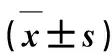
表4 人参皂苷Rb1对癫痫小鼠大脑皮层和海马Glu含量和GS活性的影响
3.4人参皂苷Rb1对癫痫小鼠大脑皮层和海马中GLT-1 mRNA和蛋白表达的影响 GLT-1是维持细胞外谷氨酸稳态的重要转运体,其表达减少或功能障碍都可能造成细胞Glu过度积累。与正常组相比,PTZ组小鼠大脑皮层和海马中的GLT-1 mRNA和蛋白表达显著降低(P<0.01),提示癫痫会造成GLT-1表达下调,进而影响其摄取细胞外谷氨酸的功能;人参皂苷Rb1各给药组小鼠大脑皮层和海马GLT-1 mRNA和蛋白表达均升高,提示人参皂苷Rb1可能通过上调GLT-1表达促进细胞外谷氨酸的摄取,使Glu含量降低。结果见表5和图1。
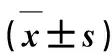
表5 人参皂苷Rb1对癫痫小鼠大脑皮层、海马中GLT-1 mRNA和蛋白表达的影响
3.5人参皂苷Rb1对癫痫小鼠大脑皮层和海马中GS mRNA和蛋白表达的影响 进入星形胶质细胞的Glu,既可参加Glu循环,也可在GS催化下转化为谷氨酰胺。GS的表达减少或功能障碍可能导致星形胶质细胞Glu不能被及时代谢,影响星形胶质细胞Glu-Gln循环。结果显示,与正常组相比,PTZ组小鼠大脑皮层和海马的GS mRNA和蛋白表达均显著降低(P<0.01),各给药组小鼠大脑皮层和海马GS mRNA和蛋白表达较PTZ组均显著升高。提示人参皂苷Rb1可能通过上调GS的表达恢复其快速代谢谷氨酸的能力,促进星形胶质细胞对细胞外过量谷氨酸的吸收代谢。见表6和图1。
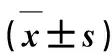
表6 人参皂苷Rb1对癫痫小鼠大脑皮层和海马中GS mRNA和蛋白表达的影响

图1 人参皂苷Rb1对癫痫小鼠大脑皮层和海马GLT-1和GS 蛋白表达的影响
4 讨论
据统计,全世界约有7 000万人患有癫痫,预计1/3的癫痫患者应用目前的药物难以得到有效治疗[9]。因此,对癫痫的发病机制及治疗药物的研究至关重要。本研究采用PTZ化学点燃方法建立癫痫小鼠模型,探讨人参皂苷Rb1治疗性给药的抗癫痫作用及其作用机制。研究发现,小鼠癫痫症状稳定后,用人参皂苷Rb1治疗性给药30 d,能延长小鼠癫痫发作潜伏期,有效缓解小鼠癫痫发作的严重程度,并降低癫痫小鼠大脑皮层与海马中的Glu含量,提高癫痫小鼠大脑皮层和海马中GLT-1及GS的RNA和蛋白表达,并增加GS活性。FJB染色结果显示,人参皂苷Rb1对癫痫小鼠海马神经细胞损伤也有保护作用。结果提示,人参皂苷Rb1治疗性给药具有确切的抗癫痫及神经保护作用,此作用可能与调节Glu-Gln循环、减少谷氨酸蓄积有关。
近年来,关于人参皂苷Rb1抗癫痫作用研究时有报道[6,10-11],但研究者均采用预防性给药的方法,即癫痫造模与药物干预同时开始,发现人参皂苷Rb1具有抗癫痫作用。从严格意义上讲,这些发现重点说明人参皂苷Rb1具有预防癫痫的效果。然而,对于已经患有癫痫的患者或动物,人参皂苷Rb1是否有治疗效果尚未知。因此本研究采用亚惊厥剂量PTZ,诱导ICR小鼠慢性癫痫发作,造模成功后采用药物干预,突出强调人参皂苷Rb1对癫痫小鼠的治疗作用,与临床上的治疗方法保持一致,进一步评价人参皂苷Rb1的抗癫痫作用。给药30 d后发现,经过人参皂苷Rb1治疗的癫痫小鼠,后肢强直、全身抽搐和跌倒的症状得到显著改善,发作级别和发作潜伏期显著降低,表明人参皂苷Rb1能明显改善PTZ癫痫小鼠发作的症状。
PTZ是一种γ-氨基丁酸(GABA)受体拮抗剂,通过抑制GABA能神经元的功能诱导动物产生惊厥,其诱导的癫痫模型与临床上小发作和失神发作类似,通过该模型筛选出的抗癫痫药物在临床上可用于小发作和失神发作的治疗[12-14]。人参皂苷Rb1能缓解PTZ诱导的癫痫小鼠的发作严重程度,在后续的临床应用方面,人参皂苷Rb1可用于癫痫小发作和失神发作的治疗,对其他类型发作也有一定作用,需要进一步研究。与PTZ相比,人参皂苷Rb1药效发挥较慢,治疗周期长,但其不良反应少,对患者伤害小。另外,作为人参的主要药效活性成分,人参皂苷Rb1已被证明具有神经保护作用[15],能够改善学习记忆能力,长期用药可预防疾病的发生,因此,人参皂苷Rb1治疗癫痫具有巨大潜力和优势。
Glu是中枢神经系统最主要的兴奋性小分子神经递质,在正常生理状态下可保持较低的细胞外水平。过量的Glu积累在突触间隙会造成神经元过度兴奋甚至神经元死亡,因此,必须迅速清除细胞外过量的Glu[16-17]。Glu正常水平的保持得益于星形胶质细胞膜上的摄取系统和细胞内的代谢酶。Glu在神经元的囊泡中和突触间隙有明显的浓度差,这种浓度差依赖谷氨酸转运体来维持[18]。当突触间隙的Glu浓度出现异常时,谷氨酸转运体就会迅速做出反应来调节Glu稳态。GLT-1作为细胞外Glu清除的关键转运体,对于维持中枢神经系统正常的生理功能至关重要。GS是人体中唯一能够合成谷氨酰胺的已知酶,主要作用是催化Glu和氨生成谷氨酰胺[19]。GS表达和活性的改变会影响Glu的清除和谷氨酰胺的积累与释放,而谷氨酰胺又是合成Glu和GABA的前体物质[20],因此,GLT-1和GS通过调节细胞内外Glu含量和GABA的合成直接影响大脑兴奋与抑制的平衡。Glu代谢异常是脑内兴奋与抑制失衡的直接原因之一,而脑内兴奋与抑制失衡可能会导致癫痫发作。GLT-1和GS作为Glu代谢调节的重要元件,其对癫痫的发病和治疗具有重要意义。本实验结果表明,人参皂苷Rb1能够上调癫痫小鼠的GLT-1表达和GS活性,从而调节Glu代谢,而其是否能够通过调节GLT-1与GS进而影响抑制性神经递质GABA的合成还有待进一步研究。此外,就GLT-1而言,其表达和功能变化对细胞内Glu代谢转化的影响也值得深入探讨。
综上所述,人参皂苷Rb1治疗性给药能缓解癫痫小鼠的发作严重程度,改善脑组织神经元损伤,发挥抗癫痫作用,其机制可能与上调Glu-Gln循环上的关键环节GLT-1和GS的表达及活性、调节Glu代谢、促进中枢神经系统兴奋和抑制恢复平衡有关。

