降脂方中活性成分含量测定方法*
汪 怡,刘 菊,杨 菊
(昆山市中医医院,江苏 昆山 215300)
20世纪80年代以来,随着社会经济的发展和居民生活方式、膳食结构的改变,中国人群血脂异常患病率明显增加。中医药治疗高脂血症疗效显著,但目前治疗方案中,中药汤剂煎煮步骤繁琐。近年来的研究表明降脂茶在辅助治疗血脂异常方面具有一定作用,并且相比药物具有更小的毒副作用[1]。
降脂方为我院临床常用于治疗高脂血症的茶饮基础方,以茶饮代替汤剂煎煮,简单方便。本方由荷叶、山楂、炒决明子、泽泻、丹参、槐米六味药组成,全方质轻性薄,寒温并用,清上通下,分消走泻,气血水同调,共奏行气活血、利湿化痰之功,旨在调节血脂代谢,改善高脂血症临床症状和血脂指标。荷叶和决明子是方中降脂的主要药物之一,现代药理学证明,荷叶中的生物碱是降低高脂血症大鼠血脂和体质量的主要有效成分[2];决明子提取物能明显降低高血脂动物血清低密度脂蛋白胆固醇和甘油三酯的含量,增加血清高密度脂蛋白胆固醇水平,降血脂成分主要为苷类、多糖、蛋白质及蒽醌类等成分[3]。本文建立了HPLC法同时测定降脂方中橙黄决明素、黄决明素、决明素、决明蒽醌4种蒽醌类成分含量的方法和用酸性染料比色法测定总生物碱,拟为降脂方的质量控制提供依据,同时也为本课题进一步研究降脂方冲泡条件奠定实验基础。
1 仪器与试药
1.1 仪器 LC-20AD高效液相色谱仪(含SPD-20A紫外检测器和LabSolutions工作站,日本岛津仪器有限公司);UV-2600紫外可见分光光度计(日本岛津公司);BT 25S电子天平(d=0.01 mg,赛多利斯科学仪器公司);MS3圆周振荡器(德国IKA公司);KQ2200E超声波清洗器(昆山市超声仪器有限公司);HWS-24型电热恒温水浴锅(上海一恒科学仪器有限公司)。
1.2 药物与试剂 荷叶(批号:181205003)、决明子(批号:190303003)、山楂(批号:190119005)、丹参(批号:190126005)、泽泻(批号:181228005)、槐米(批号:190311003)均来自苏州市天灵中药饮片有限公司,由我院药学部中药房副主任中药师按照2015年版《中华人民共和国药典》一部鉴定为合格饮片。橙黄决明素对照品(批号:111900-201605,含量98.3%,中国食品药品检定研究院);黄决明素对照品(批号:MUST-19111312,纯度:99.79%)、决明素对照品(批号:MUST-19060107,纯度:99.01%)、决明蒽醌对照品(批号:MUST-19070608,纯度:99.62%)、荷叶碱对照品(批号:MUST-19032204,纯度:98.91%)均购自成都曼思特生物科技有限公司;乙腈(色谱纯,德国Merker公司);溴甲酚绿指示剂(上海润捷化学试剂公司,批号:20180610);超纯水及纯水(美国Millipore公司);其他试剂为分析纯。
2 方法与结果
2.1 降脂方茶汤溶液的制备 根据降脂方处方用量比例,分别称取荷叶、山楂、决明子、丹参、泽泻、槐米饮片,共24 g,放入无纺布茶包,加入刚煮沸的纯水500 mL冲泡3次,每次放置30 min后,倒出茶汤,合并3次茶汤,过200目筛后,转移至2 000 mL量瓶,纯水定容。
2.2 对照品溶液的制备
2.2.1 蒽醌混合对照品溶液的制备 精密称取橙黄决明素、黄决明素、决明素、决明蒽醌对照品适量,置于100 mL量瓶中,甲醇溶解,定容,配置成含橙黄决明素120.90 μg/mL、黄决明素62.90 μg/mL、决明素42.20 μg/mL、决明蒽醌55.20 μg/mL的混合对照品储备液。再分别精密量取储备液0.3、0.6、0.9、1.2、1.5、1.8 mL转移至25 mL量瓶中,加甲醇稀释至刻度,摇匀,用0.22 μm微孔滤膜滤过,取续滤液,即得。
2.2.2 生物碱对照品溶液的制备 精密称取荷叶碱对照品适量,置于25 mL量瓶中,甲醇溶解,定容,配置成含荷叶碱0.192 mg/mL的对照品溶液。
2.3 供试品溶液的制备
2.3.1 蒽醌类成分含量测定供试品溶液的制备 精密量取50 mL茶汤溶液,加盐酸5 mL置水浴中加热水解30 min,立即冷却,用三氯甲烷振摇提取4次,每次50 mL,合并三氯甲烷液,回收溶剂至干,残渣用甲醇使溶解,转移至25 mL量瓶中,并稀释至刻度,摇匀,用0.22 μm微孔滤膜滤过,取续滤液,即得。
2.3.2 总生物碱含量测定供试品溶液的制备 取适量茶汤溶液,4 500 r/min离心10 min,分离上层澄清液,即得。
2.4 蒽醌类成分含量测定方法的建立
2.4.1 色谱条件 采用Agilent Eclipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm),流动相:乙腈-0.1%磷酸溶液(40∶60);流速:1 mL/min;检测波长:284 nm;柱温:40 ℃;进样量:20 μL。
2.4.2 检测波长的选择 分别精密称取橙黄决明素、黄决明素、决明素、决明蒽醌对照品适量,分别置于25 mL量瓶中,甲醇溶解,定容,以相应的试剂为空白,采用紫外-可见分光光度法,分别在200~800 nm区间进行全波长扫描。结果见图1。
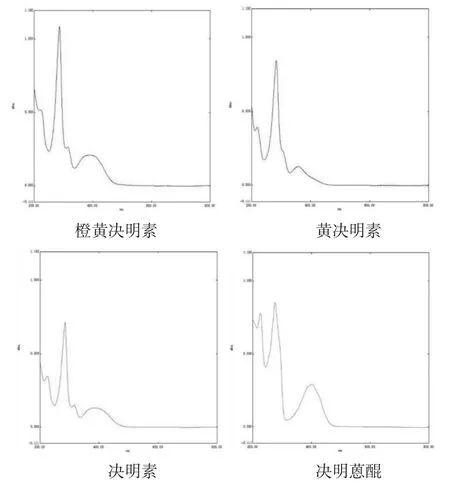
图1 对照品溶液全波长扫描图
利用软件中“峰值检测”,可知橙黄决明素最大吸收峰为286 nm,黄决明素为283 nm,决明素为284.5 nm,决明蒽醌为276 nm,结合2015年版《中华人民共和国药典》一部决明子项下含量测定的检测波长为284 nm,最终选取284 nm为检测波长。
2.4.3 专属性考察 阴性对照品溶液的制备:根据处方用量比例,称取除决明子外的其他饮片制成茶汤溶液,按“2.3.1”项下方法制备阴性对照品溶液。
分别精密吸取混合对照品溶液、供试品溶液、阴性对照品溶液各20 μL,按“2.4.1”项下色谱条件进行测定,结果见图2,结果表明,供试品色谱图中,与对照品相同保留时间处有相应色谱峰,阴性对照品色谱图中,与对照品相同保留时间处无相应色谱峰,阴性无干扰。
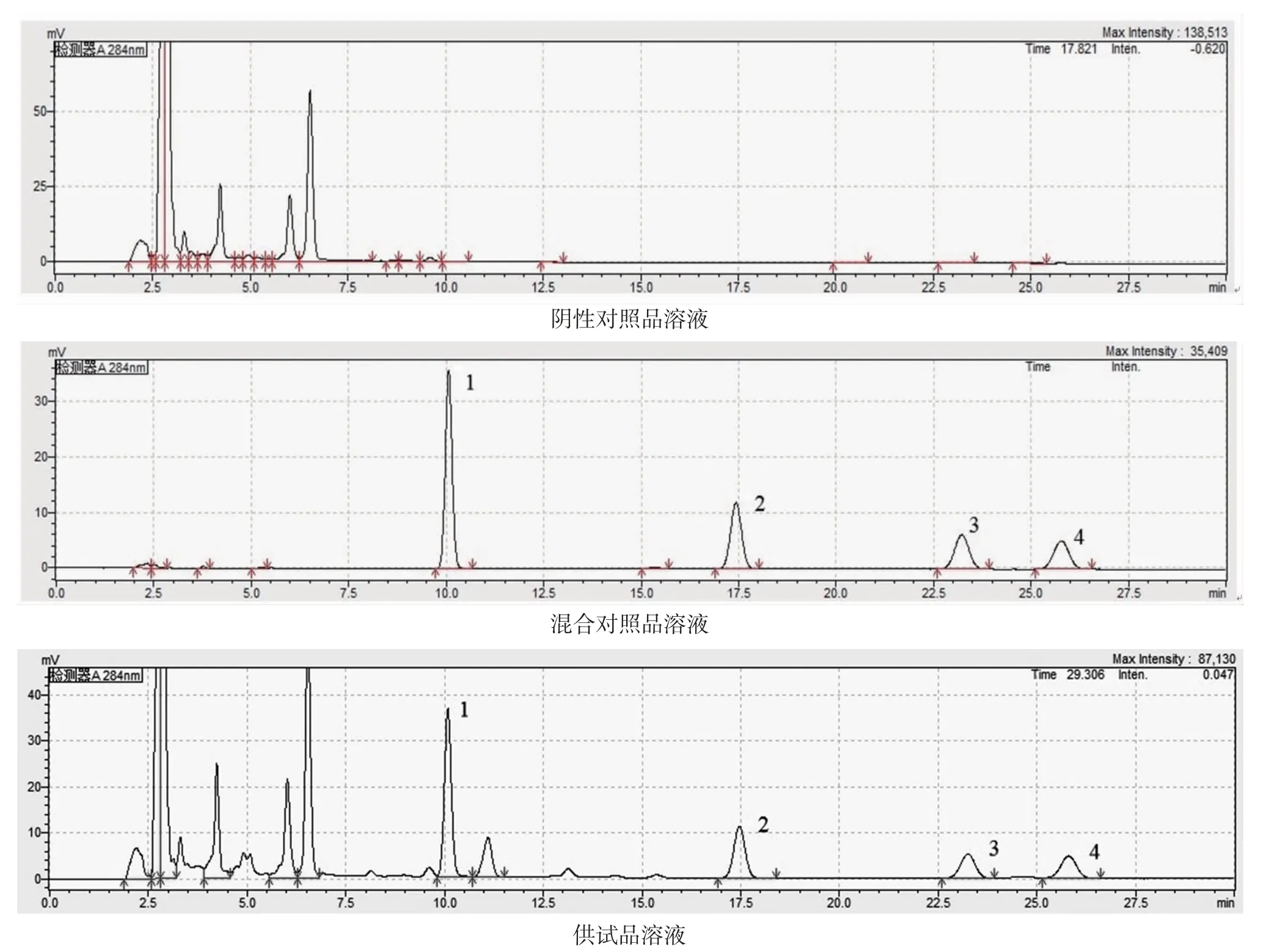
图2 各样品溶液HPLC 图
2.4.4 线性关系考察 分别精密吸取“2.2.1”项下混合对照品溶液20 μL,按“2.4.1”项下色谱条件进行测定,记录色谱峰峰面积,分别以进样量(μg)为横坐标(X),峰面积为纵坐标(Y)绘制标准曲线并进行线性回归分析,得各对照品的标准曲线回归方程、线性范围和相关系数(见表1),结果表明,各组分在相应线性范围内,峰面积与浓度具有良好的线性关系。
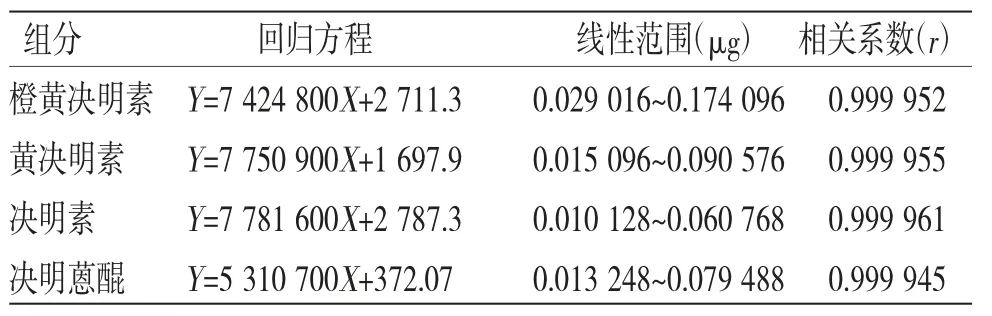
表1 线性关系考察结果
2.4.5 精密度试验 精密吸取“2.2.1”项下同一混合对照品溶液20 μL,按“2.4.1”项下色谱条件进行测定,连续进样6次,记录色谱峰峰面积,计算橙黄决明素、黄决明素、决明素和决明蒽醌峰面积的RSD值分别为1.50%、1.54%、1.52%、1.58%。结果表明仪器精密度良好。
2.4.6 稳定性试验 精密吸取同一供试品溶液20 μL,分别在0、2、4、6、12、24 h按“2.4.1”项下色谱条件进行测定,记录色谱峰峰面积,计算橙黄决明素、黄决明素、决明素和决明蒽醌峰面积的RSD值分别为1.56%、1.77%、1.50%、1.52%。结果表明供试品溶液各组分在24 h内稳定。
2.4.7 重复性试验 取同一茶汤溶液6份,按“2.3.1”项下方法,制备供试品溶液,精密吸取供试品溶液20 μL,按“2.4.1”项下色谱条件进行测定,记录色谱峰峰面积,计算橙黄决明素、黄决明素、决明素和决明蒽醌在茶汤溶液中的平均含量和RSD,结果见表2。结果表明本方法重复性良好。

表2 重复性试验结果
2.4.8 加样回收率试验 精密量取已知含量的茶汤溶液6份,每份25 mL,分别精密加入同一浓度混合对照品溶液25 mL(精密量取混合对照品储配液3.5 mL,转移至250 mL量瓶中,加水稀释至刻度,摇匀),按“2.3.1”项下“加盐酸5 mL”起,制备供试品溶液,精密吸取各供试品溶液20 μL,按“2.4.1”项下色谱条件进行测定,记录色谱峰峰面积,计算加样回收率和RSD,结果见表3。结果表明本方法的准确度符合要求。

表3 加样回收率试验结果
2.4.9 样品含量测定 分别制备3份茶汤溶液,按“2.3.1”项下方法,制备供试品溶液,精密吸取各供试品溶液20 μL,按“2.4.1”项下色谱条件进行测定,记录色谱峰峰面积,计算橙黄决明素、黄决明素、决明素和决明蒽醌在茶汤溶液中含量及药材中含量,结果见表4。

表4 样品含量测定结果(n=3)
2.5 总生物碱含量测定方法的建立
2.5.1 溴甲酚绿溶液的制备 取溴甲酚绿0.1 g,加0.05 mol/L氢氧化钠溶液2.8 mL,再加水稀释至200 mL,即得。
2.5.2 反应及测定条件的选择
2.5.2.1 缓冲溶液pH值选择 分别配制pH值为3.2、3.6、4.0、4.4、4.8、5.2、5.4、6.0的柠檬酸-柠檬酸钠缓冲溶液。
精密吸取供试品溶液10.0 mL数份,置具塞试管中,分别精密加入不同pH值的柠檬酸-柠檬酸钠缓冲溶液5.0 mL,随后加入溴甲酚绿溶液2.0 mL,摇匀,再加入二氯甲烷10.0 mL,置于涡旋振荡器振摇20 s,转移至分液漏斗中,静止15 min,分取二氯甲烷层(放入无水硫酸钠0.5 g),以二氯甲烷为参比,在200~600 nm处分别进行全波长扫描,结果见图3。
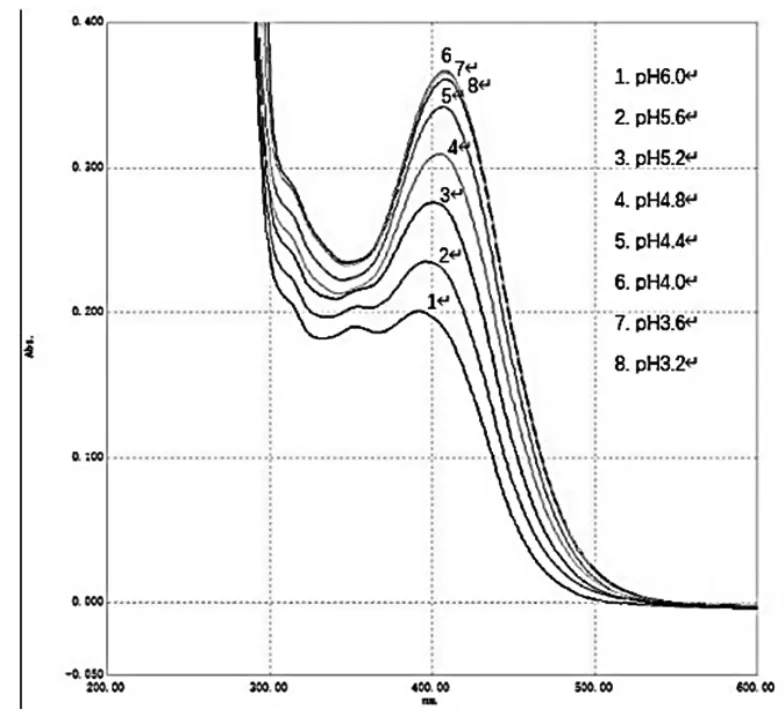
图3 不同pH 缓冲溶液条件下样品溶液全波长扫描图
根据实验结果分析,在不同pH值缓冲溶液条件下,各样品溶液在400 nm左右均有特征吸收峰,吸收峰的最大吸收波长(λmax)和最大吸光度(Amax)均有所不同(见表5),选择吸收峰吸光度最大的pH值缓冲溶液作为实验溶液,故最终选择pH值为4.0缓冲溶液。
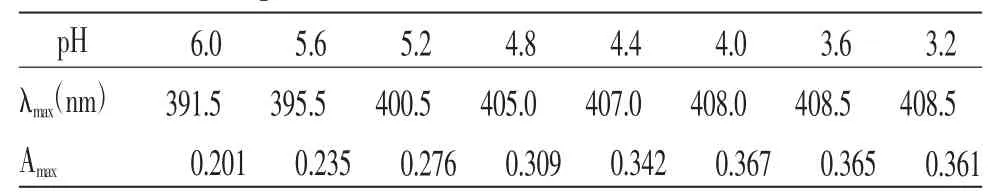
表5 不同pH 缓冲溶液条件下样品溶液的最大吸收
2.5.2.2 测定波长的选择 精密吸取对照品溶液0.8 mL,于25 mL容量瓶中,加水稀释并定容至刻度。精密吸取此对照品溶液10.0 mL,置具塞试管中,精密加入pH值为4.0的柠檬酸-柠檬酸钠缓冲溶液5.0 mL,随后加入溴甲酚绿溶液2.0 mL,摇匀,再加入二氯甲烷10.0 mL,置于涡旋振荡器振摇20 s,转移至分液漏斗中,静止15 min,分取二氯甲烷层(放入无水硫酸钠0.5g),以二氯甲烷为参比,在200~600 nm处进行全波长扫描。根据实验结果,对照品溶液的最大吸收峰为410 nm,故选择410 nm为测定波长。
2.5.2.3 酸性染料用量选择 精密吸取供试品溶液10.0 mL 5份,置具塞试管中,精密加入pH值为4.0的柠檬酸-柠檬酸钠缓冲溶液5.0 mL,随后分别加入溴甲酚绿溶液1.0、2.0、3.0、4.0、5.0 mL,摇匀,再加入二氯甲烷10.0 mL,置于涡旋振荡器振摇20 s,转移至分液漏斗中,静止15 min,分取二氯甲烷层(放入无水硫酸钠0.5 g),以二氯甲烷为参比,于410 nm处测定吸光度。结果见表6。结果表明酸性染料用量选择3.0 mL。
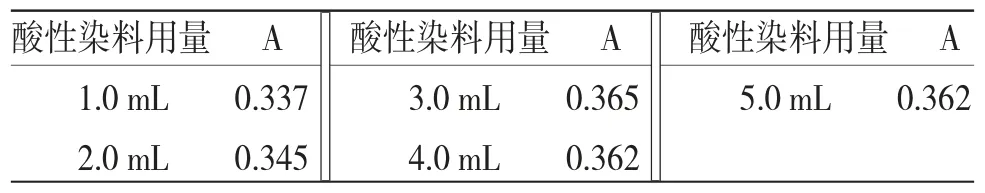
表6 酸性染料用量选择实验结果
2.5.2.4 缓冲溶液用量的选择 精密吸取供试品溶液10.0 mL 5份,置具塞试管中,分别精密加入pH值为4.0的柠檬酸-柠檬酸钠缓冲溶液2.0、4.0、6.0、8.0、10.0 mL,随后加入溴甲酚绿溶液3.0 mL,摇匀,再加入二氯甲烷10.0 mL,置于涡旋振荡器振摇20 s,转移至分液漏斗中,静止15 min,分取二氯甲烷层(放入无水硫酸钠0.5 g),以二氯甲烷为参比,于410 nm处测定吸光度。结果见表7。结果表明缓冲溶液用量选择2.0 mL。

表7 缓冲溶液用量选择实验结果
2.5.3 线性关系考察 精密吸取对照品溶液0.4、0.6、0.8、1.0、1.2、1.4 mL,于25 mL容量瓶中,加水稀释并定容至刻度。精密吸取以上各对照品溶液10.0 mL,置具塞试管中,精密加入pH值为4.0的柠檬酸-柠檬酸钠缓冲溶液2.0 mL,随后加入溴甲酚绿溶液3.0 mL,摇匀,再加入二氯甲烷10.0 mL,置于涡旋振荡器振摇20 s,转移至分液漏斗中,静止15 min,分取二氯甲烷层(放入无水硫酸钠0.5 g),以二氯甲烷为参比,照紫外可见分光光度法(2015年版《中华人民共和国药典》四部附录0401),于410 nm波长处测定吸光值。以吸光度为纵坐标,浓度为横坐标,进行线性回归。得到以下线性回归方程Y=0.006 8X-0.0144,r=0.9998,结果表明当荷叶碱对照品在30.72~107.52 μg范围内与吸光度有良好的线性关系。
2.5.4 精密度试验 精密吸取对照品溶液3.2 mL,于100 mL容量瓶中,加水稀释并定容至刻度。再精密吸取此对照品溶液10.0 mL,6份,按“2.3.1”项下“置具塞试管中”起,依法测定吸光度,RSD为1.30%,结果表明该方法精密度较好。
2.5.5 稳定性试验 精密吸取供试品溶液10.0 mL,按“2.3.1”项下“置具塞试管中”起,依法每隔30 min,共180 min内测定吸光度,RSD为0.20%,结果表明该方法在180min内稳定性良好。
2.5.6 重复性试验 按“2.1.2”项下供试品溶液制备方法同一样品溶液制备6份,精密吸取各供试品溶液10.0 mL,按“2.3.1”项下“置具塞试管中”起,依法测定吸光度。计算得平均含量以荷叶碱计算为5.871 μg/mL,RSD为1.97%。结果表明方法的重复性较好。
2.5.7 加样回收率试验 精密吸取已知含量供试品溶液5.0 mL 6份,置于具塞试管中,随后分别精密加入同一浓度对照品溶液5.0 mL,按“2.3.1”项下“置具塞试管中”后起,依法测定吸光度,计算回收率。平均回收率为102.10%,RSD为1.91%。(见表8)

表8 加样回收率实验结果
2.5.8 含量测定 按上述方法,测定3批降脂方样品溶液中总生物碱含量,结果其生药中总生物碱含量以荷叶碱计算分别为0.492、0.476、0.425 mg/g。
3 讨 论
3.1 蒽醌含量测定方法 降脂方中蒽醌类成分主要来源于决明子,主要为大黄素型蒽醌,呈游离或结合状态,样品需经过水解将结合态转变成游离态进行测定,结合2015年版《中华人民共和国药典》一部决明子[4]项下含量测定的供试品溶液的制备,利用正交实验,选用L9(34)正交表,考察盐酸用量(50 mL茶汤溶液分别加入5、15、25 mL盐酸)、水解时间(水浴加热30、75、120 min)、振摇提取次数(50 mL三氯甲烷分别振摇提取2次、3次、4次)三因素三水平的影响情况,方差分析结果显示,各因素水平对结果影响并不显著,最终根据直观分析,选择水解条件为加盐酸5 mL置水浴中加热水解30 min,立即冷却,用三氯甲烷振摇提取4次,每次50 mL。
在确定检测指标成分和流动相时,曾参照2015年版《中华人民共和国药典》一部决明子[4]项下含量测定的流动相条件以及文献资料[5-8]进行试验,色谱图中对应有多个蒽醌类成分色谱峰,按保留时间为橙黄决明素、黄决明素、决明素、决明蒽醌、大黄素、大黄酚、大黄素甲醚,但由于大黄素、大黄酚、大黄素甲醚在茶饮冲泡条件下含量较低,故选择橙黄决明素、黄决明素、决明素、决明蒽醌4个含量相对较高的成分作为检测指标成分,同时调整流动相条件,最终选择乙腈-0.1%磷酸溶液(40∶60)等度洗脱,使各指标成分峰之间能达到较好的基线分离。
3.2 总生物碱含量测定方法 目前已知的荷叶中分离得到的生物碱,按照生源途径结合化学结构类型分类,可将它们归为苯丙氨酸和酪氨酸系生物碱中的异喹啉类[2],而在萜类、吖啶酮类、甾类、有机胺类、异喹啉类或多种类型混合生物碱中,溴甲酚绿和溴麝香草酚蓝均有应用,其中异喹啉类生物碱应用溴甲酚绿较多[9]。故本实验的酸性染料选择用溴甲酚绿。
酸性染料比色法的原理是在适宜酸性条件下,生物碱阳离子可与染料阴离子定量结合,生成水难溶性有色离子对产物,有机溶剂萃取后,可以在紫外可见分光光度计中测定有机层溶液的吸光度,根据标准曲线计算出生物碱的含量。因此,缓冲溶液的种类、缓冲溶液pH和用量、酸性染料用量等都会对反应产生影响。本实验对这些影响因素进行了比较详细的研究,确定了最佳反应条件[10-17]。
在比色过程中,水分的混入会影响测定结果,因为水相中有过量的有色染料,同时水的混入使有机溶剂混浊,影响比色[18],因此加入了一定量的无水硫酸钠作为脱水剂。本实验还比较了二氯甲烷和三氯甲烷的萃取效果,发现用二氯甲烷萃取所测的吸光度更大,且二氯甲烷毒性较低,故实验选用二氯甲烷进行萃取。
综上所述,本实验建立了HPLC法同时测定降脂方中橙黄决明素、黄决明素、决明素、决明蒽醌这4种蒽醌类成分含量的分析方法和利用酸性染料比色法测定降脂方中总生物碱的方法。方法操作简便,结果准确可靠,专属性强,重复性好,为本课题今后进一步研究降脂方冲泡条件奠定了实验基础。

