紫薯花青素提取工艺及初步纯化研究
万新冉,郑晓彤,魏梓晴,任 红,黄桂东,温海祥*
(佛山科学技术学院 食品科学与工程学院,广东 佛山 528225)
花青素(anthocyanidins,OPC)是一类广泛存在于植物中的水溶性天然色素,是许多果蔬、花卉中的主要呈色物质。植物呈色深浅受pH、温度等多种因素影响[1-2]。研究表明,花青素具有保护视力、抗衰老[3]、抵御紫外线[4]、抗肿瘤[5]、抗炎症[3]等功效,广泛应用于食品添加剂[6-7]。花青素是一种具有C6-C3-C6 基本结构的类黄酮,自然条件下多与葡萄糖、鼠李糖等通过糖苷键链接形成花色苷。传统的花青素提取材料红葡萄、萝卜、紫甘蓝等易受到稳定性、季节性、价格等因素的影响,紫薯不仅克服了这些缺点且产量高,种植面广,成为了提取花青素的重要原料[1,8]。与其他来源的花青素相比,紫薯花青素在日光照射下色彩稳定性强,耐热性较强,且经花青素着色的食品,包装时无需遮光,经巴氏消毒后比较稳定[9-10]。因此,研究紫薯花青素更有现实价值及开发前景。
本文采用柠檬酸水溶液为提取剂,结合超声辅助提取紫薯花青素,采用响应面法优化紫薯花青素提取工艺。花青素在中性或弱碱性溶液中不稳定,因此在提取过程中使用酸性溶剂破坏紫薯细胞膜以提高花青素提取率[2,11]。超声辅助法有提高提取效率、缩短提取时间的特点[8]。因粗提花青素中有大量的糖类杂质,故本研究拟采用价格低廉、利用率高、适应能力强、效果佳的大孔树脂进行初步纯化,所得结果以期为紫薯花青素的深入研究利用提供参考。
1 材料与方法
1.1 材料与试剂
新鲜紫薯,购买于盒马生鲜平台;原花青素标准品(纯度≥98%,上海乔羽生物科技有限公司);纤维素酶(食品级,上海瑞永生物科技有限公司);柠檬酸、硫酸铁铵、浓盐酸、正丁醇、乙醇(分析纯)等购自广州市金华大化学试剂有限公司。
1.2 仪器与设备
超声波清洗机(型号:SB25-12DTD,宁波新芝生物科技股份有限公司),高速冷冻离心机(型号:CR22G-Ⅲ型,株式会社日立制作所),紫外分光光度计(型号:UV-1800,日本岛津公司),恒流泵(HL-2,上海青浦沪西仪器厂),水浴锅(型号:OSB-2100,上海泉杰仪器有限公司),酶标仪(型号:Multiskan FC,美国Thermo 公司)等。
1.3 试验方法
1.3.1 花青素含量的测定
参照DB12/T 885-2019《植物提取物中原花青素的测定》[12]。以原花青素标准品浓度为横坐标,吸光值A530为纵坐标,绘制原花青素浓度标准曲线,所得回归方程为y=0.001 7x-0.012 8,R2=0.996。测定花青素含量并计算粗提液样品中紫薯花青素的提取率,即

式(1)中,C 为质量浓度(g/mL),V 为料液总体积(mL),m 为紫薯干重(g)。
1.3.2 紫薯花青素提取
称取块状紫薯10 g,用柠檬酸水溶液为提取剂,添加纤维素酶(37.5 ug/mL),超声(50 ℃、100 w)提取,冷却后离心(4 000 r/min、-4 ℃、10 min)取上清液,同1.3.1 中方法测定紫薯花青素浓度,计算花青素提取率。分别考察液料比(15:1、20:1、25:1、30:1、35:1)、不同浓度提取剂(0.1 %、1 %、5 %、10 %、15%)、不同提取时间(20、25、30、35、40 min)对紫薯花青素提取率的影响。
1.3.3 响应面优化提取条件
基于单因素试验,设置Box-Behnken 响应面设计3 个因素:液料比(mL/g)、柠檬酸浓度(%)、提取时间(min),以花青素提取率为响应指标,优化提取工艺,实验因素与水平设计如表1。

表1 响应面分析因素与水平
1.3.4 紫薯花青素粗提液的纯化
取AB-8 大孔树脂层析柱,预处理后,提取物(浓度0.7 mg/mL)以1 mL/min 流速上样,到达泄漏点后,采用体积分数为75 %乙醇作为洗脱剂以相同的速度依次梯度洗脱附着的花青素[13]。计算不同量洗脱液中的紫薯花青素浓度与多糖浓度并制作洗脱曲线,确定洗脱条件。
1.3.5 多糖去除率的计算
分别取0、0.2、0.4、0.6、0.8、1.0 mL 葡萄糖标准溶液(0.1 mg/mL),蒸馏水定容至1.0 mL,依次加入1.0 mL 5 %苯酚溶液、5.0 mL 浓硫酸,振荡,静置10 min,水浴(30 ℃、20 min),恢复至室温,测490 nm吸光度,以葡萄糖质量浓度为横坐标,吸光度为纵坐标的葡萄糖浓度标准曲线[14],得到y=8.997 1x+0.011 5,R2=0.996 7。
在梯度洗脱条件优化的基础上,测定紫薯花青素粗提液经过树脂纯化前后的多糖浓度(以葡萄糖浓度计),计算多糖去除率,即
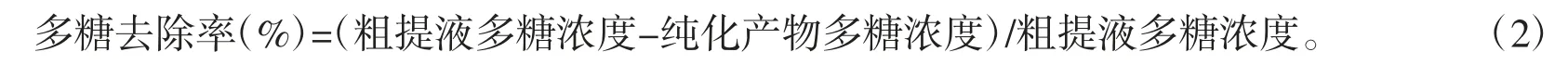
2 结果与分析
2.1 单因素实验结果
2.1.1 液料比对紫薯花青素提取率的影响
由图1 可知,随着料液比的增加,花青素提取率呈现先升高后降低的趋势。随着液料比的增加,紫薯花青素的含量逐渐增高,提取率升高,有利于花青素的提取;当液料比达到25:1 mL/g 时,花青素提取率为(5.85±0.24)%。当液料比继续增加时,紫薯花青素含量增加不明显,提取率降低,不利于花青素的提取。综上所述,25:1 mL/g 的液料比时提取效果最好。

图1 液料比对紫薯花青素提取率的影响
2.2.2 柠檬酸浓度对紫薯花青素提取率的影响
花青素在酸性条件下比较稳定,增加提取液中的柠檬酸含量有助于花青素的提取[7]。由图2 得知,当柠檬酸浓度为0.1 %时,花青素的提取率比较低,随着柠檬酸浓度增大,溶液酸性增强,花青素提取率逐渐增高,在柠檬酸浓度为10 %时达到最高。但过强的酸性环境会引起花青素水解,其稳定性也受到影响,故花青素提取率会逐步降低,综合分析选取浓度为10 %的柠檬酸作为提取剂。
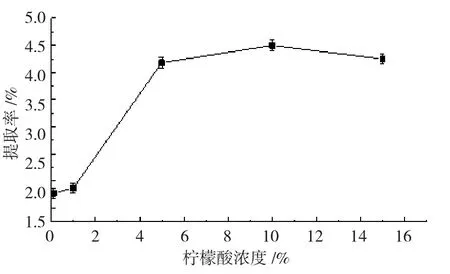
图2 柠檬酸浓度对紫薯花青素提取率的影响
2.2.3 提取时间对紫薯花青素提取率的影响
由图3 可得,提取时间对花青素提取率影响的趋势是先升高后降低,提取时间在30 min 时,花青素提取率最高。分析认为,当超声提取时间过长时,会造成提取液发热,当温度高于60℃时,花青素会处于不稳定状态而氧化分解,造成花青素的提取率下降[11],因此,提取时间为30 min 时,花青素提取率最大,为紫薯花青素最佳提取时间。

图3 提取时间对紫薯花青素提取率的影响
2.3 响应面实验设计结果
2.3.1 响应面实验结果分析
根据单因素试验结果与Box-Behnken 的中心组合设计原理,考察液料比、柠檬酸浓度、提取时间对花青素提取率的影响,3 因素3 水平响应面试验设计结果如表2 所示。
利用design expert 10.0 软件,执行多元回归分析,并对表2 中Y 值(提取率)的实验数据进行拟合[15-16],得到目标值为花青素提取率,自变量为液料比(A)、柠檬酸浓度(B)和提取时间(C)多项式回归方程

表2 Box-behnken 实验设计及结果

其中,A 和B 变量前面的正系数决定了响应指标提取率会随着这两个变量的正向变化而提高,相反,C变量的负系数意味着变量的正向变化会导致响应值的降低。在试验范围内,对于提取因素对花青素提取率的影响,变量前系数的绝对值大小显示C>B>A,表明紫薯花青素提取率随着超声时长的变化而产生较大的波动,其次是柠檬酸浓度,液料比对其影响程度最小。
从表3 看出,该模型F 值为52.53,所对应的P 值<0.000 1,说明该模型显著性极高,试验表中数据显示失拟值P=0.862 3>0.05,无显著差异。试验复相关系数R2为0.985 4 和校正测定系数R2Adj为0.966 7,说明该模型拟合程度较好,实验数据能起到参考与指导作用,复相关系数R2意味着98.54%目标值的变异性可用该模型进行解释说明。此外,低变异系数CV 为3.77 表示模型的准确度高。预测结果与实际实验值存在的实验误差较小,关联性较强,可用该回归方程对花青素提取率进行预测和分析。

表3 回归模型方差分析结果
2.3.2 响应面交互作用分析
通过观察各因素相互作用的等高线和响应面图,可以分析出花青素提取率受不同因素交互作用下的影响。比较图4 可看出,随着提取条件的变化,花青素提取率都呈现出先上升达到峰值后又降低的趋势。若等高线轮廓呈多个椭圆形[17-20],所对应的响应曲面坡度的斜率较大,表明两因素交互影响显著。观察分析图4a 中柠檬酸浓度(B)和液料比(A)交互作用图,显然该交互效应符合上述内容特征。而柠檬酸浓度(B)和提取时间(C)、液料比(A)和提取时间(C)的曲线坡度相比柠檬酸浓度(B)和液料比(A)图显得更加平缓,等高线形状也近似圆形,交互作用并不显著。模型结果显示,柠檬酸浓度(B)和液料比(A)交互作用P 值小于0.05,即差异显著;柠檬酸浓度(B)和提取时间(C)、液料比(A)和提取时间(C)交互作用下P 值均大于0.05,分别为0.112 4 和0.558 9,即差异不显著,说明响应面与等高线图分析结果与模型分析结果一致。

图4 不同处理因素交互作用对花青素提取率的响应面和等高线图
2.3.3 响应面优化结果验证
以该响应面模型拟合为前提条件,利用响应面分析软件对提取条件进行最终优化,得出最优参数为液料比25.19:1、柠檬酸浓度10.48 %、提取时间28.93 min,模型预测花青素提取率为6.03 %。根据实际情况调整为液料比25:1、柠檬酸浓度为10.5 %、提取时间为29 min,经实验验证得实际提取率为(5.9±0.89)%,与预测值接近。因此响应面法优化得到的紫薯花青素提取工艺可靠准确,可为实际生产提供理论依据。
2.4 花青素粗提液的纯化
2.4.1 上样体积对吸附效果的影响
大孔树脂是利用范德华相互作用力,吸附纯化对应物质[21],在大孔树脂吸附花青素过程中,随着上样量增加吸附量增大,当吸附量饱和时,吸附能力降低。上样量对花青素泄漏含量曲线如图5。

图5 上样体积对吸附效果的影响
当上样液于柱床体积比为1 BV 时,流出液花青素浓度为0.072±0.009 mg/mL,约为上样量的1/10,即到达泄漏点。在1 BV 后随着上样体积的增加花青素质量浓度明显增加。综上最佳上样量为1 BV。
2.4.2 动态洗脱曲线和多糖浓度曲线的测定
从图6 可看出,随着洗脱液用量的增加,洗脱液中花青素浓度先上升后下降,当洗脱液为6 BV 时,大孔树脂柱中的紫薯花青素基本洗脱完全,7 BV 后花青素浓度基本不变。多糖浓度呈下降趋势,在3 BV 洗脱液中多糖含量较低,增加洗脱液体积多糖浓度略有下降但较小。因此,综合洗脱效果和试验成本,应收集3~6 BV 洗脱液中的紫薯花青素。测得纯化后溶液花青素浓度为0.476±0.065 mg/mL,得率为68%,即纯化后提取物中花青素含量为39.984±1.24 mg/g。

图6 动态洗脱曲线
根据上述试验,测定纯化前后多糖含量,测得花青素粗提液中多糖含量为22.26±1.023 mg/mL,纯化产物多糖含量为0.16±0.078 mg/mL。多糖去除率高达(99.3±0.972)%,效果显著。
3 结论
通过单因素实验和响应面实验考察了液料比、柠檬酸浓度、提取时间对花青素提取率的影响,确定了紫薯花青素的最优提取工艺为液料比25:1 mL/g,柠檬酸浓度10.5 %,超声波处理时间为29 min,花青素提取率为(5.9±0.89)%。采用AB-8 型大孔树脂初步纯化了花青素粗提液,纯化的最佳条件为1 BV上样量,收集3~6 BV 洗脱液中的紫薯花青素,纯化后的花青素浓度为0.476±0.065 mg/mL,紫薯花青素纯化得率为68 %,即纯化后提取物中花青素含量为39.984±1.24 mg/g;对比纯化前后的花青素提取液多糖含量,粗提液多糖含量为22.26±1.023 mg/mL,纯化产物多糖含量为0.16±0.078 mg/mL,多糖去除率达(99.3±0.972)%。本论文对紫薯花青素提取的工艺和纯化做了初步研究,所得结果可为紫薯花青素的开发与利用提供一定参考。

