罗湖病毒RT-LAMP 方法的建立与应用
徐淑菲,林双庆,陈信忠,刘启霖,蔡绍鑫,曾韵颖,朱黄鑫,方成俊,孔凡德
(1.厦门海关技术中心,福建厦门 361026;2.东山海关综合技术服务中心,福建东山 363401;3.厦门海关,福建厦门 361000)
罗非鱼是全球第二大重要的养殖鱼类。我国为世界第一罗非鱼养殖大国,养殖产量约占世界总产量的50%,主要集中于广东、广西、海南和福建等地,以出口为主。2009 年夏天,以色列某养殖场罗非鱼突然大量死亡,同年,自然生长的野生罗非鱼也出现大量死亡。经证明,死亡鱼感染了罗湖病毒(tilapia lake virus,TiLV)。随后,厄瓜多尔、埃及、马来西亚、哥伦比亚、泰国、印度以及中国台湾等相继发现TiLV 感染病例[1-6]。2017 年雷燕等[7]研究报告称,从海南省养殖的罗非鱼中检测出TiLV。2019 年雷燕等[8]再次研究称,从广东、海南、福建等省的罗非鱼样品中均检出TiLV。然而,官方和其他研究团队目前均未有我国检出TiLV 的报道。
LAMP 技术即环介导的等温扩增技术(loopmediated isothermal amplification,LAMP),由于不需要PCR 仪和昂贵的试剂,目前已被广泛应用于肿瘤筛选、植物病毒检测、转基因食品检测、动物胚胎性别鉴定、水生陆生动物的细菌性及病毒性疫病检测等方面[9-10]。与普通PCR、荧光定量PCR相比,LAMP 优点突出,具有效率高、特异性好、肉眼可观察结果等特点。
目前,世界动物卫生组织(OIE)和我国尚未将TiLV 列入检疫名录,也无相应检测标准。因此,建立TiLV 检测方法,对于了解国内TiLV 的流行病学,建立对应的检测标准具有重要意义。TiLV为分段、单链的负链RNA 病毒,由10 个基因片段组成。本研究根据编码RNA 聚合酶的片段1,设计LAMP 引物,采用Genie II 等温扩增荧光检测系统,应用等温扩增技术原理,结合荧光检测技术,建立了检测TiLV 的RT-LAMP 方法。
1 材料与方法
1.1 材料
1.1.1 样品采集和处理 罗非鱼临床样品,一部分从福建省养殖场采集,具体包括诏安县梅川双田水库养殖场、漳州市常山基祥水产养殖场、诏安县红坑水库养殖场、福建铭兴食品冷冻有限公司四都水库养殖场、三姑娘水库养殖场、岭下溪水库养殖场、石厝底水库养殖场、梅州水库养殖场。另一部分为厦门海关每年进行TiLV 监控采集的样品。采集罗非鱼成鱼的肝、脾、肾和脑组织,-80 ℃冻存备用。
1.1.2 主要病毒核酸及浓度 真鲷虹彩病毒(red sea bream iridovirus,RSIV)、锦鲤疱疹病毒(koi herpesvirus,KHV)、流行性造血器官坏死病病毒(epizootic haematopoietic necrosis virus,EHNV)、金鱼造血器官坏死病病毒(goldfish haematopoietic necrosis virus,GFHNV)、流 行性溃疡综合征(epizootic ulcerative syndrome,EUS)病原、鲤春病毒血症病毒(spring viremia of carp virus,SVCV)、传染性造血器官坏死病病 毒(infectious haematopoietic necrosis virus,IHNV)、传染性鲑鱼贫血病病毒(infectious salmonid alphavirus,ISAV)、鲑鱼甲病毒(salmonid alphavirus,SAV)、病毒性出血性败血症病毒(viral haemorrhagic septicaemia virus,VHSV)等病原核酸,由深圳海关技术中心提供,上述病毒核酸浓度依次为20、20、20、30、22、20、23、15、20、20 μg/mL。
1.1.3 主要试剂及仪器 MagSi Total RNA Kit(货号M7930-02),为OMEGA 公司产品;2×Master Mix(IMM 产品号ISO-001),由北京晟泰勃科技有限公司提供;Evo M-MLV 反转录试剂盒(产品号AG11705),由艾科瑞生物有限公司提供。磁珠纯化系统(型号Auto-Pure32A),为杭州奥盛公司产品;台式冷冻离心机(型号Allegra64R),为Beckman 公司产品;等温扩增核酸检测系统(型号Genie Ⅱ),为OptiGene 公司产品。
1.1.4 TiLV 标准质粒和慢病毒 合成的TiLV 标准质粒和慢病毒序列相同,均为976 bp,包含本试验RT-LAMP 方法扩增的TiLV 片段序列(269 bp)。TiLV 质粒(5 ng/μL),由厦门普诺普和生物技术有限公司合成;TiLV 慢病毒(25 ng/μL),由厦门安提海拉生物科技有限公司合成,用以模拟真病毒。
1.1.5 相关引物 根据TiLV 毒株EC-2012 片段1(Genbank 登录号:MK392372),运用LAMP 引物设计软件PrimerExplorer,设计检测TiLV 的RTLAMP 引物,并送厦门普诺普和生物技术有限公司合成。
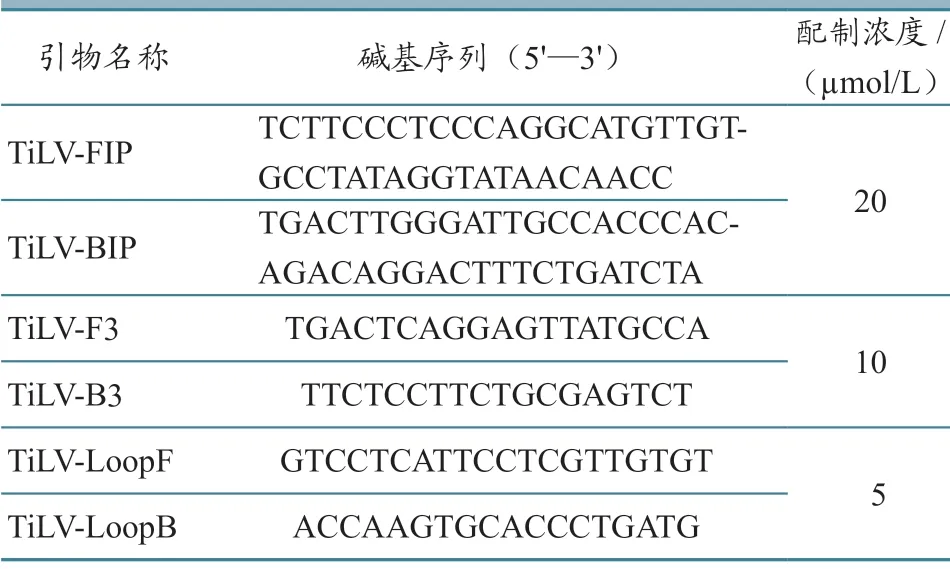
表1 引物序列
1.1.6 反应体系和反应条件(1)反转录10.00 μL 反应体系:gDNA Clean Reagent 1.00 μL,5×gDNA Clean Buffer 2.00 μL,Total RNA 7.00 μL。(2)LAMP 20.00 μL 反应体系:2×Master Mix 10.00 μL,TiLV-FIP/BIP(20 μmol/L)各1.25 μL,TiLV-F3/B3(10 μmol/L)各0.25 μL,TiLV-LoopF/B(5 μmol/L)各0.25 μL,模板1.00 μL,补充RNase-free water至总体积20.00 μL。若无特殊说明,均按照此反应体系进行试验。(3)反应条件:反转录试验为42 ℃,20 min;Genie II 等温扩增荧光检测系统默认的LAMP 反应条件(扩增65 ℃,30 min;退火从98 ℃到80 ℃,0.05 ℃/s),若无特殊说明,均按照此反应条件进行试验。
1.2 RNA 提取
按照MagSi Total RNA Kit 操作说明书进行RNA 提取。
1.3 RT-LAMP 方法建立及优化
取8 个荧光PCR 管,每管均加入2×Master Mix 10.00 μL、TiLV-LoopF/R 各0.25 μL、质量浓度为5.0×10-2ng/μL 的TiLV 质 粒1.00 μL 以 及TiLV-F3/B3 各0.25 μL(对应终浓度为0.25 μmol/L),然后第1~8 管依次加入TiLV-FIP/BIP 各1.75 μL(对应终浓度为1.75 μmol/L)、1.50 μL(对应终浓度为1.50 μmol/L)、1.25 μL(对应终浓度为1.25 μmol/L);1.00 μL(对应终浓度为1.00 μmol/L);0.75 μL(对应终浓度为0.75 μmol/L)、0.50 μL(对应终浓度为0.50 μmol/L)、0.25 μL(对应终浓度为0.25 μmol/L)、1.25×10-1μL(对应终浓度为1.25×10-1μmol/L),最后将每管反应体系用RNase-free water 补足至总体积20.00 μL。
1.4 RT-LAMP 方法灵敏度检测
将原始质量浓 度 为5.0 ng/μL 的TiLV 质 粒10 倍梯度稀释为5.0×10-1~5.0×10-8ng/μL。按照1.1.6 的RT-LAMP 反应体系(20.00 μL)配制试剂,分装到8 个荧光PCR 反应管中。第1~8 管分别加入经过梯度稀释的5.0×10-1~5.0×10-8ng/μL TiLV质粒各1.00 μL。按照1.1.6 的反应条件进行扩增。
1.5 RT-LAMP 方法重复性检测和熔解试验
将原始质量浓度为5.0 ng/μL 的TiLV 质粒10倍梯度稀释为5.0×10-1~5.0×10-8ng/μL。第1 组,按照1.1.6 的RT-LAMP 反应体系配制试剂,分装到8 个荧光PCR 反应管中,第1~8 管分别加入经过梯度稀释的5.0×10-1~5.0×10-8ng/μL TiLV 质粒各1.00 μL(对应终质量浓度为2.5×10-2~2.5×10-9ng/μL)。第2组为重复试验。按照1.1.6 的反应条件进行扩增和熔解试验。
1.6 RT-LAMP 方法特异性检测
按照1.1.6 反转录程序进行反转录试验,再按照1.1.6 的LAMP 反应体系配制试剂,平均分装到13 个荧光PCR 反应管中,第1~13 管分别加入初始质量浓度为5.0×10-2ng/μL 的TiLV 质粒、TiLV慢病毒、RSIV、KHV、EHNV、GFHNV、EUS 病原、SVCV、IHNV、ISA、SAV、VHSV、RNasefree water 各1.00 μL。按照1.1.6 的反应条件进行扩增反应。
1.7 临床样品检测
用建立的TiLV RT-LAMP 方法对300 份罗非鱼样品开展检测,反应体系和条件按照1.1.6 进行。
2 结果与分析
2.1 RT-LAMP 方法建立及优化
检测TiLV 的RT-LAMP 试验优化结果见图1。1~8 管反应结果对应图1 的曲线1~8,TiLVFIP/BIP 与TiLV-F3/B3 终浓度比例分别为14:1、12:1、10:1、8:1、6:1、4:1、2:1、1:1。随着引物TiLV-FIP/BIP 与TiLV-F3/B3 终浓度比例的减小,即TiLV-FIP/BIP 浓度的减少,扩增曲线所需时间逐渐变长(即Ct 值逐渐变大),曲线4~7 甚至在30 min 内扩增不出目的产物。曲线1~3 均出现典型的“S”型扩增曲线,曲线4~8 均未出现扩增曲线;曲线1~3 Ct 值比较接近,根据节约试剂材料原则,选择3 号曲线即第3 管的引物浓度和比例。
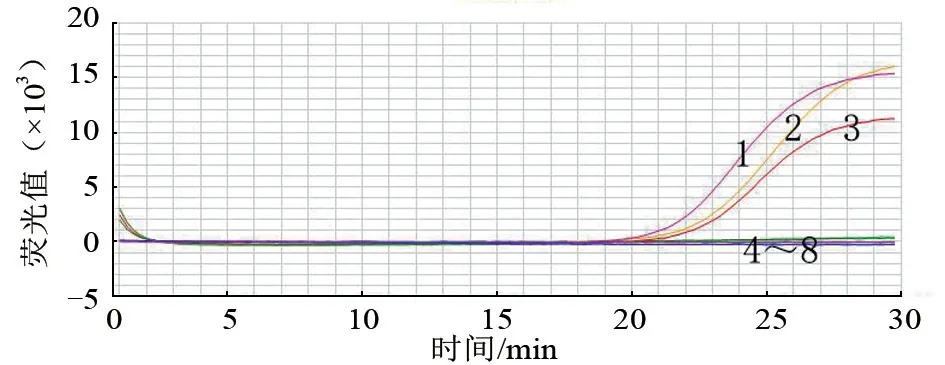
图1 RT-LAMP 引物最佳浓度探究结果
2.2 RT-LAMP 灵敏度检测
RT-LAMP 灵敏度检测结果如图2。第1~8 管分别对应图2 中的曲线1~8。曲线1~8,模板浓度逐渐递减,Ct 值越来越大,总反应时间为30 min。本试验可检测到第6 管,对应的是图2 中曲线6,终质量浓度为2.5×10-7ng/μL。因此,检测TiLV 的RT-LAMP 方法的灵敏度为2.5×10-7ng/μL。
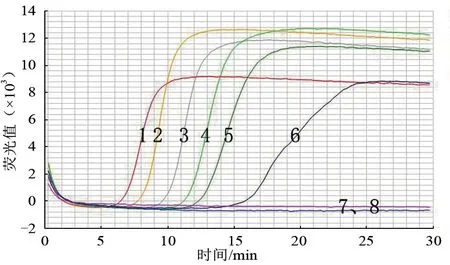
图2 RT-LAMP 灵敏度检测结果
2.3 RT-LAMP 重复性检测和熔解曲线
RT-LAMP 方法的重复性和熔解曲线试验结果如图3。第1 组试验是图3 中实线所示扩增曲线,第2 组是虚线所示扩增曲线。实线/虚线1~8 分别对应第1/2 组的第1~8 管。由图片可见,两组试验的重复性较好;两组试验熔解曲线均在84.5~85.0 ℃之间,略有差异,属于试验误差,最大误差是0.5 ℃,误差率0.6%,不影响整体熔解曲线的一致性,重复性较好,可判定扩增的是同一产物。
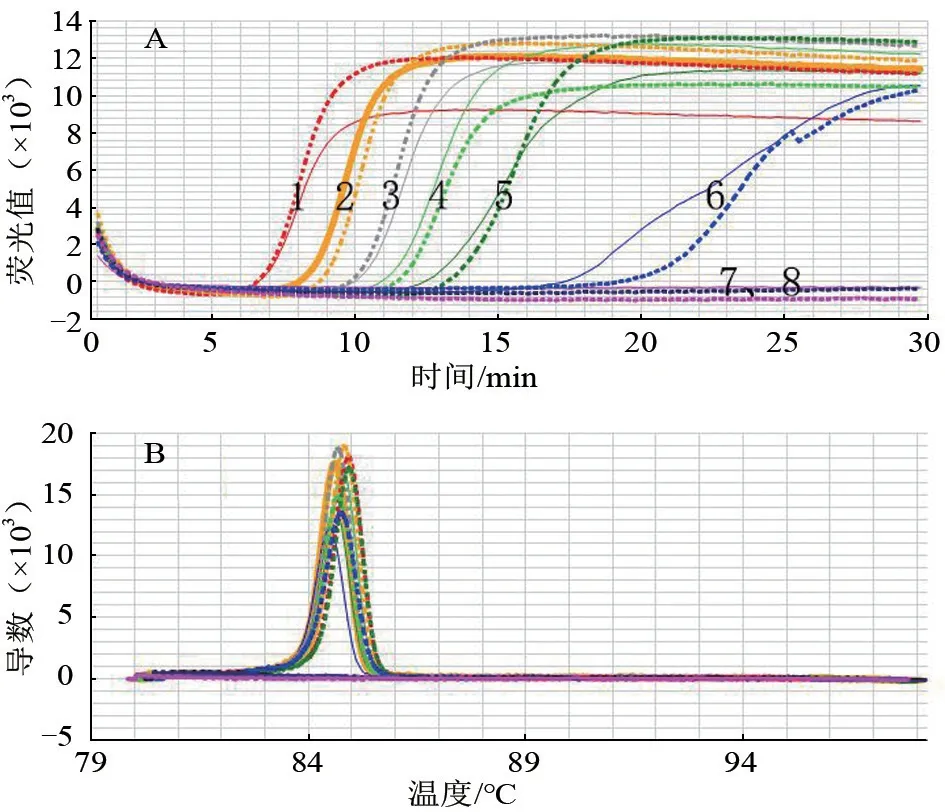
图3 RT-LAMP 重复性和熔解曲线检测结果
2.4 特异性试验
特异性分析试验结果见图4。图4 显示,建立的检测TiLV 的RT-LAMP 方法仅能够对TiLV 质粒及慢病毒进行特异性扩增,扩增曲线呈现典型的“S”型,而对RSIV 等其他病毒均无扩增曲线,说明该方法特异性良好。
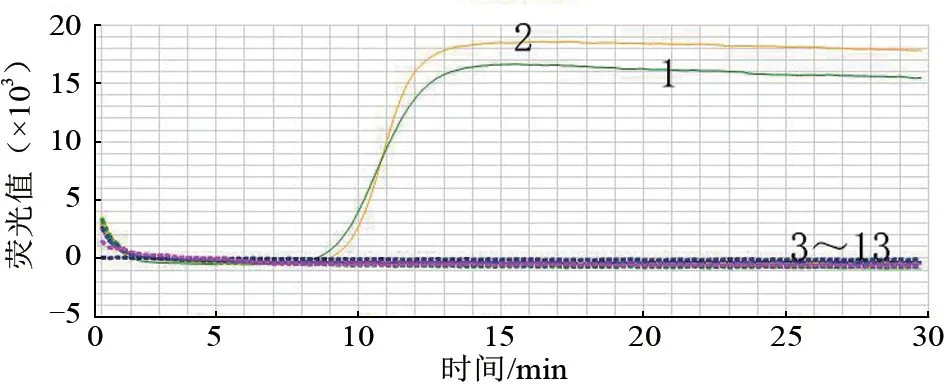
图4 RT-LAMP 特异性检测结果
2.5 临床样品检测
对300 份罗非鱼样品应用本试验建立的RTLAMP 方法进行检测,结果均未检出TiLV。综合相关文献报道[1-8]及每年海关、水产技术推广站的监测结果,推测目前国内罗非鱼感染TiLV 的可能性极低。
3 讨论
Del-Pozo 等[11]研究发现,TiLV 具有正黏病毒超微结构特征,因此推测TiLV 可能是一种新的正粘病毒。TiLV 基因组共有10 个片段,最大的是基因片段1。此片段有一个开放阅读框,与丙型流感病毒PB1 亚基序列同源性较低[12]。但LAMP 设计引物比较难,设计双重引物更难,双重LAMP 的建立相比双重PCR 和双重qPCR 更难。本团队后续还会尝试建立检测TiLV 和病毒性神经坏死病病毒(VNNV)的双重RT-LAMP。
LAMP 是2000 年由日本研究人员Notomi[13]等发明的一种新型体外等温扩增特异核酸片段的技术。其特点是针对靶基因的6 个区域设计4种特异引物,在链置换DNA 聚合酶(Bst DNA polymerase)的作用下,60~65 ℃恒温扩增,15~60 min即可实现109~1010倍的核酸扩增。与普通PCR、荧光定量PCR 相比,LAMP 的优点突出:LAMP 不需要昂贵的精密仪器,恒温状态即可;LAMP 扩增效率高,能够获得大量扩增产物,具有高特异性;通过添加loop 引物,可以加快反应,缩短一半时间(常规LAMP 反应大约需要1.0 h,加入loop 引物后可缩短为0.5 h);扩增可产生大量的副产物焦磷酸镁白色沉淀,肉眼即可观察结果,也可借助于斑点杂交或横向流动试纸条等方法辅助结果检测。本研究建立的RT-LAMP 方法,采用Genie II等温扩增荧光检测系统,可以实时监控扩增反应,通过扩增曲线进行结果判定,克服了传统靠肉眼观察结果的盲目性。但LAMP 方法也有其缺点,就是更容易污染,因此在试验过程中要特别谨慎小心。
等温扩增荧光检测系统已在疫病检测中得到应用。史秀杰等[14]、何俊强等[15]在Genie II 实时荧光等温扩增检测系统的基础上,建立了检测ISA、IHNV 的LAMP 方法。安元龙等[16]运用Genie II 实时荧光等温扩增检测系统,建立了对VHSV 进行荧光实时反转录环介导等温扩增检测方法。侯东君等[17]选定了一套可在牛羊肉中特异并灵敏检测出掺杂肉成分的引物对,以动物细胞色素b 基因组为模板可在恒温63 ℃特异性扩增出猪等基因片段而无其他扩增片段影响。徐淑菲等[18-20]建立了检测牛、猪、羊、鸡、鸭等动物源性成分的LAMP 方法。等温扩增荧光检测系统,结合荧光检测技术,比传统LAMP 方法更为完善,克服了感官判定的不确定因素,使结果更加准确可信,且可以实时监控。
本研究建立的检测TiLV 的RT-LAMP 方法,检测灵敏度是2.5×10-7ng/μL,灵敏度较高。其原因在于LAMP 方法有6 条引物,而且FIP 由F2 区和F1C 区域组成、BIP 由B1C 和B2 区域组成,且碱基长度远远超过普通PCR 引物。但LAMP 试验极易受气溶胶等污染,因此操作过程要非常小心。本研究成功建立了检测TiLV 的RT-LAMP 方法,为快速诊断、监测TiLV 提供了技术支撑。

