黄芩素下调微小RNA-130a抑制肝癌细胞侵袭机制研究
刘振方,孙巧玉,孟祥彩,武 玉
(1.石家庄市中医院普外科,河北 石家庄050051;2.石家庄市藁城人民医院神经内科,河北 石家庄 052160;3.秦皇岛市第一医院普外科,河北 秦皇岛 066000)
肝细胞癌(Hepatocellular carcinoma,HCC)为常见的恶性肿瘤,约占原发性肝癌的90%,随着医疗水平的发展,HCC患者生存率有所提升,但其发病率逐年升高,且趋于年轻化[1-2]。因此,临床迫切需要寻求新的治疗方法。微小RNA-130a(Micro RNA-130a,miR-130a)属于转录本长度在22~25 nt范围内的非编码RNA(Non-coding RNA,ncRNA)[3]。研究显示,miR-130a在人胃癌组织中高表达,其可能通过诱导上皮间质转化促进胃癌细胞迁移和侵袭[4]。miR-130a在HCC组织和高转移性HCC细胞株中高表达,沉默HCC细胞LM3中miR-130a表达可降低细胞侵袭能力,提示miR-130a可促进肝癌细胞侵袭[5]。
近年来一些中药提取物被证实在抗肿瘤方面具有一定作用,如斑蝥素、槲皮素、羽扇豆醇等。黄芩素(Baicalein)是从中药黄芩提取的黄酮类化合物。研究显示,黄芩素可抑制人HCC细胞SMMC-7721增殖、迁移和侵袭[6-7]。研究显示,黄芩素联合5-氟尿嘧啶可明显抑制HCC耐药细胞增殖并促进其凋亡,进而逆转细胞对5-氟尿嘧啶的耐药[8]。但黄芩素能否抑制miR-130a诱导的HCC细胞侵袭目前尚不明确。本研究以HCC细胞HepG2为研究对象,慢病毒转染法外源性上调miR-130a,观察黄芩素在miR-130a诱导的细胞侵袭中的作用及机制,为临床治疗HCC提供理论基础。
1 材料与方法
1.1 实验材料
1.1.1 细胞系:人肝癌HepG2细胞,购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心。
1.1.2 实验试剂:RPMI 1640培养基(批号C11875500CP)、胎牛血清(FBS,批号2132094P)和磷酸盐缓冲液(PBS,批号AE29431651)。实时荧光定量PCR试剂盒(大连宝生物公司);总蛋白提取试剂盒、细胞裂解液(上海碧云天公司);miR-130a慢病毒载体和空白载体(山东维真生物公司);慢病毒包装试剂盒、转染脂质体lipofectamine 2000(上海吉玛公司);基质金属蛋白酶-9(Matrix metalloproteinase-9,MMP-9)抗体(批号G1220)和钙蛋白酶抑制蛋白(Calpastatin)抗体(批号L2330,美国圣克鲁斯公司);磷酸甘油醛脱氢酶(Gapdh)抗体(批号201001)、羊抗小鼠IgG-HRP(批号200209);PVDF膜(美国Millipore公司)。
1.1.3 实验仪器:台式高速冷冻离心机(型号Allegra 64R Centrifuge,美国Beckman Coulter公司);超净工作台(型号SW-CJ-2FD,苏州净化设备有限公司);倒置显微镜(型号CKX41,日本Olympus公司);电泳仪、转膜槽及转印夹(美国Bio-Rad公司);凝胶成像仪(型号AI600,美国GE公司)。
1.2 实验方法
1.2.1 细胞培养:采用含10% FBS及1%青链霉素的RPMI 1640培养基培养肝癌HepG2细胞,于37 ℃、5% CO2的培养箱中培养,生长至70%汇合度进行传代或冻存。
1.2.2 慢病毒转染法外源性上调HepG2细胞miR-130a表达:HepG2细胞在12孔板生长至50%汇合度时取出细胞,弃去旧培养基,更换为含10 μg/ml 聚凝胺的RPMI 1640全培养基,将携带绿色荧光标签的miR-130a过表达慢病毒液和空载慢病毒液分别稀释50倍,各吸取50 μl加入细胞,分别设为miR-130a组、空载对照组,不经任何处理的未转染细胞作为空白组,培养箱中继续培养6 h后,更换为RPMI 1640全培养基继续培养,细胞生长至90%汇合度以嘌呤霉素进行筛选,荧光显微镜观察拍照,以实时荧光定量PCR检测miR-130a表达。
1.2.3 实时荧光定量PCR检测细胞miR-130a表达:将细胞传代至10 cm培养皿中,以20 μmol/L的黄芩素处理24 h,收集细胞,Trizol法提取细胞总RNA,检测各组细胞总RNA浓度,取1 μg反转录为cDNA,并稀释至500 μl,充分混匀备用。将miR-130a引物按正向引物与反向引物1∶1稀释,利用实时荧光定量PCR试剂盒在ABI 7300型实时荧光定量PCR系统内扩增。反应条件:95 ℃、10 s,95 ℃、10 s,60 ℃、60 s,40个循环,每组设置3个重复孔,2-△△CT法计算miR-130a的相对表达量。
1.2.4 侵袭小室实验检测细胞侵袭能力:取出分装好的Matrigel胶,以RPMI 1640培养基稀释至250 μg/ml,吸取100 μl稀释好的Matrigel胶于小室中,将侵袭小室培养板放置到培养箱静置3 h。细胞培养至对数期,消化重悬调整细胞密度至1.5×106个/ml,吸取混合均匀的细胞悬液200 μl轻轻加入Transwell小室,以20 μmol/L黄芩素处理。在24孔板小室外的下室中加入800 μl含30% FBS的RPMI 1640培养基,放置于培养箱24 h。24 h后倒掉侵袭小室中的培养基并予PBS清洗2遍,甲醇固定20 min,0.5%结晶紫水溶液染色20 min,PBS清洗2遍,用棉签轻轻擦掉小室内房细胞,放置5~10 min风干。倒置显微镜下观察,取6个视野拍照并计数,计算细胞侵袭率。
1.2.5 蛋白印迹检测细胞MMP-9和Calpastatin蛋白表达:收集细胞,于冰盒内以RIPA细胞裂解液裂解细胞10 min,12000 r/min,离心20 min,将上清液转移至预冷的0.5 ml EP管中,用BCA蛋白定量试剂盒定量,制备含蛋白30 μg/10 μl的蛋白上样缓冲液,100 ℃变性5 min,以12% SDS-PAGE电泳分离蛋白后转膜,5%脱脂牛奶封闭4 h,用MMP-9(1∶1000)、Calpastatin(1∶1000)或Gapdh(1∶1000)于4 ℃摇床孵育过夜,次日孵育羊抗鼠IgG-HRP二抗,以ECL化学发光液显色,AI600凝胶成像仪下曝光显影,读取相应蛋白条带,以目的蛋白灰度值与相对应的内参蛋白灰度值比较得到相对蛋白表达量。
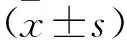
2 结 果
2.1 各组细胞miR-130a表达水平比较 见图1(表1)。荧光显微镜下,空载对照组和miR-130a组均发出强绿色荧光,提示慢病毒载体进入细胞内。RT-qPCR结果显示,空白组miR-130a表达水平与空载对照组比较,差异无统计学意义(P>0.05)。miR-130a组的miR-130a表达水平高于空载对照组,差异有统计学意义(P<0.01),提示外源性过表达miR-130a 的HepG2细胞构建成功。

图1 各组细胞miR-130a绿色荧光表达情况

表1 各组细胞miR-130a表达水平比较(%)
2.2 各组细胞侵袭能力比较 侵袭小室实验结果见图2。空白组、空载对照组及miR-130a组细胞侵袭率分别为100%、(103.9±7.1)%、(385.2±18.1)%,空白组与空载对照组细胞侵袭率比较,差异无统计学意义(P>0.05);miR-130a组细胞侵袭率高于空载对照组,差异有统计学意义(P<0.01)。

图2 各组细胞侵袭能力比较(结晶紫染色,×100)
2.3 各组细胞MMP-9、Calpastatin蛋白表达比较 蛋白印迹结果见图3。空白组、空载对照组及miR-130a组细胞MMP-9相对蛋白表达量分别为(18.6±3.0)%、(15.8±4.6)%、(121.3±8.8)%,Calpastatin相对蛋白表达量分别为(112.3±8.6)%、(116.5±9.2)%及(27.6±3.1)%。空白组与空载对照组MMP-9和Calpastatin表达比较,差异无统计学意义(均P>0.05)。miR-130a组细胞MMP-9表达高于空载对照组,miR-130a组细胞Calpastatin表达低于空载对照组,差异有统计学意义(均P<0.05)。

图3 各组细胞MMP-9、Calpastatin蛋白表达比较
2.4 黄芩素对miR-130、MMP-9和Calpastatin表达的影响 见表2(图4)。黄芩素加miR-130a组的miR-130a表达水平低于miR-130a组,差异有统计学意义(P<0.01)。黄芩素加miR-130a组细胞MMP-9表达量低于miR-130a组,黄芩素加miR-130a组细胞Calpastatin表达量高于miR-130a组,差异有统计学意义(均P<0.01)。

表2 各组细胞miR-130a、MMP-9、Calpastatin表达量比较(%)

A:空载对照组;B:miR-130a组;C:黄芩素加miR-130a组
2.5 各组miR-130a诱导细胞侵袭率比较 见图5。miR-130a组、黄芩素加miR-130a组细胞侵袭率分别为(335.6±26.2)%、(108.8±7.6)%;黄芩素加miR-130a组细胞侵袭率低于miR-130a组,差异有统计学意义(P<0.01)。

图5 各组miR-130a诱导细胞侵袭活动(结晶紫染色,×100)
3 讨 论
miR-130a作为miRNA的一种,在精子发生、改善血小板功能及肿瘤发生发展等方面发挥重要作用[9-11]。研究显示,miR-130a在胃癌[4]、肝癌[5]、鼻咽癌[12]及结直肠癌[13]等恶性肿瘤中高表达,且与肿瘤恶性生物学行为密切相关。有研究表明,miR-130a在HCC中发挥一定生物学作用,miR-130a可通过RUNX3和Wnt信号通路促进HCC细胞对顺铂耐药[14]。另有研究报道,miR-130a在HCC中表达上调,下调miR-130a可抑制HCC细胞的增殖活性,提示miR-130a在HCC中可能发挥促癌作用[15]。但是,Zheng等[16]发现miR-130a通过下调Rho-激酶2抑制肝癌细胞的增殖、迁移和侵袭能力。
细胞侵袭是肿瘤转移的必要过程之一[17]。本研究结果提示,miR-130a与HepG2细胞的恶性生物学行为有关。进一步实验发现,过表达miR-130a后HepG2细胞Calpastatin蛋白表达显著下调,MMP-9蛋白表达明显上调。Calpastatin是内源性钙蛋白酶(Calpain,CANP)抑制剂,通过与CANP形成复合体的方式抑制CANP活性[18]。提示miR-130a过表达后HepG2细胞胞内CANP活性增强。MMP-9是基质金属蛋白酶家族成员之一,研究显示沉默前列腺癌PC3细胞CANP2表达后,细胞MMP-9 表达下调,说明肿瘤细胞内存在CANP-MMP-9信号通路。且MMP-9能降解细胞外基质成分,破坏组织学屏障,促进肿瘤细胞的侵袭能力。既往有研究报道,黄芩素能抑制HCC细胞的恶性生物学行为[6-8]。因此我们观察黄芩素在miR-130a诱导的细胞侵袭中的作用,结果发现,黄芩素可抑制miR-130a诱导的细胞侵袭,分子层面研究发现黄芩素能抑制miR-130a诱导的Calpastatin表达下调以及MMP-9表达上调,通过抑制miR-130a激活的CANP-MMP-9通路降低HepG2细胞侵袭活动。黄芩素作为黄芩提取的黄酮类化合物在抗菌、抗炎、抗氧化及抗肿瘤方面均发挥一定作用[19]。
综上所述,黄芩素能抑制miR-130a诱导的肝癌HepG2细胞侵袭,该作用可能与抑制miR-130a诱导的CANP-MMP-9通路活化有关。本研究处于体外研究阶段,需进一步深入研究验证。

