4种Keggin型磷钼酸盐对蘑菇酪氨酸酶活性和黑色素生成的抑制及抗氧化作用
帅 蝶,赵美娟,陈丙年,王 力
(1.集美大学海洋食品与生物工程学院,厦门361021;2.厦门大学医院,厦门361005)
酪氨酸酶(EC 1.14.18.1)是一种同时具有单加氧酶和氧化酶活性的酶,这两种活性都是由氧与活性位点上的2个铜原子(通常称为CuA和CuB)结合而产生的.迄今,已经研究了大量的酪氨酸酶,其广泛存在于生物圈中,主要来源于植物[1,2].酪氨酸酶在黑色素生成中发挥重要作用,酪氨酸酶的下调是开发黑色素抑制剂的最主要途径[3~6].黑色素的过度积累不仅是导致水果和蔬菜褐变的原因,也是导致色素沉着紊乱的原因.酪氨酸酶抑制剂可以通过抑制酶活性来调节黑色素的过度生成,被认为是治疗色素沉着障碍的有效方法.因此,酪氨酸酶抑制剂的研究与开发在食品保鲜、化妆品和药物化学领域具有重要意义[6,7].目前,酪氨酸酶抑制剂的相关研究集中在天然物质的提取与有机物的合成,但是对于无机类抑制剂鲜有报道,而且缺乏系统的研究.
多金属氧酸盐(POMs)是由氧和早期过渡金属缩合形成的金属氧簇化合物[8],其过渡金属配体的数量和取代位置决定了其不断变化的结构和广泛的性能[9~12].这些分子由氧桥联的具有最高氧化态(如Mo,W,V)的早期过渡金属组成,它们是基于公共角度和公共边缘的单面多面体的组合.从广义上讲,多金属氧酸盐包括同多酸和杂多酸,与同多酸相比,杂多酸具有更稳定的结构和更好的多样性[13,14],因此也是研究的重点.杂多酸丰富的结构在化学领域引起了广泛关注,同时这种结构的多样性使其具有多种生物活性且毒副作用较低[15,16].研究表明,多金属氧酸盐在抑菌[17,18]、抑酶[19,20]、抗癌[21]及抗病毒[22~24]等药物化学领域显示出良好的应用价值.邢蕊等[25]研究了2种不同的钒取代Keggin型多金属氧酸盐[Na4PMo11VO40和(HGly)4PMo11VO40]对酪氨酸酶的抑制作用,发现二者均可抑制酪氨酸酶活性.
本文报道了4种过渡金属钒取代的Keggin型磷钼酸盐Na5PMo10V2O40(PMo10V2),Na6PMo9V3O40·(PMo9V3),Na7PMo8V4O40(PMo8V4)和Na8PMo7V5O40(PMo7V5)的合成与表征.以4种多酸作为抑制剂,研究了其对蘑菇酪氨酸酶活性的影响,并通过分子模拟分析无机化合物和酶蛋白之间的结合模式;考察了4种多酸对B16黑色素瘤细胞的细胞毒性和黑色素形成的抑制作用;以1,1-二苯基-2-三硝基苯肼(DPPH)和2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)自由基的清除率作为指标评价了4种多酸的抗氧化效果,旨在为开发新型酪氨酸酶抑制剂提供依据,扩大多金属氧酸盐在食品保鲜和药物化学领域的应用.
1 实验部分
1.1 试剂与仪器
RPMI 1640基本培养基购自美国HyClone公司;酪氨酸酶(EC 1.14.18.1)购自美国Sigma-Aldrich公司;1,1-二苯基-2-三硝基苯肼(DPPH)购自东京化成工业株式会社;一水合钼酸钠(Na2MoO4·H2O)、偏矾酸铵(NH4VO3)、磷酸(H3PO4)和十二水合磷酸氢二钠(Na2HPO4·12H2O)购自广东西陇化工股份有限公司;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)购自上海麦克林生化科技有限公司;胎牛血清(FBS)购自美国GEMINI公司;B16细胞购自中科院细胞库上海碧赛生物科技有限公司;所用试剂均为分析纯.
Lambda 265型紫外-可见分光光度计(UV-Vis,美国Perkin Elmer公司);Alpha型傅里叶变换红外光谱仪(FTIR,美国布鲁克公司);1374型生物安全柜(苏州赛默飞世尔公司);HERACELL Vois 160i型二氧化碳培养箱(美国Thermo Scientific公司);Synergy H1MF型多功能酶标仪(美国BioTek公司);TS100-F型倒置显微镜(日本Nikon公司).
1.2 实验过程
1.2.1 样品的制备参照文献[26,27]方法合成4种Keggin型磷钼酸盐(PMo10V2,PMo9V3,PMo8V4和PMo7V5).将Na2HPO4·12H2O,Na2MoO4·H2O和NH4VO3分别以摩尔比1∶10∶2,1∶9∶3,1∶8∶4和1∶7∶5溶解于400 mL超纯水中,用浓硫酸调节溶液pH值为2.5,于80℃加热回流6 h,缓慢冷却至室温,加入适量乙醚及硫酸萃取;收集下层的红色油状液体,挥发乙醚,并用超纯水重结晶2次后得到纯净的晶体化合物PMo10V2,PMo9V3,PMo8V4和PMo7V5.
1.2.2 酶测活体系参照文献[28,29]方法测定4种多酸的酪氨酸酶活性.将底物溶液[多巴(L-dopa)溶解于磷酸盐缓冲液(50 mmol/L,pH=6.8)],在30℃的恒温水浴锅中持续预热30 min;将酪氨酸酶溶解于pH=6.8,50 mmol/L磷酸盐缓冲液中.向96孔板中依次加入7 μL效应物(分别溶解于DMSO中的PMo10V2,PMo9V3,PMo8V4和PMo7V5)、196 μL底物及7 μL酪氨酸酶溶液,快速混合均匀,于30℃恒温反应10 min[30].使用酶标仪测定混合物在475 nm处的吸光度值.每组实验设定5组平行.
1.2.3 多酸对酪氨酸酶的抑制效果研究4种多酸对蘑菇酪氨酸酶的抑制效果基于上述酶活性测定.以0.5 mmol/LL-dopa为底物,每种效应物设定10~14个梯度浓度,酪氨酸酶溶液浓度为500 U/mL,测定相对剩余酶活性.以未添加效应物的实验组为空白对照组.依据绘制的相对剩余酶活性与效应物浓度间的函数关系曲线计算半抑制率(IC50,mmol/L)值,最终以IC50值表示效应物对蘑菇酪氨酸酶的抑制效果[31].
1.2.4 多酸对酪氨酸酶的抑制机理研究基于酶活性测定研究了4种多酸对蘑菇酪氨酸酶的抑制机理.底物L-dopa的浓度及添加量保持不变,酪氨酸酶浓度设置为100,200,300,400和500 U/mL,测定475 nm处的吸光度值.将酶促反应速率作为酶活性的函数绘图,根据得到的抑制曲线判断效应物对蘑菇酪氨酸酶的抑制机理.
众所周知,地名分类是地名学理论任务之一,也是当今地名规划、地名管理、地名档案管理和地名工具书编辑中的重要内容。现今地名分类有按地理实体性质分类,有按地名形态分类,有按地名时间分类,有按地名音、行、义分类,而陈文按专名的性质分类,是对地名分类的巨大贡献,并为地名专名科学分类奠定了基础。
1.2.5 多酸对酪氨酸酶的抑制类型研究基于酶活性测定研究了4种多酸对蘑菇酪氨酸酶的抑制类型.固定酪氨酸酶浓度为500 U/mL,改变L-dopa浓度,绘制Lineweaver-Burk类型图,判断4种多酸对蘑菇酪氨酸酶的抑制类型.
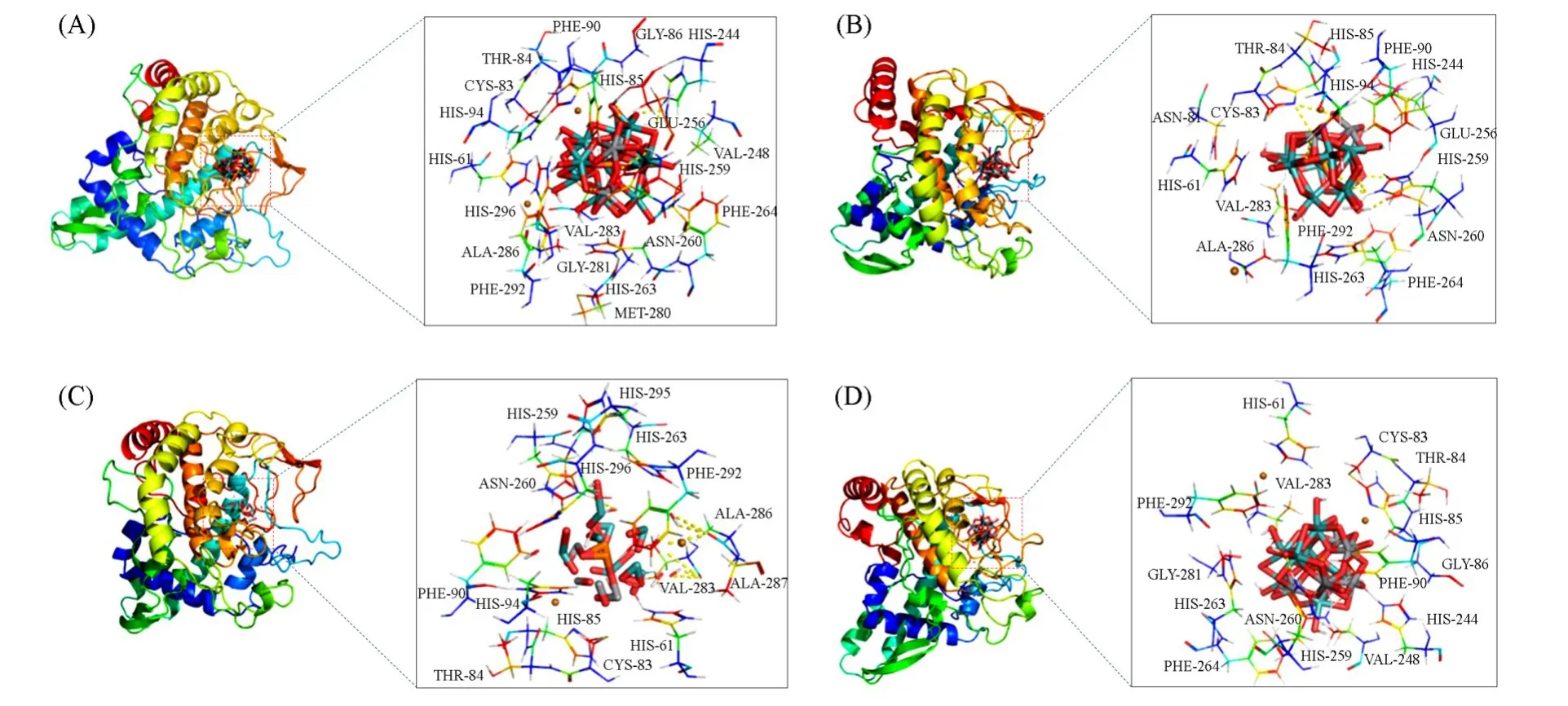
1.2.6 分子对接研究为了进一步研究效应物与蘑菇酪氨酸酶之间的结合作用,采用Molecular Operating Environment(MOE 2008.10)软件进行分子对接模拟,并使用三维分子模拟软件PyMOL 2.2.0进一步处理.酪氨酸酶是一种结构复杂的氧化还原酶,广泛存在于植物、动物、微生物及人体内.目前,来自双孢蘑菇的酪氨酸酶是酪氨酸酶的主要和廉价来源,与人类酪氨酸酶相比具有很高的相似性和同源性,作为筛选酪氨酸酶抑制剂和黑色素生成研究、酶催化反应和酶抑制剂的结构研究的模型系统被广泛应用.从UniProt蛋白质资源数据(http://www.uniprot.org/)下载酪氨酸酶的三维晶体结构,选用PDB编码为2Y9X的双孢蘑菇酪氨酸酶晶体结构作为建模模板[32].使用MOE软件模型构建工具生成4种多酸的三维结构.
构建效应物的三维结构与蘑菇酪氨酸酶在同一个MOE界面打开,选择Simulations-Dock程序将配体化合物和酶蛋白分子进行分子对接,使用London dG评分函数计算的结合自由能,最终计算得到多种评分函数(kJ/mol).评分函数分数越低表示结合得越稳定[33],通常选择所有评分函数中的第一个作为最佳对接结果[34].使用PyMOL软件进行图像分析,突出显示配体化合物与酶蛋白分子间的结合方式、作用氨基酸残基.
1.2.7 黑色素形成的抑制作用设置培养箱条件为温度37℃,CO2体积分数为5%,使用RPMI 1640完全培养基培养小鼠B16黑素瘤细胞.用显微镜观察,待细胞基本长满培养瓶底部,用PBS缓冲液清洗(沿培养瓶内壁加入);用胰酶消化(轻轻摇动培养瓶,使胰酶覆盖细胞表面约15 s);在显微镜下观察细胞脱落情况,完全培养基终止消化;用移液管抽吸培养瓶内液体,吹散细胞,制成单细胞悬液,于培养箱中继续培养48 h[35].
采用相同的方法增养B16细胞,用MTT法研究B16细胞的存活率.完成培养后进行细胞计数,调整密度至1×105cell/mL.以180 μL/孔加入到96孔板中,过夜.待贴壁后,加入20 μL浓度分别为12.5,25,50,100和200 μmol/L的多酸样品到各个孔中,培养72 h;然后用PBS缓冲液洗涤2次,各孔加入10 μL 0.5 mg/mL的MTT和90 μL完全培养基;培养4 h后,加入200 μL二甲基亚砜,于37℃振荡10 min(使结晶完全溶解),立即用酶标仪测定570 nm处的吸光度值.每一个浓度设置3个复孔[35~38].细胞存活率(Cell viability,%)按下式计算:

式中:A为吸光度.
采用与处理B16细胞相同的方法制备单细胞悬液细胞.将细胞悬液以3 mL/孔接种到6孔板中,培养24 h,弃去培养基.每孔加入0.3 mL不同浓度多酸和2.7 mL完全培养基,再培养72 h;弃去培养基,按传代的方法处理B16细胞.用PBS缓冲液清洗2次,以12000 r/min转速离心10 min,用1.0 mL 1.0 mol/L NaOH(含体积比为10%的DMSO)溶解细胞沉淀,于80℃孵育2 h.待细胞沉淀溶解充分后,测定405 nm处的吸光度值[37].
1.2.8 抗氧化能力测定参照文献[39,40]方法测定多酸的DPPH自由基清除能力.在试管中加入2 mL 0.1 mmol/L DPPH乙醇溶液及等体积的多酸;将试管置于37℃水浴锅中,避光反应30 min;用酶标仪测定波长517 nm处的吸光度值.每组重复进行3次.DPPH自由基清除能力(DPPH radical scavenging ability,%)按下式计算:

参照文献[39,41]方法测定多酸的ABTS自由基清除能力.首先以等体积比配制2.45 mmol/L过硫酸钾和7 mmol/L ABTS溶液,静置12 h后加入无水乙醇,使734 nm处吸光度值为0.68~0.72,制成ABTS稀释液.吸取1 mL ABTS稀释液和0.1 mL不同浓度的多酸加入试管中,室温下反应6 min,测定734 nm处的吸光度值.每组重复进行3次.ABTS自由基清除能力(ABTS radical scavenging ability,%)按下式计算:

2 结果与讨论
2.1 化合物的表征
图1 示出多酸PMo10V2,PMo9V3,PMo8V4和PMo7V5在1200~700 cm−1范围内的红外光谱.可见,4个化合物均有4个特征峰,分别对应Keggin型杂多酸的红外特征振动峰,即810~760 cm−1处Mo—Oc—Mo的特征峰、870 cm−1处Mo—Ob—Mo的特征峰、990~960 cm−1处Mo—Od的特征峰及1100~1060 cm−1处P—Oa键反对称伸缩振动峰[42].以上结果表明,已成功制备了具有Keggin结构的杂多酸.图2为多酸PMo10V2,PMo9V3,PMo8V4和PMo7V5的紫外-可见光谱.每种化合物的紫外数据对应Od—Mo和Ob/Oc—Mo的荷移跃迁[43],与文献报道一致,证实所合成的多酸均为Keggin结构,与红外光谱分析结果一致.

Fig.1 IR spectra of PMo10V2(a),PMo9V3(b),PMo8V4(c)and PMo7V5(d)between 1200—700 cm-1

Fig.2 UV⁃Vis spectra of PMo10V2(a),PMo9V3(b),PMo8V4(c)and PMo7V5(d)
图3 给出了4种多酸的粉末XRD谱图,可见4种多酸的谱图极其相似,在7°~10°,16°~22°和25°~30°范围内存在Keggin结构杂多酸的特征衍射峰.

Fig.3 XRD patterns of PMo11V1(a),PMo10V2(b),PMo9V3(c)(A),PMo8V4(a)and PMo7V5(b)(B)
2.2 多酸对酪氨酸酶的抑制效果
图4 示出4种多酸对酪氨酸酶的抑制效果.4种效应物对酪氨酸酶活性的抑制呈现出浓度依赖性关系,导致酪氨酸酶活力下降50%时,PMo10V2,PMo9V3,PMo8V4和PMo7V5的浓度(IC50)分 别 为(7.046±0.506),(12.128±0.574),(12.362±0.802)和(9.860±1.490)mmol/L(表1),可见PMo10V2对酪氨酸酶的抑制效果最好,但其抑制效果低于PMo11V[IC50=(0.522±0.003)mmol/L][44].

Fig.4 Inhibitory effects of PMo10V2(a),PMo9V3(b),PMo8V4(c)and PMo7V5(d)on the tyrosinase,respectively

Table 1 Enzyme kinetic results of Keggin-type vanadium-substituted phosphomolybdate on tyrosinase
金属离子、电荷数及电荷分布等都会导致多酸的活性不同程度的改变,随着过渡金属钒取代个数的增加,阴离子的电荷数逐渐增加,其氧化性逐渐降低,与酪氨酸酶间的作用趋向减弱.当钒取代个数偏大时,多酸的酸度发生明显改变,进而影响自身结构[45].由此可以判断,酸度和氧化性与多酸的活性密切相关.
2.3 多酸对酪氨酸酶的抑制机理
图5 示出4种多酸对酪氨酸酶的抑制机理.可见,4种多酸的抑制作用曲线非常相似,均相交于原点.4种多酸对酪氨酸酶的抑制作用是可逆抑制,效应物与酪氨酸酶之间以非共价键相接,复合物稳定性差,容易受到外界环境的干扰.

Fig.5 Inhibitory mechanism of PMo10V2(A),PMo9V3(B),PMo8V4(C)and PMo7V5(D)on the tyrosinase
2.4 多酸对酪氨酸酶的抑制类型
图6 示出了4种多酸对酪氨酸酶的抑制类型以及抑制常数.PMo10V2[图6(A)]和PMo8V4[图6(C)]的抑制曲线交点位于第二象限,PMo9V3[图6(B)]与PMo7V5[图6(D)]的抑制曲线交点位于第三象限,4种多酸对酪氨酸酶均为混合型抑制,这表明效应物通过与游离酶或酶-底物复合物结合.
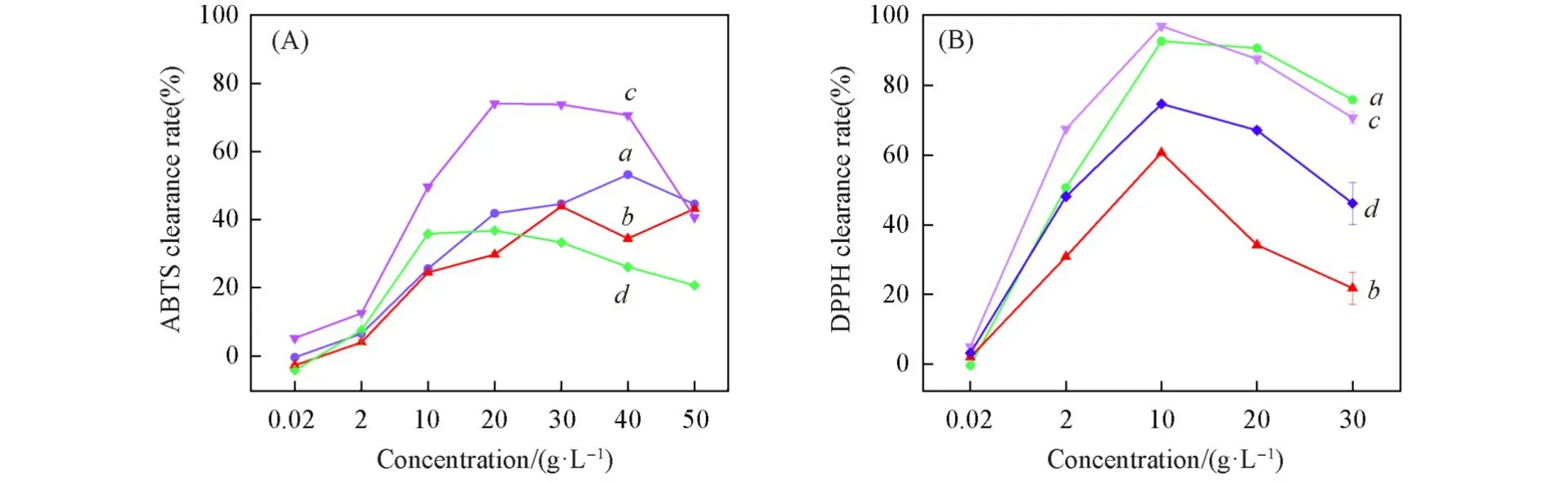
以Lineweaver-Burk图中4条抑制曲线的斜率/截距为Y值,效应物浓度为X值,二次作图得到了抑制常数.4种多酸抑制效果、抑制机理、抑制类型以及抑制常数列于表1.由表1可以看到,PMo10V2和PMo8V4的抑制常数关系为KIS>KI;PMo9V3和PMo7V5的抑制常数关系为KIS Fig.6 Inhibitory type and constants of PMo10V2(A),PMo9V3(B),PMo8V4(C)and PMo7V5(D)on the tyrosinase Fig.7 Binding mode of the Keggin series compounds and active site of tyrosinase Table 2 Molecular docking of compounds 图7 和表2给出4种多酸与酪氨酸酶的分子对接结果.由图7可知,4种效应物与酪氨酸酶之间的结合作用主要与氢键和范德华力相关,差异在于参与作用的氨基酸种类、数量不同.对接过程中,配体小分子和蛋白大分子进行Energy Minimize处理,降低两者结合的空间位阻.对接时,配体分子通过不断变换空间结构,逐渐嵌入活性位点,与蛋白分子形成多种构象,根据不同构象的评分函数确定最佳构象.评分函数结果越低,配体小分子与蛋白分子间的结合作用稳定性越高,对接更加成功.以对接效果最好的PMo10V2为例,其与酪氨酸酶的对接函数为−18.627 kJ/mol,图7(A)分别以二维结构和三维结构显示了PMo10V2与酪氨酸酶活性中心的结合位点及结合作用力.PMo10V2与酪氨酸酶活性中心的His85,His244,Glu256,His259及Asn260氨基酸以氢键相互结合,与活性中心周围的His61,Cys83,Thr84,Gly86,Phe90,His94,Val248,His263,Phe264,Met280,Gly281,Val283,Ala286,Phe292和His296氨基酸形成范德华力.极性氨基酸Thr,Cys,Asn和Gly可通过改变蛋白分子的极性影响氢键作用,带正电的His和带负电的Glu通过与配体分子内的杂多阴离子/过渡金属钒离子的静电效应影响效应物与酶之间的范德华力,疏水氨基酸Ala,Val,Phe和Met的疏水作用对PMo10V2与酪氨酸酶的结合作用也具有一定影响.表2列出了另外3种多酸的分子对接结果,进一步证实效应物与酪氨酸酶之间的结合作用主要与氢键和范德华力相关,差异在于参与作用的氨基酸种类、数量的不同. 4种多酸对黑色素形成的抑制作用研究选用B16细胞,模拟皮肤黑色素生成模型.对细胞模型进行了噻唑蓝(MTT)毒性检测(图8).在200 μmol/L的浓度范围内,处理72 h后,4种多酸对细胞均无毒害作用,并且在高浓度时促进细胞的增长.检测了4种多酸在B16细胞中对黑色素生成量的影响.由图8可见,随着多酸浓度的升高,黑色素生成量发生变化.在PMo10V2浓度达到50 μmol/L时,与未加药的对照组相比,黑色素的生成受到明显抑制,出现了极显著的差异(P<0.01),当PMo10V2浓度达到200 μmol/L时,对黑色素的抑制达到75%.在PMo9V3浓度达到50 μmol/L时,与未加药的对照组相比,黑色素的生成受到了明显抑制,出现了显著的差异(P<0.05).在PMo8V4浓度达到200 μmol/L时,与未加药的对照组相比,黑色素的生成受到了明显抑制,出现了极显著的差异(P<0.01).同样PMo7V5对黑色素生成的影响也随着药物浓度的升高受到了极显著的抑制.因此,4种多酸均能抑制黑色素的生成. Fig.8 Effects of PMo10V2,PMo9V3,PMo8V4,PMo7V5 on the cell viability(A)and melanin production(B)in B16 cell 2.7.1 ABTS自由基的清除能力ABTS被氧化后会得到蓝绿色ABTS+,其稳定存在于溶液中.抗氧化活性成分能将ABTS+清除,使溶液的颜色变浅.研究发现,吸光度值越低,会导致溶液颜色越浅,证明多金属氧酸盐化合物的抗氧化能力越强[46].4种多酸均对ABTS自由基显示出良好的清除效果,结果如图9所示.随着钒取代个数不同的多酸浓度的上升,ABTS自由基的清除率显现出先增后减的趋势.PMo8V4具有最优的ABTS自由基清除效果,能清除74.13%的自由基. 2.7.2 DPPH自由基的清除能力4种多酸能捕捉到DPPH自由基单电子,可明显观察到溶液颜色变浅,同时引起吸收值变化,故可根据吸收值的变化判断抗氧化效果好坏[47].随着钒取代个数不同的多酸浓度的上升,DPPH自由基的清除率呈现先增后减的趋势.其中,PMo8V4具有最优的清除效果,能清除96.85%的自由基. Fig.9 Effects of PMo10V2(a),PMo9V3(b),PMo8V4(c)and PMo7V5(d)on the clearance of ABTS(A)and DPPH(B) ABTS和DPPH自由基清除实验均表明PMo8V4具有最优的清除效果.但当溶液质量浓度过大时,PMo10V2,PMo9V3,PMo8V4和PMo7V5的自由基清除能力均有所下降,这主要是因为随着溶液质量浓度过大,底物浓度太大造成反应体系的黏度过高,导致了多金属氧酸盐与底物的结合受到严重影响,对反应体系中各种分子的扩散运动十分不利,故降低了整体反应的效率,进而使多酸的自由基清除能力下降. 利用水热法合成了具有Keggin型过渡金属钒取代的磷钼酸盐PMo10V2,PMo9V3,PMo8V4和PMo7V5.4种多酸对蘑菇酪氨酸酶均有抑制效果,是酪氨酸酶的可逆混合型抑制剂,PMo10V2,PMo7V5,PMo9V3和PMo8V4的抑制效果(IC50)依次为(7.046±0.506),(9.860±1.490),(12.128±0.574),(12.362±0.802)mmol/L.分子对接结果显示,氢键和范德华力是多酸与酪氨酸酶结合的主要作用力,并且证明两者之间不是以共价键结合,进一步说明这4种多酸对酪氨酸酶的抑制作用是可逆的.自由基清除实验表明,合成的多酸对DPPH具有明显的抗氧化活性.此外,4种多酸未对小鼠B16细胞显示出细胞毒性,并且显著抑制了黑色素的生成.本文结果揭示了多金属氧酸盐在分子水平上抑制酪氨酸酶的结构-功能关系,并证明其在医药、化妆品和食品工业中可能作为高效低毒的抗褐变剂.
2.5 多酸与酪氨酸酶的分子对接研究

2.6 多酸对黑色素形成的抑制作用

2.7 多酸的抗氧化活性
3 结 论

