原发性胆汁性胆管炎治疗
陈怡然,郑坤玉,李春蕾,贺成美,杨云娇, 王立,张奉春
原发性胆汁性胆管炎(primary biliary cholangitis,PBC) 原名原发性胆汁性肝硬化。随着诊断水平的提高、熊去氧胆酸(ursodeoxycholic acid,UDCA)的应用,早期确诊且对UDCA应答良好的患者仅有生化指标升高,不会进展至肝硬化,因此2015年该病正式更名为原发性胆汁性胆管炎[1]。我国健康人群中PBC的患病率为49.2/10万[2],男女比例约为1∶9,主要临床表现为瘙痒、乏力、黄疸、骨质疏松。实验室检查ALP水平升高肝内胆汁淤积,抗线粒体抗体(anti-mitochondrial antibody,AMA)阳性,即可早期诊断PBC[3]。AMA阴性的患者需检测抗Gp210抗体、抗Sp100抗体,必要时行肝穿刺组织病理学检查。
指南推荐UDCA为治疗PBC的一线药物,对UDCA应答良好的患者远期生存率与正常人大致相同。部分患者应答不良,常合并肝硬化并发症,远期预后较差。目前UDCA的应答标准尚无定论(表1)[4],建议UDCA治疗6~12个月后评估生化反应,预测组织学进展,及时调整治疗方案。对于应答标准提示预后较差的患者,应尽早采用新方案补救,联合不同机制调节胆汁酸代谢的药物及免疫治疗。免疫治疗针对PBC发病机制中的关键靶点,减少免疫介导的胆管损伤,是未来治疗的希望,然而目前转化研究结果较少,临床疗效有待验证。现对PBC治疗进展进行综述。
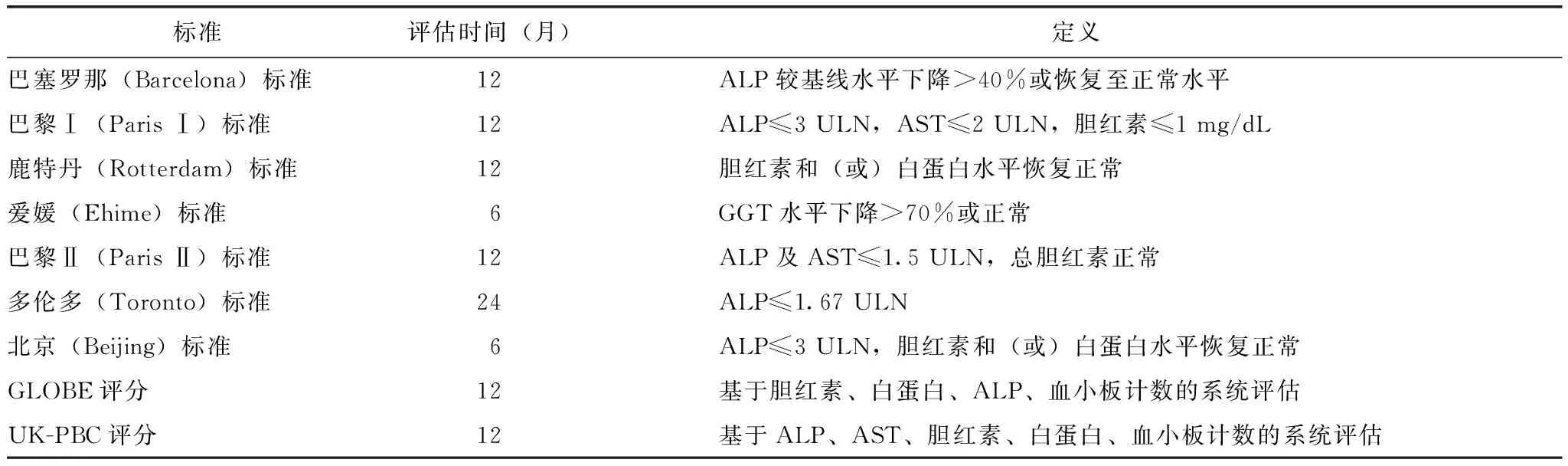
表1 UDCA应答标准定义Table 1 Definition of response to UDCA
1 调节胆汁酸代谢药物
1.1 一线治疗
UDCA是治疗PBC的首选药物,1997年由美国FDA批准用于PBC治疗,每日常规剂量13~15 mg/kg。UDCA稀释疏水性胆汁酸促进其排泄,抑制肠道外源性胆汁酸的吸收,抑制肝细胞凋亡起抗炎作用,促进碳酸氢根分泌,保护胆管上皮细胞,改善肝功能,延缓肝脏移植,降低死亡率[5]。UDCA是PBC治疗的基石,美国肝病研究学会(AASLD)建议开展新药试验时,选取UDCA标准治疗6~12个月后应答不良的患者,且临床试验期间不停用UDCA[6]。一项纳入3 902例患者的多中心队列研究显示UDCA应答不良的患者继续应用UDCA,仍能提高无肝脏移植生存率。40%的患者对UDCA应答不良[7],需严密监测UDCA治疗反应,及早评估生化指标,以改善临床预后。总体来说,UDCA安全且耐受性良好,妊娠期用药虽然未被FDA批准,但是有研究显示妊娠期服用UDCA产妇与新生儿均未出现并发症[8]。
1.2 二线治疗
1.2.1 奥贝胆酸
奥贝胆酸(obeticholic acid, OCA)2017年被FDA批准用于PBC的二线治疗。是核受体法尼醇X受体(farnesoid receptor,FXR)的强效激动剂。OCA在回肠中激活FXR,促进成纤维细胞生长因子19(fibroblast growth factors 19,FGF19)的表达,FGF19转运至肝脏与受体结合,抑制胆固醇-7α-羟化酶(cholesterol 7A1-hydroxylase,CYP7A1),抑制胆汁酸合成。OCA还可抑制胆汁酸的转运,促进其排泄,抗炎,抗纤维化,从而延缓肝硬化的进程。Kowdley等[9]报道了OCA单药治疗PBC3个月后ALP值明显降低,生化应答率远高于安慰剂组,改善了临床预后;然而OCA组严重瘙痒发生率高,瘙痒症状呈现剂量依赖性。一项纳入217例PBC患者的Ⅲ期临床试验显示,OCA常见不良反应包括瘙痒(77%)和乏力(33%),无严重不良反应[10]。尽管OCA显著改善多项生化指标,部分患者仍因不能耐受瘙痒而停药。
1.2.2 贝特类
贝特类药物靶向激动过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR,包括PPARα、PPARγ、PPARδ),可降低血脂,近年来多项研究表明其治疗难治型PBC疗效显著。PPARα激动剂抑制CYP7A1减少胆汁酸的合成,上调多药耐药蛋白3,增加胆汁酸的排泄,干扰NF-κB通路抑制炎症,减轻肝内胆汁淤积[11]。苯扎贝特对PPAR 3种亚型亲和力相似,同时激动孕烷X受体(pregnane X receptor,PXR)。一项为期24个月随机双盲安慰剂对照Ⅲ期临床试验结果表明,苯扎贝特联合UDCA治疗应答欠佳的PBC患者生化完全应答率为31%,67%患者的ALP值在24个月即可降至正常[12]。ALP恢复正常的患者瘙痒评分和肝硬化程度均较低[13]。非诺贝特是PPARα激动剂,适用于合并高脂血症的PBC患者。非诺贝特治疗UDCA应答不良的PBC患者显著降低ALP、GGT等多项生化指标,但不能改善GLOBE评分(GLOBE scoring systems)和UK-PBC风险评分(UK-PBC scoring systems,UK-PBC)[14],远期生存率仍需更多临床试验评估。一项小样本回顾性队列研究提出对于二线药物反应欠佳的PBC患者尝试应用UDCA、OCA、贝特类(苯扎贝特或非诺贝特)三联药物治疗可进一步改善生化,使部分患者的ALP水平降至正常。因此一项UDCA、OCA、贝特类三联药物治疗难治型PBC的随机对照研究正在进行中。
1.3 其他治疗
针对胆汁酸合成、转运、重吸收靶点的新药处于临床开发阶段。一项Ⅱ期临床试验显示FGF19激动剂NGM282连续皮下注射28 d后UDCA应答不良的PBC患者血清ALP水平明显下降长期疗效仍待验证[15]。PPARδ强效激动剂Seladelpar明显改善GLOBE评分,提高非肝移植生存率,有望成为治疗难治型PBC的突破口[16]。PPARα/PARδ激动剂Elafibranor减轻肝脏炎症和脂肪变性,改善肝脏纤维化,在12周内显著降低UDCA应答不良的PBC患者血清ALP水平, 80 mg组血清ALP水平下降了48.3%,PBC-40瘙痒评分较安慰剂组降低25%,且不良反应与安慰组无统计学差异[17]。PPARα/PPARγ激动剂saroglitazar现已启动Ⅱ临床试验。FXR激动剂EDP-305、Cilofexor、Tropifexor均在Ⅱ期临床试验中。
2 免疫治疗
2.1 糖皮质激素和免疫抑制剂治疗
糖皮质激素和免疫抑制剂适用于自身免疫性肝炎,但治疗PBC的效果存在争议。布地奈德联合UDCA治疗UDCA应答不良的PBC患者,虽然能够降低ALP等疾病活动相关的生化指标,但未能改善肝脏组织学[18],肝脏组织学的改变仍需大型临床数据的验证。UDCA、布地奈德、吗替麦考酚酯三种药物联合治疗可使41% PBC患者生化指标降至正常[19],UDCA、糖皮质激素、免疫抑制剂联合用药是未来治疗的希望。
2.2 靶向B细胞治疗
AMA介导的体液免疫是PBC发病的关键,应用抗CD20单克隆抗体耗竭B细胞提供了一种治疗思路。两项小规模研究结果显示利妥昔单克隆抗体(rituximab)治疗UDCA应答不良的PBC患者免疫球蛋白和AMA均降低,ALP值下降显著,但生化缓解不明显[20]。
2.3 靶向T细胞治疗
CD4+和CD8+T淋巴细胞介导了PBC患者胆管损伤和门脉周围炎症。Abatacept是重组人源化细胞毒性T淋巴细胞相关蛋白4 (cytotoxic T lympho-cyte antigen-4,CTLA4)的单克隆抗体,与抗原递呈细胞上的CD80和CD86结合,抑制T细胞的激活。Bowlus等[21]用abatacept治疗对UDCA应答不良的PBC患者,可降低非成熟的CD4+T细胞数量,但不降低CD8+T细胞数量,无法改善临床结果。
2.4 靶向细胞因子治疗
IL-12-JAK-STAT4是调节PBC患者免疫应答的重要通路。乌司奴单克隆抗体(ustekinumab)是IL-12/IL-23的拮抗剂,ustekinumab治疗对UDCA应答不良的PBC患者28周后ALP值略有降低,但未达到主要研究终点(ALP较基线下降>40%)[22]。巴瑞替尼(baricitinib)是JAK1和JAK2的抑制剂,目前在Ⅱ期临床试验中。B淋巴细胞活化因子(B cell activating factor,BAFF)调节B细胞成熟与存活,参与了CD4+CD25+Foxp3+T调节细胞(Treg)的凋亡,打破了PBC患者的免疫耐受,与IgG-AMA滴度呈正相关,靶向抑制BAFF的单克隆抗体治疗PBC疗效还有待论证。
2.5 靶向趋化因子治疗
多种趋化因子参与了胆管炎症损伤,趋化因子CXCL9/CXCL10-CXCR3在PBC发病中起到重要作用,CXCL10由巨噬细胞在干扰素-γ刺激下分泌,促进T细胞的迁移和分化,Ⅱa期临床试验表明NI-0801(抗CXCL10单克隆抗体)没有改善肝功能,反而使得ALP略有升高,原因可能是外源性中和抗体量不足,反而刺激CD8+T细胞与NK细胞CXCR3的表达增加[23]。E6011是抗CX3CL1的单克隆抗体,其安全性及可行性亟需Ⅱ期临床研究验证。
3 对症治疗
瘙痒是PBC最突出的症状,虽然与疾病的严重程度无关,但是让患者极为困扰。目前瘙痒的发生机制尚不清楚,治疗手段有限,主要的药物是消胆胺和利福平。消胆胺抑制胆汁酸在肠道的重吸收,但也干扰某些药物的吸收,如UDCA、吗替麦考酚酯等。消胆胺不耐受的患者,可将PXR激动剂利福平作为二线治疗。贝特类药物是针对性治疗PBC患者瘙痒症状的潜在药物,一项多中心RCT研究报道苯扎贝特每日400 mg连续应用3周可以显著缓解瘙痒症状[24]。对上述药物反应差或不能耐受的瘙痒患者建议使用阿片类受体拮抗剂。紫外线光疗、血浆置换等新型治疗手段安全性和经济效益尚待评估。
乏力是PBC患者的常见症状,可伴有睡眠障碍影响生活质量。乏力可能与AMA影响肌肉能量代谢相关,有研究提出应用抗CD20单克隆抗体耗竭B细胞,降低血清AMA水平,改善乏力症状。然而利妥昔单克隆抗体治疗PBC患者乏力的Ⅱ期临床试验结果无统计学差异[25]。
骨质疏松常见于绝经后女性,PBC患者发病年龄在50岁左右,加之胆汁淤积,脂溶性维生素D吸收障碍,继发甲状旁腺功能亢进,破骨细胞活化,发展到肝硬化期血清胰岛素样生长因子-1水平降低,成骨减少,更易发生骨质疏松[26]。治疗同绝经后骨质疏松,主要以补充钙剂和维生素D为基础、联合双膦酸盐、激素替代治疗。
4 间充质干细胞治疗
间充质干细胞(mesenchymal stem cell, MSCs)诱导免疫耐受,调节免疫紊乱,且免疫原性低,移植后不易产生免疫排斥反应,在PBC领域的应用前景值得期待。Wang等[27]率先应用异基因骨髓MSCs移植治疗难治型PBC患者,研究结果显示外周血CD8+T细胞比例减少,Treg细胞数量上调,延缓了肝硬化的进展。脐带MSCs治疗UDCA应答不良的PBC患者同样安全且耐受性良好,疲劳和瘙痒症状均得到缓解[28]。目前MSCs最佳移植时机、剂量、频率以及局部诱导分化的微环境仍需进一步探索,多项临床试验正在推进。
综上所述,PBC的发病与多种免疫细胞、细胞因子、趋化因子导致的自身免疫性胆管上皮损伤相关,靶向治疗PBC的生物制剂将成为新的研究方向(表2)。未来有望根据疾病的不同阶段、不同症状、不同免疫学特征进行个性化治疗,优化并发症的治疗策略,延缓肝硬化,改善预后。新药物的疗效和安全性尚待大规模临床研究证实,间充质干细胞移植亦需进一步探索。
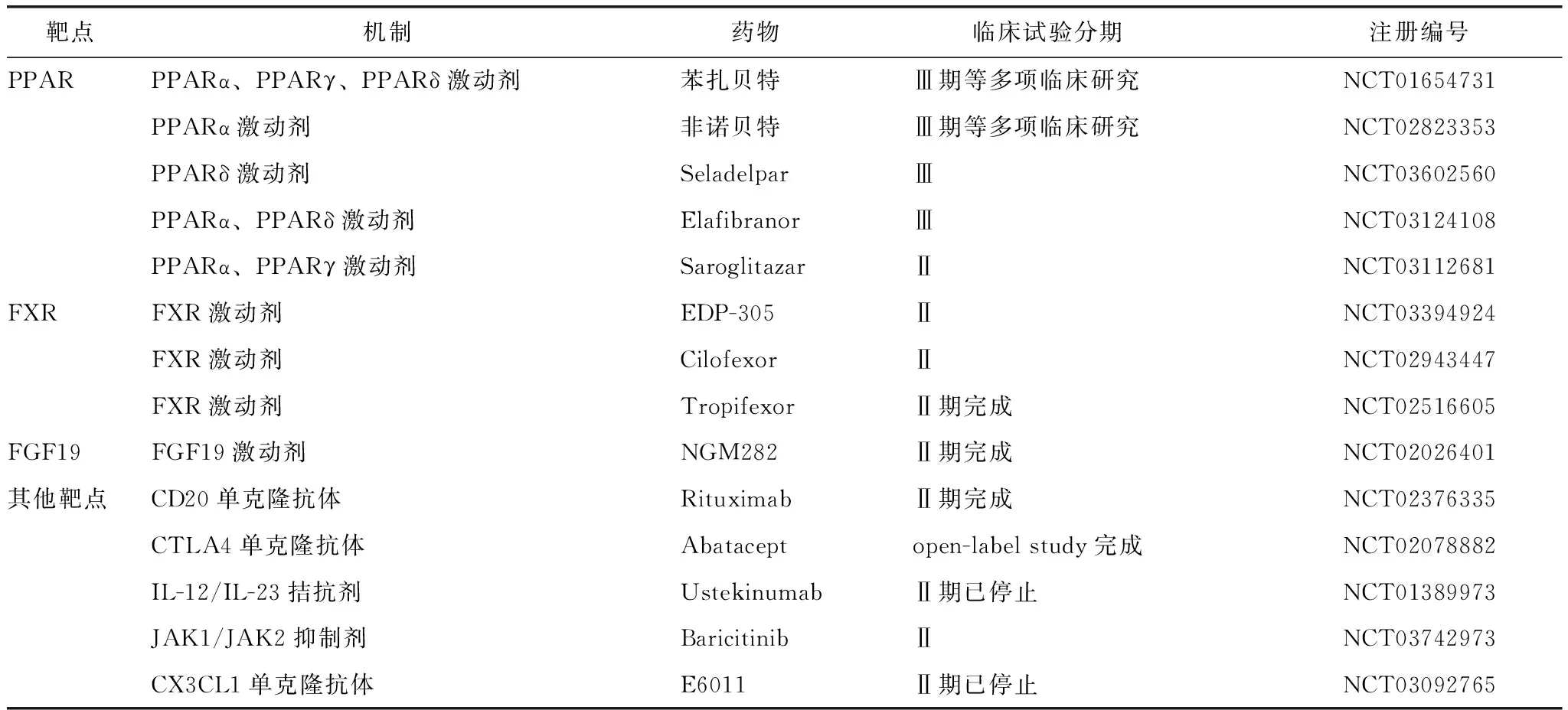
表2 PBC靶向治疗新药及其临床试验Table 2 New therapeutic drugs and clinical trails

