酸枣仁皂苷A 促进阿尔茨海默病神经干细胞模型增殖和分化作用的研究
陈吉聪,邓 艳,肖洪贺,李婉嫕,李 妍,杨静娴
(辽宁中医药大学 药学院,辽宁 大连 116600)
阿尔茨海默病(Alzheimer’s disease,AD)是中老年人常见的中枢神经系统退行性疾病,以进行性记忆力减退和认知功能障碍为主要表现[1],其典型的病理特征为大脑皮层和海马区出现老年斑、神经纤维缠结以及神经元丢失。由于缺乏有效的治疗药物,AD 已成为严重威胁人类晚年健康的主要疾病之一[2]。目前国内外现有药物虽能部分缓解AD 症状,但都无法修复脑内大量丢失的神经元,且存在一定的不良反应[3]。因此,寻找并建立能促进脑内神经再生、补充替代缺失神经元的新方法对治疗AD 具有重要意义。
神经干细胞(Neural stem cells,NSCs)是存在于神经系统中具有自我更新和多向分化潜能的一类细胞,在特定条件下能分化成神经系统的各类细胞,再生替代缺损的神经组织,重建神经功能。NSCs 的增殖、分化与迁移等行为高度依赖其生长的微环境,即神经干细胞巢。AD 脑内的病理损伤改变了神经干细胞巢,妨碍了NSCs 生物学功能的发挥,使基于原位激活内源性NSCs 的神经发生和基于外源性NSCs移植的治疗策略,都无法实现有效神经再生[4]。
酸枣仁皂苷A(JuA)是中药酸枣仁的主要活性成分,现代药理学研究表明,JuA 除具有镇静催眠、抗焦虑、抗抑郁等作用外[5],还能够抑制小胶质细胞活化引起的炎症反应,增强AD 模型小鼠学习记忆能力[6-7]。虽然JuA 的抗AD 作用逐渐受到关注,但尚无其促进神经再生的有关报道。因此,本研究通过构建APP-NSCs 细胞模型,进一步探究JuA 对APPNSCs 增殖与分化的影响,为其用于治疗AD 提供实验基础。
1 材料与方法
1.1 材料
1.1.1 试剂 酸枣仁皂苷A(批号:wkq19090304,四川省维克奇生物科技有限公司);胎牛血清(批号:19110505,浙江天杭生物科技股份有限公司);青-链双抗(批号:J190007,美国Hyclone 公司);B27(批号:175040010,美国Gibco 公司);质粒提试剂盒(美国Omega 公司);EGF、bFGF8 均购于美国PeproTech 公司;Nestin、SOX2、GFAP、NF-M、NG2 一抗均购于北京博奥森生物技术有限公司;兔抗小鼠CyTM 3 标记二抗、驴抗小鼠FITC 标记二抗均购于美国Jackson 公司;CCK8、LDH试剂盒均购于沈阳万类生物科技有限公司。
1.1.2 仪器 Ti-S 型倒置荧光显微镜(日本尼康株式会社);C00I01HW 型CO2培养箱(北京东联哈尔仪器制造有限公司);MR-96A 型酶标仪(深圳迈瑞生物医疗电子股份有限公司);MG96G 型PCR 仪(杭州朗基科学仪器有限公司);SH-510 型凝胶成像系统(杭州申花科技有限公司)。
1.1.3 实验动物 SPF 级C57BL/6 健康小鼠购于辽宁长生生物有限公司,合格证号:SCXK(辽):2013-0001。研究中所有实验动物相关操作都经过辽宁中医药大学动物伦理审查委员会批准并严格按照国际实验室伦理行为准则实施。
1.2 实验方法
1.2.1 NSCs 的分离培养与鉴定 从乳鼠海马组织中分离NSCs,以5×106个/mL 的密度置于加入增殖培养基(含20 ng/mL EGF、20 ng/mL bFGF、2%B27、1% P/S 的DMEM-F12)的24 孔板中培养。3 d半量换液,10 d 左右开始传代。免疫荧光化学法检测NSCs 标志性蛋白Nestin 和Sox2 表达。
1.2.2 APP-NSCs 模型的构建 APP-NSCs 模型按本实验室前期已报道的方法建立[8],取GFP 或GFPAPP 质粒15 μg、pLP1 质粒6.5 μg、pLP2 质粒2.5 μg、pLP/VSV-G 质粒3.5 μg,采用脂质体2000 介导转染293T 细胞,空白对照组转染GFP 质粒。培养24 h 后,荧光显微镜下观察,呈绿色荧光,收集病毒液并转染NSCs。72 h 后采用RT-PCR 法和Western blot 检测APP mRNA 以及蛋白的表达。
1.2.3 JuA 最佳药物浓度的筛选 取P3 代APPNSCs 以5×104个/孔的密度铺96 孔板,分别添加6.25、12.5、25、50、100 μmol/L JuA 培养,以正常培养的APP-NSCs 为对照,48 h 后每孔加入10 μL CCK8 试剂,37 ℃避光孵育1 h,最后使用酶标仪检测A450值并计算细胞增殖率。检测LDH 时,铺板、分组、给药培养同上,48 h 后取每孔的培养上清液按说明书操作,最后检测A450值并计算LDH 释放量。
1.2.4 JuA 对APP-NSCs 增殖能力的影响 实验共分4 组,分别为NSCs 组、NSCs-JuA 组、APPNSCs 组、APP-NSCs-JuA 组。取NSCs、APP-NSCs按上述分组以1×106个/mL 的密度铺24 孔板并置于增殖培养基中培养,7 d 后镜下随机视野拍照,每组5 张,根据标尺计算神经球直径。另取NSCs、APPNSCs 按上述分组以5×106个/孔的密度铺96 孔板,于增殖培养基中培养。48 h 后每孔添加终浓度为20 μmol/L 的BrdU,12 h 后弃去,PBS 清洗,加入4%多聚甲醛固定30 min,PBS 清洗,随后使用0.1%Triton×100 处理15 min,PBS 清洗后用2 mol/L HCl置于37 ℃下处理30 min,接着用0.1 mol/L,pH = 8.5的硼酸缓冲液中和10 min,PBS 清洗,使用5% BSA室温封闭30 min,弃去液体,孵育一抗,4℃过夜。弃去液体,PBS 清洗,加入二抗,室温孵育1h,PBS 清洗,DAPI 室温染核5 min,最后镜下随机视野拍照,每组5 张。
1.2.5 JuA 对APP-NSCs 分化能力的影响 按“1.2.4”项下分组将NSCs、APP-NSCs 以1×106个/mL的密度铺24 孔板,置于分化培养基(含10% FBS、1% P/S 的DMEM-F12)中培养,10 d 后使用免疫荧光化学法检测各组向神经元、星形胶质细胞、少突胶质细胞分化率。
1.2.6 统计学方法 用SPSS 22.0 软件进行数据分析,计量资料用均数±标准差(x±s)表示,多组间比较采用方差分析,两组间比较采用t检验。以P<0.05 为差异具有统计学意义。
2 结果与分析
2.1 NSCs 的鉴定与APP-NSCs 模型的构建
NSCs 的鉴定结果见图1,通过免疫荧光法检测发现NSCs 表达Nestin 和Sox2 双阳性,证明分离提取的细胞为未分化的NSCs。APP-NSCs 的构建过程见图2。镜下可见APP-NSCs 表达GFP 绿色荧光,证明转染成功,见图3。Western blot 及RT-PCR 结果见图4,与GFP-NSCs 组相比,APP-NSCs 组的Aβ1-42蛋白及APP mRNA 的表达量上升,结果证明APP-NSCs 模型制备成功。

图1 NSCs 的鉴定Fig. 1 Identification of NSCs
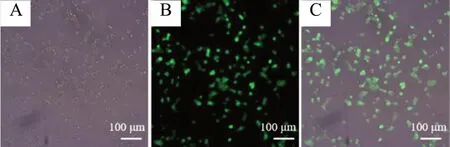
图2 APP-NSCs 的构建Fig. 2 Construction of APP-NSCs
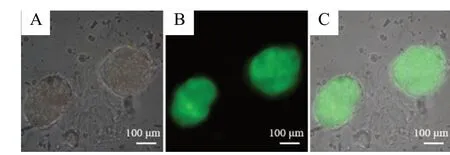
图3 APP-NSCs 的鉴定Fig. 3 Identification of APP-NSCs

图4 Western blot 条带图与RT-PCR 条带图Fig. 4 Western blot strip plot and RT-PCR strip plot
2.2 JuA对APP-NSCs细胞活性和LDH释放量的影响
与对照组相比,25、50、100 μmol/L JuA 组的细胞增殖率上升(P<0.05),LDH 释放量下降(P<0.05)。 结果表明,25、50、100 μmol/L JuA 均对APP-NSCs 具有一定的保护作用,根据实验结果,选择25 μmol/L 作为后续实验给药剂量,见图5。

图5 JuA 对APP-NSCs 细胞增殖率和LDH 释放量的影响(n = 6)Fig. 5 Effects of JuA on cellular activity and LDH release from APP-NSCs(n = 6)
2.3 JuA 对APP-NSCs 增殖能力的影响
与NSCs 组相比,NSCs-JuA 组神经球直径增大(P<0.05),APP-NSCs 组神经球直径减小(P<0.01);与APP-NSCs 组相比,APP-NSCs-JuA 组神经球直径增大(P<0.01),见图6、图7。
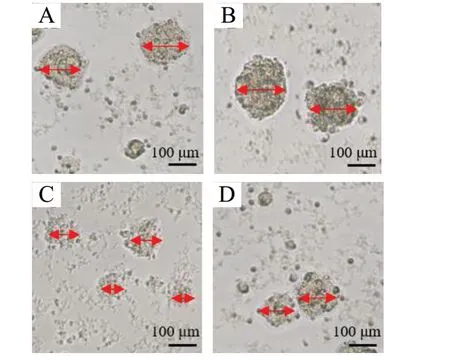
图6 JuA 对神经球直径的影响Fig. 6 Effects of JuA on the neurosphere diameter
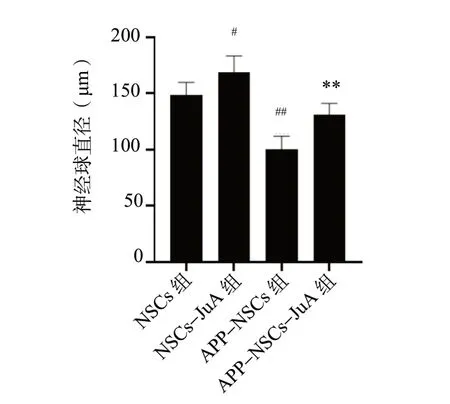
图7 JuA 对神经球直径影响的统计图(n = 5)Fig. 7 Statistical plot of the effects of JuA on neurosphere diameter (n = 5)
与NSCs 组相比,NSCs-JuA 组的BrdU+阳性率上升(P<0.05),APP-NSCs 组的BrdU+阳性率降低(P<0.01);而相较于APP-NSCs 组,APP-NSCs-JuA 组BrdU+阳性率上升(P<0.01),BrdU+结果见图8、图9。

图8 JuA 对BrdU+阳性率的影响Fig. 8 Effects of JuA on the percentage of BrdU+
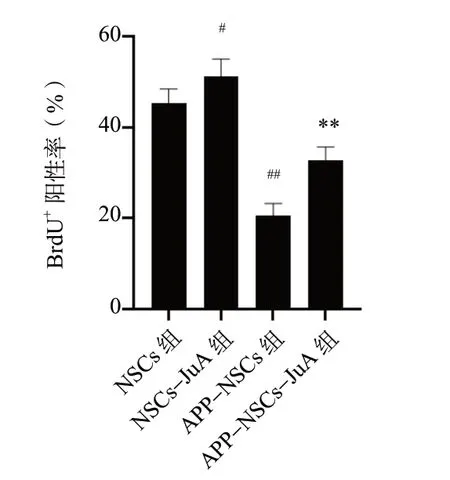
图9 JuA 对BrdU+阳性影响的统计图(n = 5)Fig. 9 Statistical plot of the effects of JuA on the percentage of BrdU+(n = 5)
2.4 JuA 对APP-NSCs 分化能力的影响
与NSCs 组相比,NSCs-JuA 组向神经元(NFM)分化的比率上升 (P<0.05),向星形胶质细胞(GFAP)分化的比率下降(P<0.05),APP-NSCs组向神经元分化的比率降低(P<0.01),向星形胶质细胞分化的比率上升(P<0.01);而APP-NSCs经过JuA 治疗后,与APP-NSCs 组相比,向神经元分化的比率上升(P<0.05),向星形胶质细胞分化的比率下降(P<0.01),结果见图10、图11。
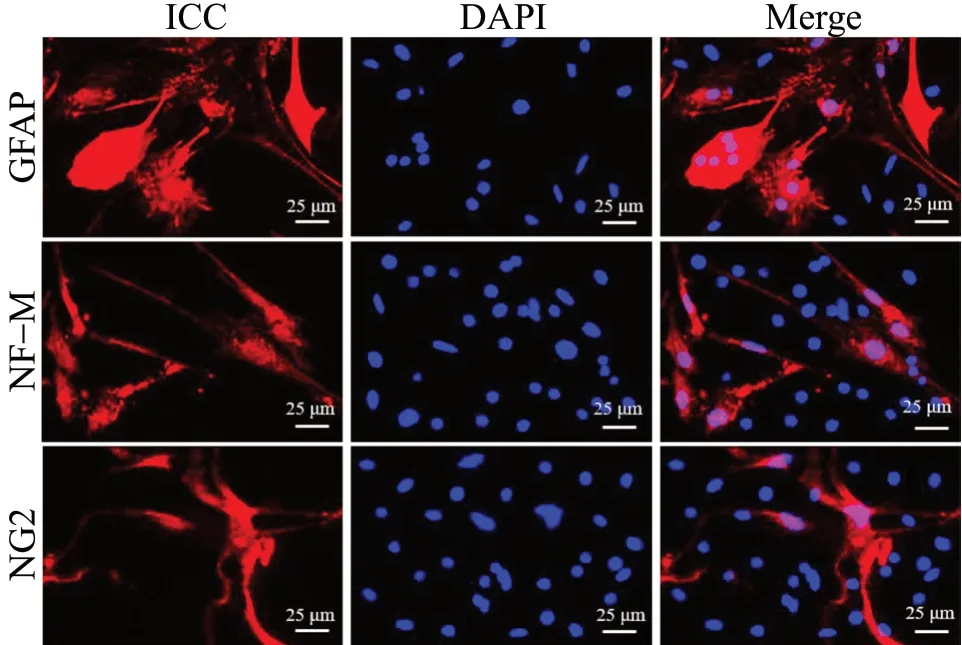
图10 JuA 对分化的影响Fig. 10 Effects of JuA on the differentiation
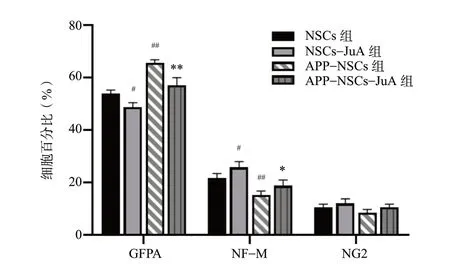
图11 JuA 对分化影响的统计图(n = 5)Fig. 11 Statistical plot of the effects of JuA on the differentiation(n = 5)
3 讨论
由于目前AD 的发病机制尚未完全阐述清楚,使得AD 体外细胞模型的构建呈现多样性。通常采用β-淀粉样蛋白、谷氨酸、过氧化氢、冈田酸等诱导SH-SY5Y 和PC12 细胞建立AD 细胞模型,揭示AD细胞凋亡、炎性反应、氧化应激损伤、Tau 蛋白磷酸化等机制[9]。而本研究采用基因转染技术,即采用APP595/596 基因转染NSCs 的方法构建AD 细胞模型,其优势在于可以持续稳定的表达Aβ,更好地模拟了脑内的微环境,一定程度上提高了病理表达的准确性。通过Western Blot 及RT-PCR 检测转染后NSCs,发现其胞内高表达APP 基因和致病Aβ1-42蛋白,由此证明APP-NSCs 模型构建成功。
NSCs 的增殖和分化对于维持大脑正常的认知和情感功能至关重要,但是随着年龄的增长大脑中神经再生逐渐衰减,而AD 患者脑内神经再生明显低于同龄水平,激活神经再生为AD 的治疗提供了新的策略。文献报道显示JuA 能有效抑制脂多糖诱导的BV-2 小胶质细胞的炎症反应[6],还可改善Aβ42诱导的小鼠认知功能障碍和脑组织损伤[9],说明JuA 具有良好的神经保护作用。本实验结果证实,JuA 能提升APP-NSCs 的存活率并降低其LDH 的释放量,并恢复APP-NSCs 的增殖能力和向神经元分化的能力,说明JuA 能够减轻过表达APP 引起的NSCs 增殖和分化功能损伤,有望改善AD 症状,但JuA 能否激活AD 模型小鼠海马神经再生以及具体机制还有待进一步研究。
4 结论
本研究以APP-NSCs 为体外细胞模型,从细胞增殖、分化方面探讨JuA 对AD 细胞模型的影响,研究证实JuA 可提高APP-NSCs 的增殖能力,并促进其向神经元分化。但作为体外实验,本实验结果可能具有一定的局限性,JuA 促进神经再生的作用有待通过动物模型进一步验证。本实验从神经再生角度出发,为JuA 用于AD 的潜在应用提供了实验基础。

