黄芪黄酮对糖尿病周围神经病变大鼠背根神经节的保护作用及机制▲
侯 君 成 玥 李佳识 魏 莱 吴强鹏 刘朝仁 侯 芳
(1 四川省攀枝花市中西医结合医院内分泌科,攀枝花市 617000,电子邮箱:m50veb@163.com;2 重庆佑佑宝贝妇儿医院手麻科,重庆市渝北区 401122)
周围神经病变是糖尿病常见的慢性并发症之一,包括运动神经、感觉神经和自主神经病变[1]。高糖状态可导致组织细胞产生氧化应激,是引起周围神经病变等糖尿病慢性并发症的一个共同机制[2]。糖尿病状态下的背根神经节十分脆弱,是高血糖损伤的直接靶点,该神经损伤是糖尿病周围神经病变的重要组成部分[3]。因此,寻找有效的背根神经节保护途径尤为重要。黄芪为豆科植物蒙古黄芪或膜荚黄芪的干燥根,黄芪黄酮是黄芪的有效成分之一,有研究显示,黄芪黄酮可降低糖尿病大鼠模型的血糖、脂联素及胰岛素水平[4],但是黄芪黄酮对糖尿病周围神经病变—背根神经节损伤的影响及机制尚未明确。链脲佐菌素具有细胞毒性,常用于糖尿病动物模型的建立[5]。因此本研究利用链脲佐菌素建立糖尿病周围神经病变大鼠模型,观察黄芪黄酮对大鼠模型背根神经节氧化应激及细胞凋亡的影响,并研究其作用机制,以期为临床上糖尿病周围神经病变的治疗提供理论基础,为以糖尿病新药的研发提供新的靶点。
1 材料方法
1.1 实验动物及主要试剂和仪器 选取40只6~7周的无特定病原体级雄性SD大鼠,体重(197.5±11.4)g,随机血糖(6.55±0.75)mmol/L,购自四川大学实验动物中心,动物的许可证号:SCXK(川)2018-026。链脲佐菌素购自翌圣生物科技(上海)股份有限公司(批号:20191124);金芪降糖片购自天津中新药业集团股份有限公司(批号:20200426);黄芪黄酮由四川大学药物分析代谢实验室提取;蛋白酶K工作液购自上海尚宝生物有限公司(批号:20190610);脱氧核苷酸末端转移酶介导的dUTP 缺口末端标记(terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling,TUNEL)细胞凋亡检测试剂盒、活性氧簇(reactive oxygen species,ROS)检测试剂盒、线粒体膜电位检测探针JC-1试剂盒均购自中国碧云天公司(批号分别为:20191213、20200426、20201002);超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛试剂盒均购自江苏凯基生物公司(批号分别为:20200113、20191206);细胞色素C(cytochrome C,Cyt-C)、B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)、B细胞淋巴瘤-2相关X蛋白(B-cell lymphoma-2-associated X protein,Bax)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved cysteinyl aspartate specific proteinase 3,cleaved Caspase3)、p38和磷酸化p38(phosphorylated p38,p-p38)抗体均购自美国Abcam公司,批号分别为(ab1809、ab4693、ab4062、ab2984、ab5535、ab9802);甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因购自博士德生物公司(批号:D8327);ECL显色液购自南京凯基生物科技有限公司(批号:22678);ZJL859BTT型血糖仪购自上海强生医疗器械有限公司;Von Frey电子测痛仪购自美国IITC。
1.2 造模及分组 给予大鼠自由饮水、自由采食,室内自然光照,室温18℃~20 ℃,分笼饲养,每笼4~5只。适应性饲喂1 周后,采用随机数字表法将大鼠分为正常对照组10只和模型组30只。造模前12~16 h禁食、不禁水,模型组大鼠按照52 mg/kg一次性腹腔注射2 %的链脲佐菌素,正常对照组腹腔注射等量枸橼酸盐缓冲液(0.1 mol/L,60 mg/kg,pH 4.5)。造模后第7 d使用血糖仪检测模型组大鼠尾尖血血糖,随机血糖>16.7 mmol/L即为造模成功。将造模成功的30只大鼠采用分层随机法分为模型组、黄芪黄酮组和阳性对照组,每组10只。
1.3 给药剂量及方法 造模成功后即日开始灌胃给药。黄芪黄酮组给药量按照成人每日服用黄芩生药量60 g/体质量(成人按照60kg体重)计算,大鼠黄芩等效剂量为成人6.3倍(依据体表面积换算),灌胃给药浓度为1 mL溶液中含黄芩生药量1 g,给药剂量相当于黄芩生药量6.3 g/kg,即黄芪黄酮给药量为0.04 g/kg;阳性对照组给予金芪降糖片(455 mg/kg)进行灌胃;正常对照组及模型组灌服等量蒸馏水。所有大鼠灌胃均为1 d/次。为了防止由于血糖过高大鼠无法存活至实验结束,模型组大鼠腹腔皮下注射1~4 IU/d的精蛋白锌胰岛素注射液(北京索莱宝生物科技有限公司,批号:39847920),使血糖平稳在20.0~25.0 mmol/L。连续观察30 d。
1.4 大鼠机械痛阈值测定 造模后30 d后,在各组大鼠处死前,使用血糖仪检测各组大鼠尾尖血血糖。同时,使用Von Frey仪测量大鼠机械疼痛阈值:将大鼠放置在升高的金属网上,盖上透明的有机玻璃罩。大鼠在环境中适应15 min后,使用Von Frey电子仪垂直刺激(电压30 V)大鼠后肢足底中部,使探头纤维稍呈S形。大鼠在受到刺激后出现快速的缩足反应,记为阳性反应,记录仪器电子屏幕上的受力数值(g)。由于身体的活动出现的缩足反应不记为阳性反应(刺激后快速缩足反应即为阳性反应)。测量1次后相隔3~5 min再次测量,每只大鼠实验重复3次,取平均值。
1.5 标本处理 干预30 d后各组大鼠给予腹腔注射10 mg/kg的12%乌拉坦(齐鲁制药有限公司,批号:190319)进行麻醉,将大鼠仰卧位固定于动物无菌手术台,固定脊椎,股部剪毛,找到坐骨神经,沿坐骨神经找到膨大的背根神经节,取出神经节组织,置于冻存管中于-80 ℃冰箱保存,备用。
1.6 细胞凋亡检测 37 ℃条件下使用蛋白酶K工作液(武汉博士德生物工程有限公司,批号:1069832)处理背根神经节组织(3~5 g)15 min,磷酸缓冲盐溶液(phosphate buffered saline,PBS)漂洗3次,15 min/次。样本干燥后,在冰上使用破膜剂处理组织2 min,滴加50 μL TUNEL反应工作液,湿盒中37℃反应1 h;15℃~25 ℃条件DMEM培养箱孵育10 min;然后PBS漂洗3次,15 min/次,加入10 mg/mL的4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI),室温环境下预染细胞核5 min,PBS漂洗2次,30 s/次。在激光共聚焦显微镜(北京普瑞赛司仪器有限公司,型号:LSM 900)下观察,出现绿色荧光为凋亡细胞,蓝色荧光为细胞核。每组随机选择5个视野(×100),计算各组凋亡细胞数。细胞凋亡率=绿色荧光的凋亡细胞数/蓝色荧光的凋亡细胞数×100%。
1.7 ROS、丙二醛和SOD含量检测 取各组大鼠神经节组织50 mg,加入1 mL匀浆缓冲液,用匀浆器充分匀浆,3 000 r/min 4℃离心10 min,取上清。采用比色法检测ROS含量,采用硫代巴比妥酸法检测丙二醛含量,采用黄嘌呤氧化酶法检测SOD含量,检测均按照试剂盒说明严格操作。
1.8 线粒体膜电位检测 取各组大鼠神经节组织500 mg,PBS清洗背根神经节3次,30 s/次,37 ℃胰酶消化45 min,然后使用巴士吸管吹打5 min,按照JC-1试剂盒说明装载荧光探针,于37 ℃培养箱孵育20 min。孵育期间每3~5 min颠倒混匀1次,以使背根神经节细胞与荧光探针能够充分接触。PBS洗涤细胞3次,5 min/次,将未进入细胞内的JC-1探针充分去除。荧光显微镜(美国Nexcope,型号:NE620)下观察并计量荧光强度,以红色荧光/绿色荧光的比值表示膜电位,比值高则线粒体膜电位水平升高,比值低则线粒体膜电位水平降低。红色荧光多则说明细胞活性大。
1.9 Cyt-C、Bcl-2、Bax、cleaved Caspase3、p38和p-p38蛋白相对表达量检测 采用蛋白免疫印迹法检测蛋白相对表达量。取各组大鼠神经节组织200 mg,加入适量裂解液(美国Thermo Fisher Scientific公司,批号:89893),冰上反应30 min, 3 000 r/min、4℃离心10 min,移液器吸取上清,保存。采用二喹啉甲酸法测定蛋白浓度。蛋白与上样缓冲液按照1 ∶4混匀,100 ℃沸水变性5 min。按照40 μg/孔加变性蛋白,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、转膜及封闭膜后,加一抗(1 ∶1 000稀释),4℃孵育过夜,PBS洗膜3次,5 min/次;加二抗(艾美捷科技有限公司,批号:PAB31742;稀释比例1 ∶2 000),37 ℃孵育2 h,PBS洗膜3次,5 min/次;膜上滴加ECL显色液,曝光、显影、定影,采用Image J软件分析灰度值。以目的蛋白与内参GAPDH的灰度值比值为各蛋白相对表达量。
1.10 统计学分析 采用SPSS21.0软件进行统计学分析。计量资料用(x±s)表示,多组间差异比较采用单因素方差分析,两两比较采用SNK-q检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 4组大鼠血糖及机械痛阈值的比较 4组大鼠造模后第7天和第30天的血糖均有统计学意义(均P<0.05),其中其他3组的血糖均高于正常对照组,而黄芪黄酮组和阳性对照组血糖均低于模型组(均P<0.05)。4组大鼠的机械痛阈值差异有统计学意义(P<0.05),其中机械痛阈值由高到低为正常对照组>黄芪黄酮组>阳性对照组>模型组(均P<0.05)。见表1。
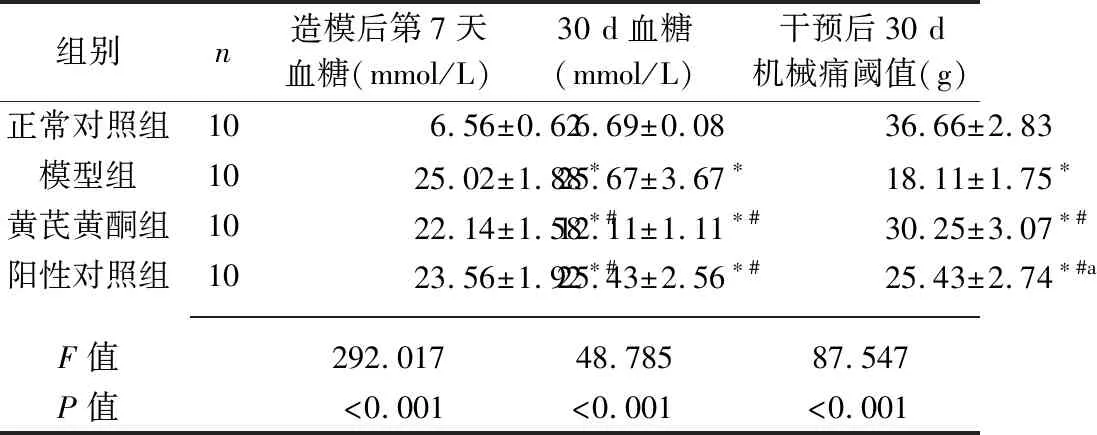
表1 4组大鼠血糖及机械痛阈值的比较(x±s)
2.2 4组大鼠背根神经节细胞凋亡率的比较 凋亡细胞核呈棕黄色,对照组凋亡细胞较少,模型组凋亡细胞较多,黄芪黄酮组和阳性对照组凋亡细胞较模型组少,见图1。4组大鼠的背根神经节细胞凋亡率差异有统计学意义(P<0.05),其中背根神经节细胞凋亡率由高到低为模型组>阳性对照组>黄芪黄酮组>正常对照组(均P<0.05)。见表2。
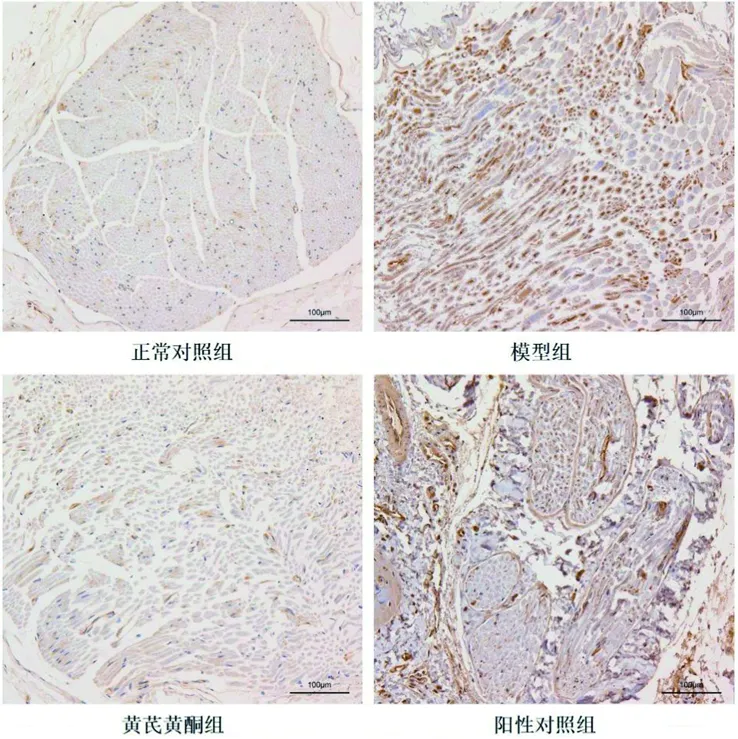
图1 4组大鼠背根神经节细胞的凋亡情况(DAPI染色,×100)

表2 4组大鼠背根神经节细胞凋亡率的比较(x±s,%)
2.3 4组大鼠背根神经节组织ROS、丙二醛和SOD含量的比较 4组大鼠背根神经节组织ROS、丙二醛和SOD含量的比较,差异均有统计学意义(均P<0.05)。其中,与正常对照组比较,模型组背根神经节组织的ROS和丙二醛含量均升高,SOD含量降低(均P<0.05);与模型组比较,黄芪黄酮组和阳性对照组背根神经节组织的ROS和丙二醛含量降低,SOD含量明显升高(均P<0.05);黄芪黄酮组背根神经节组织的ROS和丙二醛含量低于阳性对照组,SOD含量高于阳性对照组(均P<0.05)。见表3。

表3 4组大鼠背根神经节组织ROS、丙二醛和SOD含量的比较(x±s)
2.4 4组大鼠背根神经节膜电位水平的比较 4组膜电位水平由高到低为正常对照组>黄芪黄酮组>阳性对照组>模型组(均P<0.05)。见表4。

表4 4组大鼠背根神经节膜电位水平的比较(x±s)
2.5 4组大鼠背根神经节组织Cyt-C、Bcl-2、Bax、cleaved Caspase3、p38及p-p38蛋白相对表达量的比较 正常对照组、黄芪黄酮组、阳性对照组、模型组大鼠背根神经节组织的Cyt-C、Bax、p38及p-p38蛋白相对表达量均依次升高(均P<0.05)。与正常对照组比较,其他3组背根神经节组织的cleaved Caspase3蛋白相对表达量升高,Bcl-2蛋白相对表达量降低(均P<0.05);而与模型组比较,黄芪黄酮组和阳性对照组背根神经节组织的cleaved Caspase3蛋白相对表达量降低,Bcl-2蛋白相对表达量升高(均P<0.05),但黄芪黄酮组和阳性对照组间差异无统计学意义(均P<0.05)。见图2~3和表5。

图2 4组神经节组织Cyt-C、Bcl-2、Bax 和cleaved Caspase3蛋白表达情况
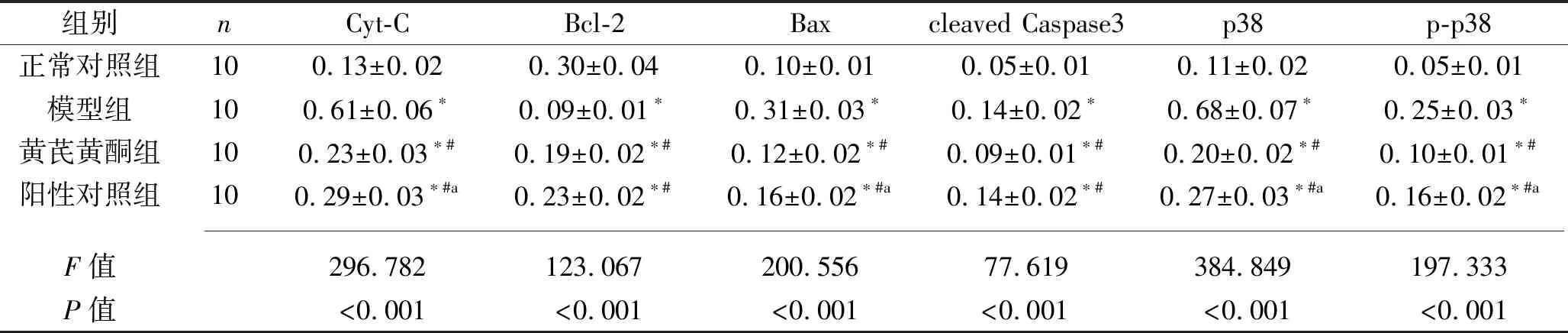
表5 4组大鼠背根神经节组织的Cyt-C、Bcl-2、Bax、cleaved Caspase3、p38及p-p38蛋白相对表达量的比较(x±s)

图3 4组神经节组织p38和p-p38蛋白表达情况
3 讨 论
痛热阈值检测、神经电生理检查及神经病理学观察是评定糖尿病周围神经病变动物模型是否成功及严重程度的主要方法。研究证实,链脲佐菌素制备的糖尿病大鼠模型成功后4~8周即可观察到与人类糖尿病周围神经病变相似的变化,包括痛温觉异常、髓鞘肿胀、神经传导速度减慢等[6-8]。本研究选择52 mg/kg的链脲佐菌素建立糖尿病大鼠模型,结果显示造模7 d 后模型组大鼠的血糖高于正常对照组,且造模30 d模型组大鼠的机械痛阈值低于正常对照组(均P<0.05),说明糖尿病周围神经病变大鼠模型建立成功。黄芪黄酮组的机械痛阈值和血糖均低于模型组(P<0.05),提示黄芪黄酮有助于改善糖尿病周围神经病变大鼠的病情。
研究表明,在糖尿病周围神经病变众多发病机制中,氧化应激占有重要位置,氧化应激可能是糖尿病并发症产生的一个核心机制[9-10]。有研究显示,在糖尿病状态下背根神经节中过氧化物、氧离子增多[11-12]。线粒体是ROS产生的主要场所,线粒体内ROS过量产生可引起线粒体内膜发生去极化,线粒体膜电位降低,膜通透性增加,Cyt-C等凋亡相关蛋白释放至胞质,进而与含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase, Caspase)9和凋亡蛋白酶激活因子1结合,Caspase9活化后进一步激活Caspase3,最终引起细胞的凋亡[13-14]。Cyt-C与膜电位是导致线粒体细胞凋亡的两个关键指标,而Caspase3是凋亡的执行者。cleaved Caspase3 可降解细胞内结构蛋白和功能蛋白,诱导细胞死亡,Caspase3处于Caspase级联反应的末端,并被细胞凋亡的内在和外在死亡途径激活,活化的Caspase3可降解细胞内结构蛋白和功能蛋白,诱导细胞死亡。Bcl-2和Bax皆为Bcl-2家族成员,分别发挥抑凋亡和促凋亡的作用,其中Bcl-2主要定位于线粒体外膜上,可降低线粒体膜渗透性,从而控制线粒体Cyt-C释放[15-16]。王超等[17]的研究显示,高糖可引起大鼠背根神经节神经元细胞活性降低,细胞凋亡增加,ROS含量升高,而筋脉通可以减弱高糖对细胞活力、凋亡及ROS的影响。倪洪岗等[18]研究发现,糖痹康可以降低糖尿病大鼠模型背根神经节ROS含量及细胞凋亡率,抑制Bcl-2表达,增强Caspase3表达。提示中药对血糖水平具有调控作用。丙二醛可间接反映细胞的损伤程度及自由基代谢变化,联合测定SOD和丙二醛,可用于反映机体清除氧自由基的能力[19]。有研究显示,黄芪黄酮可明显降低糖尿病大鼠模型血清丙二醛含量,提高血清SOD含量[20]。本研究结果显示,与正常对照组比较,模型组大鼠的背根神经节细胞凋亡率增加,背根神经节组织的ROS、丙二醛含量以及Cyt-C、Bax、cleaved Caspase3蛋白表达水平升高,背根神经节组织的SOD含量、Bcl-2蛋白表达水平及膜电位水平降低;而黄芪黄酮组大鼠的背根神经节细胞凋亡率,背根神经节组织的ROS、丙二醛含量以及Cyt-C、Bax 和cleaved Caspase3蛋白表达水平均低于模型组,背根神经节组织的SOD含量、Bcl-2蛋白表达水平及膜电位水平均高于模型组(均P<0.05)。以上结果提示黄芪黄酮可能通过抑制背根神经节组织氧化应激反应及细胞凋亡从而对糖尿病周围神经病变大鼠起保护作用。p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是MAPK家族成员之一,有诱导神经细胞凋亡的作用,p38MAPK信号通路参与了神经病变的发生和发展[21]。有研究显示,高糖所致ROS大量产生可引起p38MAPK信号通路的激活,p38MAPK又可通过进一步调节Bcl-2、Bax和Caspase3表达,最终引起神经元细胞的凋亡[22]。有研究表明,黄芪黄酮可明显降低糖尿病大鼠胰腺中p38 mRNA的表达[23]。本研究结果显示,与正常对照组比较,模型组背根神经节组织的p38及p-p38蛋白相对表达量升高(均P<0.05),说明高糖可促进背根神经节组织p38及p-p38表达;而黄芪黄酮组背根神经节组织的p38及p-p38蛋白相对表达量均低于模型组(均P<0.05),提示p38MAPK可能是黄芪黄酮抑制背根神经节组织细胞凋亡的途径之一。此外,本研究结果显示,黄芪黄酮组的机械痛阈值、氧化应激指标、细胞凋亡率及部分凋亡相关蛋白的表达、膜电位水平、p38和p-p38蛋白的表达均优于阳性对照组(P<0.05),提示黄芪黄酮对糖尿病大鼠背根神经节组织的保护作用优于传统药物金芪降糖片。
综上所述,黄芪黄酮可抑制糖尿病大鼠背根神经节组织氧化应激、细胞凋亡,以及p38MAPK信号通路,从而减轻周围神经损伤。本研究为黄芪黄酮在糖尿病周围神经病变中的应用研究提供了理论依据,值得进一步深入探究。

