基于网络药理学的小陷胸汤治疗大肠癌的机制研究
高世勇,李婉秋,王 帅,石 佳,谭慧心
基于网络药理学的小陷胸汤治疗大肠癌的机制研究
高世勇1, 3,李婉秋1, 3,王 帅1, 3,石 佳1, 3,谭慧心2*
1. 哈尔滨商业大学 药物工程技术研究中心,黑龙江 哈尔滨 150076 2. 哈尔滨医科大学附属第四医院 药学部,黑龙江 哈尔滨 150001 3. 黑龙江省肿瘤预防与抗肿瘤药物研究重点实验室,黑龙江 哈尔滨 150076
采用网络药理学探究小陷胸汤治疗大肠癌的作用机制。通过中药系统药理学数据库及分析平台(TCMSP),对组成小陷胸汤的3个单味药半夏、瓜蒌和黄连分别进行活性成分的收集和筛选,构建成分-靶点网络图,同时采用GeneCards数据库获取大肠癌疾病靶点。应用Cytoscape软件,采用蛋白互作的方式,垂钓小陷胸汤治疗大肠癌的核心靶点,并采用ClueGo对核心靶点进行基因本体(gene ontology,GO)和通路的富集分析。采用PyRx软件对核心成分及蛋白靶点进行分子对接,对网络药理学的研究结果进行验证。筛选得到32个小陷胸汤治疗大肠癌的活性成分,181个对应的蛋白靶点及9329个大肠癌疾病靶点。通过靶点垂钓的方式,得到360个小陷胸汤治疗大肠癌的核心靶点。GO富集分析发现,小陷胸汤治疗大肠癌在生物过程(biological process,BP)方面,与烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)依赖性组蛋白脱乙酰酶活性、消旋酶活性负调控、胆囊收缩素反应、调节脱氧核糖核酸酶活性等有关;分子功能(molecular function,MF)方面,与蛋白质丝氨酸/苏氨酸激酶活性、蛋白质丝氨酸/苏氨酸激酶活性调节、腺嘌呤核苷三磷酸(adenosine-triphosphate,ATP)结合、凋亡过程中半胱氨酸型内肽酶活性调节等有关;在细胞组成(cellular component,CC)方面,主要与纺锤体微管、组蛋白脱乙酰酶复合物、核小体、ESC/E(Z)复合物有关。信号通路富集分析注释得到胃泌素信号、细胞周期、乙型肝炎感染、DNA损伤反应4个相关通路。分子对接结果表明由小陷胸汤中筛选出的活性成分与对应的蛋白靶点具有良好的结合能力。小陷胸汤通过调控胃泌素信号通路、细胞周期通路、乙型肝炎感染通路、DNA损伤反应通路治疗大肠癌。
小陷胸汤;网络药理学;大肠癌;胃泌素信号通路;细胞周期通路;乙型肝炎感染通路;DNA损伤反应通路
大肠癌包括结肠癌和直肠癌。据统计,2020年全球大肠癌发病率在所有癌症中排名第3,死亡率排名第2[1]。小陷胸汤出自张仲景的《伤寒论》,由黄连、半夏和瓜蒌组成[2],具有清热化痰、宽胸散结的功效[3]。国内外多名学者发现小陷胸汤具有良好的抗肿瘤作用[3-6],对胰腺癌[7]、肺癌[8]和胃癌[9]具有较好的疗效。丁莴等[2]发现小陷胸汤可通过阻滞细胞周期、诱导细胞凋亡、抑制肿瘤血管生成、增强机体免疫能力等途径发挥抗肿瘤作用。网络药理学[10]的整体性、系统性的特点与中医药整体观、辨证论治的特点不谋而合,为中医药的研究开辟了一条新道路,为中西医研究之间的“对话”提供了一种新的“语言”。本研究通过网络药理学方法,研究小陷胸汤治疗大肠癌的作用机制,利用分子对接技术对筛选出的活性成分与治疗靶点的结合能力进行验证,旨在揭示小陷胸汤治疗大肠癌的作用机制。
1 方法
1.1 小陷胸汤活性成分及靶点筛选
通过中药系统药理学数据库和分析平台(TCMSP,http://tcmspw.com),分别以“半夏”“瓜蒌”“黄连”为关键词,以“口服生物利用度(oral bioavailability,OB)≥30%”“药物相似性(drug-likeness,DL)≥0.18”为筛选条件,获得活性成分和靶点信息[11]。利用Uniprot数据库(https://www.uniprot.org/)进行蛋白名称和基因名称的转换[12]。
1.2 小陷胸汤“活性成分-靶点”网络的构建
使用Cytoscape 3.8.2软件构建小陷胸汤“活性成分-靶点”网络图,达到可视化的目的。
1.3 大肠癌疾病靶点获取
采用GeneCards数据库[13],以“colorectal cancer”为关键词,筛选相关基因。
1.4 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建及分析
运用BisoGenet插件,获取小陷胸汤的药物靶点和大肠癌靶点的PPI信息,并获取其共有靶点。以“度中心性(degree centrality,DC)”“介度中心性(betweenness centrality,BC)”“接近中心性(closeness centrality,CC)”“特征向量中心性(eigenvector centrality,EC)”“网络中心性(network centrality,NC)”“局部边连通性(local average connectivity,LAC)”为条件对共有靶点进行筛选[14],得到核心靶点。
1.5 基因本体(gene ontology,GO)功能及通路富集分析
运用ClueGo进行生物过程(biological process,BP)、分子功能(molecular function,MF)、细胞组成(cellular component,CC)富集分析;采用“Wiki Pathways”数据集进行通路富集分析。
1.6 分子对接
将小陷胸汤的活性成分输入到PubChem中,下载SDF格式文件。将核心靶点与小陷胸汤对大肠癌作用的直接靶点垂钓,获得关键靶点。在PDB数据库中查找关键靶点的晶体结构,以分辨率低、有配体蛋白、单Macromolecule结构、Homo sapiens为参考条件,下载PDB格式。
将SDF格式的配体活性分子导入Auto Dock Tools中进行预处理。将PDB格式的关键蛋白导入PyMol中去除水分子和去除配体蛋白生成对接位点。将获取的蛋白导入Auto Dock Tools,在Edit中加氢、计算电荷、设置原子类型。
在PyRx中将处理好的配体活性分子导入Ligands中,处理好的蛋白导入Macromolecules中,运用Vina Wizard进行Run Vina计算分数,得到蛋白与配体活性分子结合的能量数值表和蛋白与配体活性分子结合能力最佳的构象文件,并采用PyMol对结果进行可视化。
2 结果
2.1 小胸陷汤活性成分的筛选
通过TCMSP数据库[15]获得小陷胸汤化学成分244个,以OB≥30%、DL≥0.18为条件对化学成分进行筛选[16],最终得到31个化学成分及其对应的181个作用靶点。小陷胸汤化学成分见表1,对应靶点见表2(部分结果)。
表1 小陷胸汤中的化学成分
Table 1 Active components in Xiaoxianxiong Decoction
序号Mol ID化学成分OB/%DL 1MOL000098quercetin46.430.28 2MOL000358β-sitosterol36.910.75 3MOL000449stigmasterol43.830.76 4MOL000519coniferin31.110.32 5MOL000622magnograndiolide63.710.19 6MOL000785palmatine64.600.65 7MOL001454berberine36.860.78 8MOL001458coptisine30.670.86 9MOL001494mandenol42.000.19 10MOL00175524-ethylcholest-4-en-3-one36.080.76 11MOL002668worenine45.830.87 12MOL002670cavidine35.640.81 13MOL002714baicalein33.520.21 14MOL002881diosmetin31.140.27 15MOL002894berberrubine35.740.73 16MOL002897epiberberine43.090.78 17MOL002903(R)-canadine55.370.77 18MOL002904berlambine36.680.82 19MOL002907corchoroside A_qt104.950.78 20MOL003578cycloartenol38.690.78 21MOL004355spinasterol42.980.76 22MOL005030gondoic acid30.700.20 23MOL005530hydroxygenkwanin36.470.27 24MOL006756schottenol37.420.75 25MOL00693610,13-eicosadienoic39.990.20 26MOL006957(3S,6S)-3-(benzyl)-6-(4-hydroxybenzyl)piperazine-2,5-quinone46.890.27 27MOL006967β-D-ribofuranoside, xanthine-944.720.21 28MOL00716510α-cucurbita-5,24-diene-3β-ol44.020.74 29MOL0071715-dehydrokarounidiol30.230.77 30MOL0071727-oxo-dihydrokaro-unidiol36.850.75 31MOL007179linolenic acid ethyl ester46.100.20
2.2 活性成分-靶点网络的构建
将31个小陷胸汤化学成分与181个潜在药物靶点,通过Cytoscape 3.8.2软件构建小陷胸汤活性成分-靶点网络图[17](图1),其中三角形代表单味药,六边形代表化学成分,菱形代表药物靶点,该网络由215个节点、419条边构成。
2.3 疾病靶点及治疗核心靶点的获取
以“colorectal cancer”作为关键词,采用GeneCards数据库,共获得大肠癌相关靶点9329个。将181个小陷胸汤作用靶点与9329大肠癌靶点进行蛋白互作,并进一步筛选出二者的共同靶点,采用DC、BC、CC等参数进行核心靶点筛选[14],共得到360核心靶点(图2)。
表2 小陷胸汤活性成分的作用靶点信息
Table 2 Target information of active components of Xiaoxianxiong Decoction
序号Mol ID化学成分靶点 1MOL002670cavidineRXRB 2MOL002714baicaleinFOSL1 3MOL000358β-sitosterolMAP2 4MOL000449stigmasterolADRB1 5MOL000519coniferinCCNA2 6MOL006967β-D-ribofuranoside, xanthine-9MTAP 7MOL0071715-dehydrokarounidiolNR3C1 8MOL002881diosmetinNCOA1 9MOL002668worenineCHEK1 10MOL000098quercetinAKR1B1 11MOL002903(R)-canadineCHRM2 12MOL000622magnograndiolideGRIA2 13MOL000785palmatineNOS2 14MOL000785palmatineESR1 15MOL000785palmatineAR 16MOL000785palmatineESR2 17MOL000785palmatinePRSS1 18MOL000785palmatineF7 19MOL002907corchoroside A_qtNR3C2 20MOL002907corchoroside A_qtNCOA2
2.4 GO功能富集分析
采用ClueGo插件,对核心靶点进行GO功能富集分析。以“MF”“BP”“CC”数据集为背景数据,构建富集分析图。
如图3所示,与MF相关的有5条主要分子功能途径,分别为蛋白质丝氨酸/苏氨酸激酶活性、蛋白质丝氨酸/苏氨酸激酶活性调节、腺嘌呤核苷三磷酸(adenosine-triphosphate,ATP)结合、凋亡过程中半胱氨酸型内肽酶活性调节、序列特异性双链DNA结合;与BP相关的5条生物过程途径,分别为烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)依赖性组蛋白脱乙酰酶活性、消旋酶活性负调控、胆囊收缩素反应、调节脱氧核糖核酸酶活性、蛋白类泛素化修饰的调控;与CC相关的有4个细胞部位,分别为纺锤体微管、组蛋白脱乙酰酶复合物、核小体、ESC/E(Z)复合物。
2.5 通路富集分析
如图4所示,Wiki Pathways通路富集分析共得到6条主要通路,分别为胃泌素信号通路、细胞周期通路、乙型肝炎感染通路、DNA损伤反应通路、组蛋白修饰、转化生长因子-β(transforming growth factor-β,TGF-β)信号通路。
2.6 配体活性成分与关键靶点的分子对接
在PubChem中查找31个配体活性分子的SDF格式文件,共找到28个。小陷胸汤与大肠癌的直接作用靶点共78个,将78个直接靶点与360个核心靶点进行交互,获得关键靶点17个,其中16个可以与小陷胸汤的配体活性分子进行对接。
运用PyRx软件,将28个配体活性分子与16个关键靶点进行分子对接。配体与受体结合能越低,则结合的构象越稳定。以结合能数值作为数据,运用prism软件绘制热图(图5),共获得476个数据。结合能小于−8 kJ/mol的有176个,占36.97%;结合能小于−10.5 kJ/mol的有6个,占1.26%;结合能小于−11 kJ/mol的有2个,占0.42%。选取结合能力最好的6个组合进行可视化,见图6。6个组合分别为corchoroside A_qt与热休克蛋白β1(heat shock protein β1,HSPB1)、5-dehydrokarounidiol与多聚ADP核糖聚合酶1(poly ADP-ribose polymerase 1,PARP1)、stigmasterol与诱导型一氧化氮合酶(inducible nitric oxide synthase,NOS2)、coptisine与表皮生长因子受体(epidermal growth factor receptor,EGFR)、5-dehydrokarounidiol与G1/S特异性细胞周期蛋白-D1(G1/S-specific cyclin-D1,CCNK1)、corchoroside A_qt与过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARG)。
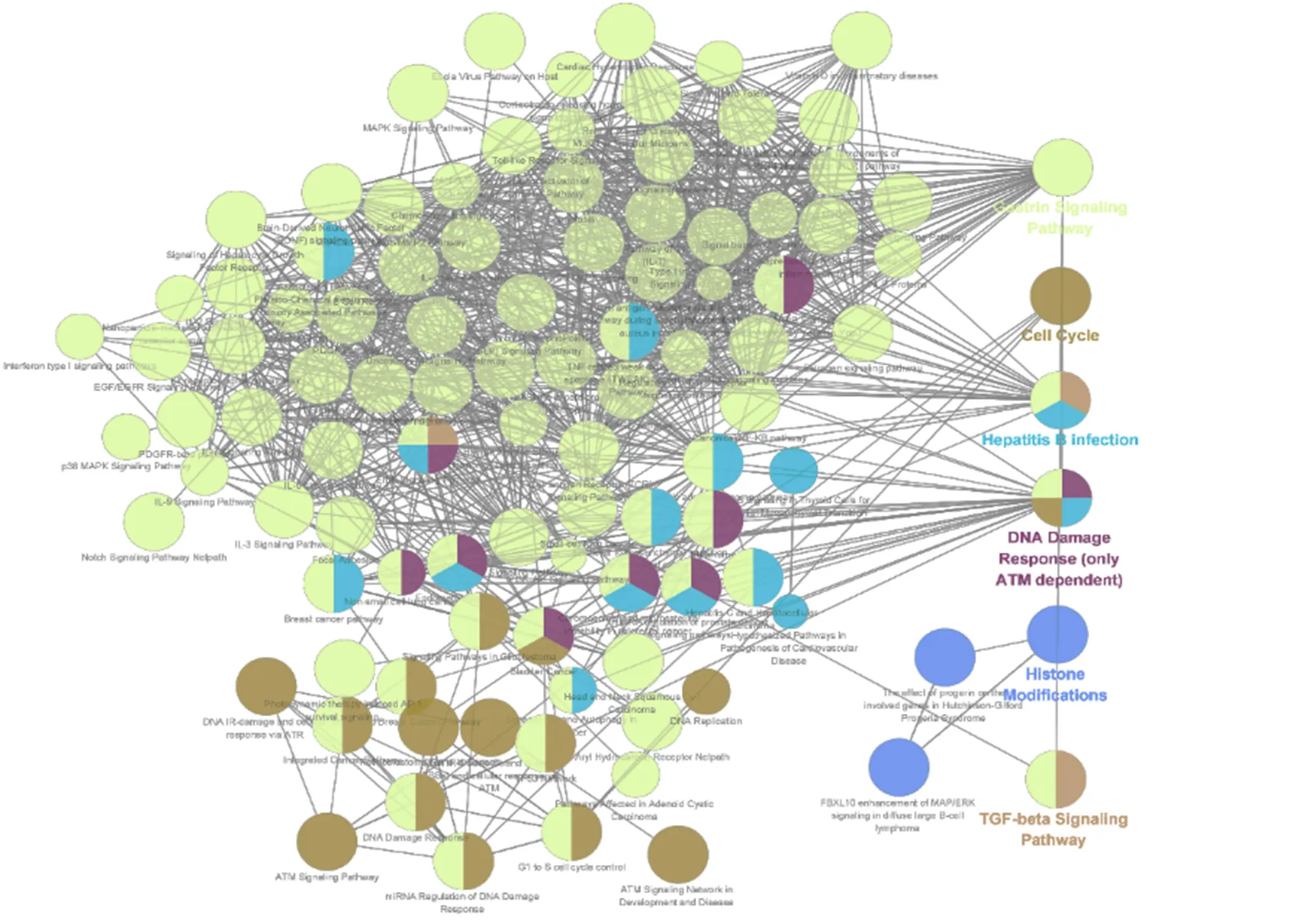
图4 小陷胸汤治疗大肠癌的通路富集分析重要通路图

图5 结合能的热图分析
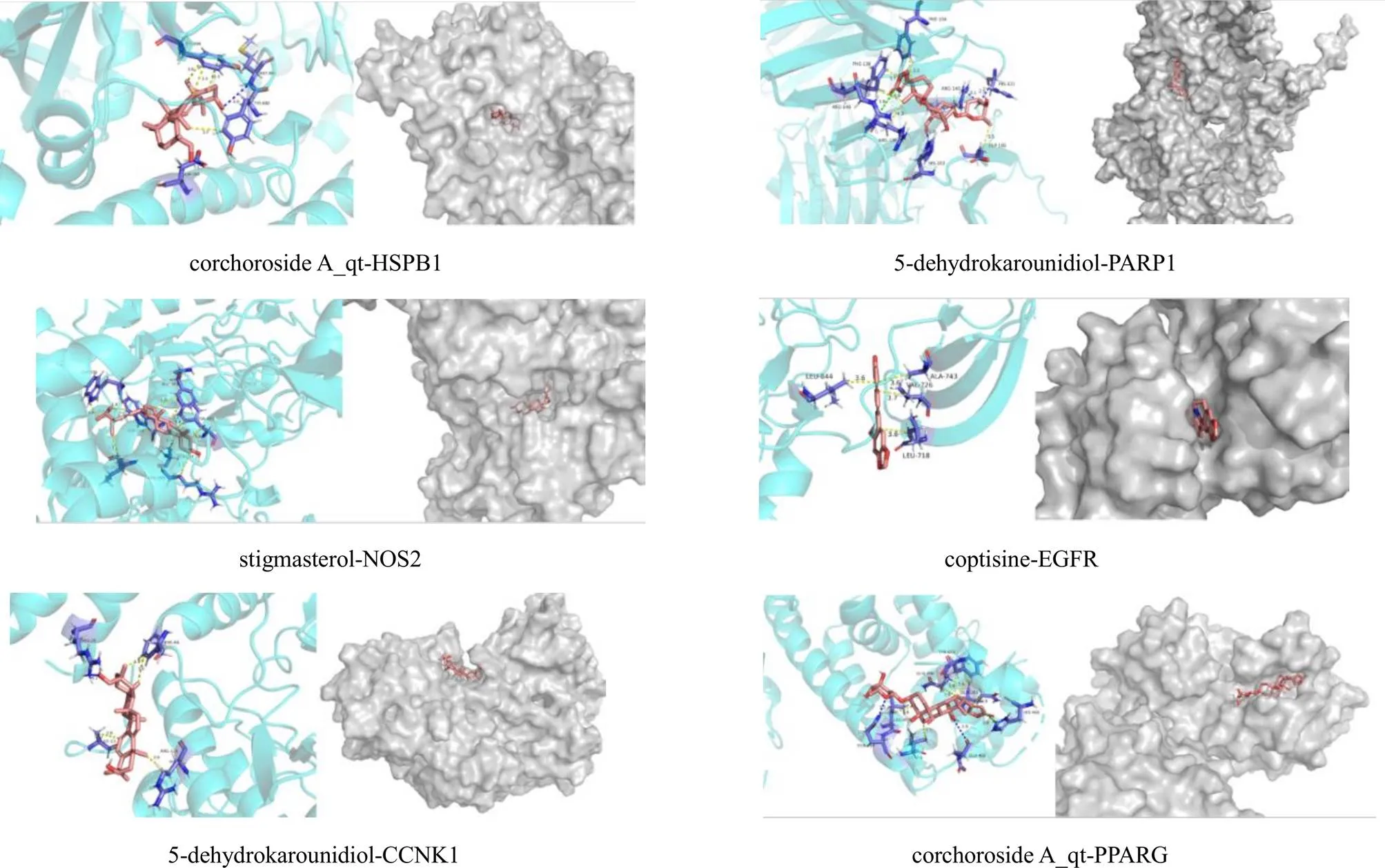
图左为配体与靶点结合方式:黄线为疏水键,蓝线为氢键,绿线为盐桥 图右为配体分子与靶点结合位置
3 讨论
小陷胸汤出自于汉·张仲景的《伤寒论》,由黄连、半夏、瓜蒌3味中药组成[1],研究发现小陷胸汤对多种肿瘤具有较好的作用[2],临床可用于治疗癌症[3-5]。本研究通过TCSMP数据库,分别获取半夏、瓜蒌和黄连的化学成分,并以OB和DL为筛选条件,得到31个化学成分及相应的181个小陷胸汤作用靶点。采用GeneCards数据库,获得大肠癌靶点9329个。进一步对小陷胸汤作用靶点和大肠癌靶点进行PPI及关键靶点垂钓,得到小陷胸汤治疗大肠癌的重要靶点,通过“DC”“BC”“CC”“EC”“NC”“LEC”为条件进行筛选,最终得到核心靶点360个。对核心靶点进行GO功能富集分析,注释小陷胸汤对大肠癌BP、MF及CC的影响;进一步对小陷胸汤治疗大肠癌的核心靶点进行通路富集分析,并结合分子对接技术,进行计算化学验证,揭示小陷胸汤治疗大肠癌的作用机制。
通过MF分析,小陷胸汤治疗大肠癌与其调控蛋白质丝氨酸/苏氨酸激酶活性、ATP结合有关。蛋白质丝氨酸/苏氨酸激酶能够调控蛋白激酶B(protein kinase B,Akt)的功能。丝氨酸/苏氨酸激酶参与协同刺激信号的启动,这类激酶一般在信号转导的中下游发挥作用[18]。通过抑制Akt信号通路,抑制大肠癌内皮细胞的增殖、迁移、侵袭及管道形成能力,从而达到抑制大肠癌的作用[19]。由此发现,小陷胸汤可通过改变蛋白质丝氨酸/苏氨酸激酶活性,使蛋白质丝氨酸/苏氨酸激酶的功能发生改变,通过调控Akt信号通路作用,影响大肠癌内皮细胞的迁移、侵袭能力,从而达到抑制大肠癌细胞增殖的作用。ATP是生物活动所需能量的直接来源,抑制ATP产生,可使癌细胞增殖所需的能量供应不足,从而达到抑制癌细胞增殖的作用[20]。本研究发现小陷胸汤可影响大肠癌ATP结合的功能,通过调控大肠癌ATP达到治疗大肠癌的作用。
BP分析发现,NAD依赖性组蛋白脱乙酰酶能够控制NAD依赖性组蛋白去乙酰化酶的活性,而抑制组蛋白去乙酰化酶活性可以诱导癌细胞凋亡和自噬[21]。本研究表明小陷胸汤能够通过抑制NAD依赖性组蛋白脱乙酰酶活性,发挥诱导大肠癌细胞凋亡和自噬,从而达到抑制大肠癌细胞增殖的作用。
CC分析发现小陷胸汤主要影响大肠癌的纺锤体微管和组蛋白脱乙酰酶复合物2个部位。纺锤体微管是放射状微管,在细胞分裂过程中的染色体运动中起重要作用。干扰微管可以调控微管的功能、破坏微管的动态平衡、阻断癌细胞纺锤体的形成、阻止有丝分裂的进程,起到抗肿瘤作用[22]。本研究发现,小陷胸汤能够影响微管的形成,推测小陷胸汤通过抑制纺锤体微管的形成,造成与细胞有丝分裂进程有关的细胞成分缺失,导致阻断细胞分裂过程从而影响细胞周期,达到抗肿瘤作用。组蛋白脱乙酰酶复合物是一类蛋白酶,对染色体的结构修饰和基因表达调控发挥着重要的作用,抑制组蛋白脱乙酰酶复合物可以逆转多种癌细胞中的布罗莫结构域(bromodomain,BRM)沉默,来抑制透明细胞肾细胞癌(renal cell carcinoma,RCC)的肿瘤进展[23]。本研究发现,小陷胸汤能够调控组蛋白脱乙酰酶复合物,推测小陷胸汤通过抑制组蛋白脱乙酰酶复合物的活性使大肠癌细胞内成分发生变化,逆转BRM沉默来抑制大肠癌的生长,起到抑制大肠癌细胞增殖的作用。
通路富集分析发现小陷胸汤通过调控胃泌素信号通路、细胞周期通路、DNA损伤反应通路等影响大肠癌。胃泌素是一种重要的胃肠激素,主要由G细胞分泌。通过阻断胃泌素与受体结合,可以阻止胃泌素抑制细胞凋亡作用,转变为促进细胞凋亡作用[24-26]。通过下调胃泌素含量,降低肿瘤干细胞标志物的表达,而阻止肿瘤的发展[27]。胃泌素可增强癌细胞的运动能力[26],促进癌细胞的迁移和侵袭能力[28-29]。本研究表明小陷胸汤通过调控胃泌素通路促进细胞凋亡、抑制细胞侵袭和迁移、抑制肿瘤细胞的发展,从而抑制大肠癌细胞增殖。细胞周期是指细胞从一次分裂完成到下一次分裂结束的整个过程。细胞周期通路的任何一个环节被阻断,都会造成细胞增殖的停滞。肿瘤抑制因子通过诱导细胞周期停滞发挥抗癌作用[30]。通过影响细胞周期的G1和G2/M期诱导细胞周期停滞可抑制大肠癌细胞的生长[31-32],阻止癌细胞进行分裂,发挥治疗大肠癌的作用[33-34]。本研究发现小陷胸汤能够调控细胞周期通路,推测小陷胸汤通过影响大肠癌的细胞周期,阻止细胞分裂进程和诱导细胞周期停滞,使大肠癌细胞不能正常分裂,从而抑制大肠癌细胞增殖,治疗大肠癌。DNA损伤是DNA复制过程中DNA核苷酸序列的永久性改变,从而导致遗传特征的改变。增加DNA损伤可使癌细胞对辐射敏感,增加了辐射诱导的细胞凋亡[35]。通过诱导DNA损伤,从而导致细胞毒作用、抑制癌细胞存活、诱导细胞死亡、引起细胞凋亡或过早衰老[36-39]。本研究发现小陷胸汤能够调控DNA损伤通路,推测小陷胸汤通过使大肠癌细胞DNA损伤产生细胞毒作用、诱导细胞凋亡、增强大肠癌细胞对辐射敏感性等作用,从而抑制大肠癌细胞增殖,治疗大肠癌。
通路富集分析发现胃泌素信号通路、细胞周期通路、DNA损伤通路具有诱导细胞凋亡、抑制细胞侵袭、阻止细胞分裂进程、诱导细胞周期停滞、产生细胞毒等作用,从而达到抑制癌细胞增殖的目的。进一步分析发现这3条通路都能够抑制细胞增殖,推测小陷胸汤通过抑制细胞增殖达到治疗大肠癌的作用。MF和BP分析结果也显示小陷胸汤具有抑制大肠癌细胞增殖的潜质,进一步佐证了通路富集分析结果。
分子对接显示小陷胸汤的活性成分与靶点具有较好的结合能力,其中HSPB1、PARP1、NOS2、EGFR、CCND1、PPARG靶点与配体活性分子结合效果最好,结合能均小于−10.0 kJ/moL。HSPB1[40]是热休克蛋白,NOS2[41]是一种同工酶,抑制这2种蛋白的表达可以抑制Akt信号通路的表达,从而抑制大肠癌的增殖。PARP1是DNA修复酶,它可以识别DNA结构损伤从而修复。PARP1可以修复癌细胞中发生损伤的DNA片段,抑制PARP1的表达可以抑制癌细胞生长[42]。EGFR[43]是表皮生长因子受体,CCND1[44]属于高度保守的细胞周期蛋白家族,抑制这2种蛋白的表达可以使大肠癌细胞生长停滞或诱导细胞凋亡,从而抑制大肠癌细胞的生长和增殖。PPARG是配体调节的核激素受体,可以与特异DNA序列结合调控基因的转录。PPARG的表达可以抑制大肠癌的生长速率[45]。因此,小陷胸汤通过抑制Akt信号通路、与特异DNA序列的结合、阻止损伤DNA片段修复、抑制细胞周期等途径,抑制大肠癌细胞增殖,从而达到治疗大肠癌的作用。分子对接的结果与GO富集分析、通路富集分析结果一致,验证了网络药理学分析结果的正确性。
综上所述,本研究采用网络药理学方法发现小陷胸汤治疗大肠癌的机制与抑制肿瘤细胞增殖、促进细胞凋亡、影响细胞周期、导致细胞DNA损伤、抑制肿瘤血管生成和诱导细胞自噬等方面有关,并通过分子对接模拟了小陷胸汤活性分子与靶点结合的情况,其治疗作用多途径、多靶点的特点与中医治疗理论辨证论治不谋而合[46]。本研究为治疗大肠癌提供了新思路,为小陷胸汤治疗大肠癌的研究提供方向和参考依据,为小陷胸汤的新药研发提供了理论依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Sung H, Ferlay J, Siegel R L,. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]., 2021, 71(3): 209-249.
[2] 丁芮, 王翔, 周鹏, 等. 小陷胸汤中抗肿瘤作用有效成分及其机制研究进展 [J]. 中国实验方剂学杂志, 2020, 26(22): 186-192.
[3] 周蕾, 刘嘉湘. 刘嘉湘运用小陷胸汤治疗肿瘤相关症状举隅 [J]. 辽宁中医杂志, 2016, 43(3): 617-619.
[4] 周佳静, 贾英杰. 贾英杰教授运用小陷胸汤合苇茎汤治疗肺癌并发恶性胸腔积液经验举隅 [J]. 西部中医药, 2012, 25(4): 31-33.
[5] 郭麒, 喻嵘, 肖碧跃, 等. 国医大师熊继柏运用小陷胸汤合方治疗恶性肿瘤经验 [J]. 湖南中医药大学学报, 2020, 40(3): 271-273.
[6] Huang C, Wang X L, Qi F F,. Berberine inhibits epithelial-mesenchymal transition and promotes apoptosis of tumour-associated fibroblast-induced colonic epithelial cells through regulation of TGF-β signalling [J]., 2020, 14(1): 53-66.
[7] 王彬彬, 沈敏鹤, 吴良村. 吴良村应用小陷胸汤治疗胰腺癌经验 [J]. 中医杂志, 2018, 59(2): 108-110.
[8] 姚鹏宇, 刘芳, 吕翠霞. 陶汉华教授基于“气血水并调”理论运用小陷胸合四君子汤加减治疗肺癌经验 [J]. 西部中医药, 2021, 34(1): 37-40.
[9] 丁芮, 葛瑞瑞, 王恩宇, 等. 加味小陷胸汤水提物通过Wnt5a/Ca2+/NFAT信号通路抑制TGF-β1介导的人胃癌MGC-803细胞上皮-间质转化及侵袭迁移 [J]. 中国实验方剂学杂志, 2021, 27(4): 37-46.
[10] 牛明, 张斯琴, 张博, 等. 《网络药理学评价方法指南》解读[J]. 中草药, 2021, 52(14): 4119-4129.
[11] Ru J L, Li P, Wang J N,. TCMSP: A database of systems pharmacology for drug discovery from herbal medicines [J]., 2014, 6: 13.
[12] 罗静初. UniProt蛋白质数据库简介 [J]. 生物信息学, 2019, 17(3): 131-144.
[13] Safran M, Chalifa-Caspi V, Shmueli O,. Human gene-centric databases at the Weizmann institute of science: GeneCards, UDB, CroW 21 and HORDE [J]., 2003, 31(1): 142-146.
[14] Zhang Y, Li Y, Mao X,. Thyroid hormone synthesis: A potential target of a Chinese herbal formula Haizao Yuhu Decoction acting on iodine-deficient goiter [J]., 2016, 7(32): 51699-51712.
[15] 汝锦龙. 中药系统药理学数据库和分析平台的构建和应用 [D]. 杨凌: 西北农林科技大学, 2015.
[16] 董音汝, 莫云秋, 郑景辉, 等. 基于网络药理学分析小陷胸汤治疗动脉粥样硬化的作用机制 [J]. 中国新药杂志, 2020, 29(3): 335-342.
[17] 刘鑫馗, 吴嘉瑞, 张丹, 等. 基于网络药理学的生脉散作用机制分析 [J]. 中国实验方剂学杂志, 2017, 23(16): 219-226.
[18] 赵传祥, 袁观斗, 陈谦, 等. 丝氨酸苏氨酸激酶受体相关蛋白在肿瘤发生发展中的作用研究进展 [J]. 中华实验外科杂志, 2018(1): 171-175.
[19] 肖高春, 郑勇斌, 童仕伦, 等. 抑制磷脂酰肌醇3激酶/丝氨酸苏氨酸蛋白激酶和丝裂原细胞外信号调节激酶/细胞外信号调节激酶信号通路对结肠癌血管内皮细胞功能的影响 [J]. 中华实验外科杂志, 2015, 32(8): 1911-1914.
[20] Hu X J, Zheng W M, Luo Y Y,.polypeptides inhibit human colorectal cancer HT-29 cells growth via suppression of IGF-1R/Akt/mTOR signaling and ATP production [J]., 2020, 72(2): 260-272.
[21] 徐春梅, 张子亦, 陈羲, 等. 组蛋白去乙酰化酶抑制剂抗肿瘤作用研究进展 [J]. 中国现代应用药学, 2016, 33(4): 509-513.
[22] Qi F, Zhou J, Liu M. Microtubule-interfering agents, spindle defects, and interkinetochore tension [J]., 2020, 235(1): 26-30.
[23] Fang R, Pan R, Wang X T,. Inactivation of BRM/SMARCA2 sensitizes clear cell renal cell carcinoma to histone deacetylase complex inhibitors [J]., 2020, 216(4): 152867.
[24] 茆家定. MAPK信号转导通路在胃泌素调节大肠癌生长中的作用及其分子机制研究 [D]. 苏州: 苏州大学, 2013.
[25] 苏薇, 吴会超. 胃泌素及其受体拮抗剂对人胃癌细胞株MKN45中骨桥蛋白表达的影响 [J]. 中国老年学杂志, 2018, 38(20): 5005-5007.
[26] 曾怡, 周建奖, 谢渊, 等. 沉默胃泌素基因抑制胃癌细胞的增殖、迁移和侵袭 [J]. 中国生物化学与分子生物学报, 2014, 30(9): 905-911.
[27] Ferrand A, Sandrin M S, Shulkes A,. Expression of gastrin precursors by CD133-positive colorectal cancer cells is crucial for tumour growth [J]., 2009, 1793(3): 477-488.
[28] 刘骏, 周建奖, 赵艳, 等. 胃泌素促进胃癌细胞的迁移和侵袭 [J]. 中国病理生理杂志, 2013, 29(4): 730-733.
[29] 丁健, 于皆平, 李丹, 等. 促胃液素对结肠癌细胞侵袭力的影响 [J]. 中华肿瘤杂志, 2005, 27(4): 213-215.
[30] Li X L, Zhou J B, Chen Z R,. P53 mutations in colorectal cancer-molecular pathogenesis and pharmacological reactivation [J]., 2015, 21(1): 84-93.
[31] Xiong Y, Xiong Y J, Liu D Y,. Retracted: Pancratistatin inhibits the growth of colorectal cancer cells by inducing apoptosis, autophagy, and G2/M cell cycle arrest [J]., 2021, 27: e932346.
[32] Park Y L, Ha S Y, Park S Y,. Reversine induces cell cycle arrest and apoptosis via upregulation of the Fas and DR5 signaling pathways in human colorectal cancer cells [J]., 2019, 54(5): 1875-1883.
[33] Han C, Song Y, Lian C. MiR-769 inhibits colorectal cancer cell proliferation and invasion by targeting HEY1 [J]., 2018, 24: 9232-9239.
[34] Yue M, Li S Q, Yan G Q,. Paeoniflorin inhibits cell growth and induces cell cycle arrest through inhibition of FoxM1 in colorectal cancer cells [J]., 2018, 17(2): 240-249.
[35] Deorukhkar A, Ahuja N, Mercado A L,. Zerumbone increases oxidative stress in a thiol-dependent ROS-independent manner to increase DNA damage and sensitize colorectal cancer cells to radiation [J]., 2015, 4(2): 278-292.
[36] Chalouati H, Boutet E, Metais B,. DNA damage and oxidative stress induced at low doses by the fungicide hexachlorobenzene in human intestinal Caco-2 cells [J]., 2015, 25(6): 448-458.
[37] Fadlalla K, Watson A, Yehualaeshet T,.extract induces DNA damage pathways and blocks Akt activation to inhibit cancer cell proliferation and survival [J]., 2011, 31(1): 233-241.
[38] Rudolf E, John S, Cervinka M. Irinotecan induces senescence and apoptosis in colonic cells[J]., 2012, 214(1): 1-8.
[39] Rigatti M J, Verma R, Belinsky G S,. Pharmacological inhibition of Mdm2 triggers growth arrest and promotes DNA breakage in mouse colon tumors and human colon cancer cells [J]., 2012, 51(5): 363-378.
[40] Cayado-Gutiérrez N, Moncalero V L, Rosales E M,. Downregulation of Hsp27 (HSPB1) in MCF-7 human breast cancer cells induces upregulation of PTEN [J]., 2013, 18(2): 243-249.
[41] Thomas D D, Wink D A. NOS2 as an emergent player in progression of cancer [J]., 2017, 26(17): 963-965.
[42] 季鸣, 姚海平, 周洁, 等. 新型PARP1/2抑制剂YHP-743的抗肿瘤作用 [J]. 药学学报, 2018, 53(6): 938-943.
[43] Hu S M, Yao X H, Hao Y H,. 8‑Gingerol regulates colorectal cancer cell proliferation and migration through the EGFR/STAT/ERK pathway [J]., 2020, 56(1): 390-397.
[44] Guo F, Xue J. MicroRNA‑628‑5p inhibits cell proliferation and induces apoptosis in colorectal cancer through downregulating CCND1 expression levels [J]., 2020, 21(3): 1481-1490.
[45] Sabatino L, Fucci A, Pancione M,. UHRF1 coordinates peroxisome proliferator activated receptor gamma (PPARG) epigenetic silencing and mediates colorectal cancer progression [J]., 2012, 31(49): 5061-5072.
[46] 张海涛, 辛鹏飞, 冯文俊, 等. 基于网络药理学分析五味消毒饮治疗关节假体周围感染的作用机制 [J]. 中国组织工程研究, 2020, 24(36): 5843-5849.
Mechanism of Xiaoxianxiong Decoction on treating colorectal cancer based on network pharmacology
GAO Shi-yong1, 3, LI Wan-qiu1, 3, WANG Shuai1, 3, SHI Jia1, 3, TAN Hui-xin2
1. Drug Engineering and Technology Research Center, Harbin University of Commerce, Harbin 150076, China 2. Department of Pharmacy, The Fourth Affiliated Hospital of Harbin Medical University, Harbin 150001, China 3. Heilongjiang Provincial Key Laboratory of Tumor Prevention and Antitumor Drugs Research, Harbin 150076, China
To explore the mechanism of Xiaoxianxiong Decoction (小陷胸汤) on colorectal cancer by network pharmacology.The active components of Banxia (), Gualou () and Huanglian () in Xiaoxianxiong Decoction were collected and screened by TCMSP, and component-target network was constructed, GeneCards database was used to obtain colorectal cancer disease targets. Cytoscape software was used to identify the targets of Xiaoxianxiong Decoction in the treatment of colorectal cancer, and ClueGo was used to perform gene ontology (GO) and pathway enrichment analysis. Components and protein targets were docked by PyRx software to verify the accuracy.Thirty-two active components of Xiaoxianxiong Decoction in the treatment of colorectal cancer, 181 corresponding protein targets and 9329 colorectal cancer disease targets were screened. By target fishing, 360 Hub targets of Xiaoxianxiong Decoction were obtained. GO enrichment analysis showed the biological process (BP) of Xiaoxianxiong Decoction in the treatment of colorectal cancer was related to NAD-dependent histone deacetylase activity, negative regulation of helioase activity, regulation of deoxyribonuclease activity, response to cholecystokinin, regulation of protein neddylation and so on. Molecular function (MF) was related to protein serine/threonine kinase activity, regulation of protein serine/threonine kinase activity, adenosine-triphosphate(ATP) binding, regulation of cysteine-type endopeptidase activity involved in apoptotic process and sequence-specific double-stranded DNA binding. Cellular component (CC) was related to spindle microtubule, histone deacetylase complex, nuclear nucleosome and ESC/E(Z) complex. The enrichment analysis of signal pathways showed that they were related with gastrain signaling pathway, cell cycle pathway, hepatitis B infection pathway and DNA damage response pathway. Molecular docking results showed that the active components screened from Xiaoxianxiong Decoction had good binding ability to the corresponding protein targets.Xiaoxianxiong Decoction can treat colorectal cancer by regulating gastrain signaling pathway, cell cycle pathway, hepatitis B infection pathway and DNA damage response pathway.
Xiaoxianxiong Decoction; network pharmacology; colorectal cancer; gastrain signaling pathway; cell cycle pathway; hepatitis B infection pathway; DNA damage response pathway
R285.5
A
0253 - 2670(2022)03 - 0773 - 10
10.7501/j.issn.0253-2670.2022.03.017
2021-11-03
黑龙江省自然科学基金资助项目(LH2021H002);2021年哈尔滨商业大学教师“创新”项目支持计划项目(LH2021H002);中央支持地方高校改革发展基金优秀青年人才项目(2020YQ12);黑龙江省卫生计生委科技计划(2017-132);黑龙江省教育厅面上项目(12541571)
高世勇,男,教授,博士(后),博士生导师,从事中药抗肿瘤药理研究。E-mail: sygao2002@163.com
谭慧心,女,副主任药师,从事中药抗肿瘤药理研究。E-mail: thxydsy@163.com
[责任编辑 李亚楠]

