紫龙金片联合铂类治疗肺癌的有效性和安全性的Meta分析
董玉梅,郭丽云,祁月潇,宋海侠,蔡雅琴,魏世鸿
紫龙金片联合铂类治疗肺癌的有效性和安全性的Meta分析
董玉梅,郭丽云,祁月潇,宋海侠,蔡雅琴,魏世鸿*
甘肃省肿瘤医院 放疗科二病区,甘肃 兰州 730050
根据现有临床资料系统评价紫龙金片辅助铂类为基础的化疗方案治疗肺癌的疗效和安全性。计算机检索中国知网(CNKI)、维普(VIP)、中国生物医学文献数据库(CBM)、万方医学网(Wanfang)、中国临床试验注册中心、PubMed、Cochrane Library、EmBase等数据库,检索时限从建库起至2021年5月,根据预先制定的纳排标准,纳入所有紫龙金片联合铂类为基础的化疗方案治疗肺癌的随机对照试验(randomized controlled trial,RCT),由2名研究人员独立筛选文献、提取数据,并参照Cochrane Reviewers 5.1手册对文献进行方法学质量评价,采用RevMan 5.3软件进行Meta分析,并对发表偏倚进行检验。最终纳入14篇文献,1026例肺癌患者,其中试验组513例,对照组513例。Meta分析结果显示,紫龙金片联合双药化疗能提高肿瘤的客观缓解率 [RR=1.55,95% CI (1.29,1.87),<0.000 01]、疾病控制率 [RR=1.20,95% CI (1.12,1.29),<0.000 01] 及生存质量[RR=1.87,95% CI (1.52,2.30),<0.000 01];减轻对白细胞、血红蛋白及血小板的抑制[RR=0.66,95% CI (0.58,0.76),<0.000 01;RR=0.62,95% CI (0.53,0.72),<0.000 01;RR=0.57,95% CI (0.46,0.71),<0.000 01]。但对肝功能、肾功能无明显改善[RR=0.69,95% CI (0.40,1.19),=0.18;RR=0.46,95% CI (0.20,1.08),=0.07]。紫龙金片联合铂类化疗药物治疗肺癌,可以提高近期疗效,改善生活质量,减少部分不良反应的发生,紫龙金片联合铂类在肺癌的治疗中是可选方案。但是受纳入研究的样本量、质量及发表性偏倚等诸多因素影响,致使该研究的结果证据质量较低,故在运用该结论时需谨慎。
紫龙金片;肺癌;化疗;有效性;安全性;Meta分析
肺癌是呼吸系统最常见的恶性肿瘤之一,也是全球发病率和死亡率名列前茅的恶性肿瘤之一,尽管2020年全球癌症统计,肺癌的发病率退居第2位,但其死亡率仍然位居首位[1],其给患者和社会带来的经济负担也是巨大的,在我国也面临着同样的窘境。根据国家癌症登记处的最新数据,肺癌仍然是中国发病率和死亡率最高的癌症[2]。而年龄标化发病率城市高于农村(191.6/10万179.2/10万),年龄标化死亡率农村高于城市(110.3/10万102.5/10万)[2-3]。肺癌的传统治疗包括手术、化疗及放疗等,近10年来,随着分子靶向治疗[4-6]及免疫治疗[7-9]在临床上取得了巨大的成功,改变了肺癌的治疗模式,但化疗在肺癌的治疗中仍然占有非常重要的地位。随着我国社会人口的老龄化,近年来,我国恶性肿瘤发病率持续上升,但年龄标化发病率似乎趋于平稳,说明人口老龄化是我国癌症发病率上升的主要原因之一。最新的癌症统计报告显示,中国癌症的发病率与年龄密切相关[2-3]。临床上大多数肺癌患者就诊时已是中晚期,失去手术治疗机会;而一部分患者由于没有基因突变或不能接受免疫治疗,化疗仍然是肺癌治疗的首选。肺癌化疗的方案仍然以顺铂或卡铂联合依托泊苷、紫杉醇、多西他赛、白蛋白紫杉醇、培美曲赛、吉西他滨及伊立替康等药物为主,铂类在肺癌治疗中的地位不可撼动。但是中晚期肺癌由于疾病本身出现的症状及化疗药物导致的严重不良反应使患者的依存性及耐受性降低,甚至放弃治疗。大量的临床研究表明,中医药联合化疗在增强抗肿瘤疗效的同时可增强机体的免疫功能[10]。紫龙金片是由黄芪、当归、白英、龙葵、丹参、半枝莲、蛇莓、郁金等多种中药组成的复方药物[11],近年来,多项研究表明紫龙金片具有抗肿瘤、提高肿瘤患者生活质量、减轻化疗不良反应等作用[12]。但紫龙金片辅助铂类为主的化疗,其有效性和安全性方面的研究较少,因此本研究采用Meta分析,旨在评价紫龙金片联合铂类为基础的化疗在肺癌治疗中的有效性及安全性,以期为紫龙金片的临床应用提供证据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 国内外公开发表的关于紫龙金片联合铂类治疗肺癌的相关随机对照试验(randomized controlled trial,RCT),不限是否使用盲法。
1.1.2 研究对象 纳入研究的受试者均为病理(组织学或细胞学)诊断明确的肺癌患者,病理类型、分期、年龄、性别、种族、国籍均不限。
1.1.3 干预措施 紫龙金片联合铂类化疗组为试验组,铂类化疗联合与不联合安慰剂组为对照组。
1.1.4 观察指标 包括客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)、卡氏活动状况(Karnofsky performance status,KPS)评分、不良反应及细胞免疫功能。(1)有效率:根据世界卫生组织(WHO)实体瘤疗效评定标准[13]判定为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾病稳定(stabilization of disease,SD)和疾病进展(progression of disease,PD);其中,ORR=(CR例数+PR例数)/总例数;DCR=(CR例数+PR例数+SD例数)/总例数。(2)患者生活质量状态:参考KPS评分[14],疗程结束后较治疗前评分增加大于10分者为提高,减少大于或等于10分者为降低,增加或减少不及10分者为稳定。生存质量改善率=治疗后KPS评分增加>10分的例数/总例数。(3)安全性指标:根据不良事件通用术语标准CTCAE 4.0[15]进行评估,包括骨髓抑制(白细胞、血红蛋白、血小板)、肝功能及肾功能。其中疗效是主要观察指标。
1.2 排除标准
以下情况之一的即可排除:研究类型没有明确交代;无法从文献中提取出有效的结局指标;重复文献;无法获取全文;样本量太小;观察组除在对照组的基础上口服紫龙金片外,还联合使用了其他药物治疗;对照组除采用常见化疗方法还联合其他治疗(如同步放化疗、联合免疫治疗、联合靶向治疗、联合中药等治疗方法)。
1.3 检索策略
计算机检索中文数据库:中国知网(CNKI)、维普(VIP)、中国生物医学文献数据库(CBM)、万方医学网、中国临床试验注册中心;外文数据库:PubMed、Cochrane Library、EmBase。各数据库检索事件均从建库至2021年5月。中文检索词包括“紫龙金”“肿瘤”“癌症”“随机对照”“随机对照试验”等;英文检索词为“zilongjin”“neoplasm”“tumors”“RCT”。均采用主题词和自由词相结合的方式进行检索。
1.4 资料提取
由2名研究员根据预先制定的纳入和排除标准独立筛选文献,对纳入的文献使用Excel表格进行资料提取、质量评价并交叉核对,如有分歧,通过讨论或请第3位研究者进行裁决。通过NoteExpress软件剔除重复文献,接下来通过阅读题名和摘要进行初筛,排除明显不符合纳入标准的文献后,对可能符合纳入标准的文献进一步阅读全文进行筛选;使用Excel表格进行资料提取,具体提取内容主要包括文献作者、发表年份、肿瘤类型、试验方法、治疗组及对照组的例数、干预措施、治疗周期及结局指标等。
1.5 质量评价
文献质量评价通过RevMan 5.3软件中Cochrane Handbook for Systematic Review of Interventions 5.3对RCT的7条偏倚风险评价工具进行评价,评价指标包括:①随机分配方法;②分配方案隐藏;③采用盲法(针对研究者和受试者);④采用盲法(针对结果的评价者);⑤结果数据的完整性;⑥选择性报道研究结果;⑦其他偏倚来源。针对每一项研究结果,对上述7项指标进行“高风险”“低风险”和“不清楚”的判断。
1.6 统计学分析
采用RevMan 5.3软件进行Meta分析。二分类数据指标的效应值采用相对危险度(relative risk,RR)来表示;连续型变量的效应指标,若所有研究的结局测量值是基于同样的度量单位得到的则用均数差(mean difference,MD),若所有研究都评估了同样的结局但按不同的方法进行测量时用标准化均数差(standardized mean difference,SMD)。2种结局指标的合成结果均以效应值及其95%可信区间(confidenceinterval,CI)表示。采用检验和值分析各研究间的异质性,并用2来表示异质性的大小:若≥0.1,2≤50%时,则表示纳入各研究之间无异质性,采用固定效应模型分析;若<0.1,2>50%,则表示存在异质性;若存在异质性,首先需分析异质性产生的原因,先去除异质性研究,再进行敏感性分析。若未找出临床和方法学异质性,可进行合并,采用随机效应模型进行分析。
2 结果
2.1 文献检索
初步检索出43篇相关文献。按照纳入、排除标准,通过阅读文献题名、摘要、全文,排除重复研究、细胞及动物实验、综述及研究内容不吻合的文献等,最后纳入符合标准的RCTs 14篇,全部为中文文献,见图1。纳入研究的基本信息见表1。
2.2 纳入研究的质量评价结果
在纳入的14项研究中,2项研究采用了随机双盲法[19,23],是高质量研究;1项研究采用了随机数字表法[22];1项研究采用了简单随机法[16];其余研究只提到了随机,未报告具体随机方法[11,17-18,20-21,24-28];14项研究的结局指标均完整[11,16-28]。纳入研究的偏倚风险评估情况见图2、3。
2.3 Meta分析
2.3.1 ORR 11项研究(791例患者)报道了ORR[11,16-17,19-23,25,27-28],首先经过异质性检验,2=54%<50%,且检验的=0.02<0.1,提示选择的研究之间的异质性具有统计学意义,需要查找异质性原因。对11篇文献进行敏感性分析,发现丁勇敏等[16]的研究对异质性影响较大,去掉该研究之后再次进行异质性检验,结果显示余下的10篇文献不存异质性(2=0<50%,=0.74>0.1);排除之后,用固定效应模型进行Meta分析。Meta分析结果显示,试验组患者ORR明显高于对照组,差异有统计学意义[RR=1.55,95% CI (1.29,1.87),=4.73,<0.000 01]。ORR森林图见图4。
2.3.2 DCR 11项研究(791例患者)报道了DCR[11,16-17,19-23,25,27-28],首先经过异质性检验,2=47%,且检验的=0.04<0.1,提示本次研究选择的文献之间具有异质性,需要查找异质性原因。对11篇文献进行敏感性分析,发现丁勇敏等[16]的研究对异质性影响较大,去掉该研究之后再次进行异质性检验,结果显示余下的10篇文献不存异质性(2=29%<50%,=0.18>0.1),用固定效应模型进行Meta分析。Meta分析结果显示,试验组患者DCR明显高于对照组,差异有统计学意义[RR=1.20,95% CI (1.12,1.29),=5.01,<0.000 01]。DCR森林图见图5。
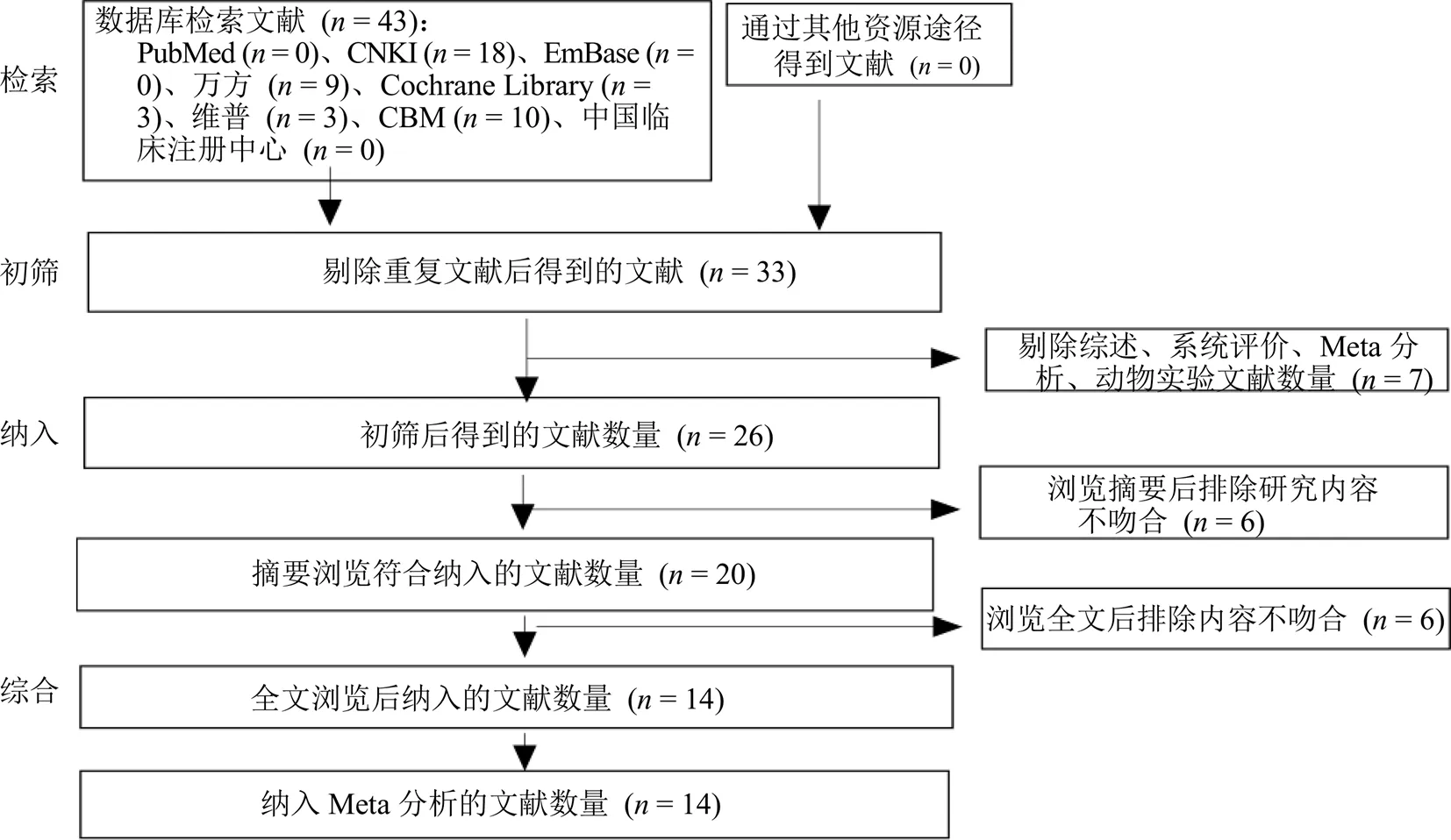
图1 文献检索流程
表1 纳入研究基本信息
Table 1 Basic information of included research
纳入研究第一作者及年份肿瘤类型试验方法n/例干预措施干预周期结局指标试验组对照组试验组对照组 陈春荣2011[11]NSCLC随机2523紫龙金片+多西他赛+顺铂多西他赛+顺铂2(1)(2)(3)(4)(5)(8)(9)(10) 丁勇敏2013[16]SCLC简单随机法2022紫龙金片+伊立替康+卡铂伊立替康+卡铂2(1)(2)(3)(8)(9) 李广生2015[17]NSCLC随机3939紫龙金片+多西他赛+奈达铂多西他赛+奈达铂2(1)(3)(4)(5)(6)(7)(8)(13)(14)(15) 李鹤飞2015[18]NSCLC随机4040紫龙金片+吉西他滨+顺铂吉西他滨+顺铂2(2)(3)(4)(5)(8)(11) 马惠文2017[19]NSCLC随机双盲法3939紫龙金片+吉西他滨+顺铂安慰剂+吉西他滨+顺铂2(1)(2)(3)(4)(5)(6)(7)(8)(9)(11)(12)(13)(14)(15) 尚瑞国2016[20]NSCLC随机3030紫龙金片+多西他赛+顺铂多西他赛+顺铂4(1)(3)(5)(8) 申婷2017[21]NSCLC随机4343紫龙金片+紫杉醇+顺铂紫杉醇+顺铂4(1)(3)(4)(5)(8) 孙彩萍2015[22]NSCLC随机数表法6464紫龙金片+紫杉醇+奈达铂紫杉醇+奈达铂2(1)(2)(13)(14)(15) 汪江2008[23]NSCLC随机双盲法3231紫龙金片+长春新碱+顺铂(或长春地辛+丝裂霉素+顺铂)安慰剂+长春新碱+顺铂(或长春地辛+丝裂霉素+顺铂)2(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)(13)(14)(15) 吴鸿彬2006[24]NSCLC随机3030紫龙金片+长春地辛+丝裂霉素+顺铂长春地辛+丝裂霉素+顺铂—(2)(8)(9)(10)(11) 吴敏信2019[25]NSCLC随机2525紫龙金片+吉西他滨+顺铂吉西他滨+顺铂2(1)(5)(8)(9)(13) 杨小纯2017[26]NSCLC随机2627紫龙金片+紫杉醇+卡铂紫杉醇+卡铂—(2)(3)(4)(8) 易辉煌2014[27]NSCLC随机6060紫龙金片+多西他赛+顺铂多西他赛+顺铂2(1)(3)(4)(5)(6)(8)(11) 于法明2018[28]NSCLC随机4040紫龙金片+吉西他滨+顺铂吉西他滨+顺铂1(1)(2)(3)(4)(5)(8)(9)
SCLC-小细胞肺癌 NSCLC-非小细胞肺癌 (1)有效率 (2)生活质量评分 (3)白细胞毒性 (4)血红蛋白毒性 (5)血小板毒性 (6)肝功能 (7)肾功能 (8)恶心呕吐(9)腹泻 (10)便秘 (11)脱发 (12)心律失常 (13)CD4 (14)CD8 (15)CD4/CD8
SCLC-small cell lung cancer NSCLC-non-small cell lung cancer (1)effective rate (2)quality of life score (3)leukotoxicity (4)hemoglobin toxicity (5)platelet toxicity (6)liver function (7)renal function (8)nausea and vomiting (9)diarrhea (10)constipation (11)alopecia (12)arrhythmia (13)CD4 (14)CD8 (15)CD4/CD8
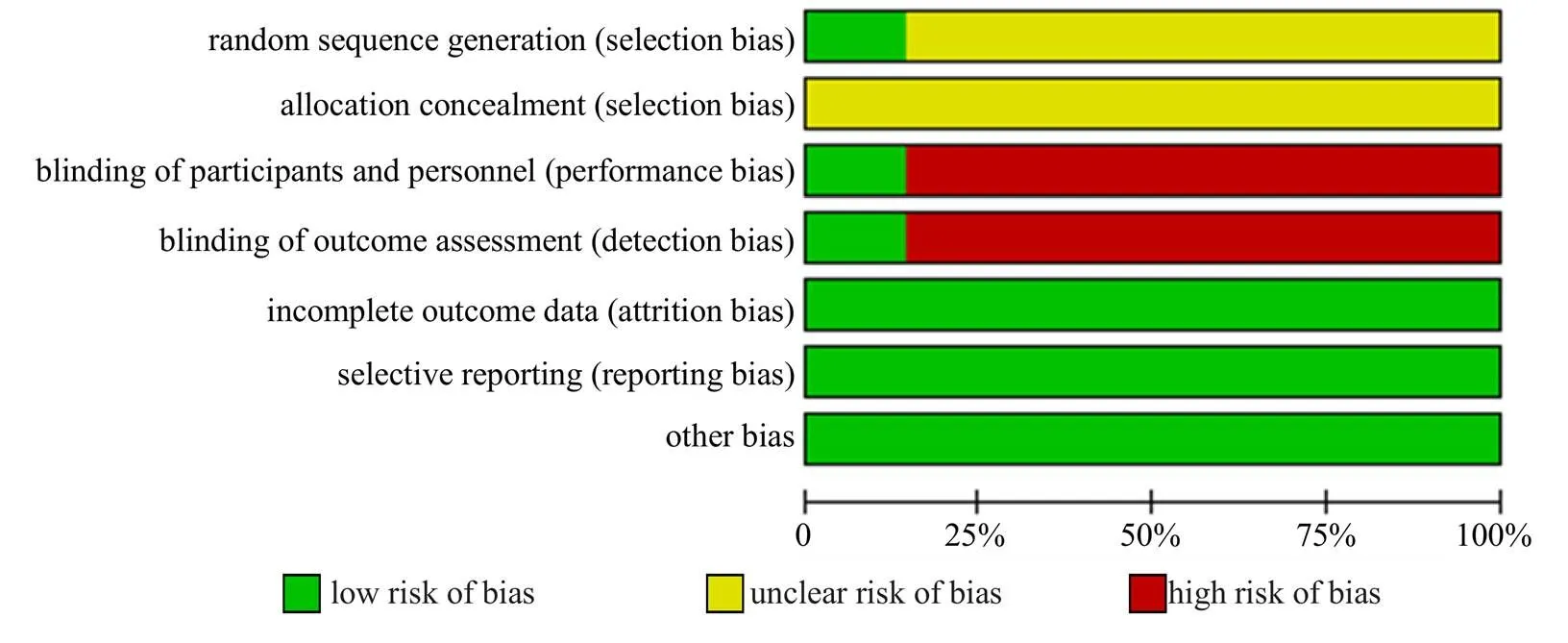
图2 纳入研究偏倚风险
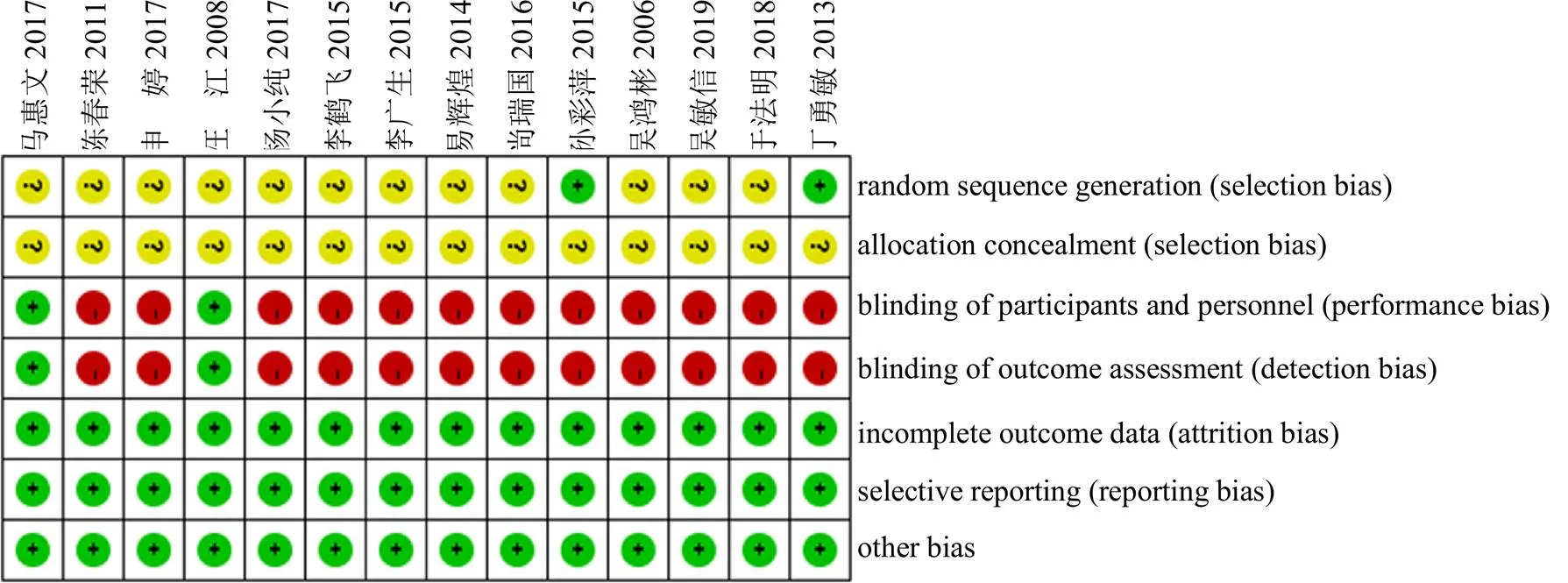
图3 纳入研究个体风险偏倚
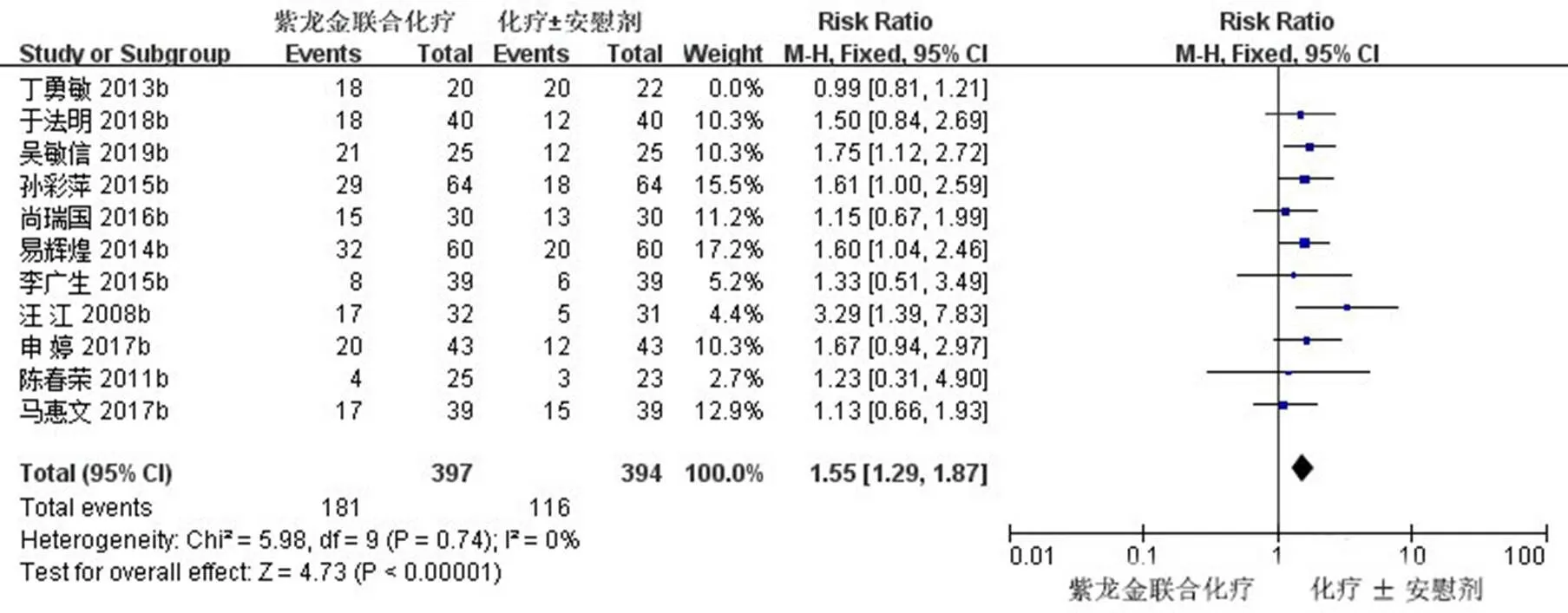
图4 紫龙金片联合铂类治疗肺癌的ORR森林图
2.3.3 生活质量改善率 9项研究(572例)报道了KPS评分[11,16,18-19,22-24,26,28],对试验组和对照组治疗前后KPS评分改善的患者做Meta分析,经异质性检验,2=60%,且检验的=0.01,提示各研究之间具有异质性,需要查找异质性原因。对9篇文献进行敏感性分析,发现吴鸿彬等[24]的研究对异质性影响较大,去除该研究之后再次进行异质性检验,结果显示余下的8篇文献不存在异质性(2=29%<50%,=0.20>0.1),排除之后,用固定效应模型进行Meta分析。Meta分析结果显示,试验组患者生活质量评分明显高于对照组,差异有统计学意义[RR=1.87,95% CI (1.52,2.3),=5.89,<0.000 01],生活质量改善率森林图见图6。
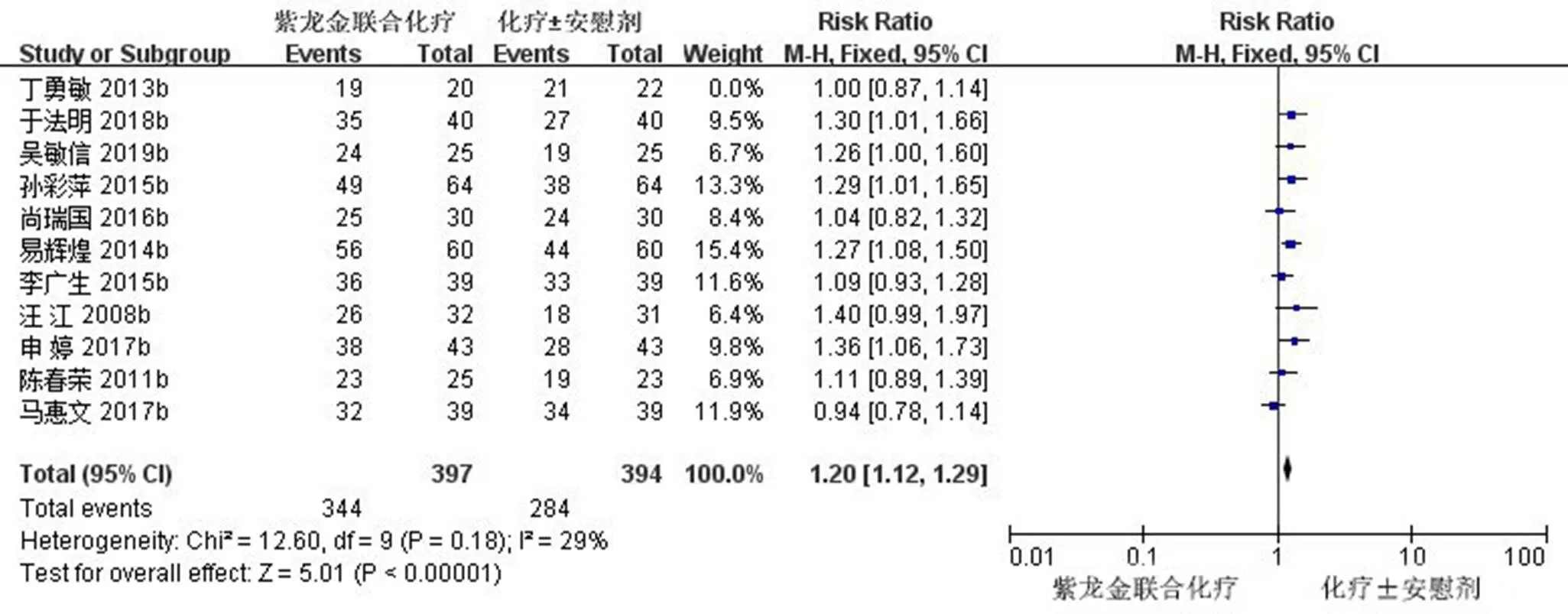
图5 紫龙金片联合铂类治疗肺癌的DCR森林图
2.3.4 安全性指标 11项研究(557例)报道了白细胞数指标[11,16-21,23,26-28],对试验组和对照组白细胞计数做Meta分析,经异质性检验,2=68%,且检验的=0.005,提示各研究之间具有异质性。对11篇文献进行敏感性分析,发现汪江等[23]、易辉煌等[27]和陈春荣等[11]的研究对异质性影响较大,去除这3项研究之后再次进行异质性检验,结果显示余下的8篇文献不存异质性(2=37%<50%,=0.13>0.1),用固定效应模型进行Meta分析。Meta分析结果显示,试验组患者白细胞数明显高于对照组,差异有统计学意义[RR=0.68,95% CI (0.59,0.79),=5.27,<0.000 01]。见图7。
9项研究(686例)报道了血红蛋白指标[11,17-19,21,23,26-28],经异质性检验,2=26%<50%,且检验的=0.22>0.1,提示各研究之间没有异质性,Meta分析结果显示,试验组患者血红蛋白明显高于对照组,差异有统计学意义[RR=0.62,95% CI (0.53,0.72),=5.98,<0.000 01]。见图7。
10项研究(743例)报道了血小板指标[11,17-21,23,25,27-28],经异质性检验,2=17%<50%,且检验的=0.29>0.1,提示各研究之间没有异质性,Meta分析结果显示,试验组患者血小板明显高于对照组,差异有统计学意义[RR=0.57,95% CI (0.46,0.71),=4.95,<0.000 01]。见图7。
4项研究(339例)报到了肝功能指标[17,19,23,27],经异质性检验,2=0<50%,且检验的=1.0>0.1,提示各研究之间没有异质性,Meta分析结果显示,试验组患者肝功能与对照组之间差异无统计学意义[RR=0.69,95% CI (0.40,1.19),=1.34,=0.18]。见图7。
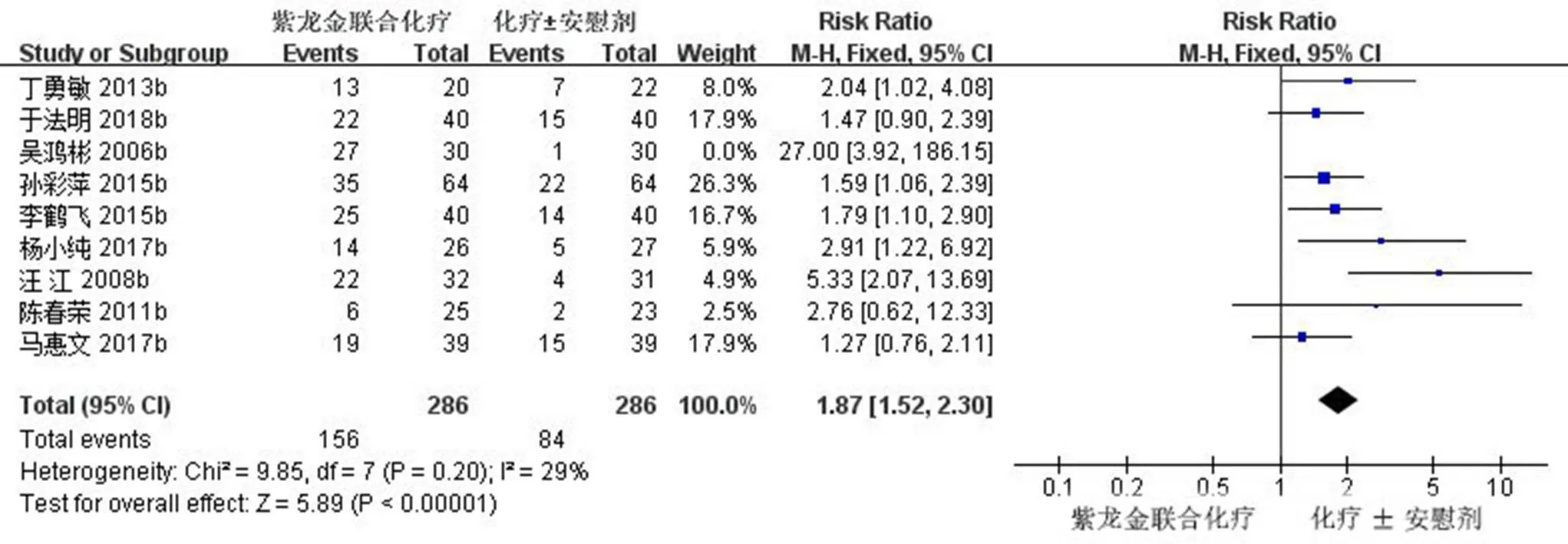
图6 紫龙金片联合铂类治疗肺癌的生活质量改善率森林图
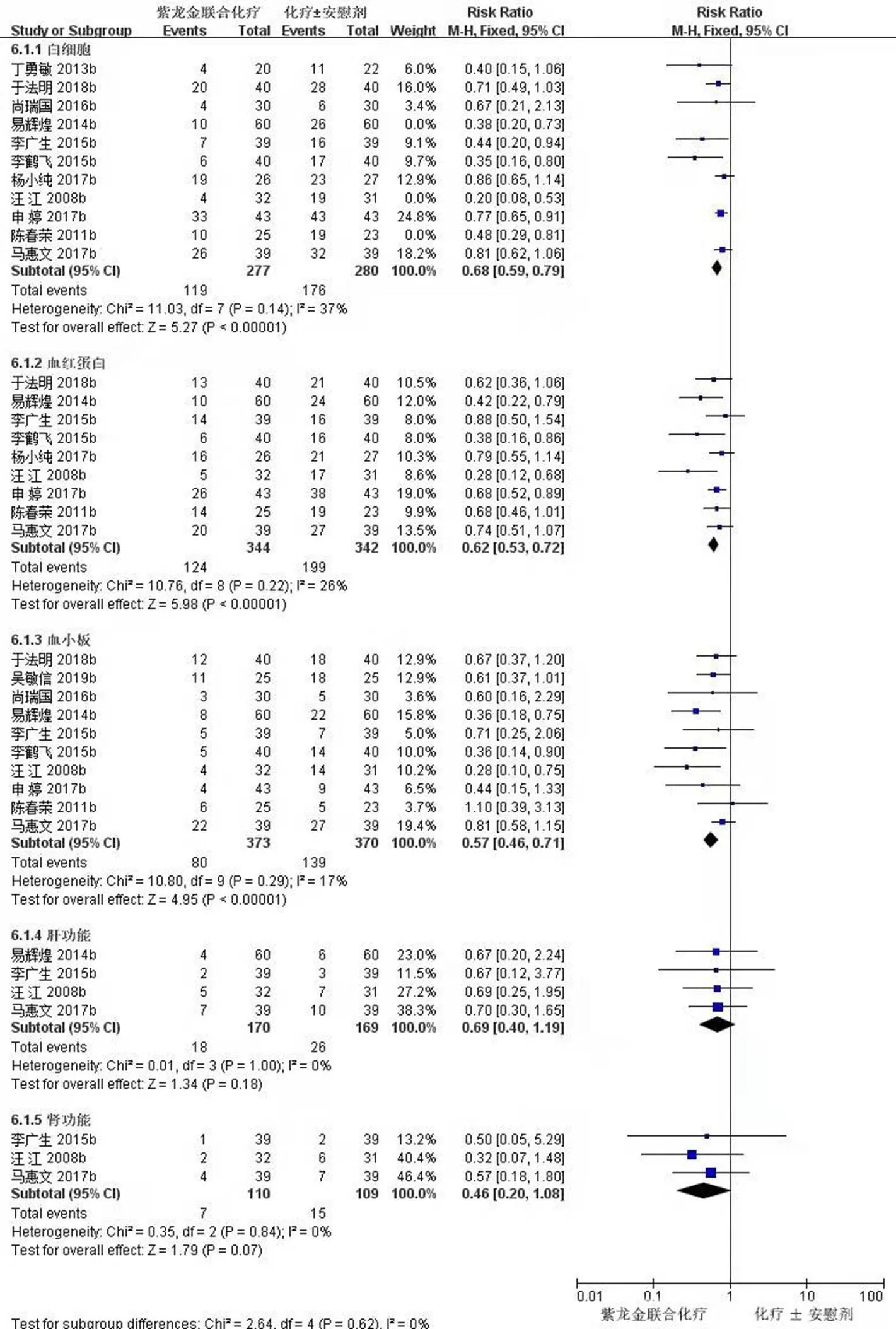
图7 紫龙金片联合铂类治疗肺癌安全性指标Meta森林图
3项研究(219例)报道了肾功能指标[17,19,23],经异质性检验,2=17%<50%,且检验的=0.84>0.1,提示各研究之间没有异质性,Meta分析结果显示,试验组患者肾功能与对照组比较差异无统计学意义[RR=0.46,95% CI (0.20,1.08),=1.79,<0.07]。见图7。
2.3.5 ORR亚组分析 对ORR进行亚组分析,完成2个周期治疗的9项研究(645例)[11,16-17,19,22-23,25,27-28],经异质性检验及敏感性分析后,2=0<50%,且检验的=0.69>0.1,提示各研究之间没有异质性,Meta分析结果显示,2周期治疗后,试验组患者ORR与对照组比较差异有统计学意义[RR=1.60,95% CI (1.30,1.96),=4.45,<0.000 01];完成4个周期治疗的2项研究(146例)[20-21],经异质性检验及敏感性分析后,2=0<50%,且检验的=0.36>0.1,提示2研究之间没有异质性,Meta分析结果显示,4周期治疗后,试验组患者ORR与对照组比较差异无统计学意义[RR=1.40,95% CI (0.94,2.08),=1.66,=0.1]。见图8。
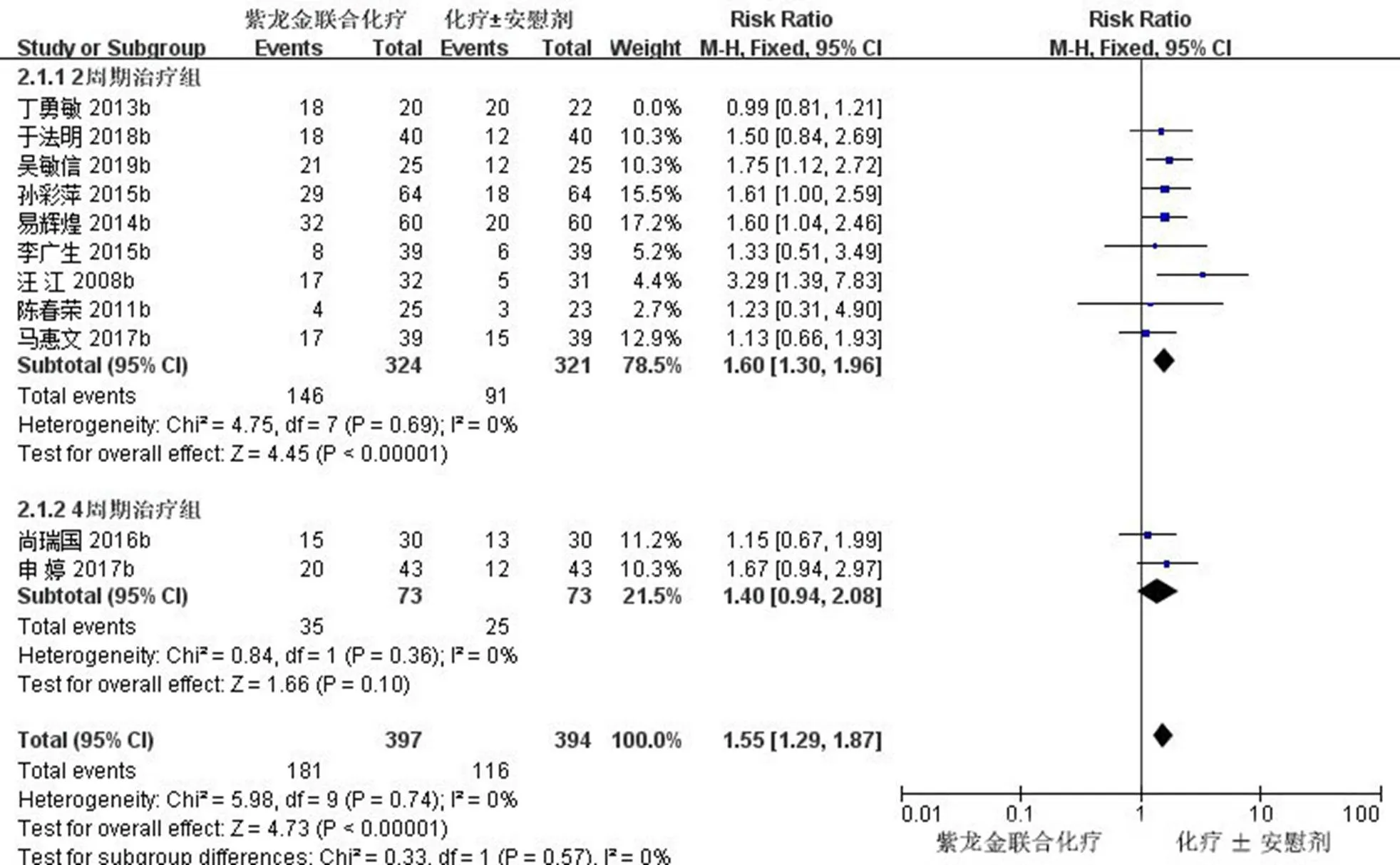
图8 ORR亚组分析的森林图
2.3.6 DCR亚组分析 对DCR进一步进行亚组分析,完成2个周期治疗的9项研究(645例)[11,16-17,19,22-23,25,27-28],经异质性检验及敏感性分析后,2=31%<50%,且检验的=0.18>0.1,提示各研究之间没有异质性,Meta分析结果显示,2周期治疗后,试验组患者DCR与对照组比较差异有统计学意义[RR=1.20,95% CI (1.11,1.30),=4.51,<0.000 01];完成4个周期治疗的2项研究(146例)[20-21],经异质性检验分析后,2=57%>50%,且检验的=0.18>0.1,提示各研究之间存在轻度异质性,但可以接受,Meta分析结果显示,4周期治疗后,试验组患者DCR与对照组比较差异有统计学意义[RR=1.21,95% CI (1.02,1.44),=2.17,=0.03]。见图9。
2.4 偏倚分析
选取ORR、DCR为指标绘制漏斗图,观察纳入的研究是否存在发表偏倚。若漏斗图对称,则认为偏倚较小;若不对称,则可能存在发表偏倚[29]。结果显示ORR的漏斗图基本对称,提示纳入的研究存在发表偏倚的可能性较小;DCR的漏斗图中显示不对称,提示纳入的研究存在一定的发表偏倚,结果见图10。进一步亚组分析显示,ORR、DCR的漏斗图,在4周期组存在明显的不对称,提示纳入的研究存在一定的发表偏倚,结果见图11。
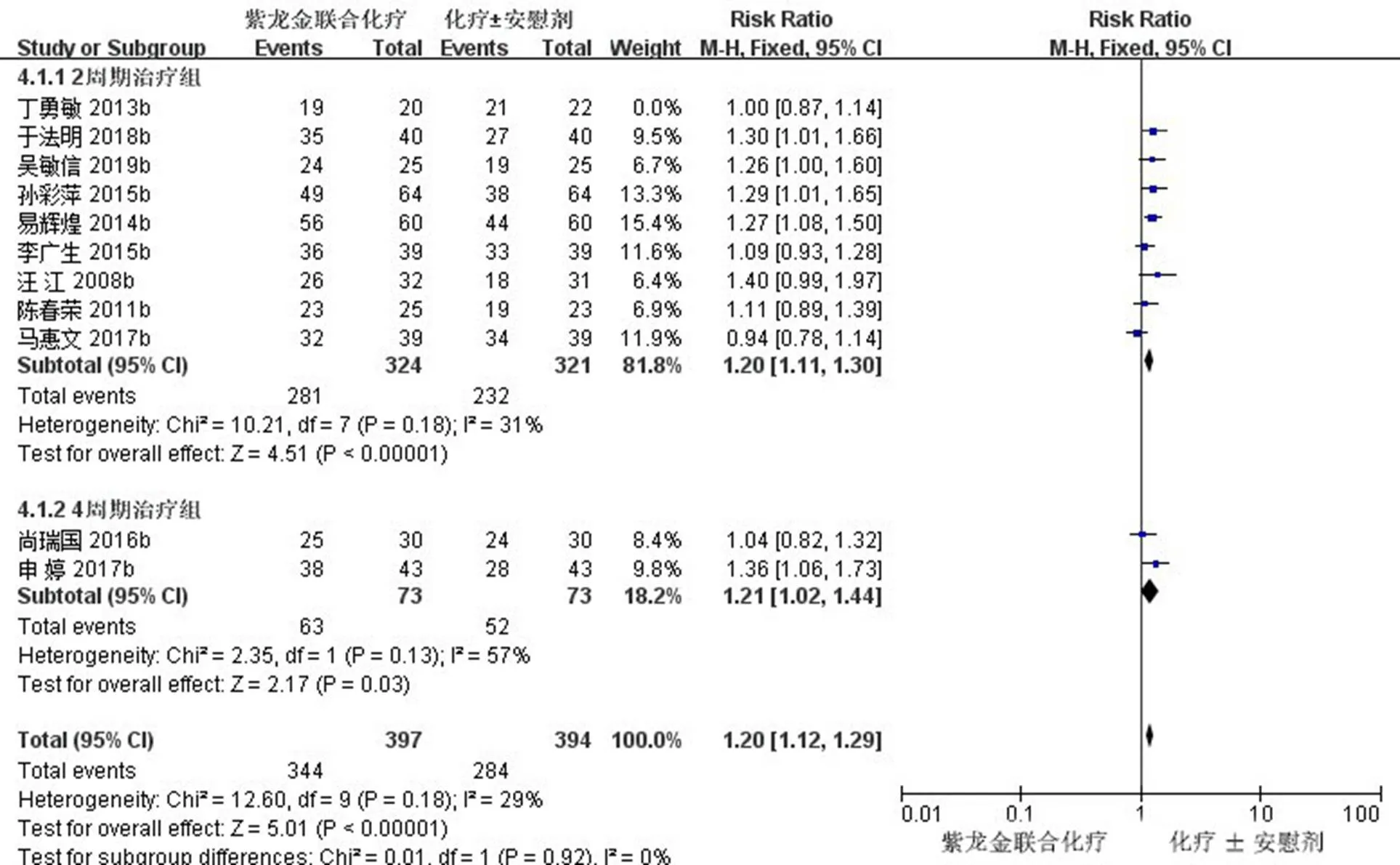
图9 DCR亚组分析的Meta森林图
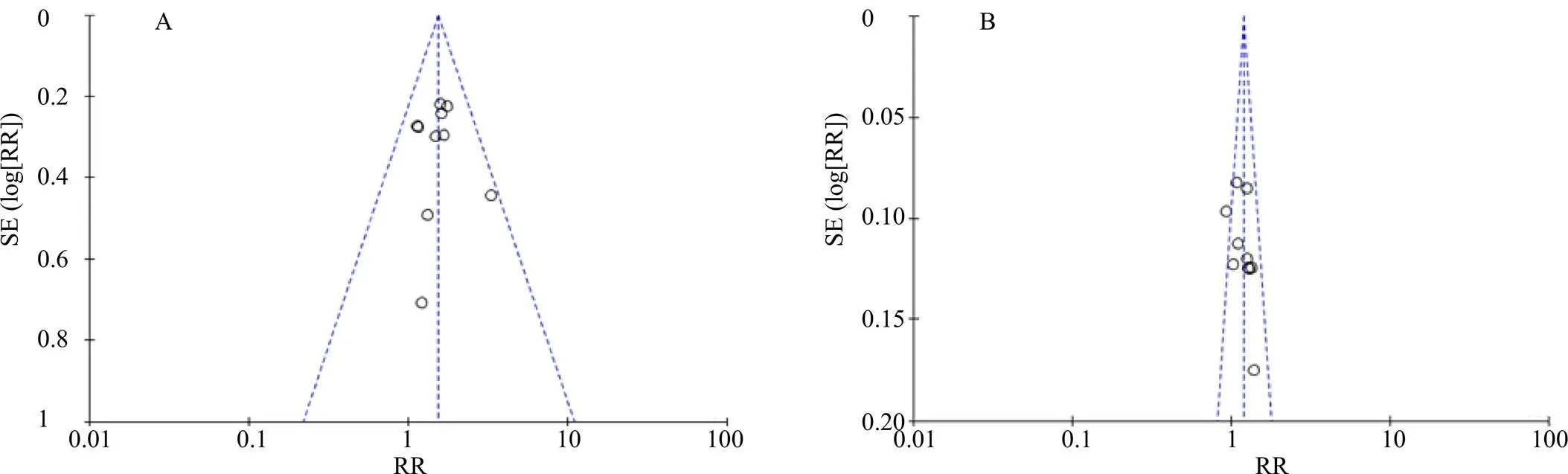
图10 ORR (A) 和DCR (B) 的漏斗图
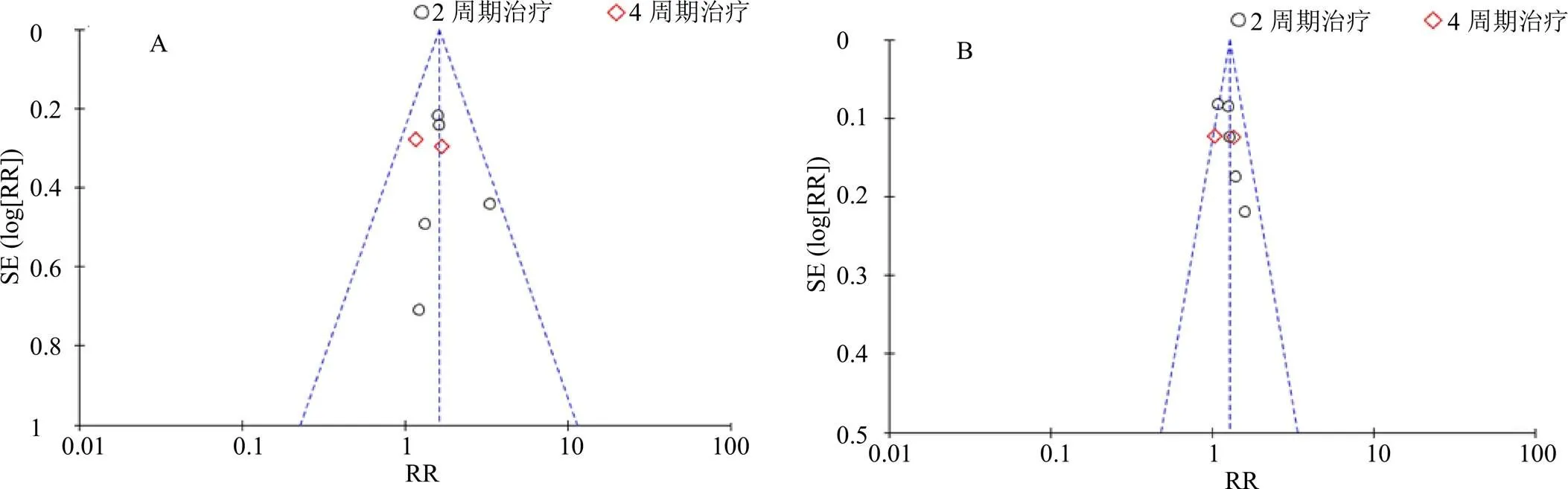
图11 ORR (A) 和DCR (B) 亚组分析的漏斗图
3 讨论
肺癌目前仍然是全球死亡率第一的恶性肿瘤[1],在中国,肺癌的发病率和死亡率仍位居首位[2]。癌症治疗带来的经济负担是不言而喻的。肺癌是男性最常见的癌症,而女性最常见的是乳腺癌[2]。由于我国东、中、西部地区在自然生态环境、经济水平、公共服务、生活方式和疾病危险因素等方面存在较大差异,恶性肿瘤的发病率和死亡率存在区域性差异。最新的研究表明,恶性肿瘤的发病率随着我国东部地区向西部地区的转移而由高到低下降,但不同地区的年龄标准化发病率相似,恶性肿瘤的死亡率也随着从东部迁移到西部地区,调整人口结构后,中部地区死亡率高于东部和西部地区[2]。肺癌的治疗包括手术切除、放疗、化疗、分子靶向治疗以及免疫治疗等。近10年来,随着肺癌治疗模式的改变[4-9],肺癌的5年生存率有所提高。2021年美国临床肿瘤学会公布了PACIFIC研究的结果,证实在III期不可切除非小细胞肺癌(non-small cell lung cancer,NSCLC)同步放化疗后度伐利尤单抗维持治疗组42.9%的患者总生存超过了5年,且1/3的患者5年仍处于无进展生存状态[30]。尽管如此,化疗仍然是肺癌治疗的基本手段,化疗可以与免疫治疗、靶向治疗联合,而同步放化疗更是不可手术切除的NSCLC和局限期小细胞肺癌的标准治疗模式[31-33]。但是,研究表明,70%的肺癌患者初诊时已是III期或IV期[34]。另外,随着我国社会进入老龄化,0~40岁年龄肿瘤发病率相对较低,然后随着年龄增长迅速升高,80~84岁达到高峰,之后略有下降[2-3],增加了肺癌治疗的难度及深度。对于不能接受局部治疗,不能接受免疫或靶向治疗的患者,化疗成了唯一的选择。尽管功能强大的止吐药物、骨髓抑制后的升白细胞、升血小板药物保证了化疗的按时、足量进行,但是治疗期间产生的呕吐、便秘、腹泻、乏力、纳差等不良反应带给患者深刻的伤害记忆,影响其后续对治疗的耐受和依存性,甚至放弃治疗。大量研究表明,中医药作为我国的国粹,在肿瘤治疗方面存在着独特的优势。临床上常见的康莱特、华蟾素、鸦胆子油、紫龙金片等中医药在抗肿瘤的同时,可以减轻化疗药物带来的不良反应[25,35]。基础研究表明,紫龙金片可通过激活细胞凋亡途径,降低P-糖蛋白表达而拮抗肿瘤细胞的多药耐药性[36]。铂类药物为基础的化疗方案,是治疗肿瘤的一线方案,肺癌治疗中常用的铂类主要是顺铂、卡铂和奈达铂;然而,常规铂类化疗常伴有不良反应,一般包括骨髓抑制、肾毒性、神经毒性、胃肠道反应、过敏反应和血细胞减少(包括白细胞减少和中性粒细胞减少、血小板减少和贫血)[37-38];同时,产生的耐药性严重降低了其疗效,限制了其临床应用价值[36,39],因此,迫切需要开发新的治疗方案。在大量的临床实践中,中成药紫龙金片联合化疗可提高患者的近期疗效和远期疗效,同时可改善生活质量,减轻部分不良反应[12]。
中医认为肺癌多是由于正气内虚、邪毒外侵引起来的,以痰浊内聚,气滞血瘀,蕴结于肺,以致肺失宣泄与肃降为基本病机。自古以来,我国的中医典籍《素问·奇病论》《灵枢·邪气脏腑病形》《素问·玉机真藏论》《难经·论五脏积病》《景岳全书·虚损》等对肺癌的临床症状及预后都有广泛的研究,对肺癌的发病及治疗具有重要的作用。紫龙金片是列入了国家医保目录的乙类处方中成药,主要由黄芪、当归、白英、龙葵、丹参、半枝莲、蛇毒、郁金等组成;该方剂中黄芪为君药,白英和龙葵为臣药,郁金为佐药,全方具有具有益气养血、清热解毒、理气化瘀的功效[40]。基础研究表明紫龙金片通过调节细胞免疫功能、影响细胞周期、激活抑癌基因、抑制癌基因等途径达到治疗肿瘤的目的[26,41-42]。在临床上,紫龙金片在肺癌、肠癌、胰腺癌、乳腺癌、胃癌[43],鼻咽癌[44]等恶性肿瘤的治疗中取得了良好的治疗效果。
本研究入组的大部分研究集中在NSCLC[11,17-28],而仅有1项研究[16]报道了小细胞肺癌(small cell lung cancer,SCLC),结果显示无论肺癌的病理类型,紫龙金片联合铂类为基础的化疗方案均可改善患者的ORR,这与大部分文献报道的结果一致[12,40];但是,紫龙金片在鼻咽癌等其他的恶性肿瘤的临床研究中,也取得了类似的结果[41,44]。而DCR是评价近期疗效的另一种方式,在临床治疗中是评价疗效的另一项重要指标,但在大多数荟萃类研究中并未采纳该指标,因此,本研究从临床实际工作的角度评价了DCR,荟萃结果显示,紫龙金片联合铂类为基础的化疗可改善患者的DCR。而在生活质量方面,同样发现紫龙金片联合铂类化疗在治疗后KPS评分高于对照组;在血液学毒性和改善化疗带来的不良反应方面,紫龙金片联合铂类化疗均优于对照组。但仅有个别的研究报道了紫龙金片联合铂类化疗的1年获益率[20]或中位生存获益率[25];紫龙金片近期疗效的获益能否转化为长期的生存获益,仍然需要进一步设计严谨的大样本的RCT来支持。在用药周期的亚组分析中,有9项研究[11,16-17,19,22-23,25,27-28]用药达到了2周期,而仅2项研究[20,21]用药达到了4周期;2组ORR 2周期差异具有统计学意义,而4周期没有统计学意义;但是2组DCR在2周期和4周期差异均有统计学意义,因此,随着用药疗程的延长,可能会改善患者的近期疗效。
纳入的研究中仅有1项是SCLC方面的,尽管得出了紫龙金片治疗有效的结论,但可能存在发表偏倚的风险。此外,纳入的研究均是小样本的RCT研究,仅有2篇文献采用了双盲,尽管提高了结论的证据级别,但大部分文献均是非盲法的RCT,总体来讲,文献的质量水平不高,结论的可靠性有待进一步大样本的RCT研究来加强其证据级别。再次,纳入的14篇文献均为中文文献,该研究存在潜在的种族偏倚。另外,纳入的研究采用了不同的化疗方案,由于样本量的限制,未进行进一步的亚组分析,可能对结果产生一定的影响。而在近期疗效的亚组分析中,由于4周期治疗的亚组研究仅有2项,可能存在一定的发表偏倚。
总之,紫龙金片联合铂类药物治疗肺癌,在提高近期疗效的同时,可提高生活质量,减轻化疗毒副反应,对肿瘤患者和医生来讲,是一种可选的方案,临床应用价值较高。但是受纳入研究的样本量、质量及发表性偏倚等诸多因素的影响,致使该研究的证据质量较低,故在运用该结论时需谨慎。后期仍需要开展多中心、大样本、多地区的RCT研究来验证该结论。
利益冲突 所有作者均声明不存在利益冲突
[1] Siegel R L, Miller K D, Jemal A. Cancer statistics, 2020 [J]., 2020, 70(1): 7-30.
[2] Wu C C, Li M N, Meng H B,. Analysis of status and countermeasures of cancer incidence and mortality in China [J]., 2019, 62(5): 640-647.
[3] 陈万青, 孙可欣, 郑荣寿, 等. 2014年中国分地区恶性肿瘤发病和死亡分析 [J]. 中国肿瘤, 2018, 27(1): 1-14.
[4] Fukuoka M, Wu Y L, Thongprasert S,. Biomarker analyses and final overall survival results from a phase III, randomized, open-label, first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia (IPASS) [J]., 2011, 29(21): 2866-2874.
[5] Yang J C H, Sequist L V, Geater S L,. Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: A combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6 [J]., 2015, 16(7): 830-838.
[6] Soria J C, Ohe Y, Vansteenkiste J,. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer [J]., 2018, 378(2): 113-125.
[7] Herbst R S, Garon E B, Kim D W,. Long-term outcomes and retreatment among patients with previously treated, programmed death-ligand 1-positive, advanced non-small-cell lung cancer in the KEYNOTE-010 study [J]., 2020, 38(14): 1580-1590.
[8] Antonia S J, Villegas A, Daniel D,. Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer [J]., 2017, 377(20): 1919-1929.
[9] Paz-Ares L, Ciuleanu T E, Cobo M,. First-line nivolumab plus ipilimumab combined with two cycles of chemotherapy in patients with non-small-cell lung cancer (CheckMate 9LA): An international, randomised, open-label, phase 3 trial [J]., 2021, 22(2): 198-211.
[10] Wang Y S, Zhang Q F, Chen Y C,. Antitumor effects of immunity-enhancing traditional Chinese medicine [J]., 2020, 121: 109570.
[11] 陈春荣, 张春梅, 王建云, 等. 紫龙金片联合多西他赛加顺铂方案治疗中晚期非小细胞肺癌临床疗效观察 [J]. 中国实用医药, 2011, 6(30): 139-140.
[12] 叶思思, 肖祖林, 任真, 等. 紫龙金片联合化疗治疗非小细胞肺癌的疗效及安全性Meta分析 [J]. 中医药导报, 2020, 26(5): 97-102.
[13] 石远凯, 孙燕. 临床肿瘤内科手册 [M]. 第6版. 北京: 人民卫生出版社, 2015: 132-140.
[14] 李晔雄. 肿瘤放射治疗学[M]. 第5版. 北京: 中国协和医科大学出版社. 2018: 1787.
[15] 皋文君, 刘砚燕, 袁长蓉. 国际肿瘤化疗药物不良反应评价系统: 通用不良反应术语标准4.0版 [J]. 肿瘤, 2012, 32(2): 142-144.
[16] 丁勇敏, 俞哲燕, 谢欢. 伊立替康及卡铂联合紫龙金片一线治疗广泛期小细胞肺癌近期疗效观察 [J]. 浙江中医药大学学报, 2013, 37(6): 745-747.
[17] 李广生, 马淑萍. 紫龙金片联合多西他赛和奈达铂治疗局部晚期非小细胞肺癌的疗效观察 [J]. 现代药物与临床, 2015, 30(12): 1506-1510.
[18] 李鹤飞, 王海波, 戴悦, 等. 紫龙金片治疗中晚期非小细胞肺癌的临床体会 [J]. 中外女性健康研究, 2015(8): 30.
[19] 马惠文, 方骏, 王思雄, 等. 紫龙金片联合化疗对晚期肺癌的临床疗效 [J]. 检验医学与临床, 2017, 14(22): 3318-3320.
[20] 尚瑞国. 紫龙金片联合多西他赛加顺铂方案治疗中晚期非小细胞肺癌临床疗效观察 [J]. 中医临床研究, 2016, 8(10): 45-46.
[21] 申婷, 魏宇森, 张洪珍. 紫龙金片联合TP方案治疗局部晚期非小细胞肺癌临床疗效及对T淋巴细胞亚群的影响 [J]. 河北中医, 2017, 39(10): 1539-1542.
[22] 孙彩萍, 王建芳, 陈遐林, 等. 紫龙金片联合化疗治疗晚期非小细胞肺癌的研究观察 [J]. 中华中医药学刊, 2015, 33(5): 1145-1147.
[23] 汪江, 颜维仁. 紫龙金片配合化疗治疗中晚期非小细胞肺癌的研究 [J]. 现代中西医结合杂志, 2008, 17(1): 3-4.
[24] 吴鸿彬, 张洁. 紫龙金片对原发性肺癌化疗增效减毒作用的临床观察 [J]. 天津药学, 2006, 18(6): 29-30.
[25] 吴敏信. 紫龙金片联合GP方案治疗非小细胞肺癌的临床价值 [J]. 人人健康, 2019(12): 115.
[26] 杨小纯, 田菲, 于建春. 紫龙金片联合PC方案治疗原发性非小细胞肺癌临床研究 [J]. 中医学报, 2017, 32(5): 715-717.
[27] 易辉煌, 陈建华. 3种中成药辅助治疗非小细胞肺癌的有效性及经济学评价 [J]. 中国医院用药评价与分析, 2014, 14(7): 589-591.
[28] 于法明, 姜东亮. 紫龙金片联合GP方案治疗非小细胞肺癌的临床研究 [J]. 现代药物与临床, 2018, 33(5): 1184-1188.
[29] 李秀艳, 陶娌娜, 张杰, 等. 脾多肽注射液辅助化疗治疗肿瘤的疗效与安全性meta分析 [J]. 中国现代应用药学, 2019, 36(8): 977-984.
[30] Spigel D R, Faivre-Finn C, Gray J E,. Five-year survival outcomes with durvalumab after chemoradiotherapy in unresectable stage III NSCLC: An update from the PACIFIC trial [J]., 2021, 39(15_suppl): 8511.
[31] NCCN Guidelines Insights: Non-Small Cell Lung Cancer, Version 2.2021 [J]., 2021, 19(3): 254-266.
[32] 张家豪, 张亚杰, 王洁, 等. 2021年V1版《NCCN非小细胞肺癌临床诊治指南》更新解读 [J]. 中国胸心血管外科临床杂志, 2021, 28(3): 271-277.
[33] 黄岩, 张力. 2020 CSCO非小细胞肺癌诊疗指南更新要点解读 [J]. 临床内科杂志, 2020, 37(8): 603-605.
[34] Zhang Y C, Simoff M J, Ost D,. Understanding the patient journey to diagnosis of lung cancer [J]., 2021, 21(1): 402.
[35] Yang J N, Zhu X M, Yuan P P,. Efficacy of traditional Chinese Medicine combined with chemotherapy in patients with non-small cell lung cancer (NSCLC): A meta-analysis of randomized clinical trials [J]., 2020, 28(8): 3571-3579.
[36] 邹珊珊, 徐榕, 何琪杨. 复方中药紫龙金克服肿瘤细胞多药耐药性的机制 [J]. 中国中西医结合杂志, 2010, 30(6): 601-606.
[37] Oun R, Moussa Y E, Wheate N J. The side effects of platinum-based chemotherapy drugs: A review for chemists [J]., 2018, 47(19): 6645-6653.
[38] Oun R, Moussa Y E, Wheate N J. Correction: The side effects of platinum-based chemotherapy drugs: A review for chemists [J]., 2018, 47(23): 7848.
[39] Xing S J, Qu Y, Li C Y,. Deregulation of lncRNA-AC078883.3 and microRNA-19a is involved in the development of chemoresistance to cisplatin via modulating signaling pathway of PTEN/AKT [J]., 2019, 234(12): 22657-22665.
[40] 刘春香, 王辉, 翟静波, 等. 紫龙金治疗非小细胞肺癌的系统评价 [J]. 辽宁中医杂志, 2013, 40(12): 2448-2453, 2637.
[41] 史东升, 周静敏, 马淑萍. 紫龙金对人非小细胞肺癌A549细胞生长及VEGF表达的影响 [J]. 中国肿瘤临床, 2011, 38(20): 1267-1270.
[42] 王军起, 崔增林, 陈家存, 等. 复方中药紫龙金对肾癌ketr-3细胞体外增殖的影响 [J]. 中国肿瘤临床, 2009, 36(22): 1315-1317.
[43] 杨爱莲, 林锦培, 林浩, 等. 紫龙金片治疗晚期恶性肿瘤临床观察 [J]. 中草药, 2018, 49(16): 3882-3884.
[44] 马涛, 王萍, 刘斌, 等. 紫龙金对防治局部晚期鼻咽癌放化疗不良反应的临床观察 [J]. 河北医药, 2015, 37(21): 3237-3239.
Efficiency and safety of Zilongjin Tablet combined with platinum-based chemotherapy in treatment of lung cancer: A Meta-analysis
DONG Yu-mei, GUO Li-yun, QI Yue-xiao, SONG Hai-xia, CAI Ya-qin, WEI Shi-hong
Second Ward, Department of Radiotherapy Gansu Provincial Cancer Hospital,Lanzhou 730050, China
The efficacy and safety of Zilongjin Tablets (紫龙金片) combined with platinum-based chemotherapy in the treatment of lung cancer were systematically evaluated according to the existing clinical data.Several electronic databases, including PubMed, Wanfang, EmBase, Cochrane Library, CNKI, Wanfang, CBM, Chinese Clinical Trial Registryand, and VIP were comprehensively searched from the construction of library to May 2021. According to the pre-established entry and exclusion criteria, all randomized controlled trials (RCTs) of Zilongjin Tablets combined with platinum-based chemotherapy in the treatment of lung cancer were included. Two researchers independently screened the literature, extracted the data, and evaluated the methodological quality of the literatures according to the Cochrane Reviewers 5.1 manual. Meta-analysis was finished and the publication bias was tested by RevMan 5.3 software.A total of 14 articles were finally included, and that included 1026 lung cancer patients, and the experimental group and the control group were 513 cases respectively. Meta-analysis results showed that Zilongjin Tablets combined with dual-drug chemotherapy could improve the objective response rate of tumors [RR = 1.55, 95% CI (1.29, 1.87),< 0.000 01], disease control rate [RR = 1.20, 95% CI (1.12, 1.29),< 0.000 01], and quality of life [RR = 1.87, 95% CI (1.52, 2.30),< 0.000 01]. It could reduce the inhibition of white blood cells, hemoglobin and platelets [RR = 0.66, 95% CI (0.58, 0.76),< 0.000 01; RR = 0.62, 95% CI (0.53, 0.72),<0.000 01; RR = 0.57, 95% CI (0.46, 0.71),<0.000 01], respectively. However, there were no significant improvement of liver and renal function [RR = 0.69, 95% CI (0.40, 1.19),= 0.18; RR = 0.46, 95% CI (0.20, 1.08),= 0.07], respectively.Based on the results of this study, Zilongjin Tablets combined with platinum chemotherapy drugs in the treatment of lung cancer can improve the short-term efficacy, improve the quality of life, and reduce the occurrence of some adverse reactions. Zilongjin Tablets is optional in the treatment of lung cancer. However, because of many factors such as the sample size, quality and publication bias of the included studies, the quality of the evidence for the results of the study is low, and caution should be exercised when you are going to apply this conclusion.
Zilongjin Tablets; lung cancer; chemotherapy; efficiency; safety; Meta-analysis
R285.64
A
0253 - 2670(2022)03 - 0806 - 12
10.7501/j.issn.0253-2670.2022.03.021
2021-07-11
甘肃省卫生行业科研计划项目(GSWSKY-2015-35);甘肃省卫生行业科研计划项目(GSWSKY-2019-82);甘肃省兰州市科技发展指导性计划项目(2019-ZD-134);甘肃省中医药管理局科研项目(GZK-2014-76);甘肃省中医药管理局科研项目(GZKP-2021-20)
董玉梅,硕士研究生,主治医师,主要从事胸部肿瘤(乳腺癌、肺癌、食管癌、胸腺瘤)的放射治疗及综合治疗。
魏世鸿,主任医师,主要从事胸部肿瘤的放射治疗及综合治疗。E-mail: weishihong100@163.com
[责任编辑 潘明佳]

