剑叶凤尾蕨乙醇提取物调控LOXL1-AS1抑制肺癌细胞增殖、迁移、侵袭
李蔚 邬海桥 李炯 张俊娜 向茜 冯霞
(重庆市中医院呼吸与危重症医学科,重庆 400021)
肺癌是最常见的恶性肿瘤之一,是癌症相关死亡的主要原因,据统计全球每年约有180万肺癌新增病例〔1〕。约85%的肺癌病例为非小细胞肺癌(NSCLC),早期NSCLC患者经手术治疗后其5年生存率可显著提高,然而70%的NSCLC患者在确诊时已处于晚期或发生转移。化疗尽管可延长NSCLC患者生存期,但多数患者在治疗后易产生耐药性,导致化疗失败。天然中草药提取物具有较好的抗肿瘤活性引起研究者的广泛关注〔2〕。剑叶风尾蕨是凤尾蕨属多年生常绿草本植物,具有清热消食、利尿止痢作用。研究显示其乙醇提取物对人结肠癌细胞SW579、肝癌细胞HepG2、胃癌细胞BGC-823及肺癌细胞H23具有一定的增殖抑制作用〔3,4〕。但目前剑叶凤尾蕨对肺癌的迁移、侵袭及增殖的影响及其机制还未有研究。类赖氨酰氧化酶1反义RNA1(LOXL1-AS1)是近年发现的新型的长链非编码RNA,研究显示,LOXL1-AS1在胶质母细胞瘤、前列腺癌中具有致癌作用,敲除LOXL1-AS1可抑制癌细胞增殖、迁移、侵袭〔5,6〕。对NSCLC微阵列分析显示,LOXL1-AS1在肺癌组织中的表达高于正常组织〔7〕,但其对肺癌细胞增殖、迁移和侵袭的影响及剑叶凤尾蕨乙醇提取物能否调控LOXL1-AS1表达参与对肺癌细胞增殖、迁移和侵袭的调控尚未可知。本研究拟通过观察不同浓度剑叶凤尾蕨乙醇提取物对肺癌A549细胞增殖、迁移侵袭及LOXL1-AS1表达的影响,初步揭示其调控肺癌细胞生物学行为的分子机制。
1 材料与方法
1.1材料 肺癌细胞A549购于美国ATCC;RPMI1640培养基和胎牛血清购于美国Hyclone公司;小干扰RNA阴性对照(si-NC)、LOXL1-AS1小干扰RNA(si-LOXL1-AS1)、空载体质粒(pcDNA3.1)、LOXL1-AS1过表达载体(pcDNA3.1-LOXL1-AS1)购于上海吉玛制药有限公司;细胞计数试剂盒(CCK-8)购于北京索莱宝生物科技有限公司;Transwell小室和基质胶购于美国BD公司;兔源细胞周期蛋白(Cyclin)D1抗体、兔源p21抗体、兔源基质金属蛋白酶(MMP)-2抗体、兔源磷酸甘油醛脱氢酶(GAPDH)抗体及山羊抗兔Ⅱ抗购于美国Abcam公司;鼠源E钙黏附蛋白(E-cadherin)抗体及山羊抗鼠Ⅱ抗购于美国Santa Cruz公司;Trizol试剂喝RIPA裂解液购于上海碧云天公司;LipofectamineTM2000购于美国Invitrogen公司。
1.2细胞培养和分组 A549细胞用RPMI1640培养基(含10%胎牛血清)于37℃、含5%CO2、饱和湿度的细胞培养箱内培养,每隔1 d换液1次,当细胞铺满瓶底80%时进行传代,取对数期A549细胞进行实验。将A549细胞分为0 mg/ml组、3 mg/ml组、6 mg/ml组、12 mg/ml组、si-NC组、si-LOXL1-AS1组、剑叶凤尾蕨乙醇提取物6 mg/ml+pcDNA3.1组和剑叶凤尾蕨乙醇提取物6 mg/ml+pcDNA3.1-LOXL1-AS1组。3 mg/ml组、6 mg/ml组、12 mg/ml组为分别采用剑叶凤尾蕨乙醇提取物浓度为3、6、12 mg/ml的细胞培养液处理A549细胞48 h。si-NC组、si-LOXL1-AS1组分别为转染si-NC、si-LOXL1-AS1的A549细胞。剑叶凤尾蕨乙醇提取物6 mg/ml+pcDNA3.1组和剑叶凤尾蕨乙醇提取物6 mg/ml+pcDNA3.1-LOXL1-AS1组为分别将pcDNA3.1、pcDNA3.1-LOXL1-AS1转染至A549细胞后,采用含6 mg/ml的剑叶凤尾蕨乙醇提取物的细胞培养液处理48 h。细胞转染参照LipofectamineTM2000使用说明书步骤进行。
1.3方法
1.3.1剑叶凤尾蕨乙醇提取物的制备 剑叶凤尾蕨乙醇提取物的制备参考文献〔4〕进行,具体如下:将剑叶凤尾蕨于阴凉处晾干,粉碎后,取10 g样品加乙醇100 ml利用索氏抽提器连续回流提取8 h,稀释提取液至乙醇含量为30%,将石油醚Ⅱ和提取液按照1∶2比例混合后萃取2次,弃去石油醚层,合并萃取蒸干后,加入适量二甲基亚砜溶解,磷酸盐缓冲液(PBS)定容,获得1 g/ml的提取液,灭菌后,置于4℃冰箱备用。
1.3.2CCK-8法检测细胞存活 将A549细胞按照5×103个细胞/孔细胞密度接种于96孔板,当细胞贴壁后,弃去孔内上清液,每孔加入含不同浓度剑叶凤尾蕨乙醇提取物(3、6、12 mg/ml)的RPMI1640培养液200 μl,另外设置对照(0 mg/ml)组只添加200 μl的RPMI1640培养基,孵育48 h后,每孔加入10 μl的CCK-8试剂,培养箱继续孵育4 h,酶标仪检测450 nm波长处各孔的吸光度值,计算细胞存活率。
1.3.3Transwell实验检测细胞迁移和侵袭 收集剑叶凤尾蕨乙醇提取物(3、6、12 mg/ml)处理48 h的A549细胞和0 mg/ml组细胞,PBS洗涤细胞2次后,用无血清RPMI1640细胞培养液调整细胞浓度为1×106个/ml。将包被基质胶的Transwell小室进行基底膜水化后,取200 μl细胞悬液加入Transwell上室,24孔板下室加入500 μl含20%胎牛血清的RPMI1640培养基,常规培养24 h,用棉签轻轻拭去上室未穿膜细胞,甲醇固定,结晶紫染色后,将Transwell小室倒置于显微镜下观察细胞过膜情况,随即选取5个视野拍照和细胞记数,取均值即为侵袭细胞数目。迁移实验采用未包被基质胶的Transwell小室,其他步骤同侵袭实验。
1.3.4Western印迹检测CyclinD1、p21、E-cadherin和MMP-2蛋白的表达 收集剑叶凤尾蕨乙醇提取物(3、6、12 mg/ml)处理48 h的A549细胞和0 mg/ml组细胞,利用PIPA裂解液提取细胞蛋白。二喹啉甲酸(BCA)试剂盒测定蛋白样品浓度。将蛋白样品与2×上样缓冲液以1∶1比例混合,沸水浴变性5 min,进行聚丙烯酰胺凝胶电泳分离细胞蛋白。电泳结束后后,将细胞蛋白电转至硝酸纤维素膜,采用5%脱脂牛奶中室温封闭膜1 h,TBST洗膜2 min,加入Ⅰ抗(p21抗体1∶1 000稀释,内参GAPDH抗体1∶2 500稀释,其他抗体稀释比例为1∶500)侧摆摇床室温孵育2 h,TBST洗膜10 min,洗膜3次,加入Ⅱ抗(1∶1 000稀释)侧摆摇床室温孵育1 h,TBST洗膜10 min,洗膜3次,加入化学发光显色试剂于暗室内显色,以GAPDH为内参,应用ImageJ软件分析各组细胞目的蛋白的灰度值。
1.3.5qRT-PCR检测LOXL1-AS1的表达水平 收集剑叶凤尾蕨乙醇提取物(3、6、12 mg/ml)处理48 h的A549细胞和0 mg/ml组细胞,Trizol法提取细胞总RNA,分光光度法测定RNA浓度和纯度。利用逆转录试剂盒合成cDNA,qRT-PCR检测LOXL1-AS1的表达水平。PCR引物由上海生工生物工程公司合成。引物序列如下:LOXL1-AS1上游引物序列5′-TTCCCATTTACCTGCCCGAAG-3′,下游引物序列5′-GTCAGCAAACACATGGCAAC-3′;GAPDH上游引物序列5′-GGAAGGACTCATGACCACAGTCC-3′,下游引物序列5′-TCGCTGTTGAAGTCAGAGGAGACC-3′。以GAPDH为内参,2-ΔΔCt法计算LOXL1-AS1的表达水平。
1.3.6抑制LOXL1-AS1对细胞A549细胞增殖、迁移、侵袭的影响 将A549细胞按照5×103个细胞/孔细胞密度接种于96孔板,当细胞融合度约为60%时,利用脂质体LipofectamineTM2000分别将si-NC、si-LOXL1-AS1转染至A549细胞,转染48 h按照1.3.2步骤检测转染效果。
1.3.7过表达LOXL1-AS1逆转剑叶凤尾蕨乙醇提取物对细胞A549增殖、迁移、侵袭的影响 利用脂质体LipofectamineTM2000分别将pcDNA3.1、pcDNA3.1-LOXL1-AS1转染至A549细胞,采用含6 mg/ml的剑叶凤尾蕨乙醇提取物的细胞培养液处理48 h。
1.4统计学分析 采用SPSS20.0软件进行t检验、单因素方差分析、SNK-q检验。
2 结 果
2.1剑叶凤尾蕨乙醇提取物对细胞A549增殖的影响 与0 mg/ml组比较,剑叶凤尾蕨乙醇提取物处理A549细胞后,细胞存活率显著降低,CyclinD1蛋白的表达显著降低,p21蛋白的表达显著升高(P<0.05),且呈剂量依赖性(均P<0.05),见图1、表1。

1~4:0 mg/ml组、3 mg/ml组、6 mg/ml组、12 mg/ml组,下图同图1 剑叶凤尾蕨乙醇提取物对细胞A549增殖蛋白表达的影响

2.2剑叶凤尾蕨乙醇提取物对细胞A549迁移、侵袭的影响 与0 mg/ml组比较,剑叶凤尾蕨乙醇提取物处理A549细胞后,迁移和侵袭细胞数目显著减少,E-cadherin蛋白的表达显著升高,MMP-2蛋白的表达显著降低(P<0.05),且呈剂量依赖性(均P<0.05)。见表1,图2。

图2 剑叶凤尾蕨乙醇提取物对细胞A549迁移、侵袭蛋白表达的影响
2.3剑叶凤尾蕨乙醇提取物对细胞A549中LOXL1-AS1表达的影响 0、3、6、12 mg/ml组A549细胞中LOXL1-AS1表达水平分别为〔(1.01±0.10)、(0.70±0.07)、(0.47±0.04)、(0.23±0.02)〕,与0 mg/ml组比较,剑叶凤尾蕨乙醇提取物处理A549细胞后,A549细胞中LOXL1-AS1的表达水平均显著降低(P<0.05),且呈剂量依赖性(均P<0.05)。
2.4抑制LOXL1-AS1对细胞A549增殖、迁移、侵袭的影响 与si-NC组比较,si-LOXL1-AS1组A549细胞LOXL1-AS1的表达水平显著降低,细胞存活率、迁移和侵袭细胞数显著降低(P<0.05),CyclinD1和MMP-2蛋白表达显著降低,p21和E-cadherin蛋白表达显著升高(均P<0.05)。见图3、表2。

图3 抑制LOXL1-AS1对细胞A549增殖、迁移、侵袭蛋白表达的影响
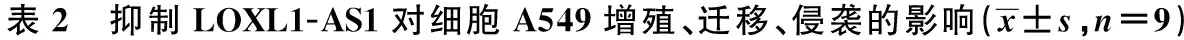
2.5过表达LOXL1-AS1能逆转剑叶凤尾蕨乙醇提取物对细胞A549增殖的影响 与剑叶凤尾蕨乙醇提取物6 mg/ml+pcDNA3.1组比较,剑叶凤尾蕨乙醇提取物6 mg/ml+pcDNA3.1-LOXL1-AS1组A549细胞LOXL1-AS1的表达水平显著升高,细胞存活率显著升高,CyclinD1蛋白的表达显著升高,p21蛋白的表达显著降低(P<0.05)。见表3,图4。


1,2:剑叶凤尾蕨乙醇提取物6 mg/ml+pcDNA3.1组、剑叶凤尾蕨乙醇提取物6 mg/ml+pcDNA3.1-LOXL1-AS1,下图同图4 过表达LOXL1-AS1能逆转剑叶凤尾蕨乙醇提取物对细胞A549增殖蛋白表达的影响
2.6过表达LOXL1-AS1能逆转剑叶凤尾蕨乙醇提取物对细胞A549迁移、侵袭的影响 与剑叶凤尾蕨乙醇提取物6 mg/ml+pcDNA3.1组比较,剑叶凤尾蕨乙醇提取物6 mg/ml+pcDNA3.1-LOXL1-AS1组A549细胞迁移和侵袭数目显著增加,MMP-2蛋白的表达显著升高,E-cadherin蛋白的表达显著降低(P<0.05)。见图5,表4。

图5 过表达LOXL1-AS1能逆转剑叶凤尾蕨乙醇提取物对细胞A549迁移、侵袭蛋白表达的影响

3 讨 论
肺癌是我国最常见的恶性肿瘤,其发病率和死亡率均居恶性肿瘤之首,已造成严重的社会和经济负担〔8,9〕。尽管肺癌治疗方案不断进展,肺癌患者的预后仍然很差,患者的5年生存率约为15%〔10〕。
研究显示中草药提取物在肺癌治疗中有一定疗效〔11〕。白花蛇舌草通过抑制丝裂原活化蛋白激酶(MAPK)通路抑制肺癌细胞的体内外增殖,诱导细胞凋亡〔12〕。岩黄连提取物可抑制裸鼠A549细胞移植瘤的生长,减轻肺癌骨转移对骨质的破坏〔13〕。此外,刺齿凤尾蕨提取物对人肝癌细胞和结肠癌细胞具有一定的体外抗增殖活性〔14,15〕。CyclinD1是细胞增殖的关键蛋白,其在细胞周期从G1期向S期转换中发挥促进作用,是细胞增殖的关键蛋白,而p21则发挥相反的作用。E-cadherin是上皮细胞的标志蛋白,当细胞上皮间质转化(EMT)过程中,上皮细胞失去细胞间连接和极性,获得间充质细胞特性,提高细胞的迁移和侵袭能力〔16〕。MMP-2可降解细胞外基质,促进细胞浸润转移。检测增殖、迁移侵袭相关蛋白表达发现CyclinD1和MMP-2蛋白的表达显著降低,p21和E-cadherin蛋白的表达显著增加,与功能实验结果一致。提示剑叶凤尾蕨乙醇提取物可有效抑制A549细胞增殖、迁移和侵袭,具有肺癌治疗潜力。
LOXL1-AS1位于人类染色体15q24.1位置,由10 781个核苷酸组成。研究显示氧化应激和循环机械应激分别导致人晶状体上皮细胞和神经根管内皮细胞中LOXL1-AS1表达的失调,与青光眼和剥脱综合征密切相关〔17,18〕。随后在癌症中逐渐发现LOXL1-AS1表达失调。LOXL1-AS1在骨肉瘤组织中呈高表达,其高表达与骨肉瘤患者肿瘤大小、远端转移、组织学分级及总生存时间有关,下调LOXL1-AS1可有效抑制骨肉瘤细胞增殖、迁移和侵袭〔19〕。LOXL1-AS1高表达还与胆管癌淋巴结浸润、原发肿瘤局部淋巴结远处转移分期及预后不良有关,其可促进胆管癌细胞增殖、迁移、侵袭和减少肿瘤凋亡,从而在胆管癌中发挥致瘤作用〔20〕。本研究结果说明剑叶凤尾蕨乙醇提取物通过调控LOXL1-AS1表达参与对肺癌细胞恶性生物学行为的调控。

