不同产地杜仲雄花的非靶向代谢组学比较与分析
孟益德,吕庚鑫,刘攀峰,赵 培,杜红岩,杜兰英
(1.国家林业和草原局 泡桐研究开发中心,河南 郑州 450003;2.南京林业大学,江苏 南京 210037;3.中国林业科学研究院 经济林研究开发中心,河南 郑州 450003;4.经济林种质创新与利用国家林业和草原局重点实验室,河南 郑州 450003;5.河南省产品质量监督检验院,河南 郑州 450003)
杜仲Eucommia ulmoideOliv.是第四纪冰川侵袭后留存于我国的单种属孑遗树种,也是目前我国重要的经济林树种[1]。杜仲雄花是我国珍贵的花粉资源,富含多种人体健康有益成分,已开发出杜仲雄花茶、保健酒、养生挂面、功能饮料等系列产品,在市场上倍受青睐[2]。迄今在杜仲雄花中发现黄酮类、苯丙素类、环烯醚萜类、木脂素类等活性物质[3],以京尼平苷、桃叶珊瑚苷、绿原酸、异槲皮苷的研究最为广泛和深入[4-5]。已证明杜仲雄花具有抗炎、抗菌、抗病毒、降血压、降血脂、抑菌、抗老化等药理作用[6]。2014年,杜仲雄花被我国国家卫生委员会列入新资源食品名录[7]。
近年来代谢组学技术已广泛地应用于中药材质量控制与品质评价、资源鉴定、植物分类、亲缘关系评估以及代谢调控网络等领域[8-9]。应用UPLC-QTOF/MS 并结合多维统计分析方法将黄岑野生居群划分为3 种化学型,鉴定出4个差异代谢物,可用于区分不同产区的黄芩[10]。也有研究通过非靶向代谢组学方法发现不同茶树群体中代谢物含量差异显著,并且各种群具有各自的特征代谢物[11]。基于LC-ESI-Triple TOF-MS/MS 技术对杜仲雄花中32 种化学成分进行了分析鉴定,结果表明,杜仲雄花化学成分与杜仲皮相似,但是雄花的黄酮苷类成分含量高于杜仲皮[12]。
杜仲雄花代谢成分是品质形成的重要因素[13],但对杜仲雄花品质性状区分的物质基础尚不明确。以往研究多集中在少数代谢成分的测定和评价方面[14-15],尚未利用代谢组方法进行整体和系统研究,而这对于杜仲雄花种质资源鉴定、评价以及代谢成分的生物合成机制研究极为重要。
杜仲在我国亚热带至温带的27 个省份均有分布[1]。贵州省遵义市是杜仲药材的道地和主要产区,河北省安国市、四川省广元市为我国传统的杜仲药材生产基地,而洛阳市和新乡市为河南省新型杜仲资源培育的主要聚集区之一[16-17]。因此,本研究通过对5 个典型产地的杜仲雄花进行UPLCQTOF/MS 代谢组学分析,解析不同杜仲种质雄花代谢成分的整体性差异,为后续全面开展杜仲种质资源精准评价提供参考依据。
1 材料与方法
1.1 试验材料
采样树树龄6 a,采自于中国林业科学研究院经济林研究开发中心杜仲国家种质资源库,地理坐标34°55′N,113°36′E,不同种质立地条件以及管理方式基本一致。2018年采集2~4 株样树盛花期的新鲜雄花,每种质6 个生物学重复。除去鳞片和混生在雄花序内的小叶后置50 mL 离心管内液氮冷冻,带回室内-80℃保存。
1.2 杜仲雄花形态性状的测定
分别测定5 份种质枝皮颜色、雄花序形状、雄花颜色、雄花序数量、单雄花序鲜质量、雄花序长度、雄花序宽度、雄花数量、雄花长度、雄蕊数量以及雄蕊长度等11 个形态指标,每个指标测定10 个生物学重复。
1.3 提取液的制备
称取100 mg 杜仲雄花进行液氮研磨,之后向样品中加入120 μL 预冷的50%甲醇,涡旋1 min,室温下孵育10 min,将提取混合物在-20℃下储存过夜。4 000 r/min 离心20 min,上清液转移至96孔板,待LC-MS 分析。每个样品取10 uL 进行合并制备QC 样品。
1.4 UPLC-QTOF/MS 分析
利用超高效液相色谱(SCIEX,UK)系统进行物质分离和高分辨质谱TripleTOF5600plus (SCIEX,UK) 对样品进 行物质鉴定。液相分析条件:1) 色谱柱(Waters ACQUITYUPLC BEH Amide column)1.7 µm,2.1 mm×100 mm;2) 流动相A 为水+25 mmol 乙酸铵+25 mmol 氨水,B 为乙腈(加0.1%甲酸);3) 梯度洗脱条件:0~0.5 min,95% B;0.5~9.5 min,95%~65% B;9.5~10.5 min,65%~40% B;10.5~12 min,40% B;12~12.2 min,40%~95% B;12.2~15 min,95% B;4) 柱温35℃,流速0.4 mL/min,每个样品的进样量为4 µL。分别采用电喷雾电离正离子(ESI+)和负离子(ESI-)模式检测柱中洗脱的代谢物,质谱条件:离子源温度650℃,质谱电压5 000 V,气体Ⅰ和气体Ⅱ设置60PSI,帘气30PSI,在DDA 模式下获得质谱数据。每10 针样品插入1 个质控样品,用于监测和评估质谱系统稳定性及试验数据的可靠性[18]。
1.5 代谢组数据注释
质谱下机数据利用MSConvert 软件转化为.mzXML 格式,利用XCMS 进行峰选择、峰分组、保留时间校正等预处理,提取到的物质利用Camera 软件进行加合离子注释。使用metaX 软件对一级质谱信息进行鉴定,并利用KEGG、PLANTCYC 数据库进行代谢物注释。二级质谱信息利用HMDB 数据库以及in-house 标准数据库进行匹配,利用HMDB 数据库进行注释。将QC 样本中缺失数量超过50%的特征离子和测定样本中缺失数量超过80%的特征离子去除,剩余缺失值的峰值用k-最近邻算法进行填充[18]。
1.6 数据分析
综合ESI+模式和ESI-模式得到的二级质谱数据进行多元统计分析,在SIMCA-P 14.1 软件中进行主成分分析(principal component analysis,PCA),考察不同样本生物学重复之间的差异性。采用正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)衡量每个种质与其它4 个种质代谢组之间的差异性,根据变量对分组贡献值vip ≥1、组间变化的显著性(P<0.05)及差异倍数(fold change ≥2 和fold change ≤0.5)进行差异性代谢物的筛选。通过R语言对筛选出的雄花差异代谢成分进行聚类分析。
2 结果与分析
2.1 不同产地杜仲雄花的形态特征
不同产地杜仲雄花的形态特征见图1和表1。不同产地杜仲雄花的枝皮颜色有4 种类型,分别为青灰色、灰褐色、青褐色和褐色;雄花序形状较为一致,多为扁球形;雄花颜色略有相同。河北安国和河南新乡杜仲的雄花序数量(14.4±3.53,14.1±2.02)显著高于其他3 个产地的杜仲种质;河南洛阳杜仲种质的单雄花序鲜质量(2.04±0.49 g)显著高于其他4 个产地;而四川广元和贵州遵义杜仲种质的雄花序宽度(33.06±2.67 mm,32.82±2.68 mm)较高;雄花数量(9.67±0.58)以四川广元最低。
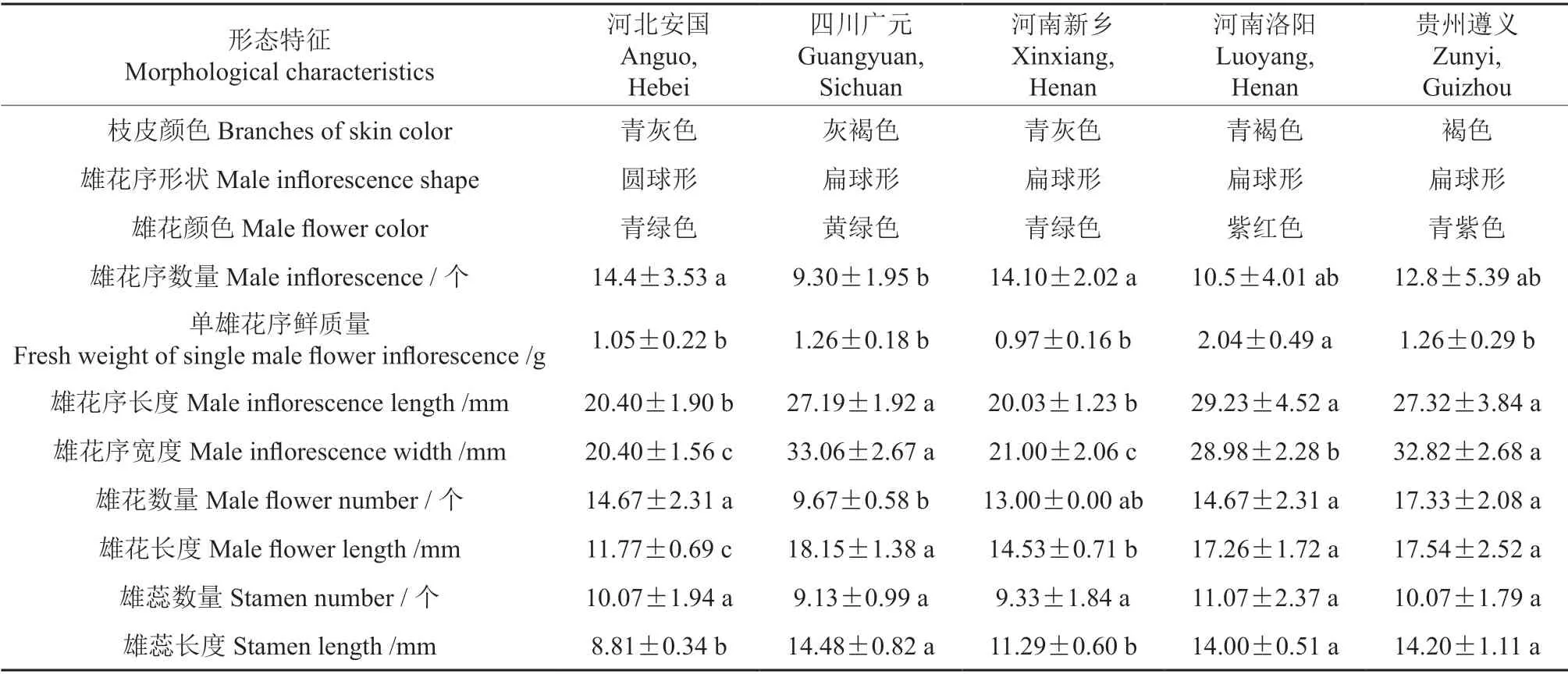
表1 不同产地杜仲雄花形态特征的比较分析Table 1 Comparison of the morphological characteristics of Eucommia ulmoides male flowers from different producing areas

图1 不同产地杜仲雄花的形态特征Fig.1 Morphological characteristics of Eucommia ulmoides male flowers from different producing areas
2.2 不同产地杜仲雄花代谢组的测定
从样本TIC 重叠图(图2)可以看出,正负离子模式下的TIC 重叠度均较高,所检测到物质峰都比较丰富,分别在ESI+和ESI-模式下获得13 341 个和10 387 个初始特征离子(表2),以及11 351 个和9 051 个高质量特征离子。在正负离子模式下,KEGG 数据库分别注释到6 062 和3 637 个代谢物,PLANTCYC 数据库注释到3 120和1 400 个代谢物。对一级质谱信息进行筛选,ESI+和ESI-模式下定性到1 368 个代谢物和899个代谢物。

表2 总离子数和鉴定统计Table 2 Total ion number and identification statistics

图2 不同产地杜仲雄花的TIC 重叠图Fig.2 TIC overlap of Eucommia ulmoides male flowers from different producing areas
ESI+和ESI-模式下二级质谱信息筛选定性到212 个代谢物和37 个代谢物。根据HMDB 数据库对二级定性到的代谢物进行分类,羧酸及其衍生物86 个,脂质和类脂分子35 个,核苷、核苷酸及类似物28 个,有机杂环28 个,有机氧化合物21 个,黄酮类化合物19 个,苯环型化合物14 个,肉桂酸及其衍生物7 个,生物碱及其衍生物4 个,有机氮化合物4 个。
2.3 不同产地杜仲雄花代谢组的比较分析
2.3.1 代谢组数据的稳定性考察
不同产地杜仲雄花代谢组PCA 分析结果(图3)表明,各产地杜仲雄花的生物学重复以及6 个QC 样品都聚集在一起,说明各产地杜仲雄花代谢组数据的稳定性较好,在测定过程中未出现明显偏差。PCA 分析可区分出4 个主成分,其中主成分1(PC1)的贡献率为47.2%,主成分2(PC2)的贡献率为21.2%,不同样本在两个维度上表现出较为明显的分离趋势,表明不同产地杜仲雄花的代谢组具有一定的差异性。
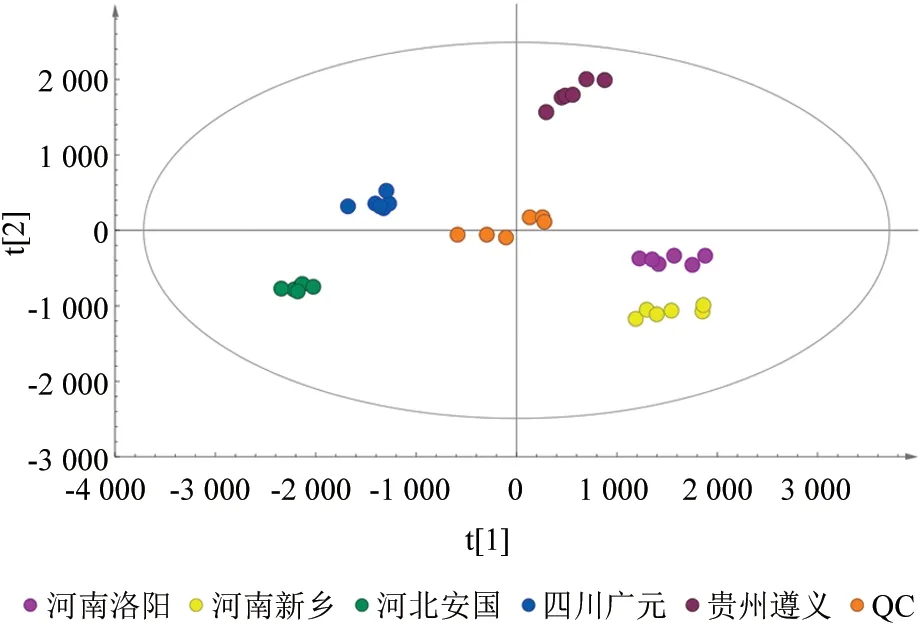
图3 不同产地杜仲雄花代谢组的PCA 得分Fig.3 PCA scores of male folwer metabolome of Eucommia ulmoides from different producing areas
2.3.2 不同产地杜仲雄花的差异性比较
不同产地杜仲雄花代谢组OPLS-DA 分析结果表明,每个种质与其他4 个种质代谢组之间差异明显(图4)。OPLS-DA 模型中各组都位于置信区间内,同时参数R2Y和Q2都大于0.9(表3),表明模型可靠。对OPLS-DA 进行排列验证(n=200,即200 次排列实验),在各组模型验证中,最右侧点对应为原始模型的R2Y和Q2,灰点和相应颜色点分别代表Y置换后模型的R2和Q2,均小于原始模型的R2Y和Q2,即相应点都不超过相应的线,表明模型没有过拟合。
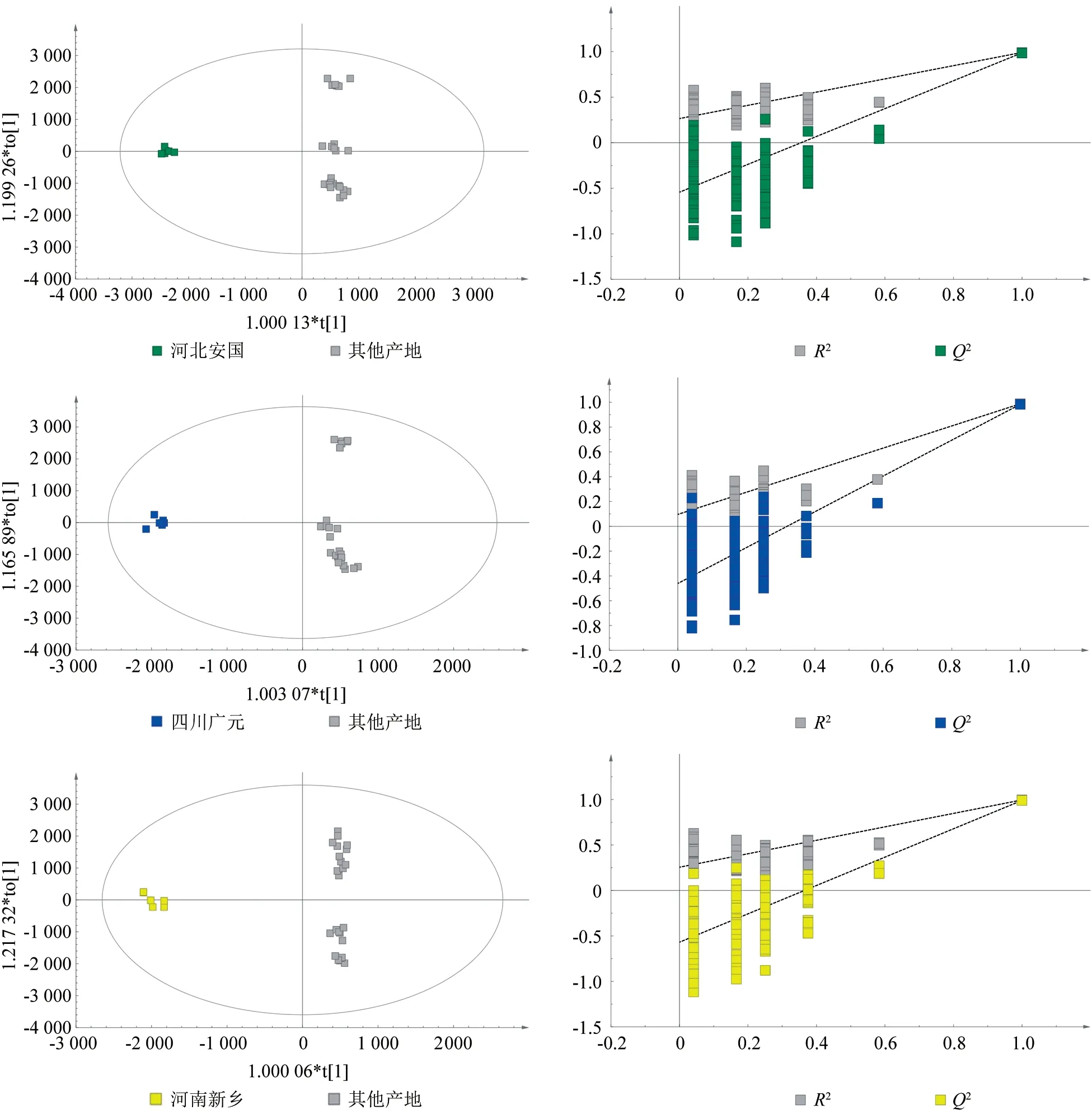
图4 不同产地杜仲雄花代谢物的OPLS-DA 得分和置换检验Fig.4 OPLS-DA score and replacement test of metabolites from Eucommia ulmoides male flowers from different producing areas
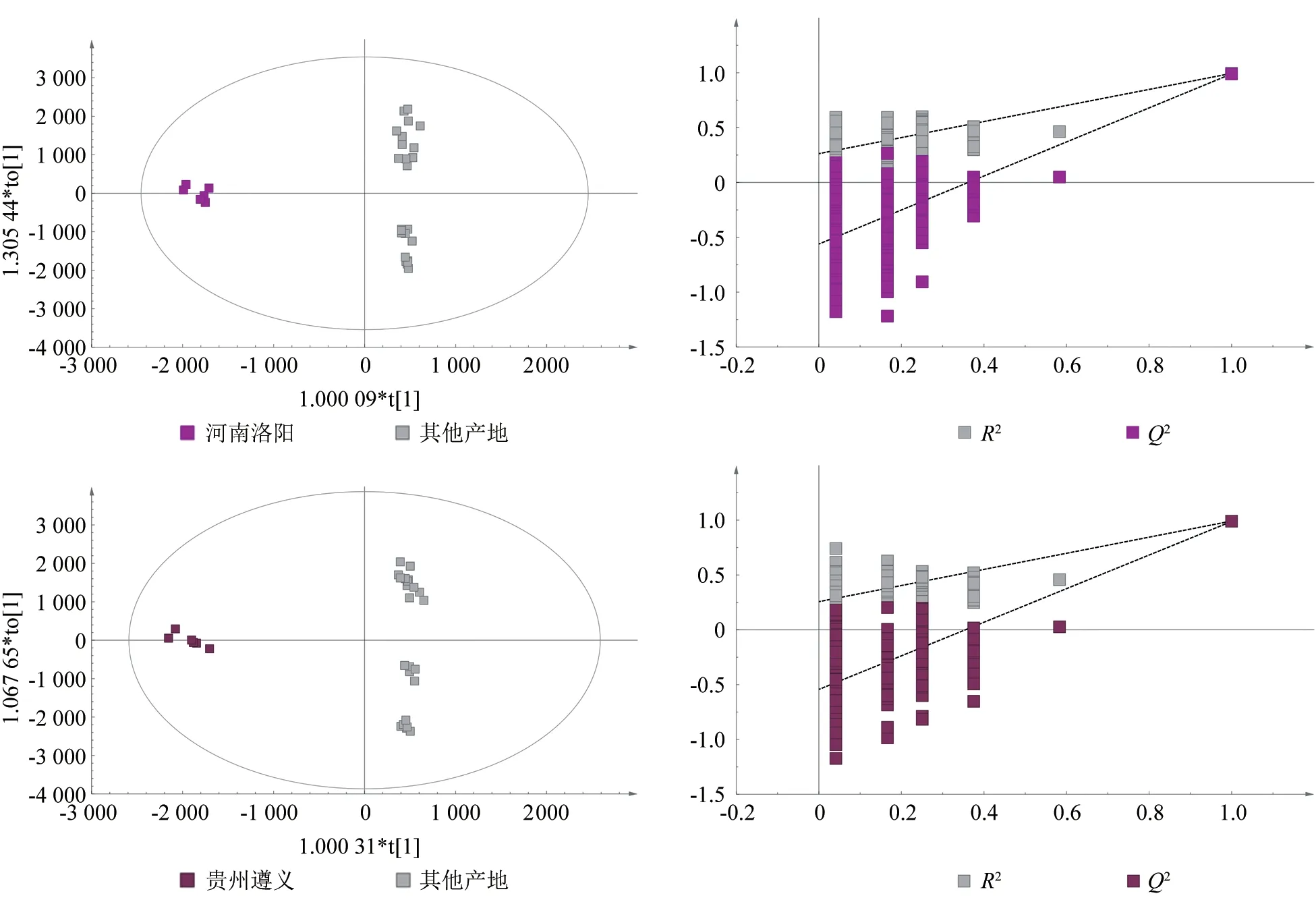
续图4Continuation of Fig.4
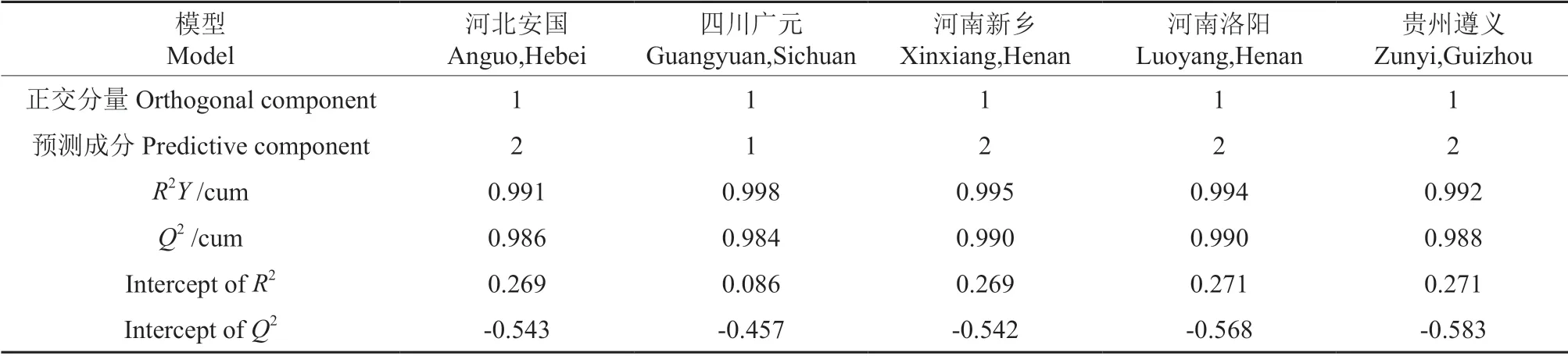
表3 OPLS-DA 模型的主要评估指标Table 3 Main evaluation indexes of OPLS-DA model
2.3.3 差异代谢物的筛选
对定性到的249 个代谢成分进行差异性代谢物筛选,共筛选出45 个差异代谢物,筛选结果见表4。河北安国、四川广元、河南新乡、河南洛阳、贵州遵义杜仲种质相较于其他种质分别筛选到22、18、12、5、13 个差异代谢物(图5)。其中,黄酮类化合物最多,为11 个;其次是羧酸及其衍生物,为10 个。对不同产地杜仲雄花的特有差异代谢物和共有差异代谢物进行交集分析(图6),5 个产地杜仲雄花的特有差异代谢物分别有11、7、4、2、5 个。3 个及以上样本共有差异代谢物为花生四烯酸、硬脂酸、3-羟基-3-甲基戊二酸、锦葵色素-3-葡糖苷、根皮素、咖啡酸、绿原酸,属于脂质和类脂分子、黄酮类化合物、肉桂酸及其衍生物、有机氧化合物。

表4 杜仲雄花差异代谢物的鉴定信息†Table 4 Identification information of differential metabolites in male flowers of Eucommia ulmoides
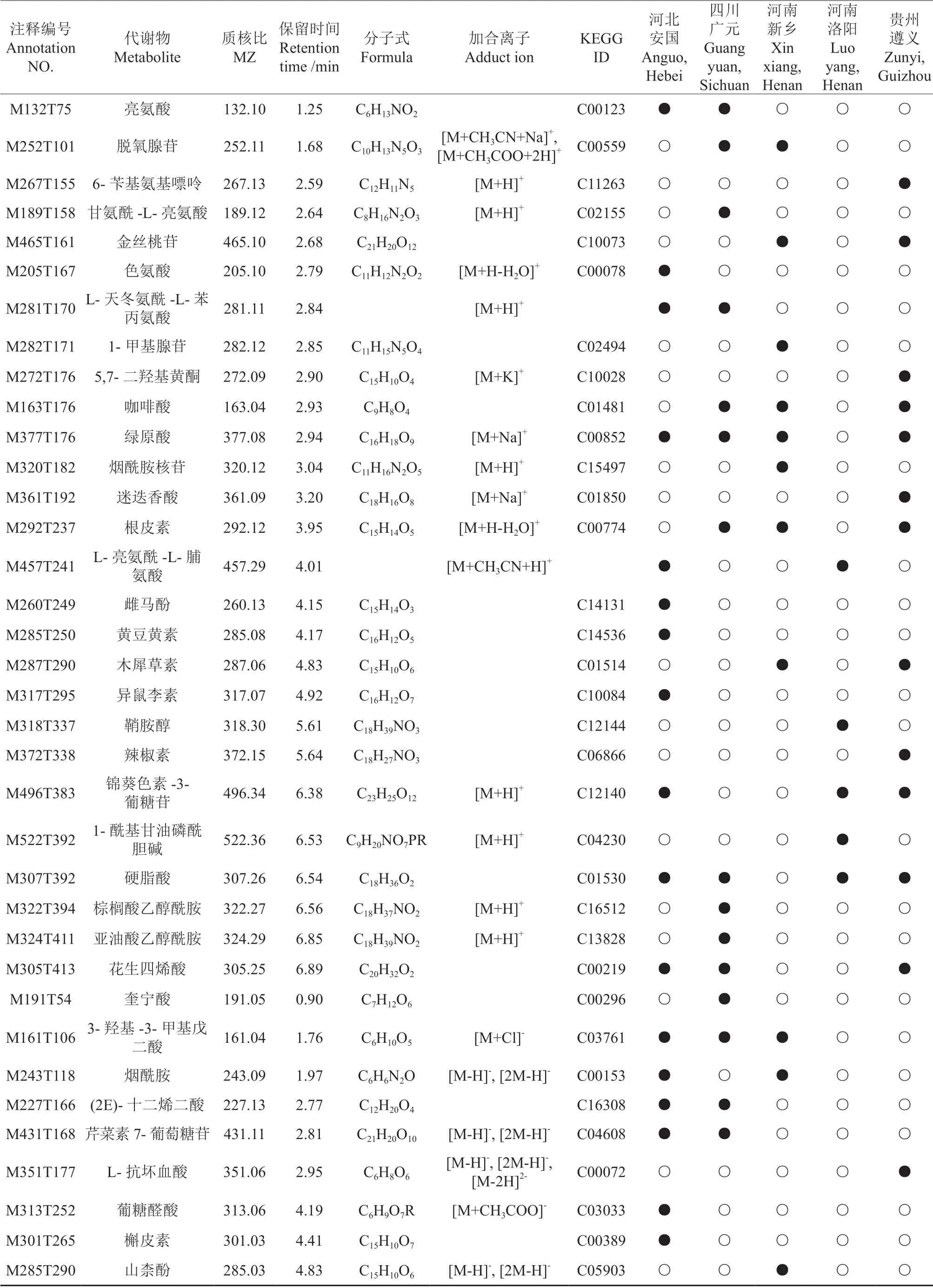
续表4Continuation of table 4

图5 不同产地杜仲雄花差异代谢物的火山图Fig.5 Volcanic map of differential metabolites in male flowers of Eucommia ulmoides from different producing areas
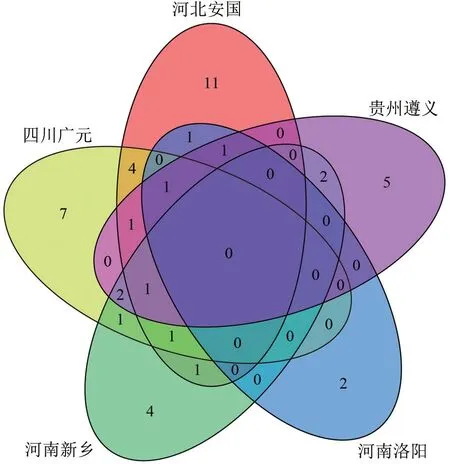
图6 不同产地杜仲雄花差异代谢物的韦恩图Fig.6 Venny plot of differential metabolites in male flowers of Eucommia ulmoides from different producing areas
2.3.4 差异代谢物聚类及通路分析
根据筛选出的差异代谢物的特征进行聚类分析(图7),河北安国、四川广元、河南新乡、河南洛阳、贵州遵义杜仲种质分别有4、1、5、4、11 个代谢物的表达量明显高于其他种质,即相对成分含量增加。河北安国杜仲相对于其他产地杜仲种质上调的化合物为硬脂酸、3-羟基-3-甲基戊二酸、烟酰胺、雌马酚。四川广元杜仲上调的化合物为芹菜素7-葡萄糖苷。河南新乡杜仲上调的化合物为烟酰胺核苷、1-甲基腺苷、脱氧腺苷、3-羟基己糖、根皮素。河南洛阳杜仲上调的化合物为L-亮氨酰-L-脯氨酸、1-酰基甘油磷酰胆碱、鞘胺醇、锦葵色素-3-葡糖苷。贵州遵义杜仲上调的化合物最多,为咖啡酸、木犀草素、5,7-二羟基黄酮、金丝桃苷、迷迭香酸、辣椒素、花生四烯酸、硬脂酸、绿原酸、L-抗坏血酸、6-苄基氨基嘌呤。通过KEGG 数据库对差异代谢物质进行通路富集分析,45 种显著差异的代谢物主要分布在4 条代谢途径中,分别为氨酰基-tRNA 生物合成、类黄酮生物合成、黄酮和黄酮醇的生物合成、ABC 转运蛋白。
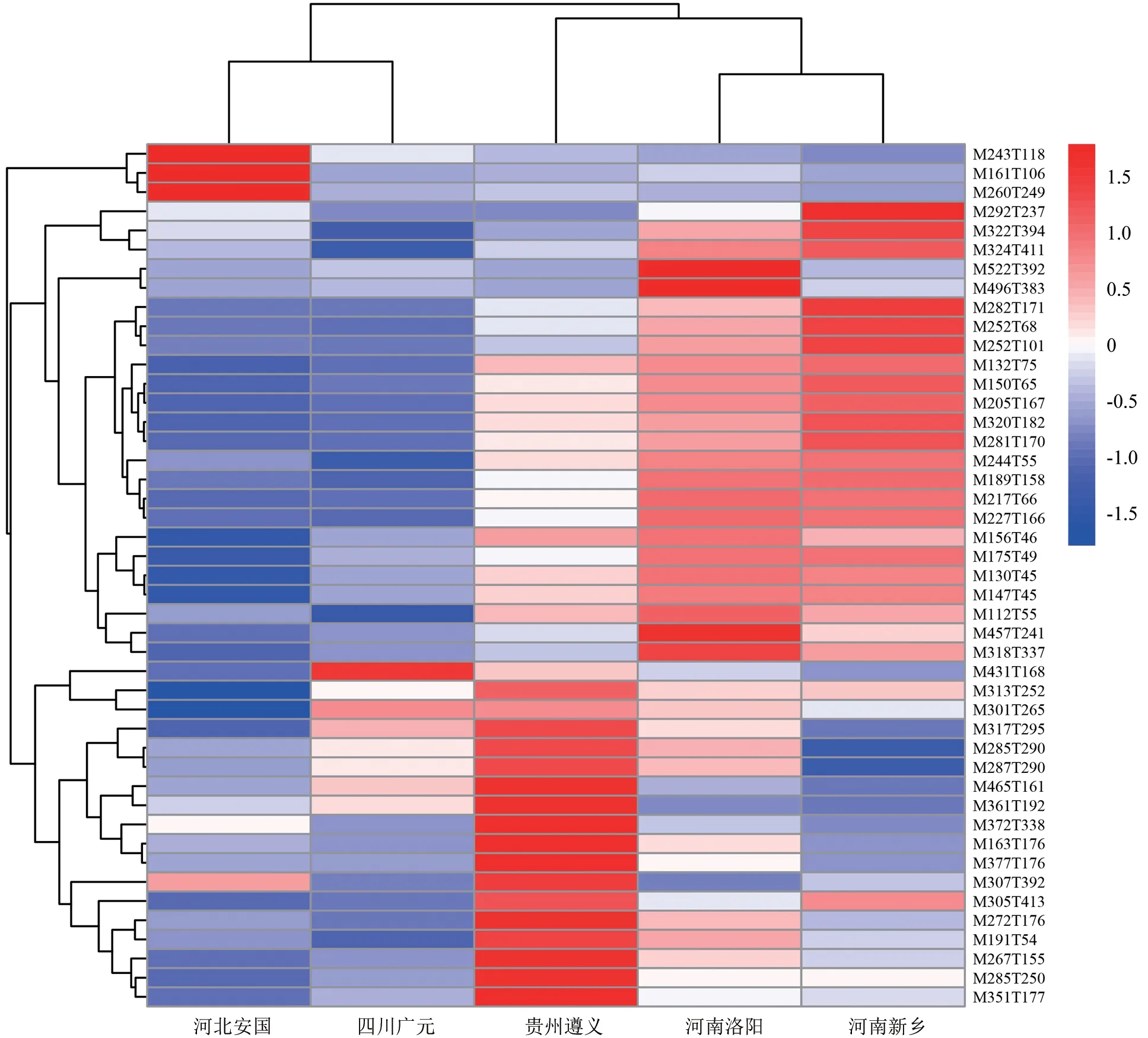
图7 不同产地杜仲雄花间差异代谢物聚类分析Fig.7 Cluster analysis of differential metabolites among male flowers of Eucommia ulmoides from different producing areas
3 讨论与结论
代谢组学包括靶向和非靶向,其中非靶向代谢组学能从整体反映代谢物的变化,提供更广泛的代谢物覆盖,实现不同样品间代谢特征的比较[19-20]。本研究采用UPLC-QTOF/MS 结合多元统计方法,对不同产地杜仲的雄花进行代谢组学分析,在ESI+模式和ESI-模式下分别获得13 341个和10 387 个特征离子,对一级质谱信息进行筛选,ESI+和ESI-模式下定性到1 368 个代谢物和899 个代谢物。检索公共数据库in-house 标准数据库二级质谱图,筛选定性到正离子模式212 个代谢物和负离子模式37 个代谢物。通过PCA 分析,不同样本表现出明显的分离趋势,表明不同产地杜仲雄花的代谢组具有一定的差异性。
通过对差异代谢物的筛选,共筛选出45 个显著差异代谢物,主要参与氨酰基tRNA 生物合成、类黄酮生物合成、黄酮和黄酮醇生物合成以及ABC 转运蛋白等代谢途径。其中,黄酮类化合物最多,为11 个;其次是羧酸及其衍生物,为10 个。严颖等[5]对杜仲雄花中木脂素类、环烯醚萜类、苯丙素类和黄酮类等32 种成分进行了初步鉴定,丁艳霞等[21]从杜仲雄花95%乙醇提取物中分离鉴定了柚皮素、槲皮素、异鼠李素-3-O-β-D-葡萄糖苷、芦丁、紫云英苷等10 个黄酮化合物。在本研究中也同样鉴定到紫云英苷、柚皮素、山柰酚、槲皮素、芦丁等黄酮类化合物。前期系统研究了不同种质杜仲雄花主要活性成分含量的多样性,发现京尼平苷酸变异系数最大,其次是异槲皮苷、绿原酸等[14]。测定了杜仲种质资源雄花中的17 种氨基酸,发现脯氨酸(Pro)、半胱氨酸(Cys)、赖氨酸(Lys)和蛋氨酸(Met)变异系数相对较高[15]。含量变化程度较高的代谢成分绿原酸、赖氨酸(Lys)和蛋氨酸(Met)在本研究中筛选为差异代谢物。
贵州遵义杜仲种质酚类化合物咖啡酸,苯丙素类化合物迷迭香酸、绿原酸,黄酮类化合物5,7-二羟基黄酮、木犀草素、金丝桃苷含量明显高于其他种质。河南洛阳杜仲种质锦葵色素-3-葡糖苷含量明显高于其他种质。杜庆鑫等[22]发现不同变异类型的红叶杜仲叶片绿原酸、京尼平苷、总黄酮、花色苷含量明显高于绿叶杜仲。河南洛阳和贵州遵义雄花颜色呈现紫红色和青紫色,可能与黄酮类化合物含量具有一定相关性。通过对不同产地杜仲雄花的形态特征进行测定,发现河南洛阳和贵州遵义杜仲种质的雄花序数量、单雄花序鲜质量、雄花序长度和宽度、雄花数量和长度、雄蕊数量和长度与其他种质相比平均值较高,且河南洛阳和贵州遵义产地的种质相对于其他产地上调的差异代谢物较多,含量较高。Shi 等[23]对小麦重组自交系进行了代谢产物-农艺性状关联,发现共定位于同一位点的代谢产物与农艺性状显著相关。差异代谢物可能与杜仲雄花形态性状有一定的相关性,有待进一步研究。
LC-MS 仪器具有高灵敏性和多功能性,可以在非靶向代谢组学研究中检测数万个特征,是代谢组学研究中应用最广泛的平台[24-25]。但是在测定过程中不可避免地产生大量错误的阳性信号并与真实信号相混合,且存在同位素和加和离子,检测到的代谢数据很大部分是冗余的[26-27]。在本次检测过程中存在很多假阳性质谱峰信号无法注释到代谢物,加之数据库中很多代谢物存在同分异构体,导致鉴定结果出现很多一个特征离子对应多个代谢物,影响代谢物注释,因此后续需要对注释出的代谢物进行靶向代谢组验证。本研究对5 个代表性产地杜仲雄花进行了代谢组学分析,初步证明不同雄花种质的代谢成分存在明显差异,但是从代谢组角度出发开展杜仲种质资源的精准评价,需要测定更多的种质资源进行进一步的探索研究。

