变温调控破囊壶菌发酵生产二十二碳六烯酸
张明亮,王俊,翁可欣,李力,黄建忠,林清强*
1(福建师范大学 生命科学学院,福建 福州,35018) 2(工业微生物发酵技术国家地方联合工程研究中心,福建 福州,35018)
二十二碳六烯酸(C22:6,cis-4,7,10,13,16,19-docosahexaenoic acid,DHA)对人类健康起重要生理作用,能影响细胞膜功能、增强机体免疫、治疗抑郁症、治疗和预防心脑血管疾病、抗肿瘤、抗炎、对抗肥胖、促进大脑发育、促进视力发育和预防老年痴呆等[1]。人类和哺乳动物无法从头合成DHA,只能从食物中摄取。DHA的主要来源是鱼类和植物。由于鱼油容易受环境污染,存在食品安全隐患,人们对从可持续、安全和经济生产DHA的替代资源的研究越来越广泛。许多微生物物种/菌株具有大量合成DHA的能力,且DHA占总脂肪酸的比例很高,这些天然生产者主要包括海洋细菌、真菌、原生生物和微藻。破囊壶菌(Aurantiochytriumsp.)是从海水中分离得到的海洋单细胞真菌,其生长快,生物量高,油脂及DHA含量较高,一直以来被认为是理想的DHA生产菌株[2-4]。同时,破囊壶菌与裂殖壶菌(Schizochytriumsp.)的同源性很高[5],后者也是当前DHA产业化的主要生产菌,其安全性已得到论证[6]。
近些年来,微生物生产DHA的发酵工艺研究比较多,如通过控制溶氧、pH及优化碳源提高DHA产量等[7-9]。温度对产油微生物生物量、油脂含量及组成的影响已有一些研究报道[5,10-12]。温度是DHA生物合成的一个非常重要的环境因素。本课题组前期研究低温胁迫对裂殖壶菌DHA生物合成及超氧化物歧化酶(superoxide dismutase,SOD)表达的影响,发现低温有利于DHA的积累,低温胁迫下SOD的mRNA表达量最高[13]。近年,温度促进DHA积累的机制也有一些研究报道,MA等[14]通过转录组测序手段研究了低温对Aurantiochytriumsp.积累DHA的影响,发现参与信号转导、细胞成分的生物合成、糖脂代谢的相关基因的差异表达对菌体低温适应至关重要;HU等[15]研究了低温对裂殖壶菌生物合成DHA的影响及机制,低温可以显著增加DHA占总脂肪酸的含量,但负责DHA生物合成的聚酮合酶(polyketide synthase,PKS)途径基因的表达水平没有明显的差异,而支链氨基酸降解途径和戊糖磷酸途径及其相关基因表达明显上调,饱和脂肪酸生物合成(脂肪酸合成途径基因和苹果酸酶)明显下调,这促进了大量底物乙酰-CoA进入PKS途径合成DHA。低温可以显著提高DHA占总脂肪酸的含量,但对细胞生物量的积累不利。另外,不同温度对油脂的积累也有明显的影响,但如何平衡三者量的关系,温度优化调控可能是DHA工业化发酵生产过程中的关键。
本研究以Aurantiochytriumsp.FN21为研究对象,该菌为经纤维素水解液驯化的破囊壶菌突变株,在富营养培养基中拥有积累较高DHA水平的能力[16]。通过优化温度调控策略,实现生物量、总脂肪酸含量及DHA的含量平衡,以促进DHA产量提高,也为提高DHA产量及品质提供新思路。
1 材料与方法
1.1 主要仪器设备
YXQ-2S-30SⅡ高压灭菌锅,上海博迅实业有限公司;SW-CJ-2G超净工作台,苏州净化设备有限公司;ZHWY-2122B双层全控温摇床,上海智诚分析仪器有限公司;SBA-40D生物传感器,山东省科学院生物研究所;GUJS-15-100 AUTOBIO型全自动机械搅拌成套不锈钢发酵罐,镇江东方生物工程设备技术有限责任公司;Microfuge©22R高速台式冷冻离心机,BECKMAN COULTEK;DO电极、pH电极计,METTLER TOLEDO;6890C-5975N气质联用仪,Agilent。
1.2 菌株
破囊壶菌(Aurantiochytriumsp.FN21),海水中分离筛选并通过纤维素水解液驯化,保存于-80 ℃超低温冰箱中。
1.3 培养基
种子培养基(g/L):葡萄糖30,蛋白胨10,酵母浸汁粉5,海水晶15。发酵培养基葡萄糖含量为90 g/L,其他配方参考课题组前期已发表文献[16]。
1.4 培养条件
15 L发酵罐发酵:按接种量5%~10%将种子液移入发酵罐中,初始发酵体积8 L,葡萄糖20 g/L,通气量1.0~2.0 vvm(air volume/culture volume/min),搅拌速度200~600 r/min(根据溶液控制),在24~108 h间流加700 g/L的葡萄糖,每隔12 h取样,测定残糖含量、生物量、油脂含量及DHA含量。
1.5 测定方法
发酵液残糖含量测定:取1 mL发酵样品8 000 r/min,5 min离心,去除菌体及固体残渣,取上清液,稀释至合适浓度,使残糖值下降至0.6~0.8 g/L,使用生物传感器测定样品葡萄糖含量,残糖量=测量值×稀释倍数。细胞干重、总脂肪酸含量及脂肪酸组成分析参考课题组前期发表的文献[16]。
2 结果与分析
2.1 温度对破囊壶菌生物量、总脂肪酸产量及DHA产量的影响
ZENG等[12]考察了不同温度对裂殖壶菌产DHA的影响,发现低温(15 ℃)会延长细胞的培养的时间,当温度>35 ℃时,细胞生长受到抑制,20~30 ℃为裂殖壶菌较佳的培养温度。在摇瓶发酵水平考察了温度对破囊壶菌生物量、总脂肪酸产量及DHA产量的影响,分别设置了15、20、25、28、30、35 ℃的培养温度。从图1-a可知,当培养温度为15 ℃时,Aurantiochytrium.sp.FN21的生物量明显减少,其生长受到抑制。当温度为20~35 ℃时,可以获得较大的菌体生物量,尤其是当温度为28 ℃时,菌体生物量最大为41.41 g/L,说明此温度为菌体最适的生长温度。由图1-b可知,温度对Aurantiochytriumsp.FN21总脂肪酸的作用规律与生物量类似,20~35 ℃的培养温度较利于破囊壶菌油脂的积累。当培养温度为28 ℃时,收获最大的总脂肪酸量达到18.13 g/L。15 ℃培养时,总脂肪酸产量较低(4.41 g/L),主要是由于此温度下培养获得的生物量较低。
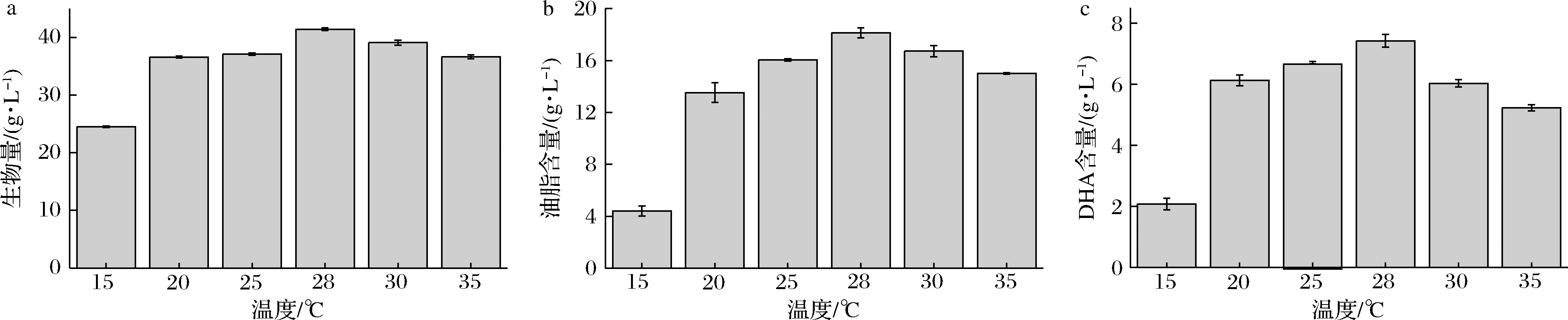
a-生物量;b-油脂含量;c-DHA含量图1 温度对破囊壶菌细胞生长、油脂含量及DHA含量的影响Fig.1 Effects of temperature variation on biomass,total lipid and DHA production by Aurantiochytrium sp.FN21.
在不同温度培养条件下,破囊壶菌的DHA产量变化较大,其变化趋势总体与菌体生物量及总脂肪酸产量的变化趋势呈正相关,但也有一些差异。当培养温度为15 ℃时,DHA产量最低为2.08 g/L,主要是因为该温度下菌体生物量及总脂肪酸量均比较低。随着培养温度的升高,DHA产量显著提高,培养温度为28 ℃时达到最大值7.42 g/L,但培养温度进一步提高,DHA产量的降幅也明显增加(图1-c所示),说明DHA占总脂肪酸的比例可能有明显的下降。
2.2 温度对破囊壶菌油脂含量及组成的影响
从表1可知,不同培养温度对破囊壶菌油脂含量及组成的影响较大。15 ℃培养时,菌体油脂占细胞干重含量最低(18.02 g/L),但DHA占总脂肪酸的比例最高为47.16%。当培养温度为25~28 ℃时,油脂含量处于最高区间(42.81~43.78 g/L),说明此温度阶段有利于油脂积累。随着温度的升高,DHA占总脂肪酸的含量降低,从15 ℃时的47.16%降低到了35 ℃时的32.71%。另外,二十二碳五烯酸(docosapentaenoic acid,DPA)与DHA的比值(DPA/DHA)不断增加(从0.12到0.33),说明低温有利于DHA的积累,同时可降低DPA的生成。而C16∶0(棕榈酸)的含量随着培养温度的升高而升高,说明高温利于饱和脂肪酸的形成。特别值得注意的是,温度越低,奇数不饱和脂肪酸(C15)含量越低,可能低温有利于脂肪酸α-氧化途径的进行,因为奇数碳脂肪酸是通过此途径形成[17]。
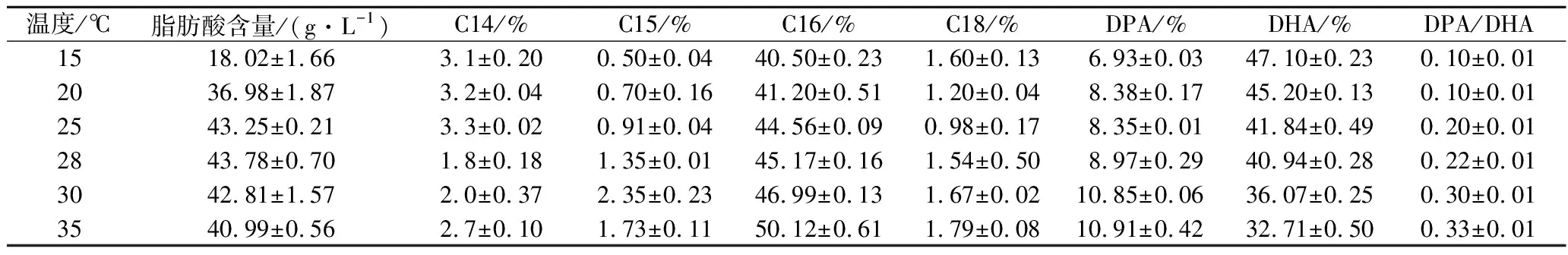
表1 不同培养温度下破囊壶菌脂肪酸的组成Table 1 Fatty acid compositions (of total fatty acids) of Aurantiochytrium sp.FN21 under different temperature
2.3 分阶段控温提高DHA产量
破囊壶菌发酵过程可分为细胞数量增长期和细胞体积增长期。在第1个时期,细胞数量增加,体积增加不明显。第2个时期细胞数目几乎不增加,细胞体积变大,胞内脂质大量积累。由上述结果可知,当培养温度为28 ℃时,可以收获最大的菌体生物量,当温度区间为25~30 ℃时,总脂肪酸占细胞干重的量最优。随着温度的降低,能够明显的增加DHA占总脂肪酸的含量。基于Aurantiochytriumsp.FN21的生长特性,我们设计了以下变温策略:0~84 h时28 ℃培养,84~120 h时20 ℃培养(二阶段控温);0~84 h培养温度为28 ℃,84~108 h为25 ℃,108~120 h为15 ℃(三阶段控温),分别研究其对破囊壶菌生长、油脂及DHA产生的影响,结果如表2所示。
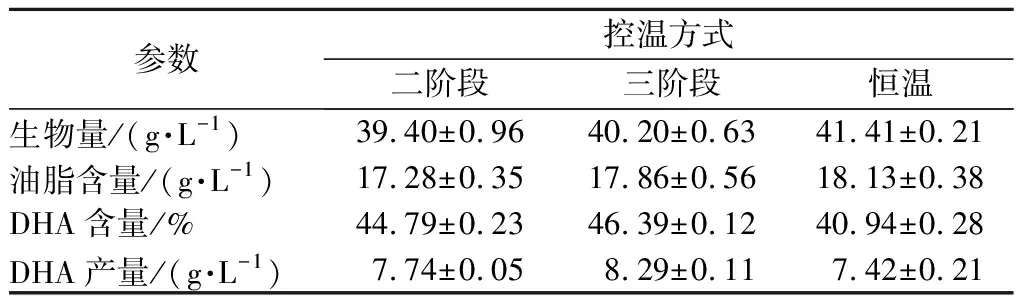
表2 控温方式对破囊壶菌发酵的影响Table 2 Effects of different temperature control mode on the fermentation of Aurantiochytrium sp.FN21
由表2可知,与对照组(全程28 ℃培养)相比,二阶段和三阶段控温培养对破囊壶菌生物量及油脂含量均有微降,而DHA占总脂肪酸量的比例有显著提高,三阶段控温DHA含量46.39%,二阶段控温时DHA含量为44.79%,相比对照组,分别提高了11.33%和10.94%。采用三阶段控温策略可以有效地平衡生物量、油脂含量及DHA占总脂肪酸含量三者的关系,使它们均达到较高的水平,最终DHA产量达8.29 g/L,比对照提高了11.73%。
2.4 三阶段控温对分批补料培养破囊壶菌产DHA的影响
根据以上实验结果,我们在15 L发酵罐中采取三阶段控温策略高密度发酵破囊壶菌生产DHA,实验结果见图2。
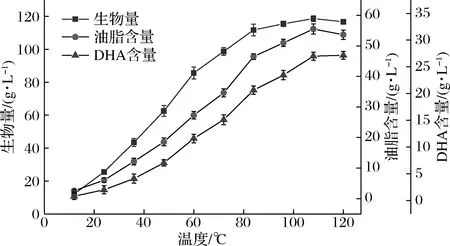
图2 采用三阶段变温发酵破囊壶菌的生长、油脂含量 及DHA积累曲线Fig.2 The curve of growth,total lipid and DHA accumulations by Aurantiochytrium sp.FN21 under three-phase temperature shifting
从图2可知,在整个发酵过程中,破囊壶菌的生物量、油脂含量及DHA含量均不断提高。当84 h变温(25 ℃,84~108 h)后,菌体生物量、总脂肪酸含量及DHA含量增幅减小,108 h开始以15 ℃发酵,生物量有略微下降,可能是由于细胞停止生长,小部分菌体开始裂解。120 h时油脂含量有所降低,从108 h的55.15 g/L减少到了53.63 g/L,说明低温减少总脂肪酸占比;而120 h比108 h的DHA产量略有增加(从26.99 g/L增加到27.17 g/L),这主要由于DHA占总脂肪酸的含量还在上升,从48.62%上升到了50.66%。
来源于Schizochytrium和Aurantiochytrium的高产DHA的菌株,DHA含量均可达40%以上[4]。采用分批补料的高密度培养模式,可以最大程度的得到高的生物量、油脂含量及DHA产量。CHANG等[18]研究了溶氧对高密度培养Schizochytriumsp.S31产DHA的影响,优化发酵工艺后DHA产量达21.26 g/L,占总脂肪酸的33.94%;LI等[19]优化了碳源使用策略,AurantiochytriumlimacinumSR21发酵得到32.36 g/L,占总脂肪酸的43.70%。这两项研究获得的DHA产量均处于较高水平,但DHA占总脂肪酸含量的比例偏低,说明还有一定的提升空间。YIN等[9]采取分阶段控制pH策略,优化了发酵中细胞生长与DHA合成的平衡关系,最终,生物量、油脂含量及DHA占总脂肪酸含量均得到提高。本研究借鉴此策略,经三阶段控温,提高了DHA的品质及产量,最终DHA产量达27.17 g/L(表3),处于国内外较先进的发酵水平。
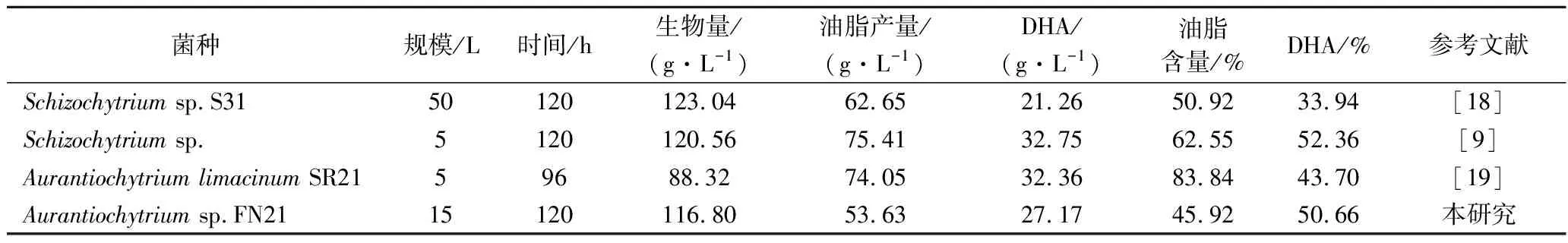
表3 部分高产DHA菌株的发酵水平Table 3 Some stains of high DHA productivity for fermentation
3 结论与讨论
本研究探索了不同温度对破囊壶菌Aurantiochytriumsp.FN21的生物量,总脂肪酸产量及DHA产量的影响。我们发现,低温利于DHA积累但不利于细胞生长,高温利于细胞生长但不利于DHA合成。基于摇瓶实验结果,提出了三阶段控温策略,在发酵前期(0~84 h),采用最利于细胞生长及产油的温度(28 ℃)培养;至发酵中后期(84~108 h),采取较有利于细胞生长、产油及DHA积累的温度(25 ℃)培养;最后发酵阶段(108~120 h),不考虑生物量及油脂含量的积累,采取更低温度(15 ℃)进一步胁迫破囊壶菌积累DHA,最终在15 L发酵罐中培养获得27.17 g/L的DHA,且DHA占总脂肪酸比例较高(50.66%)。本研究为破囊壶菌工业化发酵生产DHA提供了借鉴。

