青杨天牛嗅觉相关基因的鉴定及表达谱分析
张健 谢婉莹 董曼羽 付立波





摘要:为探讨青杨天牛嗅觉基因的种类,以期为采用RNA干涉技术调控青杨天牛种群提供理论依据,采用Illumina HiSeqTM 2500测序平台对青杨天牛的触角进行转录组测序,利用BLAST同源搜索的方法鉴定嗅觉相关的基因,采用RT-PCR技术研究嗅觉相关基因的表达谱。共鉴定出青杨天牛嗅觉基因包括:43个气味结合蛋白(OBP)、15个化学感受蛋白(CSP)、56个嗅觉受体(OR)和24个离子受体(IR)。反转录PCR(RT-PCR)结果表明,青杨天牛的嗅觉基因存在性别及组织器官间的特异性。
关键词:青杨天牛;嗅觉基因;表达分析
中图分类号: Q969.511.4;S186文献标志码: A
文章编号:1002-1302(2022)04-0023-06
收稿日期:2021-03-19
基金项目:吉林省教育厅科学技术研究项目(编号:JJKH20210880KJ);长春师范大学自然科学基金(编号:2019-12)。
作者简介:张 健(1981—),男,吉林长春人,博士,副教授,主要从事昆虫学研究。E-mail:zhangjian@ccsfu.edu.cn。
通信作者:付立波,博士,教授,主要从事生理学研究。E-mail:15804303739@163.com。
昆虫在与植物长期协同进化的过程中,形成高度特化并且灵敏的嗅觉感受系统以识别外界环境中的各种化学信号,并将其转化为体内的电信号,最终指导昆虫完成寄主选择、求偶、交配、产卵、躲避天敌等一系列的行为[1-2]。参与昆虫嗅觉识别的蛋白质,主要包括:气味结合蛋白(odorant binding proteins,OBPs)、气味受体(odorant receptors,ORs)、化學感受蛋白(chemosensory proteins,CSPs)、感觉神经膜蛋白(sensory neuron membrane proteins,SNMPs)、离子型受体(ionotropic receptors,IRs)、气味降解酶(odorant-degrading enzymes,ODEs)等[3-4]。
青杨天牛(Saperda populnea)隶属鞘翅目(Coleoptera)、天牛科(Cerambycidae)、沟胫天牛亚科(Lamiinae)、楔天牛属(Saperda),又名青杨楔天牛[5],广泛分布于我国的北方地区,是我国重要的森林防治检疫对象,主要危害杨属(Populus)和柳属(Salix)的林木[6]。青杨天牛的幼虫主要钻蛀幼龄杨树的枝干,受害部位形成纺锤状的虫瘿,阻碍杨树养分的正常运输,造成枝梢干枯,易遭风折,如危害在幼树主干髓部,可造成整株枯萎死亡[7]。由于天牛体表具有较为坚硬的鞘翅,传统的化学防治及生物防治手段很难达到理想的防治效果。目前,基于天牛成虫与寄主植物之间化学信息联系的化学生态研究,已成为天牛防治新途径的研究热点。诸多研究表明,天牛的嗅觉在利用寄主植物释放的挥发性次生物质识别寄主的过程中起非常关键的作用。本研究旨在通过转录组测序和RT-PCR技术确定青杨天牛主要的嗅觉相关蛋白基因及其表达谱情况,为基于嗅觉调控的环境友好型害虫防治新技术的设计和开发提供依据。
1 材料与方法
1.1 试验材料
在吉林省白城市镇赉县采集到被青杨天牛危害的青杨树枝,带回室内并在养虫笼中培养[温度:(27±1) ℃,湿度:(75±5)%,光—暗周期16 h—8 h]直到成虫羽化,并饲喂杨树侧枝和叶子。
1.2 试验方法
1.2.1 RNA提取和cDNA合成
在体式显微镜下,使用DEPC处理过的镊子将羽化10 d左右的青杨天牛成虫触角剥离,共选取20头成虫,分别包括10头雌虫和10头雄虫。获取的组织在使用前需在经DEPC处理过的1 ∶1的水和乙醇溶液中在冰上保存。总RNA的提取使用TRIzol溶液将触角混匀,提取后,在乙醇/异丙醇沉淀中加入30 μL去RNA酶水。在提取结束后,整个RNA用Nano-Drop 2000(Thermo Fisher Scientific,Waltham,MA,USA)和1%琼脂糖凝胶电泳检测。在紫外吸收值 230 nm/260 nm和260 nm/280 nm下检测RNA产物的纯度,在28S rRNA条带证实了RNA的完整性。在RT-PCR试验中从5头天牛个体中获得RNA样品。从雌性样品中得到共2 000 ng的总RNA。因此,相同数量的总RNA被转化成cDNA,通过20 μL体系,包括:4 μL的first-strand buffer(250 mmol/L Tris pH值8.3、375 mmol/L KCl和15 mmol/L MgCl2),1 μL 10 mmol/L dNTP mix、1 μL RNaseout、1 μL DTT(0.1 mol/L)、1 μL oligo-(dT) 20 primer(50 μmol/L)和1 μL Superscript Ⅲ reverse transcriptase(200 units/μL)(Invitrogen,15 Carlsbad,CA,USA)。cDNA的合成在50 ℃下进行45 min后在70 ℃下进行15 min。
1.2.2 RNA测序、组装和功能注释
对于RNA测序,总RNA样品用Qubit 2.0 (Thermo Fisher Scientific,Waltham,MA,USA)和Agilent 2100 Bioanalyzer(Agilent Technologies,Santa Clara,CA,USA)进行测序。高质量的RNA被送到博瑞得科技公司(中国杨凌)用于cDNA的建库和测序。mRNA的纯化使用magnetic oligo(dT)beads(中国北京全式金)。RNA序列库用AMPure XP bead kit的随机接头引物来进行Illumina 测序(Beckman Coulter,Inc.,Brea,CA,USA)。触角cDNA样品使用AMPure XP beads(Beckman Coulter,Inc.)进行纯化。短cDNA片段通过末端修复配适器进行扩增。合适长度的片段利用Agencourt AMPure XP beads(Beckman Coulter,Inc.)选择并通过PCR进行扩增。测序通过Illumina HiSeqTM 2500进行。
1.2.3 青杨天牛嗅觉相关基因的鉴定
根据本研究转录组测序的结果,与已鉴定出的包括云斑天牛[8]、松褐天牛[9-10]和光肩星天牛[11]的嗅觉基因序列进行比对分析,对青杨天牛嗅觉基因进行命名。
1.2.4 青杨天牛嗅觉相关基因RT-PCR
收集不同组织时选取触角20对、头部(去除触角)10个、胸部10个、腹部10个、足和翅各30对。选择青杨天牛触角具有全长阅读框的同源基因,其中包括:22个OBP、9个CSP、9个OR、4个触角IR(IR8a1、IR8a2、IR25a和IR76b)及它们的亚型进行RT-PCR分析。进行半定量RT-PCR的cDNA样品制备同上。为进行表达定量和半定量RT-PCR试验,从雌性天牛触角和其他器官提取的1 μL DNA酶处理后的cDNA样品作为模板,以β-Actin作为内参基因。
PCR反应条件如下:94 ℃预变性1 min 30 s;94 ℃ 变性30 s,55 ℃退火30 s,68 ℃ 延伸30 s,32个循环;最后68 ℃ 7 min。12 μL的扩增产物检测采用1%琼脂糖凝胶电泳检测。每个扩增产物至少进行3次重复,采用ImageJ 1.6(http://rsb.info.nih.gov/ij/)进行分析。
2 结果与分析
2.1 青杨天牛触角转录组生物信息学分析
2.1.1 转录组测序产量统计
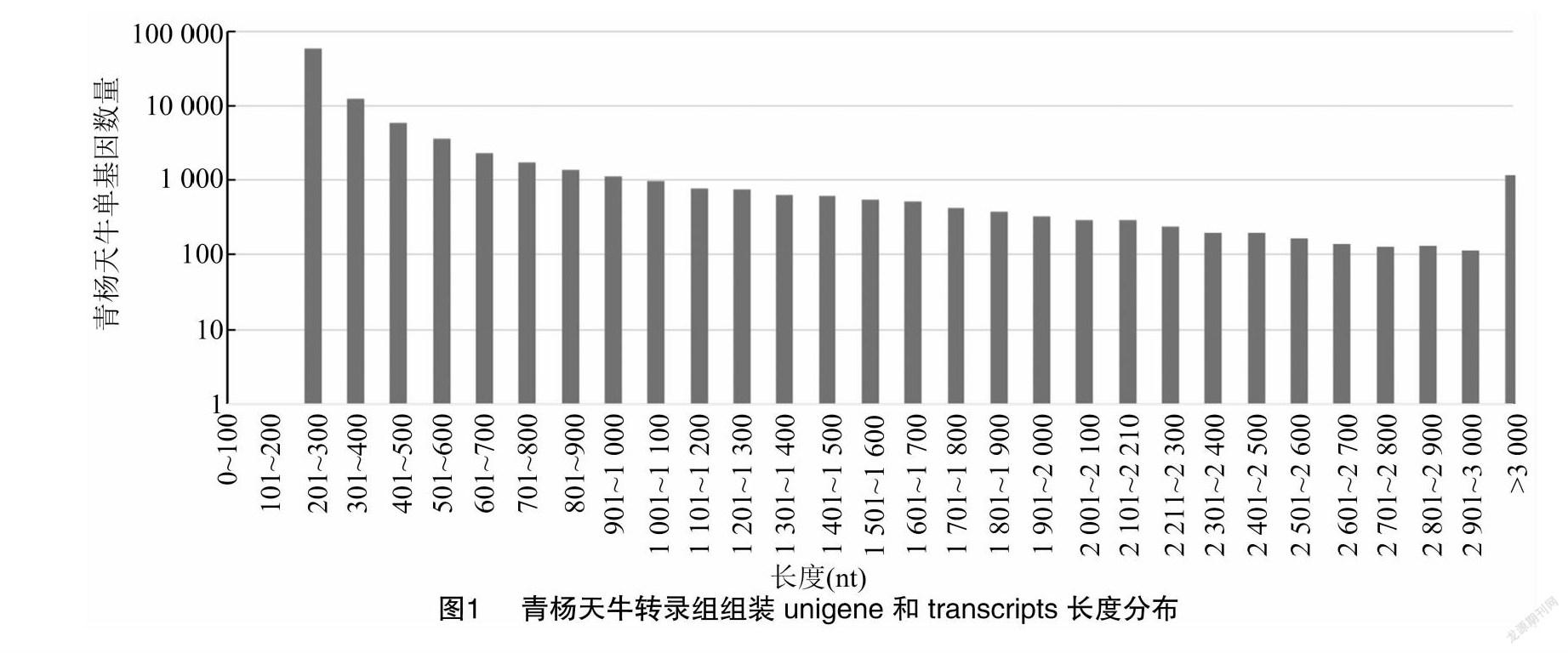
由图1可知,测序产生的clean碱基数为15.35 Gb。最终筛选得到 87 984 条unigene。所有87 984條unigene平均长度为471.41 bp,其中长度(1~2 kb)有5 612 unigene,长度(>2 kb)有2 492 unigenes,长度超过 1 kb 有8 104 unigene,其中36 147 unigene与已知蛋白基因匹配。
2.1.2 基因功能注释
由图2可知,GO分类结果,12 932个成功进行GO注释的unigene可以分成3个类别:累积到生物学过程(biological process)不同亚类的26 942个次,细胞组分(cellular component)不同亚类的17 735个次,归到分子功能(molecular function)不同亚类的15 944个次。在生物学过程类别中,metabolic process和cellular process基因数最高,分别为8 343个和6 174个;细胞组分类别中,cell part和cell是最高的2个亚类,分别是3 963个和 3 961个;而与触角基因表达相关的catalytic activity和binding是分子功能类别中丰度最高的2个亚类,分别为7 203个和6 270个。
由图3可知,青杨天牛触角unigene按照同源基因数据聚类(COG,clusters of orthologous groups databases)功能注释,可分为 25 个功能群。其中,注释为一般功能预测类,复制、重组及修复类,翻译与核糖体构建及合成生物源类的unigene个数最多,分别为3 051、1 349、1 279条;而注释为核酸结构类、细胞外结构类、RNA加工和修饰类的unigene最少,分别为4、19、80条。
2.2 青杨天牛嗅觉相关基因的鉴定
由表1、表2可知,共鉴定出青杨天牛嗅觉基因包括:43个OBP、15个CSP、56个OR和24个IR。根据它们的长度、启动子密码子、终止密码子和蛋白质结构,22个OBP、9个CSP、4个OR和2个IR具有全长的开放阅读框。
2.3 青杨天牛嗅觉相关基因的表达
由图4可知,RT-PCR试验结果表明,虽然SpopOBP3、SpopOBP4、SpopOBP6、SpopOBP9、SpopOBP10、SpopOBP23、SpopOBP27、SpopOBP29、SpopOBP33和SpopOBP38在非嗅觉组织中表达,大量的嗅觉基因仍在触角特异性的表达。其中,SpopIR76b、SpopOR24、SpopOBP3、SpopOBP4、SpopOBP6、SpopOBP16、SpopOBP17、SpopOBP19、SpopOBP23、SpopOBP24、SpopOBP33、SpopCSP3、SpopCSP4、SpopCSP5和SpopCSP7 在青杨天牛的触角中高表达。
3 讨论与结论
本研究共鉴定出青杨天牛嗅觉基因主要包括:43个气味结合蛋白(OBP)、15个化学感受蛋白(CSP)、56个嗅觉受体(OR)和24个离子受体(IR)。这些基因存在性别特异性,后续应进一步深入研究。
与光肩星天牛的OR相比较[11],由表2可知,青杨天牛的OR数量相对较低,说明大量青杨天牛的OR可能没有被鉴定出来。然而,青杨天牛的OR数量明显高于松褐天牛,说明本研究中的测序深度是足够的。此外,本研究鉴定出43种青杨天牛的OBP,在光肩星天牛和松褐天牛分别鉴定出51种和52种[10-11],为以后进一步的嗅觉相关基因进化分析提供了充足的数据。
大量的CSP在非嗅觉组织中,表明CSP的功能是探测二氧化碳、幼虫的发育和足的再生[12]。SpopOBP24在雌性触角中高表达,说明该基因与雌虫的特异性行为有关,例如交配和产卵。Zhang等研究表明,在一些种类的天牛中存在接触性性信息素(contact sex pheromone)[13],因此SpopOBP24值得进一步深入研究。SpopOBP23、SpopCSP3和SpopCSP4在雄性触角中高表达。Leal等发现一些种类的天牛存在雄性信息素,但青杨天牛的性信息素成分目前并不明确,有必要进一步对SpopOBP23、SpopCSP3和SpopCSP4的功能进行研究[14]。
截至目前,对鞘翅目昆虫当中嗅觉感受蛋白的研究国内外仅报道30余个种[11-12,15],天牛科昆虫中报道了8个种[16-21],仅光肩星天牛和赤拟谷盗等个别物种大部分嗅觉蛋白家族有系统报道,绝大多数的物种仅研究了1个或几个蛋白家族甚至或仅报道了个别嗅觉基因序列。由于序列和物种的数量有限,不能对整个嗅觉蛋白家族进行进化分析,无法将OBPs等进一步划分到各个亚型,鞘翅目作为昆虫纲最大的一个目,未来有更多物种的嗅觉基因采用分子生物学手段进行鉴定,这有利于促进整个昆虫纲嗅觉蛋白的进化研究。另外,通过RNA干涉技术或基因敲除等手段观察昆虫行为也是未来需要进一步拓展的方向。
参考文献:
[1]杜立啸,刘 杨,王桂荣. 昆虫外周嗅觉系统信号转导机制研究进展[J]. 中国科学(生命科学),2016,46(5):573-583.
[2]Leal W S. Odorant reception in insects:roles of receptors,binding proteins,and degrading enzymes[J]. Annual Review of Entomology,2013,58:373-391.
[3]巩中军,周文武,祝增荣,等. 昆虫嗅觉受体的研究进展[J]. 昆虫学报,2008,51(7):761-768.
[4]张 瑜,张胜男,张媛媛,等. 昆虫嗅觉机制研究进展[J]. 福建农业学报,2016,31(5):538-544.
[5]萧刚柔. 中国森林昆虫[M]. 2版.北京:中国林业出版社,1992:510-511.
[6]李亚杰. 中国杨树害虫[M]. 沈阳:辽宁科学技术出版社,1983:321-325.
[7]刘 娥,李成德. 青杨楔天牛危险性分析[J]. 林业科技开发,2009,32(2):70-72.
[8]Li H,Zhang A,Chen L Z,et al. Construction and analysis of cDNA librariesfromtheantennaeofBatocerahorsfieldiandexpressionpattern of putative odorant binding proteins[J]. Journal of Insect Science (Online),2014,14(1):57.
[9]Li N,Sun X,Wang M Q. Expression pattern and ligand binding properties of odorant-binding protein 13 from Monochamus alternates Hope[J]. Journal of Applied Entomology,2017,141(9):751-757.
[10]Wang J,Li D Z,Min S F,et al. Analysis of chemosensory gene families in the Beetle Monochamus alternatus and its parasitoid Dastarcushelophoroides [J].ComparativeBiochemistryand Physiology(Part D,Genomics & Proteomics),2014,11:1-8.
[11]Mitchell R F,Hughes D T,Luetje C W,et al. Sequencing and characterizing odorant receptors of the cerambycid Beetle Megacyllene caryae[J]. Insect Biochemistry and Molecular Biology,2012,42(7):499-505.
[12]Zhang A,Oliver J E,Chauhan K,et al. Evidence for contact sex recognition pheromone of the Asian longhorned beetle,Anoplophora glabripennis (Coleoptera:Cerambycidae)[J]. Die Naturwissenschaften,2003,90(9):410-413.
[13]Leal W S,Shi X,Nakamuta K,et al. Structure,stereochemistry,and thermal isomerization of the male sex pheromone of the longhorn Beetle Anaglyptus subfasciatus[J]. Proceedings of the National Academy of Sciences of the United States of America,1995,92(4):1038-1042.
[14]謝翠琴,聂红毅,苏松坤. 昆虫触角转录组研究进展[J]. 应用昆虫学报,2016,53(6):1157-1164.
[15]詹文会,张苏芳,耿红卫,等. 天牛嗅觉基因感受相关蛋白研究进展[J]. 河南农业科学,2018,47(3):1-6.
[16]周 行,沈 杰. 农业昆虫的功能基因组学研究:回顾与展望[J]. 环境昆虫学报,2017,39(2):239-248.
[17]Wang J,Hu P,Gao P,et al. Antennal transcriptome analysis and expression profiles of olfactory genes in Anoplophora chinensis[J]. Scientific Reports,2017,7(1):15470.
[18]Pang J X,Zeng X,Jy Z,et al. Chemosensory transmembrane protein families in the coffee white stemborer,Xylotrechus quadripes (Coleoptera:Cerambycidae)[J]. Environmental Entomology,2018,47(4):969-981.
[19]吉帅帅,庄翔麟,刘乃勇. 灭字脊虎天牛触角转录组中气味结合蛋白基因的鉴定及表达谱分析[J]. 四川农业大学学报,2018,36(2):193-202.
[20]Li H,Zhang G,Wang M. Chemosensory protein genes of Batocera horsfieldi (Hope):Identification and expression pattern[J]. Journal of Applied Entomology,2012,136(10):781-792.
[21]Hu P,Wang J,Cui M,et al. Antennal transcriptome analysis of the Asian longhorned beetle Anoplophora glabripennis[J]. Scientific Reports,2016,6:26652.
3299500338241

