无种质基因型限制结缕草组培快繁体系研究
许建民 仇学文 刘艳 梁慧敏






摘要:结缕草从愈伤组织发育成胚性愈伤再进一步分化为完整植株一直是该领域的研究重点与难点。本研究通过试验建立起一套完善的无种质基因型限制的結缕草组培快繁体系。结果表明,愈伤组织诱导培养基为MS+2 mg/L 2,4-D+0.2 mg/L 6-BA+40 g/L蔗糖最为合适,体胚细胞诱导培养基为改良MS+2 mg/L 2,4-D+0.2 mg/L NAA+0.1 mg/L 6-BA+40 g/L蔗糖最为合适,胚状体增殖与生长培养基为MS+0.1~0.2 mg/L 2,4-D+1 mg/L NAA+01 mg/L 6-BA+30 g/L蔗糖最为合适,成苗快繁培养基为MS+0.02~0.05 mg/L NAA+1~2 mg/L 6-BA+30 g/L蔗糖最为合适,生根培养基MS最为合适。
关键词:种质;基因型;结缕草;组培;快繁体系
中图分类号:S317 文献标志码: A
文章编号:1002-1302(2022)04-0036-07
收稿日期:2021-05-11
基金项目:江苏农林职业技术学院重点科技创新类项目(编号:2017kj09);江苏高校“青蓝工程”项目(编号:2019)。
作者简介:许建民(1981—),男,甘肃张掖人,硕士,副教授,主要从事设施园艺环境控制研究。Tel:(0511)87290588;E-mail:jsnlxjm@vip.163.com。
通信作者:梁慧敏,博士,教授,主要从事林草生物技术育种研究。Tel:(0511)87290588;E-mail:278151187@qq.com。
结缕草属(Zoysia)植物主要分布于亚洲东部广大区域内,在我国主要分布于从东北辽宁到南方广西等地的沿海狭长地带。由于结缕草生态环境复杂多样,具有典型严格的异花授粉特性,导致结缕草种间杂交及天然杂种大量存在,种内变异很大,也使得天然野生种群个体间保持了丰富的自然变异、基因型差异及遗传多样性。
利用生物技术结合常规育种方法进行结缕草新品种的选培育,是提高结缕草育种效率的有效途径。采用生物技术进行品种或种质基因型改良及种质快繁最有效的途径就是建立高频体细胞胚再生技术体系,因为体细胞胚是单细胞起源的,体细胞胚再生途径不但重演了合子胚形态发生的过程,实现了再生种子的来源,也是种质保存、诱导体细胞变异或基因转化的理想受体。体细胞胚快繁不仅能保证优良种群个体基因遗传一致性和稳定性,还能保持新种质的特异性。所以,体细胞胚再生技术是植物组培克隆中最具吸引力的研究力向。
结缕草是禾本科中较难培养的物种,大部分研究选择的材料是以1~3个种或种质基因型为主,牵涉的种质基因型数量较少,且以多细胞的器官发生途径为主[1-4],从愈伤组织变成胚性愈伤组织及再生植株都较困难,组培再生率低,再生过程长。有研究提出,结缕草体细胞胚的产量和质量依赖于对培养基组成和植物激素等条件的优化[5],但这方面的研究较少。因此,建立结缕草无种质基因型限制的高频体胚再生培养技术是实现结缕草种质改良与高效利用的关键,具有重要的现实意义。
1 材料与方法
1.1 试验材料
试验于2018—2020年间在江苏农林职业技术学院江苏现代园艺工程技术中心开展,以分别来源于辽宁、青岛半岛、江苏及长三角周边地区、广东及周边地区的野生或育成的结缕草5个种8个种群的种质基因型为材料,包括结缕草[Zoysia japonica Steud.(Z1)]、中华结缕草[Zoysia sinica Hance(Zz)]、沟叶结缕草[Zoysia matrella (L.) Merr(Zg)]、大穗结缕草[Zoysia macrostachya Franch.et Saw.(Zd)]、细叶结缕草[Zoysia tenuifolia Willd. ex Trin.(Zx)]、青岛结缕草[Zoysia japonica cv. Qingdao(Zq)]、兰引Ⅲ号结缕草[Zoysia japonica cv. Lanyin3(Z3)]、华南半细叶结缕草[Zoysia matrella cv. Huanan(Zh)]等,分别用符号Z1、Zz、Zg、Zd、Zx、Zq、Z3、Zh表示。
1.2 试验方法
1.2.1 外植体处理及无菌苗获取
切取生长期的8种结缕草半嫩茎带2~4节匍匐茎段,先用洗洁精水冲洗10 min左右,再用3%次氯酸钠溶液消毒 15 min,在无菌室用75%乙醇消毒30 s,无菌水冲洗4次,0.1%氯化汞消毒7 min,无菌水冲洗7次,灭菌吸水纸吸干水分,剪取含2~3个节外植体接种到无菌芽苗培养基上进行无菌芽苗的萌动生长驯化培养与预筛选(培养基配方:1/4 MS+0.1 mg/L GA3+0.2 mg/L 6-BA+20 g/L蔗糖),每瓶接种5棵苗,共接种200瓶,在1 000~1 500 lx光照下 16 h/d,培养26~28 d。培养温度为白天室温(28±2) ℃,夜晚(20±2) ℃。
1.2.2 愈伤组织的获取
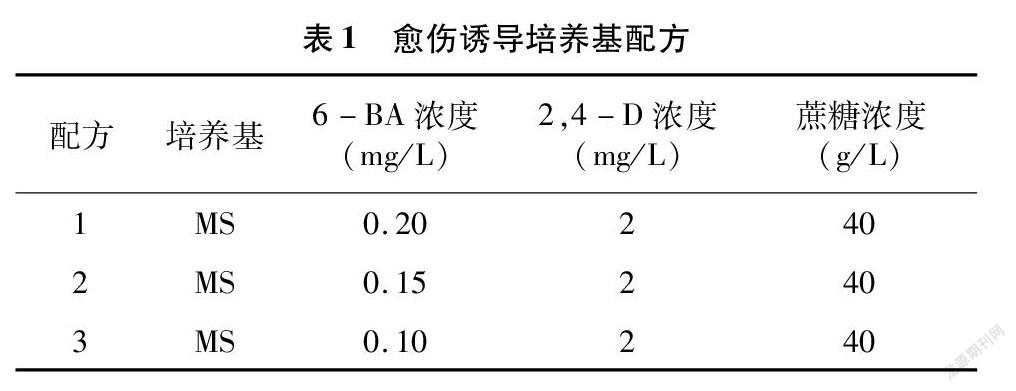
每种结缕草选择开始萌动生长但未污染的芽苗原基600个,接种到3种不同配方的愈伤诱导培养基上,培养基配方如表1,每个处理每培养皿接种40个外植体,试验重复5次,培养温度同上,暗培养28~30 d后统计胚性愈伤组织的诱导率。
愈伤组织诱导率=产生愈伤的外植体数量接种外植体总数×100%。
1.2.3 体胚细胞的诱导
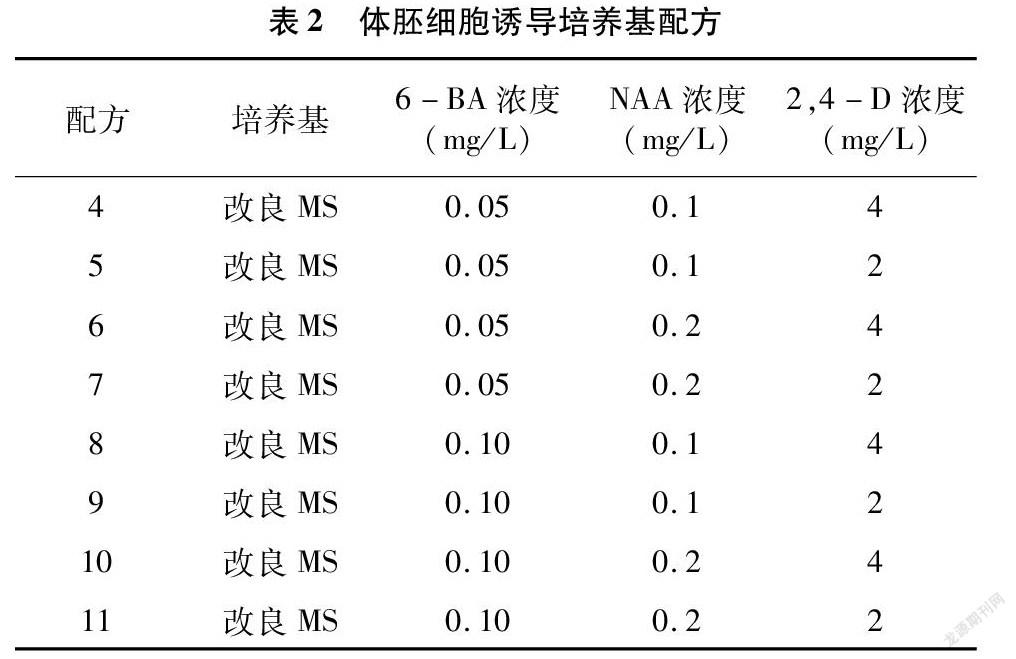
选择愈伤分化最好的配方处理下的愈伤组织,继续培养。培养基采用改良MS(用乙二胺四乙酸铁钠盐替代硫酸亚铁和乙二胺四乙酸二钠,微量营养元素配方采用SH配方的浓度,有机试剂采用B5配方的浓度)+2,4-D+NAA+6-BA+40 g/L蔗糖+0.7%琼脂的完全组合(表2)。每个处理每瓶接种12个愈伤,重复4次,暗培养下发育14 d,培养温度同上,观察胚状体发育情况。
胚状体发生率=发育成胚状体的愈伤数愈伤组织总数×100%。
1.2.4 胚状体的增殖与生长
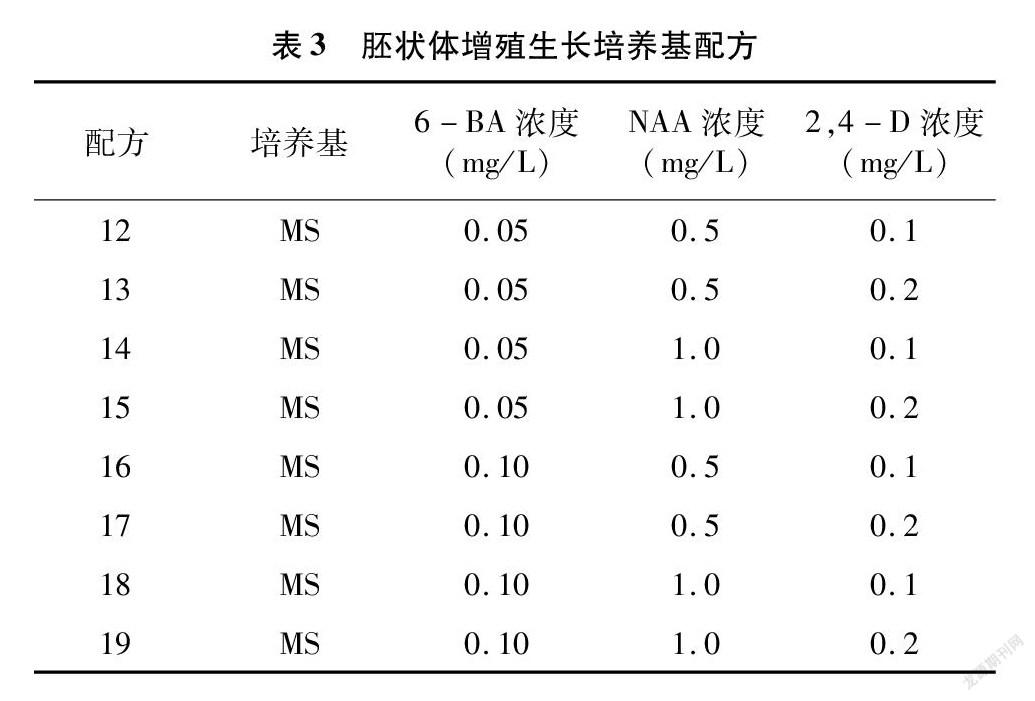
选取发育状态良好、生长至鱼雷期的胚状体继续进行增殖与生长培养。培养基采用MS+(0.1、0.2 mg/L)2,4-D+(0.5、1.0 mg/L)NAA+(0.05、0.10 mg/L)6-BA+30 g/L 蔗糖+0.7%琼脂的完全组合(表3)。每瓶
接种9个胚状体组织,重复4次,在1 000~1 500 lx光照下16 h/d,培养26~28 d。培养温度同上。45 d 后观察胚状体的生长分化状态,统计丛芽萌发率。
丛芽萌发率=萌发的丛芽数量接种的胚状组织总数×100%。
1.2.5 结缕草的成苗快繁培养
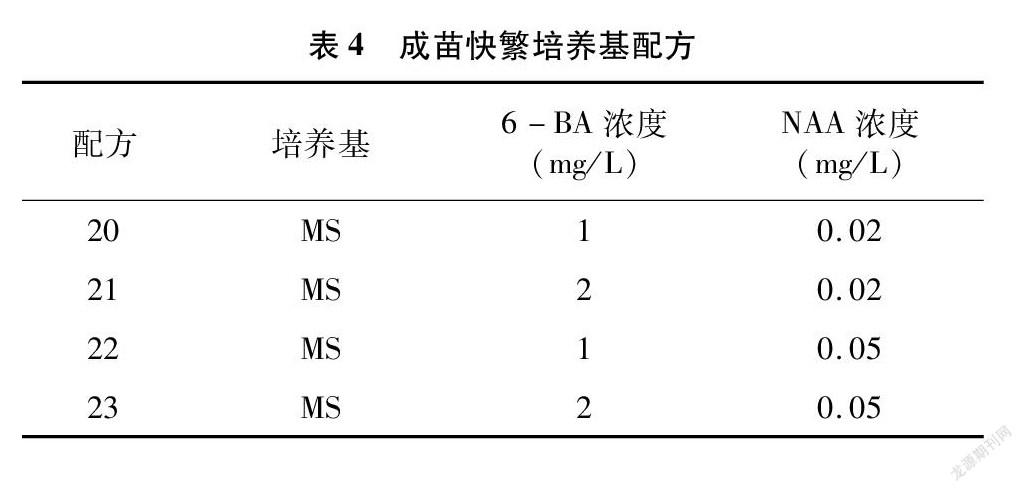
将分化好、生长状态优的结缕草丛生芽接种到成苗快繁培养基上,进行继代培养。培养基采用MS+(0.02、0.05 mg/L)NAA+(1、2 mg/L)6-BA+0 g/L蔗糖+0.7%琼脂的完全组合(表4)。每个处理下每瓶接种6个丛生芽,重复4次,在1 000~1 500 lx光照下16 h/d,培养26~28 d。培养温度同上。30 d后进行继代培养,并统计不同处理下的丛生芽增殖系数。
丛生芽增殖系数=增殖芽数/接种芽数×100%。
1.2.6 丛生芽的壮苗生根培养
将快繁后获得的结缕草成苗转接到壮苗生根培养基上进行生根培养。培养基采用1/2 MS+(0、0.05、0.10 mg/L)IBA+20 g/L蔗糖+0.7%琼脂的完全组合(表5)。每个处理下每瓶接种10个结缕草丛生芽,重复4次,2 000~2 500 lx光照强度下培养26~30 d,培养温度同上,统计再生植株的生根率。
生根率=生根的丛生芽数接种数×100%。
1.2.7 再生植株的移栽
将壮苗生根培养后得到的生根的再生植株移栽到温室小花盆中,盆土组分配比为蛭石 ∶泥炭土 ∶园土=2 ∶4 ∶4;移栽后遮阴处理,初期每天浇水1~2次,成活后逐渐减少浇水次数,15~20 d后统计成活率。
成活率=移栽后的成活数移栽总数×100%。
2 结果与分析
2.1 愈伤组织的诱导
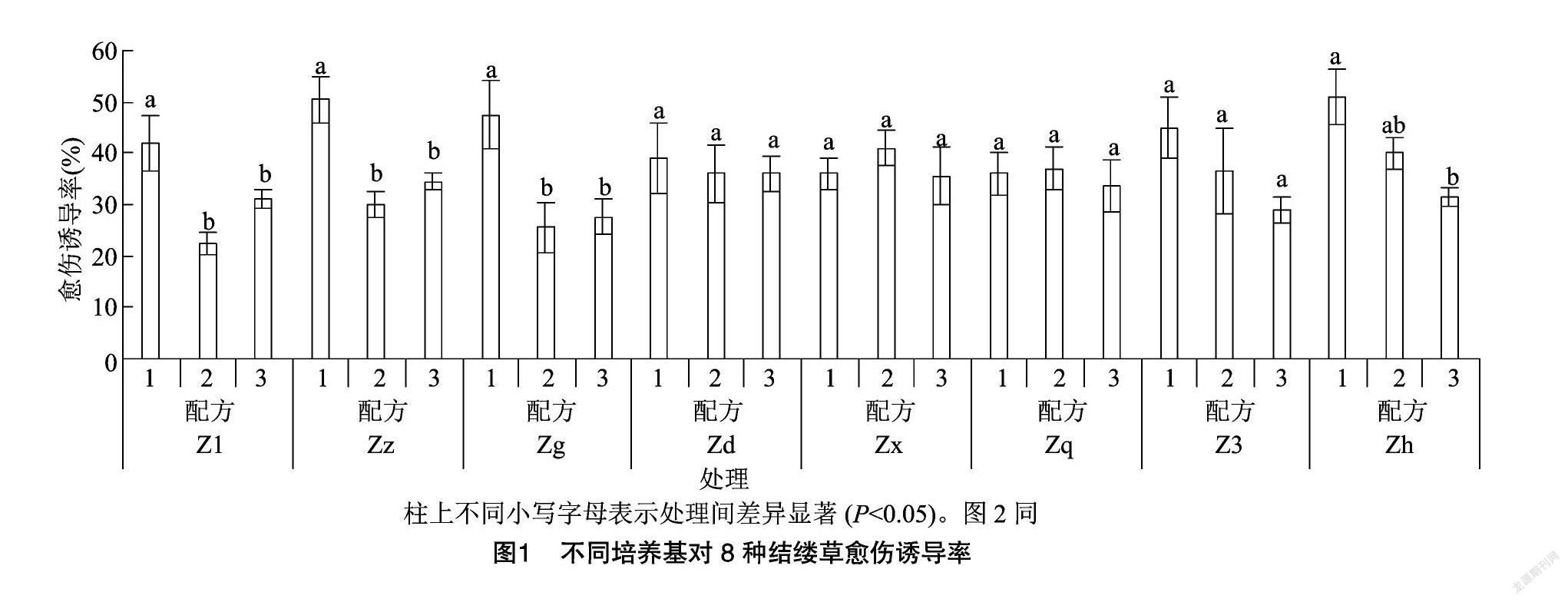
如图1所示,在不同配方处理下的8种结缕草愈傷组织诱导率不尽相同。Z1、Zz、Zg、Zh这4种结缕草在不同配方处理后,愈伤诱导率均有显著性差异,且都以配方1处理下产生的愈伤居多。而Zd、Zx、Zq、Z3这4种结缕草在不同的培养基配方处理后,愈伤诱导率未出现显著性差异。从图1也可以看出,除Zx与Zq是在配方2处理下的愈伤诱导率最高以外,其余的均是以配方1处理下的愈伤诱导率最高。
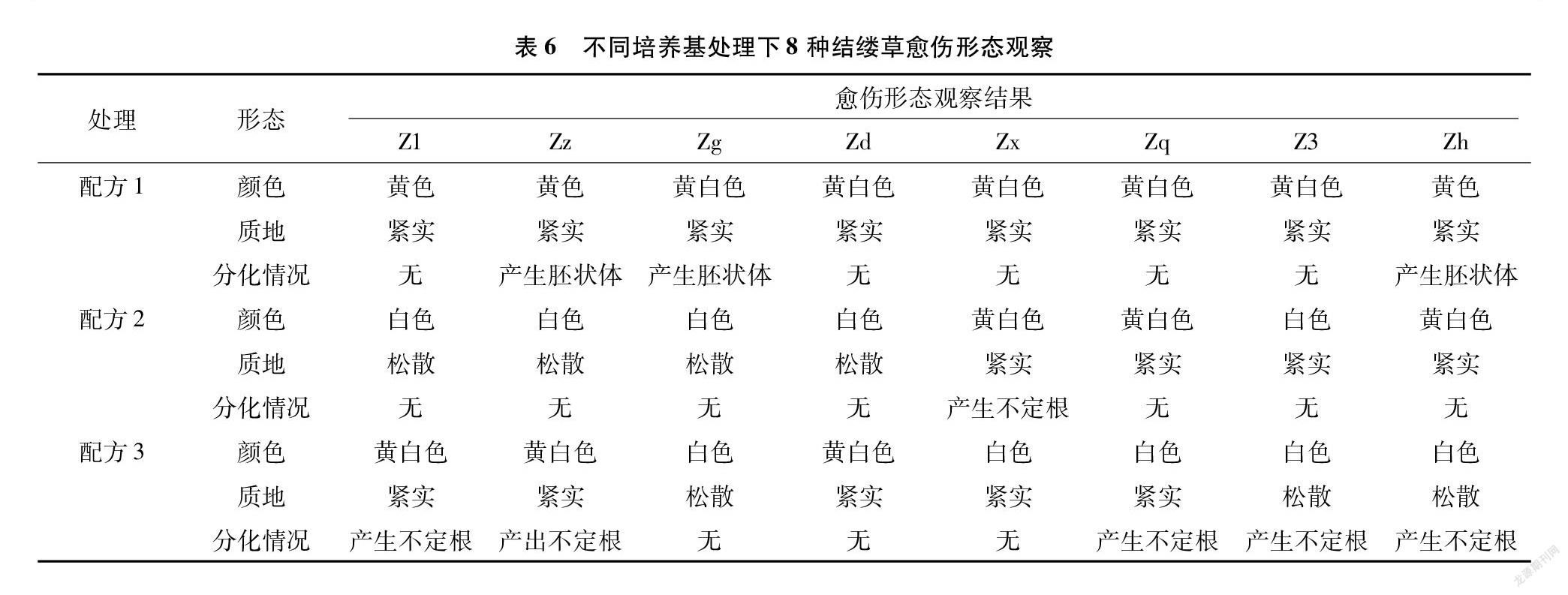
在对外植体进行脱分化培养时,产生的愈伤组织颜色与质地明显存在差异且部分外植体出现了再分化的现象。本试验中规定若超过2/5的外植体出现再分化的现象,则认为该培养基可导致植物再分化。从表6中可以发现,配方1处理下的8种结缕草外植体形成的愈伤组织颜色均为黄色或黄白色,质地紧实,Zz、Zg、Zh这3种结缕草则出现了球形胚、鱼雷胚等典型的胚状体组织,这表明,配方1在一定程度上可以直接诱导结缕草外植体分化成为胚性愈伤组织。在配方2、配方3处理下外植体产生的愈伤组织,均有部分存在松散、紧密性差的情况,而有些则再分化成了根,这表明配方2、配方3也可以诱导结缕草产生愈伤组织,但产生的愈伤组织多为普通的愈伤组织。
2.2 体胚细胞的诱导
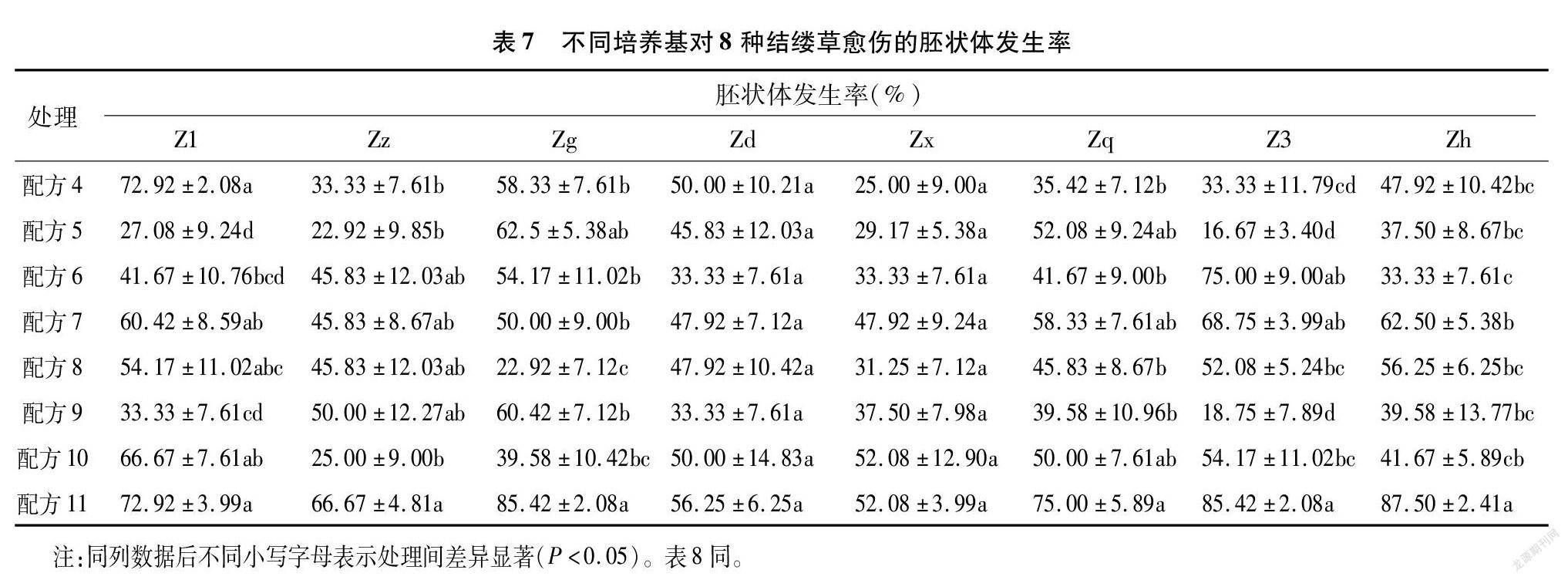
将愈伤组织转接到体胚细胞诱导培养基上进行进一步培养,可获取体细胞胚状体。随着时间推移,用肉眼即可观察出胚状体的发生情况与发育状态。本试验以出现肉眼可见的胚状体(即球形胚、心形胚、鱼雷形胚、子叶形胚)为判定标准。从表7可以看出,总体以配方11处理下的8种结缕草愈伤组织出现的胚状体数量最多,胚状体发生率最高。Zd、Zx这2种结缕草愈伤组织在不同配方处理下,胚状体发生率无显著性差异;而其余品种结缕草在不同配方处理下,存在显著性差异。配方7、配方8也能适合大多数的结缕草愈伤组织发育成为胚状体。
2.3 胚状体的增殖与生长
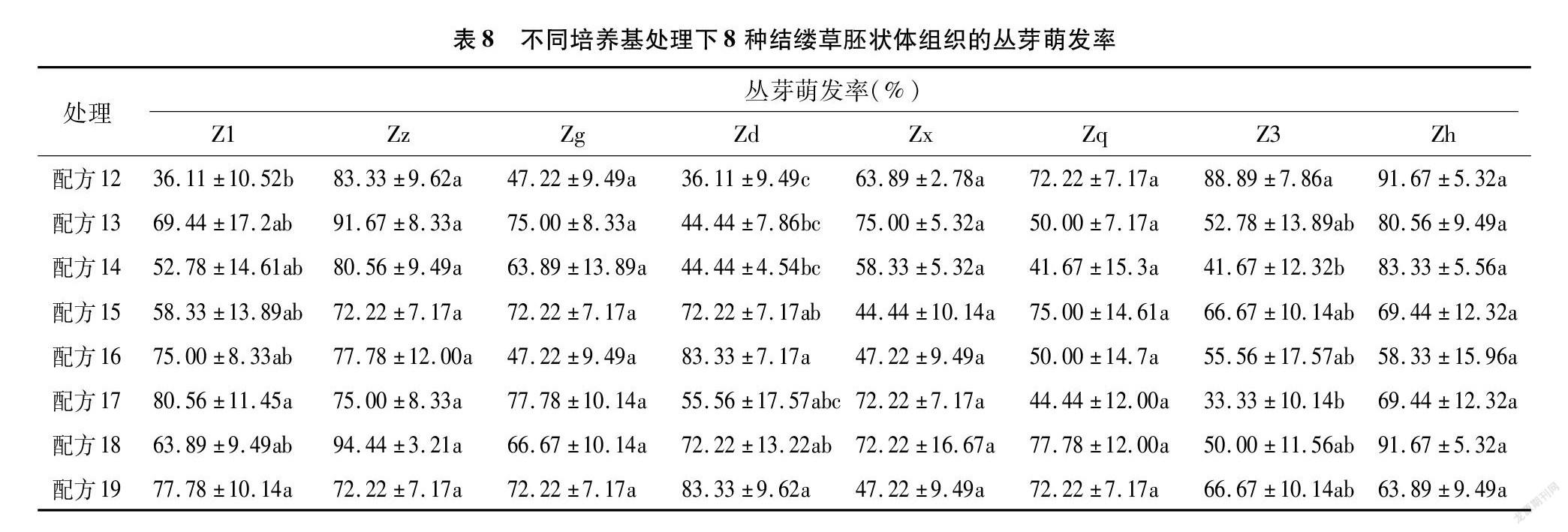
将通过体胚细胞诱导培养基处理过后产生的胚状体接种到胚状体增殖与生长培养基上,进行胚状体的增殖与芽的诱导。从表8可以看出,8种配方处理下的结缕草胚状体,几乎每种都能诱导产生丛芽。Zz、Zg、Zx、Zq、Zh这5种结缕草胚状体对不同的培养基配方敏感性并不显著,在8种配方处理下都产生了不定芽且无显著性差异。Z1、Zd、Z3则表现出明显的差异性,Z1以配方17处理下的胚状体芽萌发率最高,Zd则以配方16和19处理下的萌发率最高,Z3则是配方12处理下的最高。综合来看,配方18与配方19可以有效地诱导大多数结缕草胚状体产生芽,配方15、配方16、配方17也可以诱导大多数的结缕草胚状体产生芽,不过对部分种质基因型结缕草胚状体的效用会略低于配方18与配方19。
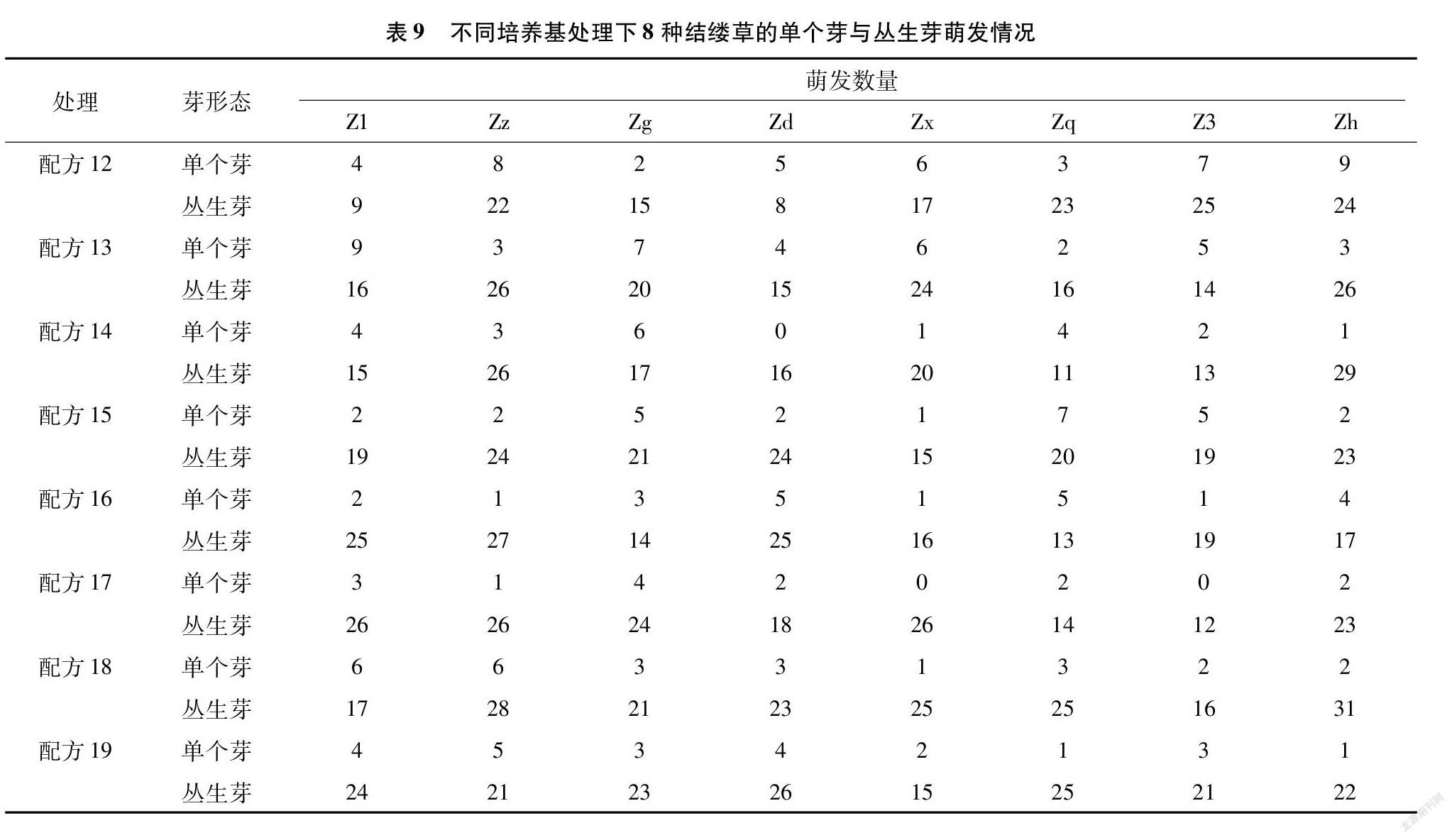
由胚状体发育而来的芽可以细分为单个芽与丛生芽。从表9的数据可以看出,相对于单个芽而言,结缕草胚状体更容易分化出丛生芽。配方14处理下的Zd与配方17处理下的Z3的芽萌发率很低,但萌发出来的芽均为丛生芽;而配方17处理下的Zx的芽萌发率为几种配方里面最高的,但萌发出来的芽也均为丛生芽,这或许与结缕草之间不同的基因型有关。
2.4 结缕草的成苗快繁培养
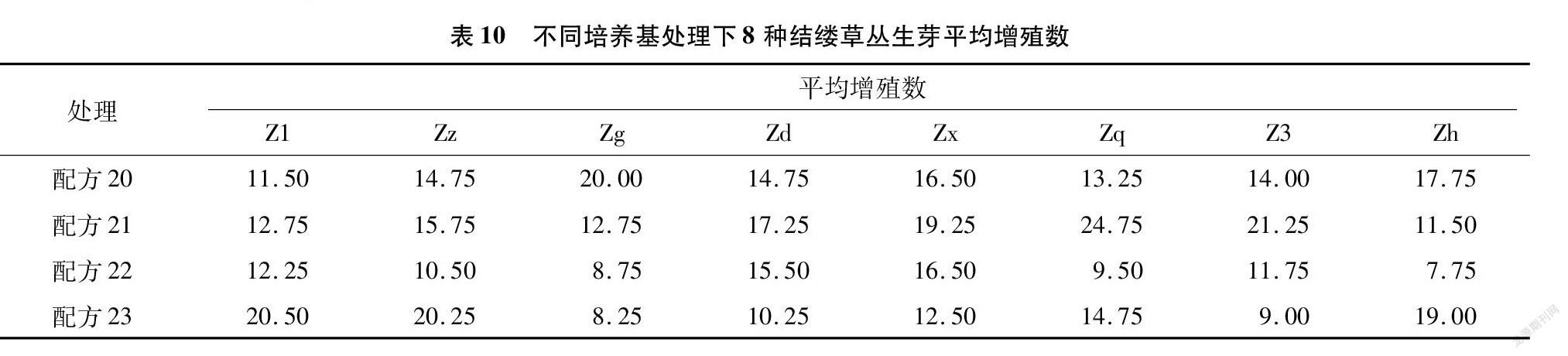
从表10可以看出,8种结缕草在不同配方处理下的增殖数都有很大的差异,极差最大的为配方21与配方22处理下的Zq,极差达到了15.25,极差最小为配方20与配方22处理下的Zx,极差为0。Z1、Zz、Zd、Zx这4种结缕草的增殖数在4种配方处理下都超过了10,表明这4种结缕草更容易快速繁育。
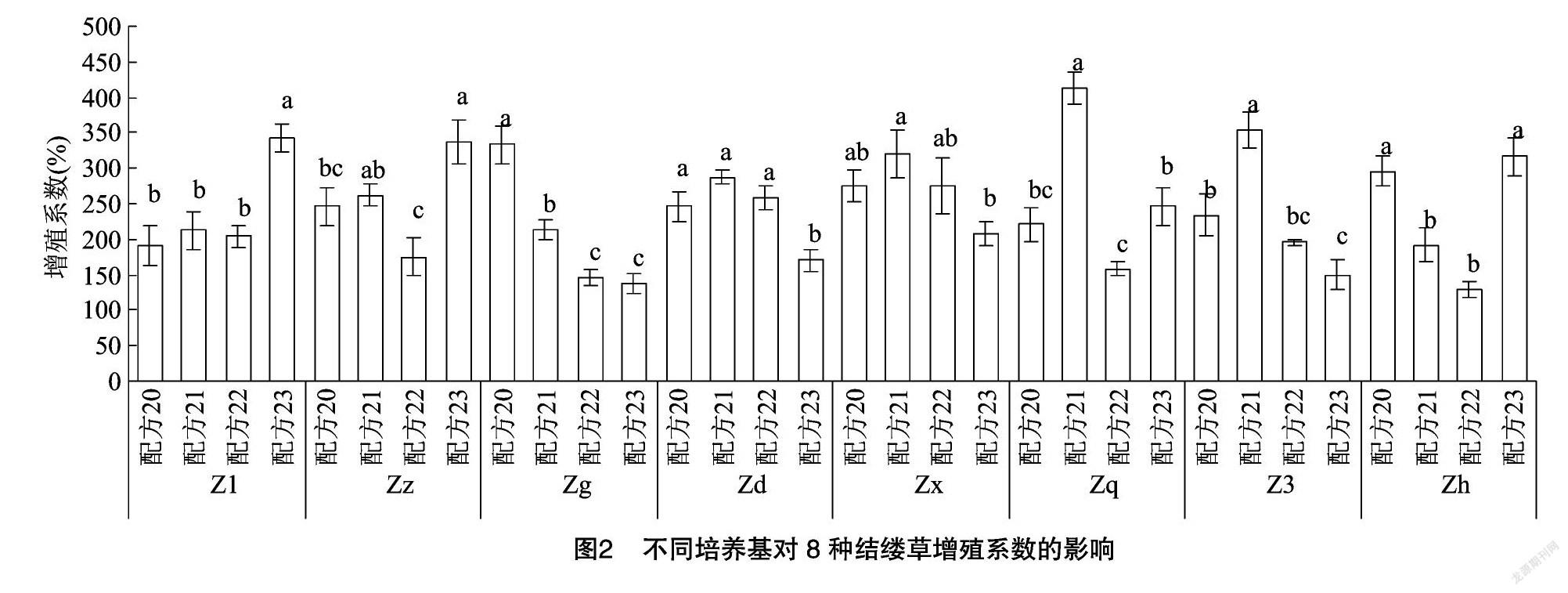
对图2进行分析,可以发现在不同配方处理下的每种结缕草增殖系数都存在显著性差异。但很难找到可以最大化促进8种结缕草快繁的配方。Z1、Zz、Zh在配方23处理下的增殖系数最高,与其他配方间存在显著性差异;Zd、Zx、Zq、Z3在配方21处理下的增殖系数最高,与其他配方间存在显著性差异;而Zg则在配方20处理下的增殖系数最高,与其他配方间存在显著性差异。
2.5 壮苗生根培养与植株移栽
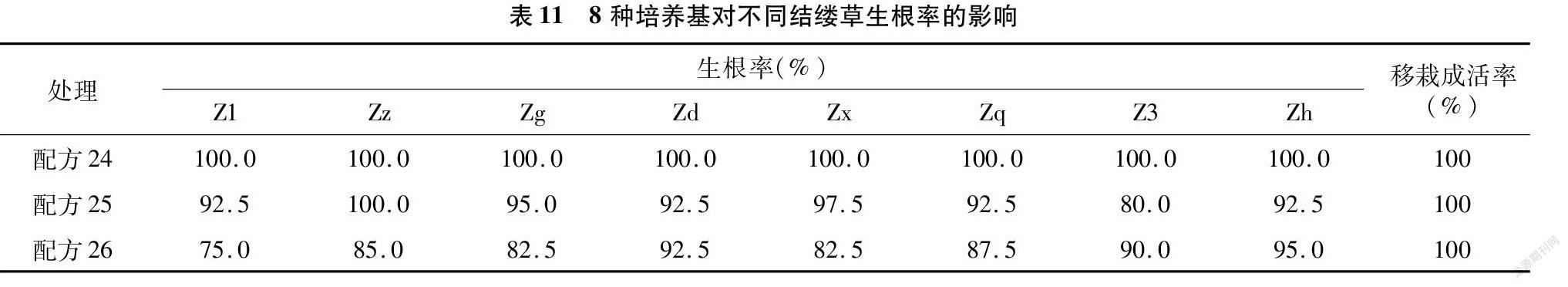
从表11可以看出,纯MS培养基即可有效地促进结缕草根的分化,加入IBA后部分植株根的生长受到了影响,且浓度越高,根的分化就越受到抑制。根的良好生长也很大程度上促进移栽后成活率的提高,本试验中根部生长良好的结缕草移栽成活率为100%。
3 讨论与结论
结缕草愈伤组织的难获取曾很长时间限制着结缕草组培快繁体系的建立。本试验中通过添加高浓度的生长素2,4-D与低浓度的6-BA配合使用,成功获得了8种结缕草的愈伤组织,这表明高浓度的2,4-D对结缕草愈伤的获取起着至关重要的作用,这与前人的研究结果一致。柴明良等曾通过将萌发的结缕草种子接种到高浓度2,4-D的MS培养基上以获得愈伤组织,但获得的愈伤组织却未能成功再分化[6]。Bhaskaren等的研究表明,2,4-D在大多数禾本科植物的愈伤诱导中都扮演着重要的角色[7]。张磊等将2,4-D、NAA、IAA、6-BA这4种激素单独使用,发现以2,4-D处理的愈伤诱导率最高[8],本试验结果与之也基本一致。但张磊等试验获得的愈伤诱导率高达64.6%[8],本试验中愈伤诱导率最高也仅有51%,或许与这2个试验的愈伤诱导配方不一样有关。
一般外植体脱分化后获得的愈伤可分为胚性愈伤与普通愈傷,胚性愈伤可进一步分化成完整植株,而体胚细胞的诱导主要经历愈伤组织诱导阶段和分化培养阶段[9]。普通愈伤组织经诱导培养后一部分分化出胚性细胞,单个胚性细胞再分裂和分化形成一个由多细胞组成的原胚,即胚性愈伤组织[10]。贾玉芳等研究表明,MS+2.0 mg/L 2,4-D的组合效果最好,胚性愈伤组织比率为8583%[11],本试验中,最适合胚性愈伤诱导的培养基配方为改良MS+0.1 mg/L 6-BA+0.2 mg/L NAA+2 mg/L 2,4-D,胚性愈伤组织的比率最高可达到88%,这与前人研究结果基本一致。Linacero等[12]和钱永强等[13]都证明了过高或过低的2,4-D浓度都不利于胚性愈伤组织的形成和分化作用。本试验中部分结缕草在含4 mg/L 2,4-D配方处理下的体胚细胞诱导率极低,这表明高浓度的2,4-D会抑制体胚细胞的形成,但也有部分结缕草在含2 mg/L 2,4-D配方处理下的体胚诱导率较低,这表明低浓度的2,4-D也会抑制体胚细胞的形成,这与前人研究成果基本一致。但本试验中几种结缕草在高浓度或低浓度的2,4-D处理下的结缕草均有较高的体胚细胞诱导率,这或许与结缕草间的基因型不同或有其他激素参与进来共同作用有关,具体的机理还有待进一步探讨。
有学者研究表明,在分化阶段,暗培养条件后,愈伤组织通过分化成胚性愈伤组织,经体细胞发生途径产生再生植株的数量大大高于光培养条件下愈伤组织的分化[14-18]。本试验采取的即此途径,胚状体芽的分化率最高可达到94%,这与前人的研究成果基本一致。杜敏华等研究表明,0.5 mg/L NAA最适于结缕草芽的分化[19],本试验中,配方12、13、16、17的NAA含量均为0.5 mg/L,且大多数能促进芽的分化,具有显著性差异,这与前人的研究成果基本保持一致,至于部分结缕草的体胚细胞未能促进芽萌发,可能与其基因型有关。丛生芽的生命力与繁殖力明显高于单个芽[20],本试验的配方诱导出来的不定芽多数为丛生芽,为结缕草的成苗快繁建立了良好的基础。
王栋的研究表明,培养基MS+0.1 mg/L IBA+0.1 mg/L 6-BA最有利于试管苗芽的增殖,芽数平均可增殖至9个以上[21],本试验未能找出最适合各种结缕草快繁最佳培养基配方,但本试验中使用到的配方处理后新增平均芽数均能超过9,较前人试验结果较高,这可能与本试验中激素浓度较高有关。宋俊芳等的研究结果表明,添加1 mg/L的IBA就能明显促进根的分化[22],本试验的结果与之不符,可能与种苗状态有关,也有可能与结缕草间基因型有关,具体原因有待进一步探讨。
本试验旨在寻找出一种无种质基因型限制的结缕草组培快繁体系。通过试验得出,愈伤组织诱导培养基为MS+2 mg/L 2,4-D+0.2 mg/L 6-BA+40 g/L 蔗糖最为合适,体胚细胞诱导培养基为改良MS+2 mg/L 2,4-D+0.2 mg/L NAA+0.1 mg/L 6-BA+40 g/L蔗糖最为合适,胚状体增殖与生长培养基为MS+0.1~0.2 mg/L 2,4-D+1 mg/L NAA+0.1 mg/L 6-BA+30 g/L蔗糖最为合适,成苗快繁培养基为MS+0.02~0.05 mg/L NAA+1~2 mg/L 6-BA+30 g/L蔗糖最为合适。
参考文献:
[1]闫晓玲,赵新烁. 结缕草愈伤组织诱导的影响因素[J]. 农村经济与科技,2016,27(18):34-35.
[2]吴艳歌,毕 波,柴明良. 细胞分裂素对沟叶结缕草愈伤组织生长及其抗氧化系统的影响[J]. 核农学报,2016,30(7):1288-1295.
[3]马龙雪,赵丽萍. 大穗结缕草愈伤组织诱导及植株再生研究[J]. 黑龙江农业科学,2016(9):15-18.
[4]路 佳,葛荣朝,孙振元,等. 日本结缕草茎节和愈伤组织再生体系的优化[J]. 河北师范大学学报(自然科学版),2011,35(5):519-526.
[5]王渭霞,胡张华,陈锦清,等. 松南结缕草成熟胚愈伤组织的诱导和再生[J]. 草业学报,2006,15(3):132-137.
[6]柴明良,郭达初,钮友民,等. 三种结缕草试管繁殖研究[J]. 科技通报,1993,9(6):411-415.
[7]Bhaskaran S,Smith R H.Regeneration in cereal tissue culture:a review[J]. Crop Science,1990,30(6):1328-1337.
[8]张 磊,吴殿星,胡繁荣,等. 结缕草组织培养及农杆菌介导转化的主要因子优化[J]. 草业学报,2004,13(4):100-105.
[9]魏文霞,刘苗苗,张婷婷,等. 黄瓜胚状体途径再生体系的建立[J]. 西北农林科技大学学报(自然科学版),2019,47(4):32-40.
[10]何业华,方少秋,马 均,等. 菠萝愈伤组织中体细胞胚起源过程的组织细胞学观察[J]. 园艺学报,2010,37(5):689-696.
[11]贾玉芳,陈 曙,柴明良. 沟叶结缕草胚性愈伤组织继代培养基对其生长和再生的影响[J]. 园艺学报,2010,37(8):1311-1316.
[12]Linacero R,Vazquez A M.Somatic embryogenesis from immature inflorescences of rye[J]. Plant Science,1990,72(2):253-258.
[13]钱永强,孙振元,韦善君,等. 中华结缕草成熟胚再生影响因素研究[J]. 核农学报,2005,19(6):436-440.
[14]史滟滪,刘艳军,杨静慧,等. 花椰菜松散型胚性愈伤组织的诱导[J]. 天津农业科学,2019,25(5):9-12.
[15]史滟滪,杨静慧,刘 婷,等. 马铃薯松散型胚性愈伤组织的诱导[J]. 天津农业科学,2016,22(12):20-23.
[16]温 琳,惠國强,杨海鹏,等. 半夏叶柄愈伤组织诱导与分化最适培养基筛选[J]. 山西农业科学,2017,45(6):905-908,977.
[17]张朝晖,张宗申,陈 阳,等. 杂交构树体细胞胚诱导研究[J]. 河南农业科学,2016,45(12):127-131.
[18]李海霞,谢久凤,孙金花. 玉米幼胚胚性愈伤组织诱导和继代研究[J]. 江苏农业科学,2020,48(7):74-77.
[19]杜敏华,柴春月. 日本结缕草离体培养及高频率植株的再生[J]. 东北林业大学学报,2007,35(10):17-19.
[20]赵玉芬,储博彦,尹新彦,等. 白砂糖对大花萱草‘红运’试管苗生根的影响[J]. 林业科技开发,2013,27(4):30-32.
[21]王 栋. 沟叶结缕草组织培养及植株再生的研究[D]. 重庆:西南大学,2008.
[22]宋俊芳,金 芳,孙吉雄,等. 兰引3号结缕草组织培养研究[J]. 草原与草坪,2007,27(5):29-31,36.
3262500338270

