解决高考实验探究题的关键策略
李书霞
(清华大学附属中学)
作为研究化学物质及其变化的重要手段,探究实验能够在实践层面实现对学生创新能力和学科素养的发展,实验探究题是高考中的重点和难点,最能体现能力立意的命题指导思想.
1 分析高考真题,梳理实验探究的高频考点

表1

图1
通过分析近十年的高考真题,我们不难发现高频考点聚焦在“探究物质性质和反应规律两方面”.这些常考元素和物质(如硫和铁的化合物)的价态和性质多变,能构建多种反应和转化关系,以此作为载体创设情境,可以命制综合性强、陌生度高、推理路径长、思维容量大的实验探究题.
2 预测和推测结合,探寻解决实验探究题的关键策略
2.1 分析预测的角度——物质性质
物质性质主要是物理性质和化学性质两个方面,物理性质包括“颜色、气味、状态、硬度、密度、熔点、沸点、溶解性”等;化学性质则涉及“稳定性、酸碱性、氧化性、还原性、配位性”等.在分析实验探究题时,先关注题目中出现的关键物质,对其性质和可能发生的反应进行预测,从“价态和类别”两个角度入手,先对单一物质进行分析预测,再对两种或两种以上物质混合时可能发生的反应再次进行分析预测.
【举例】向某溶液体系中投入下列物质会引起的变化.
SO2:酸性、还原性、配位性.
Na2S:碱性、还原性、配位性、可能生成难溶的硫化物沉淀.
Na2SO3:弱碱性、还原性、配位性、可能生成难溶的亚硫酸盐沉淀.
AgNO3:弱酸性、氧化性(Ag+或酸性条件下的)、配位性、可能生成难溶的银盐.
KI:中性、还原性、配位性.
K2C2O4:弱碱性、还原性(含+3价碳)、配位性、可能生成难溶的草酸盐.
CuSO4或CuCl2:酸性、氧化性(可能生成0价或+1价铜)、配位性、可能生成难溶铜盐.
FeCl3:酸性、氧化性、配位性、可能生成难溶的铁盐.
2.2 分析预测的角度——反应类型
1)预测反应
复杂的实验探究题会出现多种物质混合,我们需要预测可能发生的变化和转化关系.其实无论多复杂的体系,所能发生的反应无非以下三大类.
a)复分解反应:酸碱反应、生成沉淀的反应、生成弱电解质的反应等.
b)氧化还原反应:强氧化剂+强还原剂=弱氧化剂+弱还原剂.
c)配位反应:一般过渡金属(或Al3+)作中心原子,Cl-、SCN-、CN-、H2O、NH3、CO、NO、等作为配体,多数配合物具有特征颜色.
2)预测反应之间的关系
面对具体物质和具体问题时,我们需要思考这些反应之间是什么关系,是竞争还是协同,速率快慢比较如何,反应程度大小怎样,思考过程中可能遇到以下情况.
a)某些溶液混合后,沉淀反应速率快,而且溶解度很小,导致离子浓度迅速减小,无法再发生其他反应,例如亚硫酸钠和硝酸银溶液混合生成亚硫酸银沉淀.
b)有些溶液混合后,发生配位反应的速率快,优先出现鲜明的配合物颜色,且配位反应平衡常数也较大,导致离子浓度很低,无法发生氧化还原反应,如草酸钾和氯化铁溶液混合生成翠绿色的草酸合铁配合物.
c)有些溶液混合后也是配位反应速率快,优先出现鲜明的配合物颜色,但配位反应具有可逆性且平衡常数较小,氧化还原反应速率慢但平衡常数大,所以随着时间的推移,氧化还原反应最终取胜.如将SO2通入FeCl3溶液中,先出现红棕色的配合物,但放置较长时间后溶液颜色变为氧化还原反应后的浅绿色(Fe2+).
例1化学小组实验探究SO2与AgNO3溶液的反应.
(1)实验1用图2所示装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A 和白色沉淀B.

图2
①浓H2SO4与Cu反应的化学方程式是____.
②试剂a是________.
(2)对体系中有关物质性质分析得出:沉淀B 可能为Ag2SO3、Ag2SO4或二者混合物.(资料:Ag2SO4微溶于水;Ag2SO3难溶于水.)
实验2验证B的成分,如图3所示.

图3
①写出 Ag2SO3溶于氨水的离子方程式:________.
②加入盐酸后沉淀D 大部分溶解,剩余少量沉淀F.推断D 中主要是BaSO3,进而推断B 中含有Ag2SO3.向滤液E 中加入一种试剂,可进一步证实B中含有Ag2SO3.所用试剂及现象是_________.
途径1:实验1中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D.
实验3探究的产生途径.
①向溶液A 中滴入过量盐酸,产生白色沉淀,证明溶液中含有_________:取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B 中不含Ag2SO4.做出该判断的理由:_______.
②实验3的结论_________.
(4)实验1中SO2与AgNO3溶液反应的离子方程式是_________.
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应.将实验1所得混合物放置一段时间,有Ag和生成.
(6)根据上述实验所得结论为_________.

(1)首先依据上述思维模型进行主动预测,如图4所示.
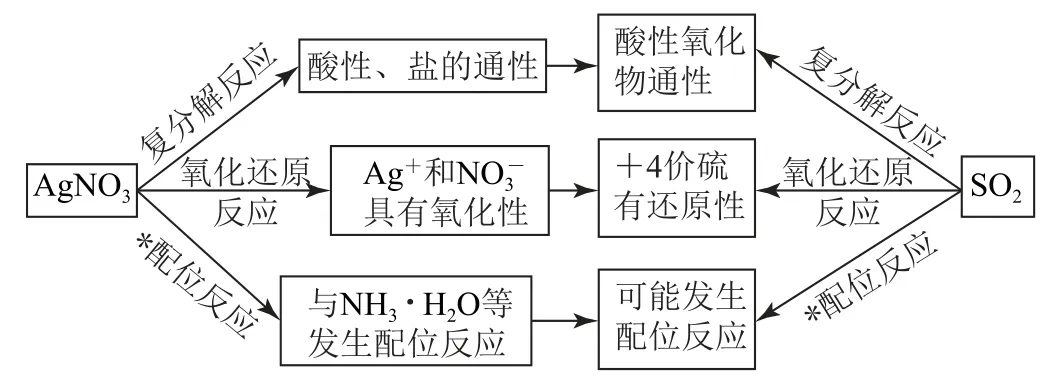
图4
(2)结合题目所给的实验现象进行合理推测.
对SO2通入AgNO3溶液中得到的白色沉淀B进行合理推测.
推测1:复分解反应——白色沉淀为Ag2SO3.
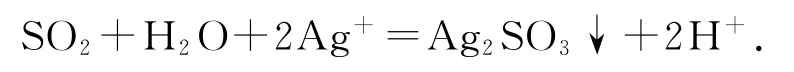
推测2:氧化还原反应——白色沉淀为Ag2SO4.
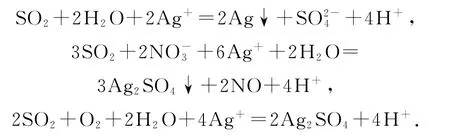
推测3:上述反应同时发生——白色沉淀为Ag2SO3和Ag2SO4.
(3)进一步结合题目所做的其他实验进行深入分析和探究.
在此题目中我们看到,SO2与AgNO3溶液生成Ag2SO3的速率大于生成Ag和的速率,所以我们预测的配位反应和氧化还原反应没有发生,只发生了沉淀反应;为什么在实验1中+4价硫没有被氧化,却在实验2中被氧化了呢? 推测可能是实验2的碱性环境带来的影响.
答案(1)①SO2↑+2H2O;②饱和NaHSO3溶液.
(3)①Ag+;Ag2SO4溶解度大于BaSO4,没有BaSO4沉淀时,必定没有Ag2SO4;②途径1不产生,途径2产生.
(4)2Ag++SO2+H2O=Ag2SO3↓+2H+.
(6)该实验条件下,SO2与AgNO3溶液生成Ag2SO3的速率大于生成Ag和的速率,碱性溶液中更易被氧化为.
3 关注影响因素,突破反应原理探究的难点
3.1 影响反应原理的因素
在探究反应原理时,会遇到“反应方向、速率和限度”的问题,影响因素就显得尤为重要.总结如表2所示.

表2
知道这些影响因素之后,还要具体分析这些因素之间的关系,比如温度高可以加快反应速率,但可能不利于提升转化率,那么就要兼顾二者的需求,选择合适的温度范围;但是如果某反应使用了催化剂,在选择温度的时候,首要考虑的则是催化剂适宜的催化温度;很多反应都存在副反应,主副反应之间通常是竞争关系,调控反应条件时要考虑对主副反应的影响是相反还是一致的.
3.2 改变条件可能产生的影响
1)温度:速率、平衡、气体溶解度、物质稳定性、催化剂活性、副反应.
2)pH:微粒存在形式、水解或电离平衡、氧化还原性强弱、竞争放电.3)浓度:速率、平衡、放电顺序、氧化还原性强弱.4)药品的滴加顺序:酸碱性、微粒浓度相对大小、反应的先后.
3.3 氧化还原反应规律探究的注意事项
1)影响氧化性、还原性强弱的“三度”:温度、浓度、酸碱度等.如酸性高锰酸钾的氧化性比中性时强,浓硝酸比稀硝酸氧化性强等.
2)S2-、I-、Fe2+,题目中出现这些强还原性离子时,要意识到它们可能要被O2或其他物质氧化,通常要考虑空气中O2对实验造成的干扰.
3)若某氧化还原反应本该发生,却因为其他反应的干扰未能观察到预期现象,则排除干扰的实验方案是:设计双液原电池,将氧化剂和还原剂隔开,避免发生复分解或配位反应,导致离子浓度降低,无法进行氧化还原反应.
4)不主动干预时,化学反应速率通常会随反应进行而逐渐减小,但有时也会出现先增大后减小的情况,可能有两个原因:反应放热导致体系温度升高、生成了可以催化该反应的产物.
例2 实验1向1mL0.1mol·L-1FeSO4溶液中加入1mL0.1mol·L-1AgNO3溶液,开始时,溶液无明显变化,几分钟后,出现大量灰黑色浑浊,反应过程中温度几乎无变化,测定溶液中Ag+浓度随反应时间的变化如图5所示.

图5
实验2实验开始时先向试管中加入几滴Fe2(SO4)3溶液,重复实验1,实验结果与实验1相同.

Ag+浓度随反应时间的变化出现短时间内的断崖式下降,且溶液温度无变化,只能说明是自催化现象,实验2 排除了产物之一Fe3+的影响,可得出的结论是:另一产物即灰黑色的银单质催化了该反应.
例3文献表明:相同条件下,草酸根的还原性强于Fe2+.为检验这一结论,完成如下实验.资料:
ⅰ.草酸(H2C2O4)为二元弱酸.
ⅱ.三水三草酸合铁(Ⅲ)酸钾[K3Fe(C2O4)3·3H2O]为翠绿色晶体,光照易分解.其水溶液中存在:.
ⅲ.FeC2O4·2H2O 为黄色固体,微溶于水,可溶于强酸.
实验1通过Fe3+和在溶液中的反应比较Fe2+和的还原性强弱,如表3所示.

表3
(2)取实验1 中少量晶体洗净,配成溶液,滴加KSCN 溶液,不变红.继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素.加硫酸后溶液变红的原因是_________.
(3)经检验,翠绿色晶体为K3Fe(C2O4)3·3H2O.设计实验,确认实验1中没有发生氧化还原反应的操作和现象是________.实验1中未发生氧化还原反应的原因是_________.
(4)取实验1中的翠绿色溶液光照一段时间,产生黄色浑浊且有气泡产生.补全反应的离子方程式:
实验2通过比较H2O2与反应的难易,判断二者还原性的强弱,如表4所示.

表4
(5)证明Fe2+被氧化的实验现象是________.
实验3通过其他实验方案比较Fe2+和的还原性强弱.
(7)用FeCl3溶液、K2C2O4溶液和其他试剂,设计实验方案比较Fe2+和的还原性强弱.画出装置图并描述预期现象________.

既然将FeCl3溶液、K2C2O4溶液直接混合后,二者优先发生配位反应,那么能否通过其他实验方案比较Fe2+和的还原性强弱呢? 双液原电池便是最好的选择了,可以将氧化剂和还原剂隔离在两个区域,避免直接混合发生其他反应干扰对氧化还原反应的判断.但是设计双液原电池之后对现象的描述不能仅限于“电流计指针偏转”,因为两极产生电势差是很容易的,比如吸氧腐蚀.所以还要检验氧化还原反应的产物,最好是还原反应的产物,因为溶解氧是可能干扰实验的,而还原产物则不受其干扰.所以此题中,在双液原电池工作一段时间后,取烧杯中的溶液,滴加K3Fe(CN)6溶液检测还原产物即Fe2+.
答案(1)+3.
(3)取少量实验1 中的翠绿色溶液,滴加K3Fe(CN)6溶液,不出现蓝色沉淀;Fe3+与生成稳定的[Fe(C2O4)3]3-,浓度降低,Fe3+的氧化性和的还原性减弱.
(5)Ⅱ中产生大量红褐色沉淀或Ⅲ中得到翠绿色溶液.
(7)

图6
电流计的指针偏转,电池工作一段时间后,取少量左侧烧杯中的溶液,滴加K3Fe(CN)6溶液,出现蓝色沉淀.
(完)

