例析化学计算在高考中的考查
——以2021年6月浙江高考化学选考试题为例
董 顺
(安徽省砀山中学)
化学作为一门自然科学,既有自己的科学体系,又有与之适应的思维方法.定性分析解决的是“有什么”“是什么”的问题,而定量研究解决的是“有多少”的问题,下面以2021年6月浙江高考化学选考试题为例阐述化学计算在高考中的考查.
1 以氧化还原反应为载体考查化学计算
例1关于反应K2H3IO6+9HI=2KI+4I2+6H2O,下列说法正确的是( ).
A.K2H3IO6发生氧化反应
B.KI是还原产物
C.生成12.7gI2时,转移0.1mol电子
D.还原剂与氧化剂的物质的量之比为7∶1

该反应的电子转移情况可表示如下:
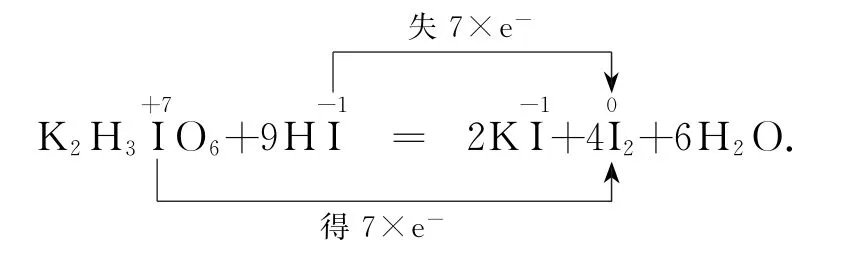
由电子转移情况可知,K2H3IO6作氧化剂发生还原反应,HI作还原剂发生氧化反应,I2既是氧化产物又是还原产物,KI既不是氧化产物也不是还原产物,还原剂与氧化剂物质的量比为7∶1,生成4molI2时转移7 mol电子,因此生成12.7gI2(物质的量为0.05mol)时,转移电子为0.0875mol,故答案为D.
【说明】本题以氧化还原反应的知识为载体,考查反应变化与规律等必备知识和辨析基本概念、处理转化数据等关键能力,体现变化观念与平衡思想的学科核心素养.准确分析陌生方程式中各元素的价态、电子转移方向及守恒关系是解答本题的关键.
2 以NA 为载体考查化学计算
例2设NA为阿伏加德罗常数的值,下列说法不正确的是( ).
A.标准状况下,1.12L18O2中含有中子数为NA
B.31gP4(分子结构:)中的共价键数目为1.5NA
C.100mL0.1mol·L-1的NaOH 水溶液中含有氧原子数为0.01NA
D.18.9g三肽C6H11N3O4(相对分子质量为189)中的肽键数目为0.2NA

标准状况下,1.12L18O2的物质的量为0.05 mol,1个18O2中含有中子数为20个,则0.05 mol18O2中含有的中子数为1mol,选项A 正确.31g P4的物质的量为0.25mol,由白磷的分子结构可知,1个白磷分子中含有6个共价键,所以0.25mol白磷中的共价键数为1.5mol,选项B正确.NaOH 水溶液中含有溶质氢氧化钠和溶剂水,氧原子数目为二者氧原子数目的和,选项C 错误.18.9g三肽C6H11N3O4的物质的量为0.1 mol,1个三肽分子中含有2个肽键,所以0.1mol三肽中的肽键数目为0.2mol,选项D 正确.答案为C.
【说明】本题以阿伏加德罗常数为载体,考查原子结构、化学键、多肽的结构、电解质溶液及物质的量的有关计算,突出对知识应用的考查,考查化学语言与概念、物质结构与性质等必备知识和分析与推测等关键能力,体现了宏观辨识与微观探析的学科核心素养,熟练掌握相关概念及相关概念使用的注意事项是解答该类试题的关键.
3 以反应速率、平衡常数及平衡转化率为载体考查化学计算
例3一定温度下,在100mLN2O5的CCl4溶液中发生分解反应:2N2O5⇌4NO2+O2.在不同时刻测量放出的O2体积,换算成N2O5浓度如表1所示.
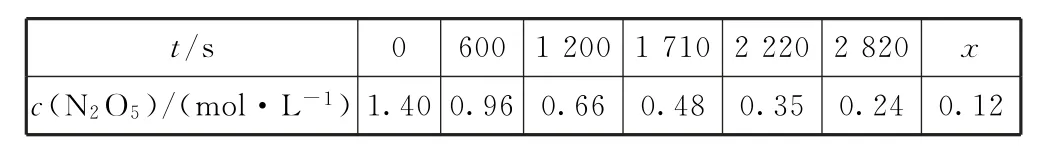
表1
下列说法正确的是( ).
A.600~1200s,生成NO2的平均速率为5.0×10-4mol·L-1·s-1
B.反应2220s时,放出的O2体积为11.8L(标准状况)
C.反应达到平衡时,v正(N2O5)=2v逆(NO2)
D.推测表1中的x为3930

根据表1数据可知600~1200s,
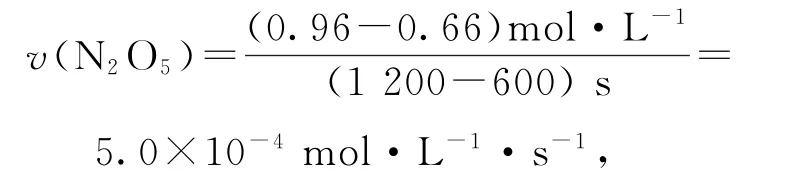
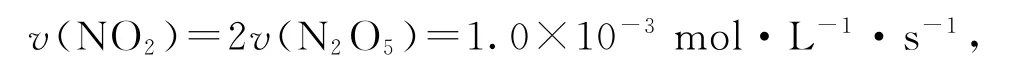
选项A 错误.由表中数据可知,反应2220s时,
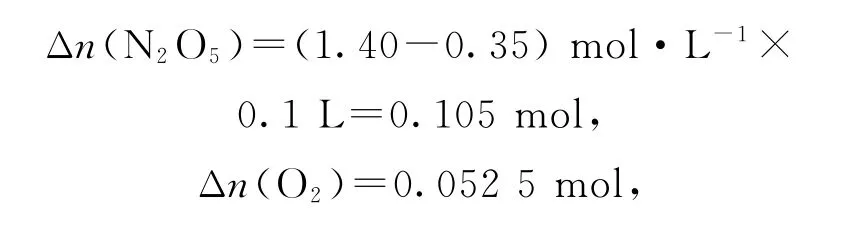
放出的O2在标准状况下的体积为0.0525 mol×22.4L·mol-1=1.176L,选项B 错误.反应达到平衡时,正、逆反应速率相等,用不同物质表示该反应的速率时,其数值之比等于化学计量数之比,2v正(N2O5)=v逆(NO2),选项C 错误.由表中数据知,该反应每经过1110s(600~1710s,1710~2820s)N2O5的浓度会变为原来的,因此,N2O5的浓度由0.24 mol·L-1变为0.12 mol·L-1时,用时也是1110s,所以x=2820+1110=3930,选项D正确.答案为D.
【说明】本题以N2O5的分解反应为情境载体,考查了化学反应速率的相关计算、影响因素及化学平衡状态的判断等知识,考查反应变化与规律等必备知识和处理转化数据、分析实验数据、归纳总结规律等关键能力,体现了变化观念与平衡思想的学科核心素养.理解速率、平衡的相关概念,弄懂题给信息是解答此类试题的关键.
例4含硫化合物是实验室和工业上的常用化学品.请回答:
(1)实验室可用铜与浓硫酸反应制备少量SO2:
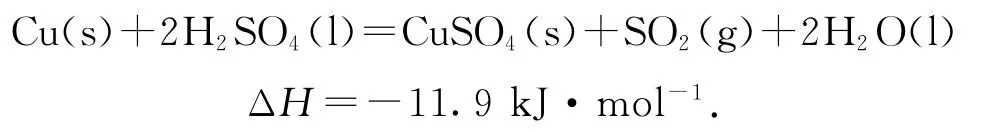
判断该反应的自发性并说明理由_________.
(2)已知2SO2(g)+O2(g)⇌2SO3(g) ΔH=-198kJ·mol-1.850K 时,在一恒容密闭反应器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1.
①该温度下反应的平衡常数为_________.
②平衡时SO2的转化率为________.

(1)反应Cu(s)+2H2SO4(l)=CuSO4(s)+SO2(g)+2H2O(l)是气体分子数增加的反应,即ΔS>0,因为ΔH<0,则在任何温度下,该反应的ΔH-TΔS<0(T为热力学温度)均成立,因此该反应在任何温度下都能自发进行.
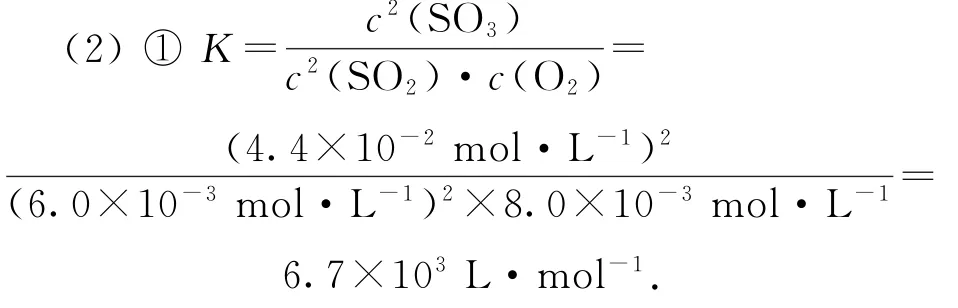
②平衡时SO2的转化率为
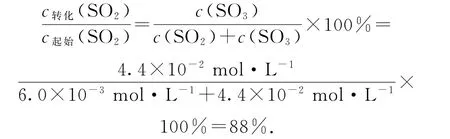
答案(1)不同温度下都能自发,是因为ΔH<0,ΔS>0.(2)①6.7×103L·mol-1;②88%.
【说明】本题以含硫物质的转化为情境素材考查反应方向的判断、平衡常数及平衡转化率的计算,考查了反应变化与规律等必备知识和科学推理论证、处理转化数据等关键能力,体现了变化观念与平衡思想、证据推理与模型认知等学科核心素养.理解相关概念并熟练计算是解答该类试题的关键.
4 以物质组成的推断为载体考查化学计算
例5将3.00g某有机物(仅含C、H、O 元素,相对分子质量为150)样品置于燃烧器中充分燃烧,依次通过吸水剂、CO2吸收剂,燃烧产物被完全吸收.实验数据如表2所示.
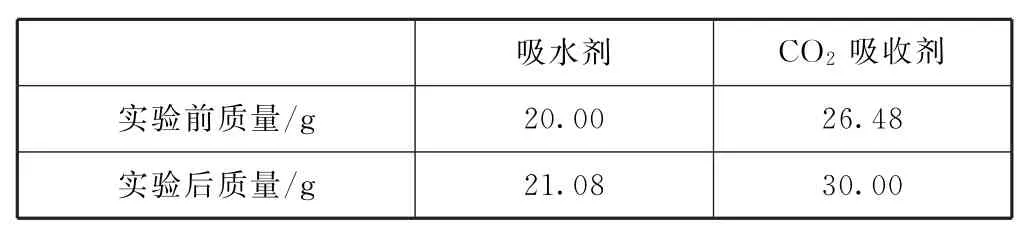
表2
请回答:
(1)燃烧产物中水的物质的量为________mol.
(2)该有机物的分子式为________(写出计算过程).

(1)由表中数据,吸水剂增加的质量全部为有机物完全燃烧生成水的质量,则生成水的物质的量为
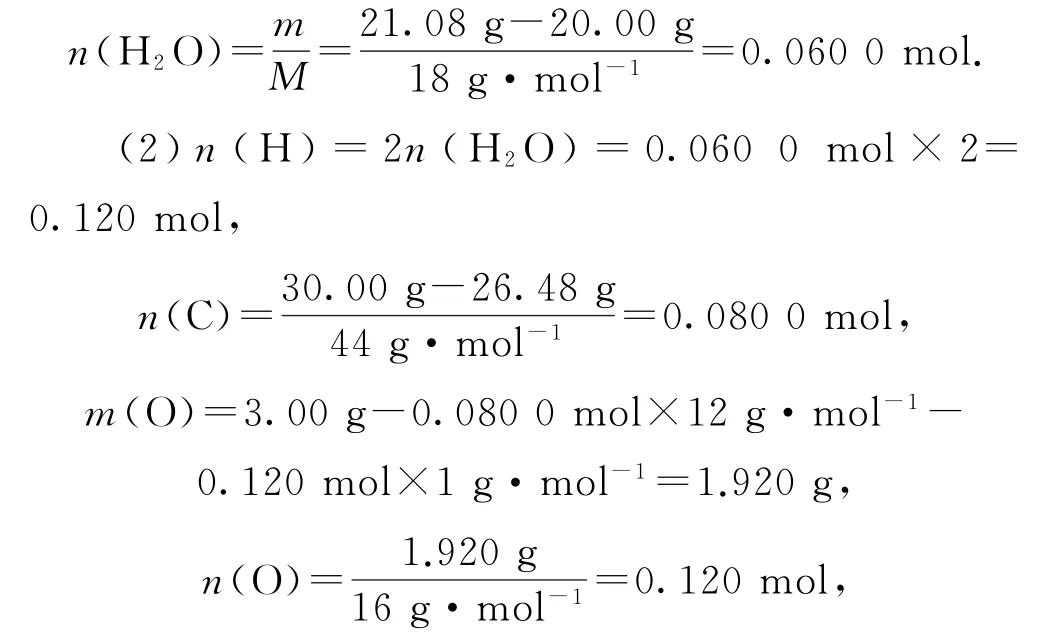
则n(C)∶n(H)∶n(O)=2∶3∶3,最简式为C2H3O3,由相对分子质量为150,得有机物的分子式为C4H6O6.
答案(1)0.0600.(2)C4H6O6.
【说明】本题以燃烧法测定有机物的组成实验为载体,考查有机物分子式的确定及物质的量的相关计算等知识点,考查实验原理与方法等必备知识和获取有关信息、分析实验数据等关键能力,体现以科学探究与创新意识、证据推理与模型认知为主的学科核心素养.
例6固体化合物X 由3种元素组成,某学习小组开展如图1所示探究实验.
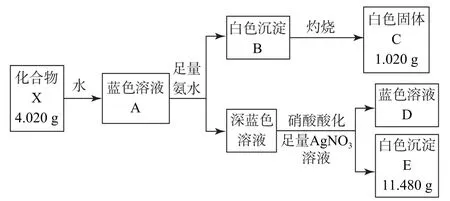
图1
其中,白色沉淀B能溶于NaOH 溶液.请回答:
(1)白色固体C 的化学式是_________,蓝色溶液D 中含有的溶质是________(用化学式表示).
(2)化合物X 的化学式是_________.

A 为蓝色溶液,则A 中含有Cu2+;A 与氨水反应生成白色沉淀B和深蓝色溶液,白色沉淀B能够溶于NaOH 溶液,则B为Al(OH)3,白色固体C为Al2O3,则A 中含有Al3+;深蓝色溶液含有[Cu(NH3)4]2+,与AgNO3溶液反应生成白色沉淀E,则E为AgCl,可知深蓝色溶液中含有Cl-;则A 中存在Cu2+、Al3+和Cl-,化合物X 中含有Cu、Al、Cl3种元素.
(1)根据分析可知,白色固体C 为Al2O3;溶液D中含有的阳离子有Cu2+、、Ag+、H+,阴离子有,溶液中含有Cu(NO3)2、NH4NO3、AgNO3、HNO3.
(2)由图示数据并根据原子守恒可知,4.020g X 中
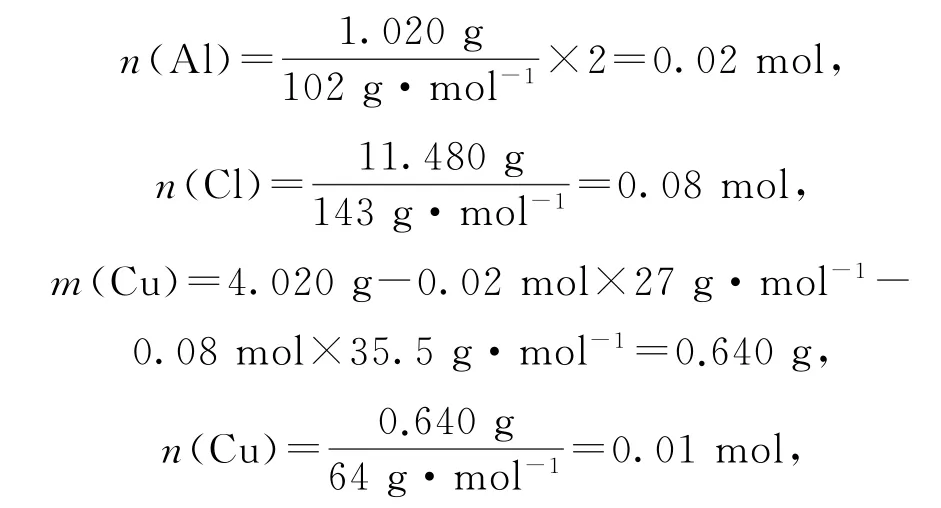
则n(Cu2+)∶n(Al3+)∶n(Cl-)=1∶2∶8,可得X 的化学式为CuAl2Cl8.
答 案(1)Al2O3;Cu(NO3)2、NH4NO3、AgNO3、HNO3.(2)CuAl2Cl8.
【说明】本题以物质组成的探究为载体,考查物质组成的计算、物质性质的探究等知识点,考查实验原理与方法、物质转化与应用等必备知识和获取有关信息、分析物质性质、识别有效证据、分析实验数据等关键能力,体现以科学探究与创新意识、证据推理与模型认知为主的学科核心素养.
5 以滴定分析法为载体考查化学计算
例7产品分析:取一定量Cl2O 浓溶液的稀释液,加入适量CCl4、过量KI 溶液及一定量的稀H2SO4,充分反应.用标准Na2S2O3溶液滴定(滴定Ⅰ);再以酚酞为指示剂,用标准NaOH 溶液滴定(滴定Ⅱ).已知产生I2的反应(不考虑Cl2与水反应):
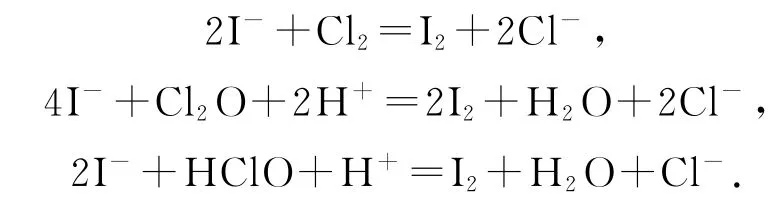
实验数据如表3所示.

表3
①用标准Na2S2O3溶液滴定时,无须另加指示剂.判断滴定Ⅰ到达终点的实验现象是_________.
②高纯度Cl2O 浓溶液中要求(Cl2O 和HClO 均以Cl2O 计).结合数据分析所制备的Cl2O 浓溶液是否符合要求________.

①溶有I2的CCl4溶液呈紫红色,用标准Na2S2O3溶液滴定I2过程中,当I2恰好反应完全时,溶液呈无色,因此滴定I2到达终点的实验现象是CCl4中由紫红色突变到无色,且30s不恢复.
②由2I-+Cl2=I2+2Cl-、4I-+Cl2O+2H+=2I2+H2O+2Cl-、2I-+HClO+H+=I2+H2O+Cl-(HClO 为Cl2O 与H2O 反应的产物)可得关系式:Cl2O~2H+~2I2,由实验数据可知Cl2O 和HClO 共消耗H+物质的量
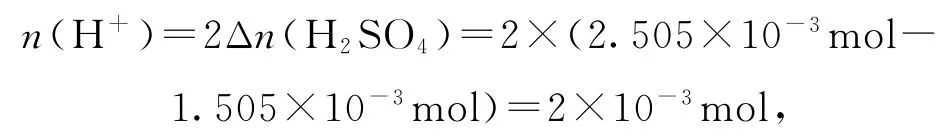
则Cl2O 与I-反应生成的n(I2)=n(H+)=2×10-3mol,溶液中n(Cl2O)=1×10-3mol,加入过量KI溶液共生成的n(I2)为2.005×10-3mol,因此Cl2与I-反应生成的n(I2)为2.005 × 10-3mol-2×10-3mol=5×10-6mol,由此可知溶液中n(Cl2)=5×10-6mol,所以高纯度Cl2O 浓溶液中,则所制备的高纯度Cl2O 浓溶液符合要求.
答案①CCl4中由紫红色突变到无色,且30s不恢复.②溶液中Cl2O 和Cl2分别为1.000×10-3mol、5×10-6mol,,符合要求.
【说明】本题以Cl2O 的制备及含量测定为情境载体,考查滴定终点的判断及氧化还原反应的相关计算等知识.试题侧重考查考生迁移应用知识的能力和实验基本技能,考查实验原理与方法等必备知识和获取有关信息、预测反应现象、分析实验数据等关键能力,体现了证据推理与模型认知、科学探究与创新意识的学科核心素养.
由以上分析能够看出在2021年6月浙江选考化学试题中对化学计算的考查比重非常大,这反映出化学学科不仅重视定性分析而且重视定量计算,所以应引起广大考生的高度重视,面对化学计算不要畏难,应静下心来认真分析,掌握化学学科的必备知识和解答此类试题的关键能力,注重过程的渗透,最终落实到素养的提升上来,真正适应新时代的高考模式,适应新时代理工科对化学创新人才的要求.
(完)

