化学必修第一册模拟测试题
熊芳媛
(佛山市顺德区第一中学)
(测试时间75分钟 满分100分)
第Ⅰ卷 (共44 分)
一、选择题(本题包括16小题,共44 分.第1~10题,每小题2分;第11~16题,每小题4分.在每小题给出的四个选项中,只有一项符合题目要求.)
1.我国古代的四大发明是人类文明的重大贡献.下列与四大发明相关的应用,涉及化学变化的是( ).
A.造纸术——文字书写 B.火药——矿山爆破
C.印刷术——书籍出版 D.指南针——海上导航
2.下列图示方法能完成相应实验的是( ).
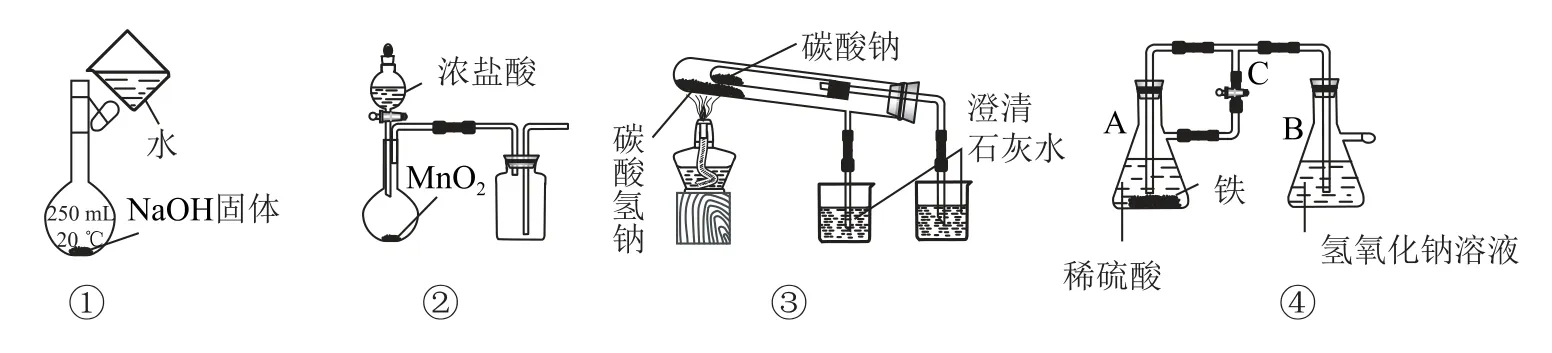
A.用图①配制一定物质的量浓度的NaOH 溶液
B.用图②在实验室制取Cl2
C.用图③探究碳酸氢钠和碳酸钠的热稳定性
D.用图④制备少量Fe(OH)2并能较长时间看到其呈白色
3.考古时利用14C测定文物的年代,下列关于14C的说法正确的是( ).
A.核外电子数为8 B.质子数与中子数之差为8
C.与14N 互为同位素 D.能与O2反应生成14CO2
4.分类是科学研究的重要方法,下列物质分类正确的是( ).
A.碱性氧化物:Na2O、Fe2O3、Na2O2B.同素异形体:石墨、C60、金刚石
C.非电解质:乙醇、二氧化碳、氯气 D.碱:苛性钠、纯碱、一水合氨
5.根据元素周期表和元素周期律,判断下列叙述不正确的是( ).
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.如图所示实验可证明元素的非金属性:Cl>C>Si
6.过氧化钠常用作呼吸面具或潜水艇的供氧剂,下列说法错误的是( ).
A.Na2O2的电子式:
B.Na+的结构示意图:
C.7.8gNa2O2中含有阴、阳离子总数为0.4NA
D.Na2O2与足量CO2反应生成标准状况下2.24LO2时,转移的电子数为0.2NA
7.设NA代表阿伏加德罗常数的值,下列说法正确的是( ).
A.标准状况下,11.2L H2O 中含有H—O 键的数目为NAB.32g氧气所含原子数目为NA
C.足量的钠与1molO2加热反应,转移的电子数为4NAD.17g氨气所含电子数目为10NA
8.下列叙述中,正确的是( ).
A.相同条件下,1体积的CH4与1体积的CO、CO2的混合气体所含碳原子数相同
B.等质量的O2和O3中所含分子数相同
C.H2SO4的摩尔质量是98
D.将98gH2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2mol·L-1
9.下列实验操作、现象与结论相符的一组是( ).

10.在强酸性溶液中,下列各组离子能大量共存的是( ).
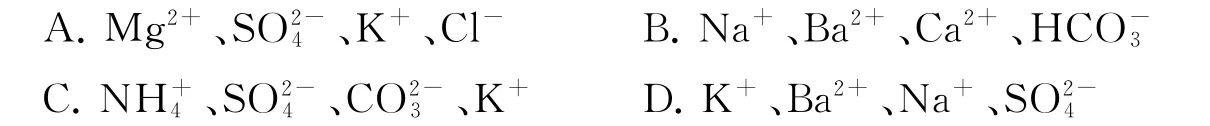
11.配制500mL0.100mol·L-1的NaCl溶液,部分实验操作示意图如下.
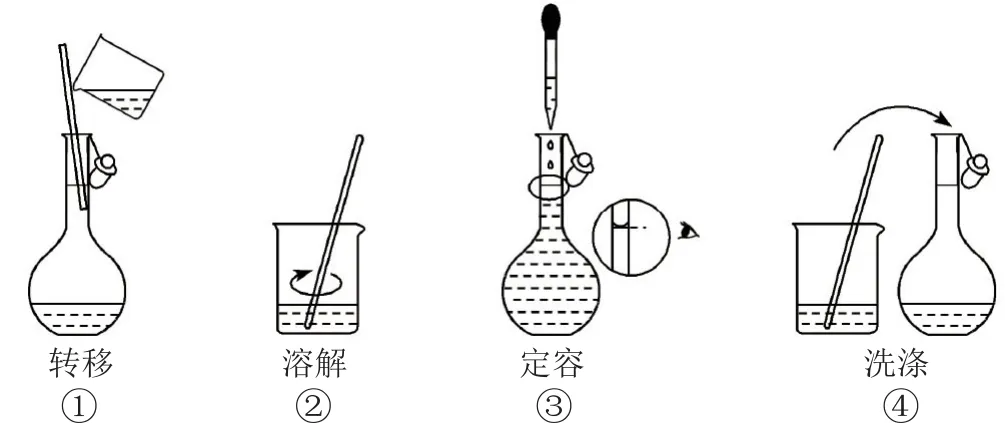
下列说法正确的是( ).
A.实验中需用到的仪器有:托盘天平、250mL容量瓶、烧杯、玻璃棒、胶头滴管等
B.上述实验操作步骤的正确顺序为①②④③
C.容量瓶需用自来水、蒸馏水洗涤,干燥后才可用
D.定容时,仰视容量瓶的刻度线,会使配得的NaCl溶液浓度偏低
12.下列反应对应的离子方程式正确的是( ).
A.将铁粉加入盐酸中:2Fe+6H+=2Fe3++3H2↑
C.NaOH 溶液中通入过量CO2:
D.Ba(OH)2溶液与稀硫酸反应:
13.卤素互化物如ICl、ICl3等具有与卤素单质相似的性质.实验室可用右图所示装置(夹持仪器已略去)制取少量ICl3.已知:反应I2+Cl2=2ICl,ICl的熔点为27.2℃,沸点为97.4℃,容易水解,能发生反应:ICl+Cl2=ICl3.下列叙述错误的是( ).
A.圆底烧瓶A 中的固体可以为KMnO4
B.装置B、C中的试剂分别为饱和食盐水和浓硫酸
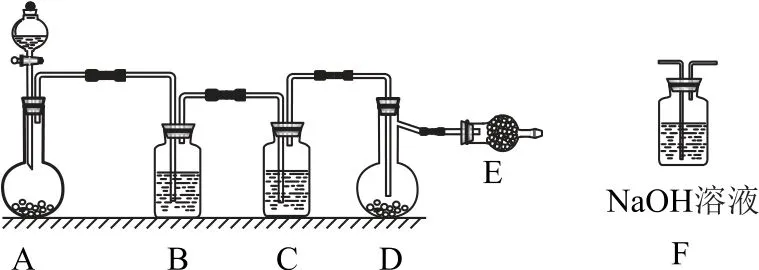
C.装置E的作用为吸收尾气,可用装置F替代
D.盐酸的滴加速度过快,ICl的产率会明显下降
14.二氧化氯(ClO2)是国际上公认的安全、无毒、绿色消毒剂和去污剂,可用于饮用水和环境的消毒杀菌处理,可以去除水体或环境中的氰化物污染等,去除氰化物污染的反应原理为2ClO2+2CN-=2CO2+N2+2Cl-.下列关于该反应的说法错误的是( ).
A.氧化剂只有ClO2B.氧化剂与还原剂的物质的量之比为1∶1
C.氧化产物只有CO2D.转移1mol电子时,理论上生成6.72L(标准状况)气体
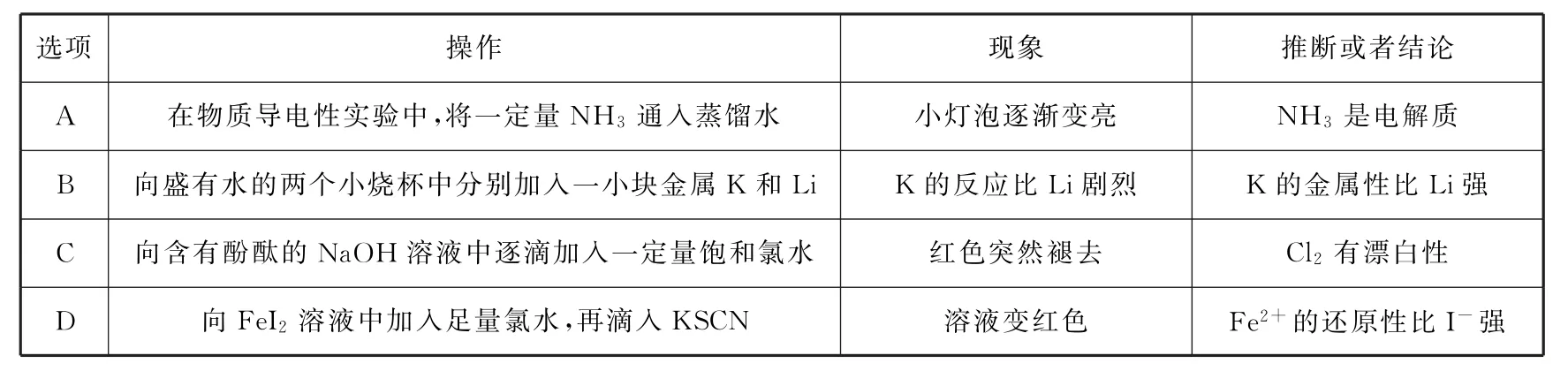
15.以下实验操作、现象、推断或者结论均正确的是( ).
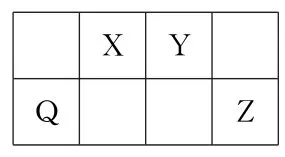
16.Q、X、Y 和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22.下列说法正确的是( ).
A.原子半径:r(Y)>r(X)
B.最高价氧化物的水化物的酸性:Q 比Z强
C.Z的某种氧化物常用于自来水消毒
D.Q 与Y 形成的化合物含有离子键
第Ⅱ卷 (共56 分)
二、非选择题(本题包括4小题,共56 分.)
17.(14分)几种主族元素在周期表中的位置如图.根据图中所示回答下列问题:
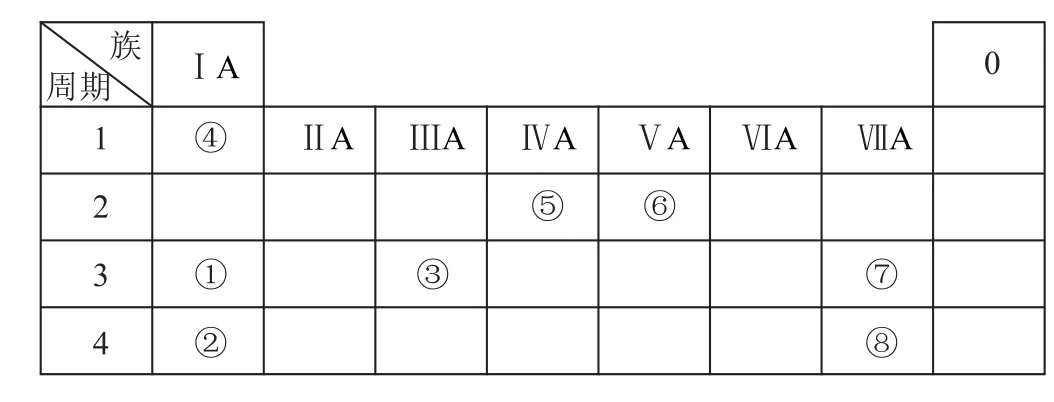
(1)元素⑥的氢化物的电子式是_________.
(2)①③⑦3种元素原子半径由大到小的顺序是________(用元素符号表示).
(3)图中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_________,该元素在周期表中的位置是________.
(4)①②③3种元素最高价氧化物对应水化物碱性最强的是_________(填化学式).①与③最高价氧化物对应水化物反应的离子方程式为________.
(5)⑦的非金属性强于⑧,从原子结构的角度解释其原因:_________.下列表述中能证明这一事实的是________(填字母).
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱
(6)①和④形成的是_________(填“离子”或“共价”)化合物.
18.(14分)硫酸亚铁是一种补铁剂,某兴趣小组利用经过初步处理的含有Fe2+的废液制备硫酸亚铁晶体的流程如图所示.
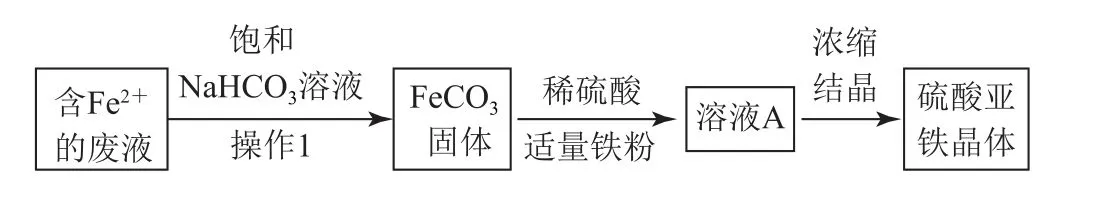
(1)加入饱和NaHCO3溶液后,得到白色沉淀,则操作1为________,若NaHCO3溶液浓度偏低可能会形成胶体,验证的方法为_________.
(2)加入铁粉的作用是________.
(3)可使用已知浓度的酸性高锰酸钾溶液测定废液中Fe2+的浓度.
①配平方程式,并用单线桥法表示电子转移过程:
____KMnO4+____FeSO4+____H2SO4=____MnSO4+____K2SO4+____Fe2(SO4)3+____H2O.
②已知Fe2+与NaHCO3按物质的量1∶2的比例恰好完全反应,该反应的离子方程式为_________.
(4)该兴趣小组在研究硫酸亚铁(FeSO4)热稳定性时,作出了两种假设:
①假设按CaCO3受热分解的方式分解,反应的化学方程式为_________.
②假设按KClO3受热分解的方式分解,已知产物中有两种酸性氧化物,则分解反应的化学方程式为______.
(5)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,硫酸亚铁可用于干法制备高铁酸钠,主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中Na2O2是_________(填“氧化剂”“还原剂”或“既做氧化剂又做还原剂”).
19.(14分)某NaHCO3样品中含有NaCl杂质,为测定试样中的质量分数,某同学设计了2种方案.
方案1:取5.0g样品溶于水,加入适当指示剂,逐滴滴入1.0mol·L-1盐酸,待完全反应时,测定所消耗的盐酸的体积.回答下列问题:
(1)上述测定需配制100mL1.0mol·L-1的盐酸.
①若用10mol·L-1浓盐酸配制溶液,需量取浓盐酸_________mL.
②配制过程中不需要用到的仪器是_________(填字母),还需要的仪器是_________.
③配制过程中出现以下情况,所配制溶液浓度偏高的是_________.
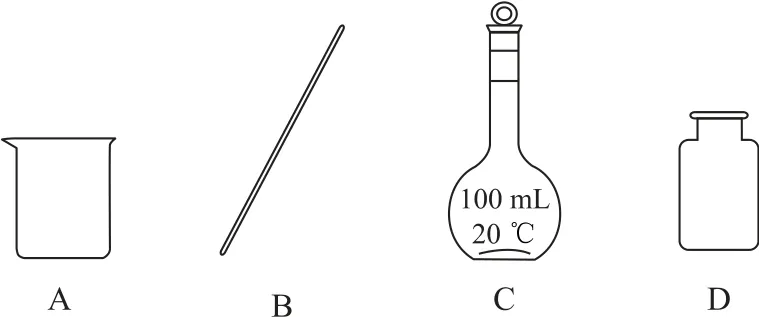
A.没有洗涤烧杯和玻璃棒
B.如果加水超过了刻度线,取出水使液面恰好到刻度线
C.量取浓盐酸时仰视刻度线
D.定容时俯视刻度线
(2)若测得消耗盐酸的体积为25.0mL,样品中NaHCO3的质量分数为_________.
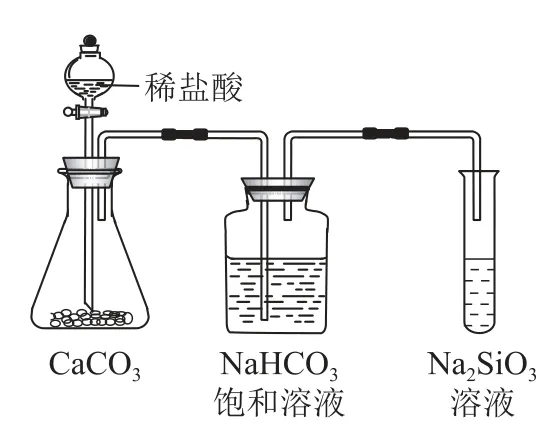
方案2:称取样品wg,按如图装置进行测定.
(3)装置A 中反应的化学方程式为_________.
(4)装置D 的作用是_________.
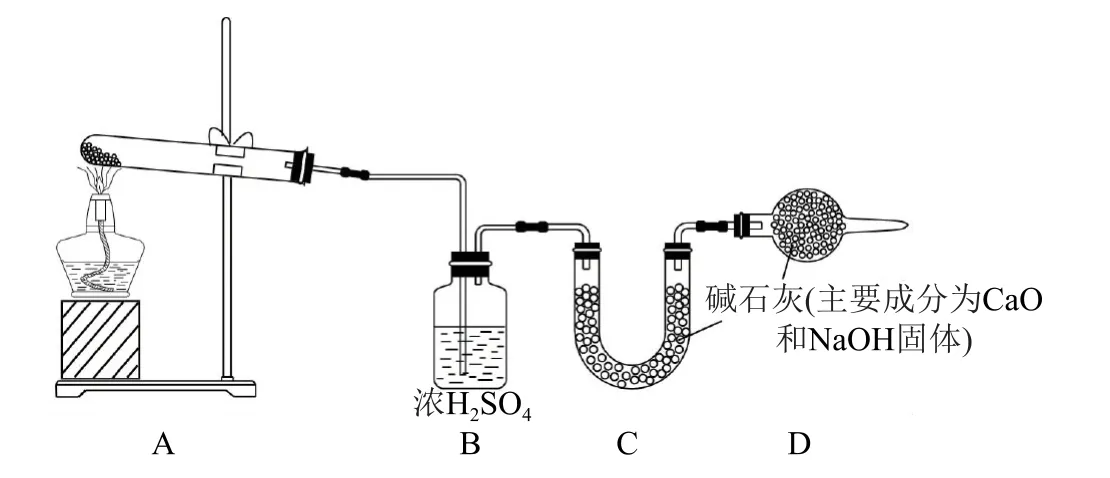
(5)简述该方案测定样品中碳酸氢钠的质量分数的实验过程和计算原理.
20.(14分)已知:亚硝酸(HNO2)是一种弱酸,且不稳定,易分解生成NO 气体和NO2(红棕色)气体;亚硝酸是一种还原剂,能被常见的强氧化剂氧化,但在酸性溶液中它也是一种氧化剂,如能把Fe2+(浅绿色)氧化成Fe3+(棕黄色);AgNO2(白色)是一种难溶于水、易溶于酸的化合物.请仔细阅读以上信息,回答下列问题:
(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转换为Fe3+而中毒,可以服用维生素C解毒.下列关于此过程的叙述不正确的是________(填字母).
a.亚硝酸盐被还原 b.亚硝酸盐是还原剂
c.维生素C将Fe3+还原为Fe2+d.维生素C被氧化
(2)下列方法不能用来区别NaNO2和NaCl的是_________(填字母).
a.取样加水溶解后,向其中加入稀盐酸
b.取样加水溶解后,向其中加入AgNO3溶液
c.取样加水溶解后,向其中加入稀硫酸酸化的淀粉-KI溶液
(4)某厂废液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________.
A.NaCl B.NH4Cl C.HNO3D.浓H2SO4
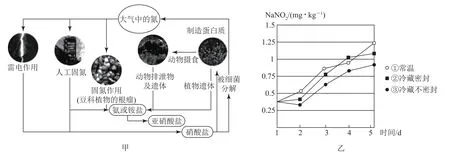
(5)自然界氮的循环过程如图甲所示.氮的循环中,亚硝酸盐是重要的一环,利用化合价可推知亚硝酸盐具有_________性和________性,亚硝酸盐和酸性高锰酸钾反应的离子方程式为________.
(6)研究不同条件下保存萝卜,发现亚硝酸钠含量随时间变化如图乙所示,若要保证在亚硝酸钠含量低于1mg·kg-1时食用,则3种条件下保存时间由长到短的顺序是________(填序号).