表达猪繁殖与呼吸综合征病毒N蛋白的重组腺病毒的构建及其免疫原性分析
刘庆庆,吴 鹏,李培东,张江伟,陈创夫,肖陈诚
(1.石河子大学动物科技学院,石河子 832000;2.人兽共患传染性疾病防治协同创新中心,石河子 832000;3.石河子大学生命科学学院,石河子 832000)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起,发病猪以出现严重的生殖衰竭和呼吸窘迫为特征[1-2]。该病于20世纪80年代末在美国首次报道[3-4],并于1995年在中国北京首次发现,此后在全国范围内迅速传播[5];2006年在中国出现的能引起高发病率和高死亡率疫情的高致病性PRRSV给养猪业造成了严重的经济损失[6-8]。2013年以后,一种与美国毒株NDC30相似性很高的新型PRRSV毒株NADC30-like在中国多个地区逐渐流行[9-10],对养猪业构成了巨大的威胁。
PRRSV是一种有包膜的正链 RNA 病毒,属于尼多病毒目动脉炎病毒科[11-12]。目前,根据其基因组序列的特征,将PRRSV毒株较为系统地分为欧洲型和美洲型2种基因型,也称为基因Ⅰ型和基因Ⅱ型[13]。2个PRRSV基因型只有约60%的相似性,但这2种毒株所引起的PRRS的临床症状较相似[14]。
核衣壳蛋白(N,15 ku)、膜蛋白(M,19 ku)和包膜糖蛋白(GP5,26 ku)是PRRSV的主要结构蛋白,分别由ORF7、ORF6和ORF5基因编码[15]。另外3个糖蛋白GP2、GP3和GP4代表次要结构蛋白。N蛋白具有高度抗原性,因此成为用于检测病毒特异性抗体以进行诊断或监视的候选蛋白。在感染PRRSV的猪产生的诸多特异性抗体中,最早产生的是针对N蛋白的抗体且抗体存在时间最长。此外,有研究发现以PRRSV N蛋白作为亚单位疫苗组分可增强疫苗保护率[16-18]。
本研究通过腺病毒包装技术成功表达N蛋白,并在分子和动物水平上鉴定其反应原性和免疫原性,以期为PRRS的诊断与防控提供物质材料。
1 材料与方法
1.1 试验动物、细胞和载体
8周龄健康昆明雌性小鼠购自新疆医科大学实验动物中心。质粒pDC316-mCMV-EGFP及PBHGLOX (delta)E1,3Cre均购自淼灵质粒平台;大肠杆菌Top10感受态细胞购自天根生化科技(北京)有限公司;293A细胞购自北京北纳创联生物技术研究院。
1.2 主要试剂
T4 DNA连接酶、限制性内切酶EcoR Ⅴ和Hind Ⅲ均购自TaKaRa公司;无内毒素质粒大提试剂盒及DNA凝胶回收试剂盒均购自天根生化科技(北京)有限公司;RIPA细胞裂解液购自北京索莱宝科技有限公司;DM2000 DNA Marker、100 bp DNA Ladder、反转录试剂盒和HRP标记的羊抗猪抗体均购自康为世纪生物科技有限公司;1 kb DNA Ladder购自礼美生物科技(上海)有限公司;佐剂Gel和LM及临床PRRSV抗体阳性血清均由石河子大学人兽共患病实验室制备并保存;PRRSV抗体检测试剂盒购自上海江莱生物科技有限公司。
1.3 目的基因设计及合成
依据PRRSV HNjz15 毒株(GenBank登录号:KT945017.1)的N基因序列,对序列进行密码子优化并在末端加上His标签序列,同时在该序列的上、下游分别加上EcoR Ⅴ和Hind Ⅲ酶切位点,N基因由通用生物系统(安徽)有限公司合成。
1.4 重组腺病毒的构建
将N基因与穿梭载体pDC316-mCMV-EGFP用限制性内切酶EcoR Ⅴ和Hind Ⅲ进行酶切,使用T4 DNA连接酶将纯化的酶切产物进行连接,产物转化大肠杆菌Top10感受态细胞,重组质粒经PCR、双酶切及测序鉴定均正确后命名为pDC316-N。将穿梭质粒pDC316-N与AdMax腺病毒系统的骨架质粒PBHGLOX(delta)E1,3Cre共同转染汇合度为60%~70%的293A细胞,置于37 ℃、5% CO2细胞培养箱中培养,待80%左右细胞发生病变并从底部脱落时,收获病毒液,将获得的病毒命名为rAd-N;连续传代进行扩增,浓缩后检测病毒的半数组织培养感染剂量(median tissue culture infective dose,TCID50),提取病毒DNA进行PCR鉴定。
1.5 RT-PCR及Western blotting检测PRRSV N蛋白的表达
取接种重组腺病毒和未接种重组腺病毒的293A细胞各一板,按TRIzol裂解法提取总RNA,用反转录试剂盒反转录后进行PCR检测。用收获的重组腺病毒液接种长满单层的293A细胞,裂解后加入0.2倍体积的5×SDS蛋白上样缓冲液,进行SDS-PAGE,转印到0.22 μm PVDF膜上,使用临床PRRSV抗体阳性血清和HRP标记的羊抗猪IgG进行Western blotting鉴定。
1.6 小鼠免疫试验
1.6.1 小鼠免疫接种 将50只昆明小鼠随机分为7组,各组按照表1程序进行免疫。每组小鼠均采用背部皮下免疫,0.5 mL/只,均在注射疫苗前用断尾法采血,之后每次间隔7 d采血,持续5周。将采集的血液立即置于37 ℃培养箱静置沉淀2 h,6 000 r/min离心10 min,收集其清亮透明的上清,-20 ℃保存备用。

表1 小鼠免疫及分组情况
1.6.2 免疫小鼠抗体水平检测 使用PRRSV抗体ELISA试剂盒检测免疫后各周小鼠的抗体水平。
1.7 统计分析
试验数据采用SPSS 17.0软件进行单因素方差分析(One-Way ANOVA),采用LSD检验法进行组间多重比较,结果用平均值±标准差表示。P<0.05表示差异显著。
2 结 果
2.1 重组腺病毒穿梭质粒的构建
将pDC316-N菌液进行PCR扩增,产物用2.0%琼脂糖凝胶电泳,结果显示,得到大小约为400 bp的条带(图1),与预期结果相符。对pDC316-N重组质粒进行双酶切鉴定,酶切得到大小约为5 850和400 bp的条带(图2),测序结果与PRRSVN基因合成序列一致,表明pDC316-N穿梭质粒构建成功。

M,100 bp DNA Ladder;1~4,重组质粒pDC316-N PCR产物;5,阴性对照M,100 bp DNA Ladder;1-4,PCR products of recombinant plasmid pDC316-N;5,Negative control图1 重组腺病毒穿梭质粒pDC316-N的PCR鉴定Fig.1 PCR identification of recombinant Adenovirus shuttle plasmid pDC316-N
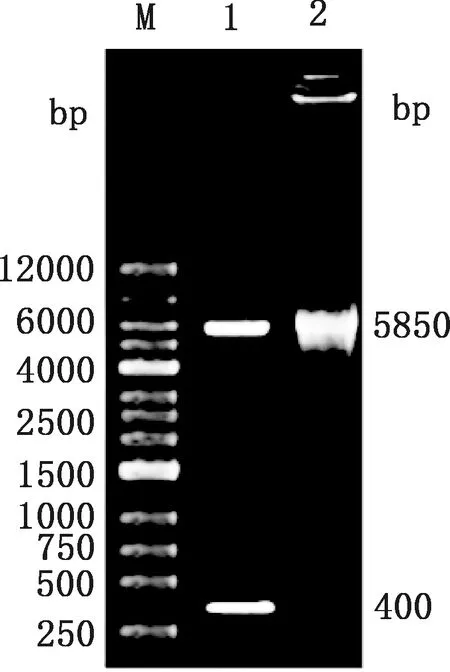
M,1 kb DNA Ladder;1,pDC316-N双酶切产物;2,pDC316-mCMV-EGFP双酶切产物M,1 kb DNA Ladder;1,Double digestion products of pDC316-N;2,Double digestion product of pDC316-mCMV-EGFP图2 重组腺病毒穿梭质粒pDC316-N双酶切鉴定Fig.2 Identification of recombinant Adenovirus shuttle plasmid pDC316-N by double enzyme digestion
2.2 重组腺病毒构建
重组穿梭质粒与骨架质粒共同转染293A细胞后10 d,细胞出现病变(图3),收集病变的293A细胞,获得1株重组腺病毒rAd-N。将重组腺病毒连续传代,接种后48~72 h均出现细胞病变,提取DNA,PCR可扩增出400 bp的目的条带,对照组无任何条带(图4),测得浓缩后重组腺病毒病毒TCID50为10-10.239。

A,293A细胞对照;B,感染rAd-N的293A细胞A,293A cell control;B,293A cells infected with rAd-N图3 重组腺病毒rAd-N的包装(100×)Fig.3 Packaging of recombinant Adenovirus rAd-N (100×)

M,DM2000 DNA Marker;1、2,rAd-N PCR产物;3阴性对照M,DM2000 DNA Marker;1 and 2,PCR products of rAd-N;3,Negative control图4 重组腺病毒rAd-N的PCR检测Fig.4 PCR detection of recombinant Adenovirus rAd-N
2.3 重组腺病毒的表达检测
RT-PCR检测结果显示,在400 bp处出现明亮的条带(图5),表明该重组腺病毒表达的PRRSVN基因能在293A细胞内转录和表达。 Western blotting检测结果显示,在14 ku处观察到特异性条带 (图6),与预期N蛋白分子质量大小基本一致,重组腺病毒rAd-N可与临床PRRSV抗体阳性血清结合,表明重组腺病毒rAd-N具有良好的反应原性。
2.4 抗PRRSV特异性抗体的检测
由图7可知,每组小鼠抗体含量随着时间的持续而变化,rAd-N各免疫组小鼠初免第1周抗体水平明显升高,且抗体含量显著高于G组(对照组)(P<0.05),说明rAd-N能激起小鼠产生特异性的抗PRRSV抗体。在免疫后第5周时,除A组外其他各免疫组抗体水平仍显著高于G组(对照组)(P<0.05)。在B、D、F组中,D组于初次免疫后第1周抗体水平显著高于B组(P<0.05),并于初免后第2周显著高于F组(P<0.05), F组初次免疫后
第3周抗体水平显著高于B组(P<0.05),免疫rAd-N后,A、C、E组之间抗体水平虽有所差异,但差异不显著(P>0.05)。 在所有免疫组中,D组(Gel佐剂)抗体水平较其他组稍高,最高可达7.84 U/L。在免疫后第3和5周,使用同一佐剂时,初次免疫后加强免疫组(B、D、F组)抗体水平高于对应的单剂免疫组(A、C、E组),但差异不显著(P>0.05)。

M,100 bp DNA Ladder;1~5,rAd-N RT-PCR产物;6,阴性对照M,100 bp DNA Ladder;1-5,rAd-N RT-PCR product;6,Negative control图5 重组腺病毒rAd-N RT-PCR检测Fig.5 RT-PCR detection of recombinant Adenovirus rAd-N

1、2,重组腺病毒rAd-N与PRRSV抗体阳性血清反应1 and 2,Recombinant Adenovirus rAd-N reacted with PRRSV antibody positive serum图6 重组腺病毒rAd-N Western blotting检测Fig.6 Western blotting detection of recombinant Adenovirus rAd-N

同一时间点,肩标不同字母表示差异显著(P<0.05);肩标相同字母或无字母标注表示差异不显著(P>0.05)At the same time point,values with different letter superscripts mean significant difference (P<0.05);While with the same or no letter superscripts mean no significant difference (P>0.05)图7 小鼠抗体水平变化Fig.7 Changes in mouse antibody levels
3 讨 论
PRRS自发生以来给全球养猪业造成了巨大的经济损失,其病原PRRSV的高度变异给该病的预防和诊治造成了很大困难,目前依然没有治疗该病的特效药。腺病毒表达载体可承载多种异源基因,对静止和分裂期细胞均可感染,目前已被广泛应用于基因疫苗的研究,在人和动物的腺病毒构建和临床应用上均有成功的案例[19-20]。N蛋白由ORF7基因编码,是PRRSV的重要结构蛋白之一,也是组成病毒核衣壳的唯一组分,在病毒粒子中含量较高,具有丰富的抗原表位,免疫原性最强。研究表明,N蛋白质中心区域(50-66位氨基酸)在欧洲型和美洲型毒株间高度保守[21-22]。PRRSV感染机体后,体内最先出现针对N蛋白的免疫反应且可持续很长时间,对PRRSV的诊断具有非常重要的意义[23]。本研究利用腺病毒表达系统构建PRRSVN基因重组腺病毒表达载体,以期为PRRSV的诊断和防控提供材料。
研究者利用重组腺病毒表达GP5、GP4、GP3、M蛋白及GP3-GP5和GP3-GP4-GP5等融合蛋白,并对其作为疫苗的可行性做了研究,取得了一定的效果[24-26],但目前国内鲜有用重组腺病毒表达N蛋白的报道。程福亮等[27]采用表达PRRSV N蛋白作为包被抗原建立了PRRSV抗体ELISA检测方法;杨佰启等[22]用原核表达制备的N蛋白具有良好的免疫原性和反应原性。但原核表达的N蛋白并不能保证其具有天然的活性,本研究所用腺病毒表达系统为真核表达系统,表达的外源蛋白与天然蛋白构象一致,具有生物活性,可为进一步探究N蛋白功能奠定一定的基础。
本研究用PRRSV抗体ELISA检测试剂盒检测接种小鼠不同时期血清中的特异性抗体水平,结果表明首免后抗PRRSV抗体水平迅速升高,加强免疫后抗体水平升高,维持时间更长,表明疫苗可引起小鼠机体的体液免疫应答,且与首免后加强免疫可提高免疫效果的研究结果一致。佐剂能延长抗原在体内的保留时间,使抗原与免疫细胞有充分的接触时间,增强机体对抗原的特异性免疫应答,产生较多的中和抗体,本试验选用LM和Gel佐剂配合重组腺病毒rAd-N免疫小鼠,结果表明,与LM佐剂相比,Gel佐剂免疫效果稍好,但只在个别时间点差异显著,可能是小鼠的个体差异所致。腺病毒六邻体蛋白是激活先天免疫的有效佐剂[28],本试验中设置的无佐剂免疫组抗体水平虽比含佐剂组抗体水平稍低,这与腺病毒疫苗具有天然的佐剂效果的研究结果一致,为腺病毒疫苗免疫方式和佐剂使用提供一定的参考依据。
4 结 论
本研究成功构建重组腺病毒rAd-N,RT-PCR检测显示该重组腺病毒能在293A细胞内转录和表达PRRSV N蛋白,且Western blotting分析其具有良好的反应原性,免疫小鼠后可引起特异性免疫反应,该研究可为PRRSV的血清学诊断(ELISA等)提供参考依据。
——一道江苏高考题的奥秘解读和拓展

