大豆转录因子GmWIN1-1的鉴定与表达分析
蔡桂萍,黄旭升,史先飞,李润植,张 莉
(山西农业大学 农学院,山西 太谷 030801)
大豆(Glycine max)是世界主要的粮油作物之一,为人类提供丰富的蛋白质和食用油,亦是畜禽饲料的优质资源[1-2]。但在我国大豆种植面积小,并且在整个生长发育过程中经常受到各种逆境因素的影响,目前大豆油的主要来源仍然依靠进口[3],提高大豆产量成为了一项艰巨的任务[4]。因此,挖掘大豆抗逆基因和解析其作用的分子机制具有重要意义,可为培育高产优质和多重抗逆性的优良大豆品种奠定基础。
已有研究表明,基因的启动子是一段能被RNA聚合酶识别与结合,并启动基因表达的DNA序列。启动子含有多种顺式作用元件,可调控非生物胁迫、光照、植物激素等信号通路。例如,彭亚男[5]在大豆中发现,GmCBL7基因启动子参与调控大豆对高盐和干旱胁迫的应答。冯志娟等[6]研究发现,大豆GmTIP2:6基因启动子促使低温、高盐胁迫下GUS酶活性上调表达。因此,启动子核心顺式元件的鉴定有助于研究靶基因介导植物抗逆性机制。
转录因子作为一种DNA结合蛋白,可与启动子顺式作用元件相互作用,激活或抑制目标基因转录。转录因子WAX INDUCER1/SHINE1(WIN1/SHN 1)是AP2/ERF(APETALA 2/ethyleneresponse factor)超家族的ERF-B6亚家族[7],已发现在拟南芥(Arabidopsis thaliana)[8]、水 稻(Oryza sativa)[9]、小麦(Triticumaestivum)[10]、大麦(Hordeumvulgare)[11]、番 茄(Lycopersiconesculentum)[12]、苹 果(Malus pumila)[13]和甘蓝型油菜(Brassica napus)[14]等高等植物中介导蜡质生物合成调控。其中,在拟南芥中过表达AtWIN 1导致叶和茎表皮蜡质积累以及拟南芥耐旱性的显著增加[15]。在盐胁迫条件下,过表达BnWIN 1导致甘蓝型油菜蜡积累增加了20%~22%,并促进了生长,而油脂积累未有明显变化[14]。在硬粒小麦中Td SHN1的过表达增加了酵母对多种非生物胁迫的耐受性[10]。目前,还未发现关于大豆WIN1家族成员介导大豆油脂生物合成和胁迫应答及其他生物学过程的调控。
为深入了解转录因子GmWIN1-1是否介导大豆油脂合成和非生物胁迫响应的调控,本研究依据已有的大豆转录组数据,以拟南芥AtWIN1蛋白序列为索引,同源比对鉴定获得1个具有完整开放阅读框(ORF)的大豆GmWIN1-1;使用生物信息学软件分析其编码蛋白理化性质、蛋白结构和基因启动子顺式元件等,并采用qRT-PCR分析转录因子GmWIN 1-1在大豆不同组织中的表达量以及对干旱胁迫的响应,为深入研究大豆GmWIN1家族成员生物学功能和大豆抗逆性遗传改良提供新见解。
1 材料和方法
1.1 试验材料
以生长周期较短的大豆优选品种Jack为试验材料。
1.2 材料处理
选取长出第1片真叶的大豆幼苗,用质量分数为20%的PEG6000溶液进行干旱胁迫处理[16],共设置7个处理时间,即0、2、4、6、9、12、24 h,每个处理时间取材3株。
1.3 Gm WIN1-1蛋白的生物信息学分析
以拟南芥AtWIN1编码序列为索引,在山西农业大学分子农业与生物能源研究所实验室已有的大豆转录组数据库中Blast比对,获得转录因子GmWIN1的cDNA序列信息。使用NCBI-ORF分析cDNA序列是否具有完整的开放阅读框(ORF),经比对分析获得1条具有完整开放阅读框的大豆GmWIN1 cDNA序列,命名为GmWIN 1-1。通过NCBI中CDD数据库分析GmWIN1-1的保守结构域。利用Gene Structure Disply Server网站分析GmWIN1-1的基因结构[17]。
利用在线网站ProtParam分析大豆GmWIN1-1蛋白理化性质;利用Ex PASy数据库中的ProtScale预测疏水性;利用在线网站SOPMA预测GmWIN1-1蛋白二级结构构成;在线网站SWISSMODEL对GmWIN1-1蛋白进行三级结构预测分析并建模[18];在线软件PlantCARE预测GmWIN1-1起始密码子前2 000 bp序列的核心作用元件。所有生物信息学工具网址如表1所示。
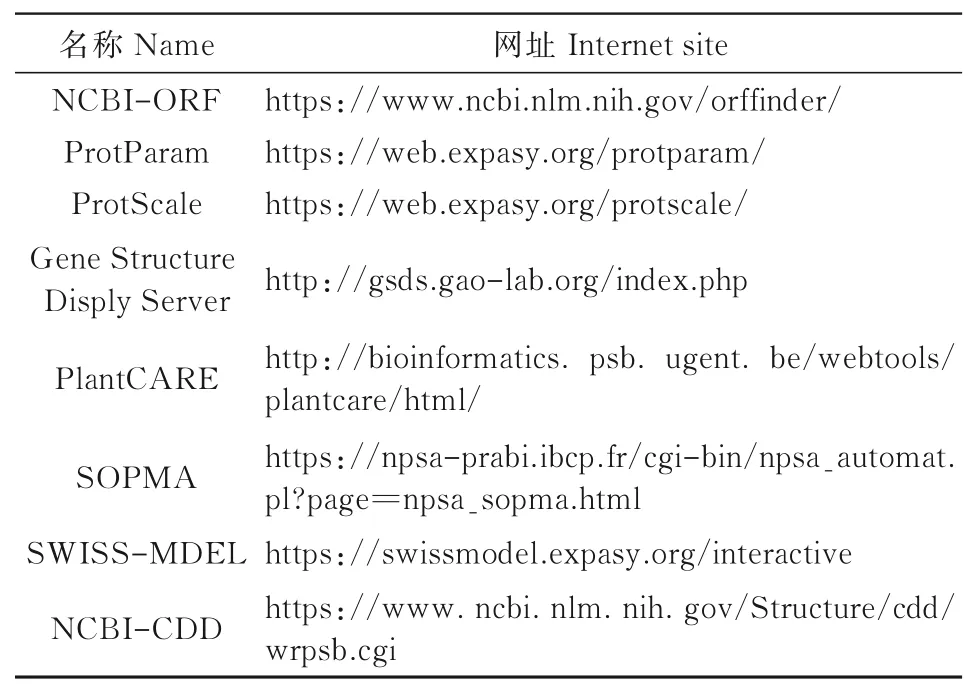
表1 生物信息学工具Tab.1 Bioinformatics tools
1.4 GmWIN1-1蛋白的多序列比对和系统发育分析
从NCBI中调取水稻、紫花苜蓿、大麦、拟南芥的WIN 1蛋白序列,使用DNAMAN软件比对不同物种WIN1蛋白序列相似性。使用在线软件MEME(https://meme-suite.org/meme/tools/meme)分析不同物种WIN 1蛋白序列的基序。运用MEGA 7.0软件,采用邻接法(Neighbor-joining)对GmWIN1-1蛋白构建系统进化树,设定Bootstrap值为1 000[19]。
1.5 RNA提取及实时荧光定量PCR
用植物Transzoltm试剂(Transgen Biotech,北京)提取了大豆的总RNA,用gDNA remover(GenStar,中国)去除基因组DNA污染。用StarScriptⅡRT Mix(GenStar,中国)将第一链互补DNA(cDNA)在20μL体积的总RNA(2μg)合成。
以上述的cDNA为模板,扩增引物序列如表2所示。依照TB Green™Premix Ex Taq™II(北京TaKaRa)说明方法进行qRT-PCR检测,设置6个生物重复。
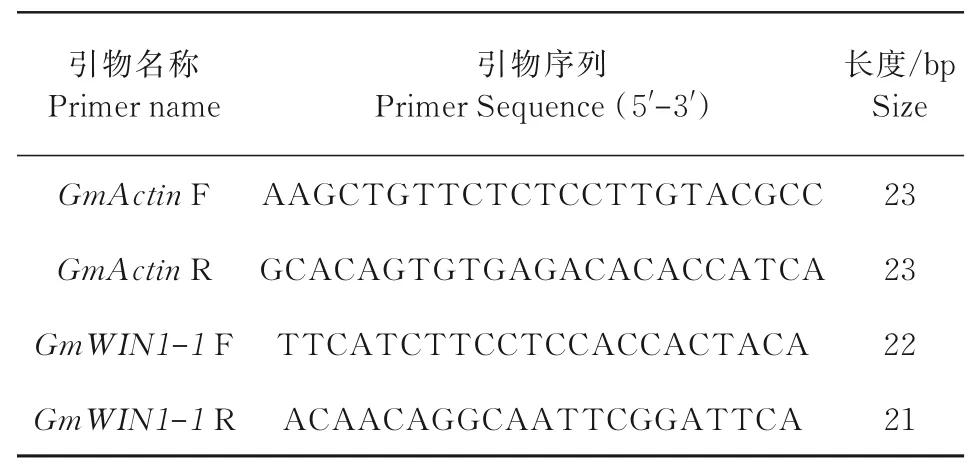
表2 荧光定量PCR所用引物Tab.2 Primers used in fluorescence quantitative PCR
1.6 数据处理
采用Bio-Rad CFX Manager和IBM SPSS Statistics 20软件对数据进行统计分析。采用单因素(One-way ANOVA)和Duncan法进行方差分析和多重比较(α=0.05)。利用Excel 2003和Adobe Illustrator CS6软件作图。
2 结果与分析
2.1 大豆Gm WIN1-1转录因子的鉴定
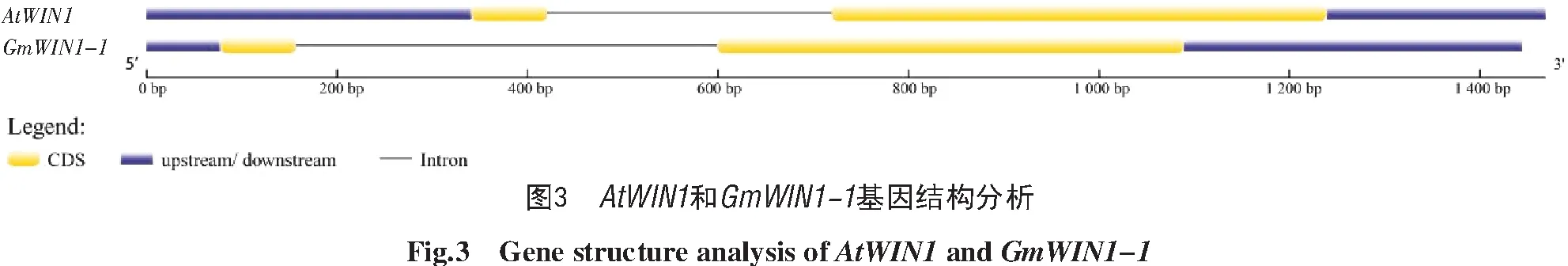
依据模式植物拟南芥AtWIN1的编码序列,在山西农业大学分子农业与生物能源研究所实验室已有的大豆转录组数据Blast比对,获得几个候选GmWIN1成员。经比对分析获得1条具有完整开放阅读框(ORF)的候选GmWIN 1,命名为GmWIN1-1。该cDNA阅读框全长570 bp,编码189个氨基酸(图1)。结构域预测结果如图2所示,AtWIN 1和GmWIN1-1分别具有1个AP2保守结构域。基因结构结果如图3所示,AtWIN 1和GmWIN1-1均含2个外显子和1个内含子,且具有5′和3′非翻译区。


2.2 大豆Gm WIN1-1蛋白的基本理化性质分析
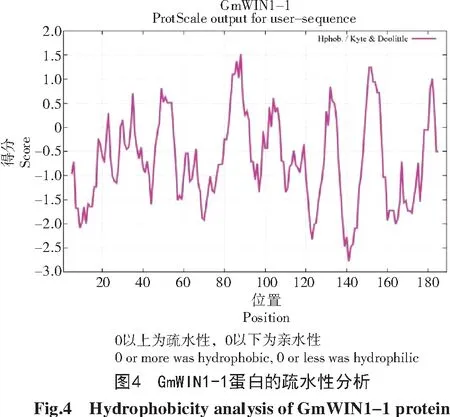
利用ProtParam工具分析大豆GmWIN1-1蛋白基本理化性质,结果如表3所示。该蛋白长度为189个氨基酸;理论等电点为8.45,属于碱性蛋白;蛋白的分子质量为21.2 ku;该蛋白的不稳定性指数为68.34,属于不稳定蛋白;脂肪系数为69.63;总平均亲水系数为-0.694,为亲水性蛋白。疏水性结果如图4所示,在0以下的峰居多,与基本理化性质预测结果一致,属于亲水性蛋白。

表3 GmWIN1-1蛋白理化性质Tab.3 Physical and chemical properties of GmWIN1-1 protein
2.3 大豆Gm WIN1-1蛋白的高级结构分析
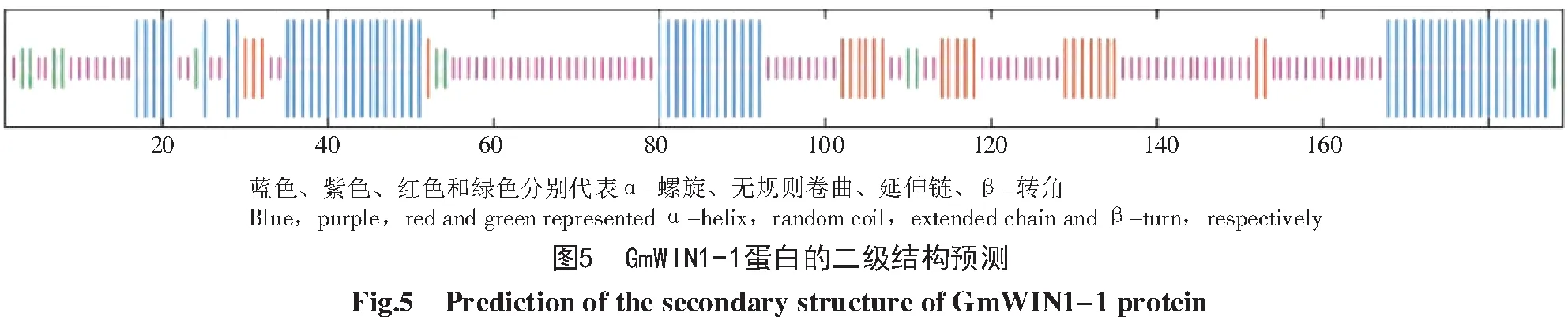
利用在线软件SOPMA预测GmWIN1-1蛋白的二级结构,结果如图5所示,无规则卷曲所占的比例最高,为50.79%,α-螺旋所占的比例为30.69%,延伸链和β-转角所占的比例分别为13.23%和5.29%。分析结果表明,大豆GmWIN1-1蛋白的二级结构主要由α-螺旋和无规卷曲构成,该蛋白为混合型蛋白。
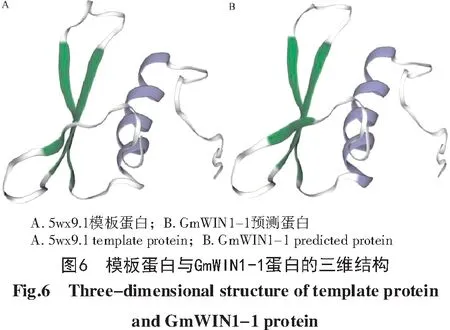
用SWISS-MODEL软件分析GmWIN 1-1蛋白的三级结构,结果如图6所示,使用模板蛋白5wx9.1对GmWIN1-1蛋白进行同源建模,模板蛋白与GmWIN1-1蛋白氨基酸序列相似性为45%,覆盖率为34%,GmWIN 1-1的保守序列范围为4-68位氨基酸。
2.4 大豆GmWIN1-1蛋白的序列比对及系统进化分析
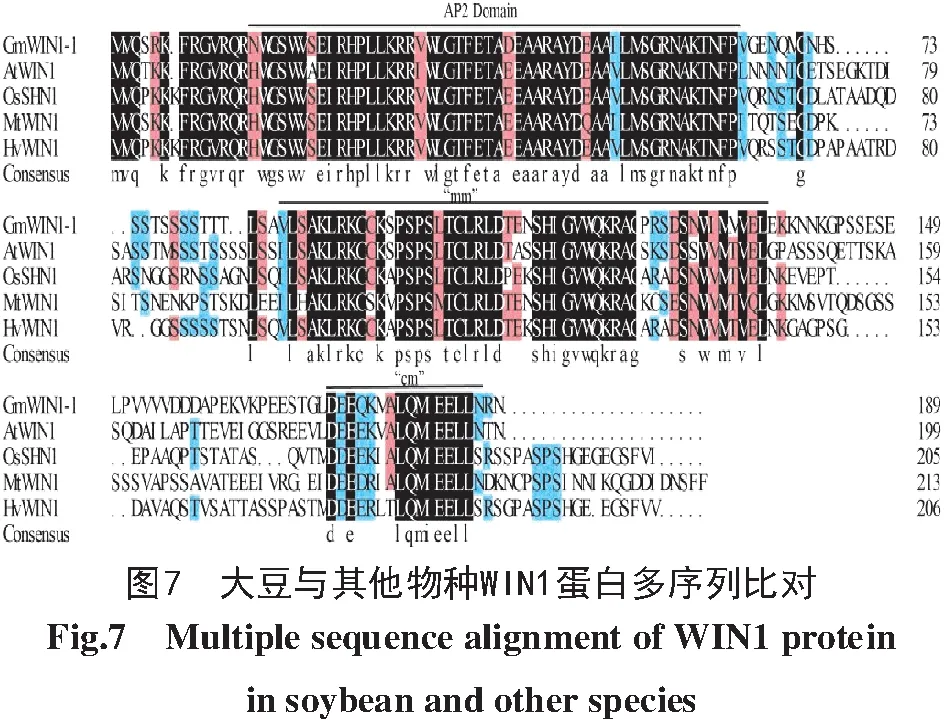
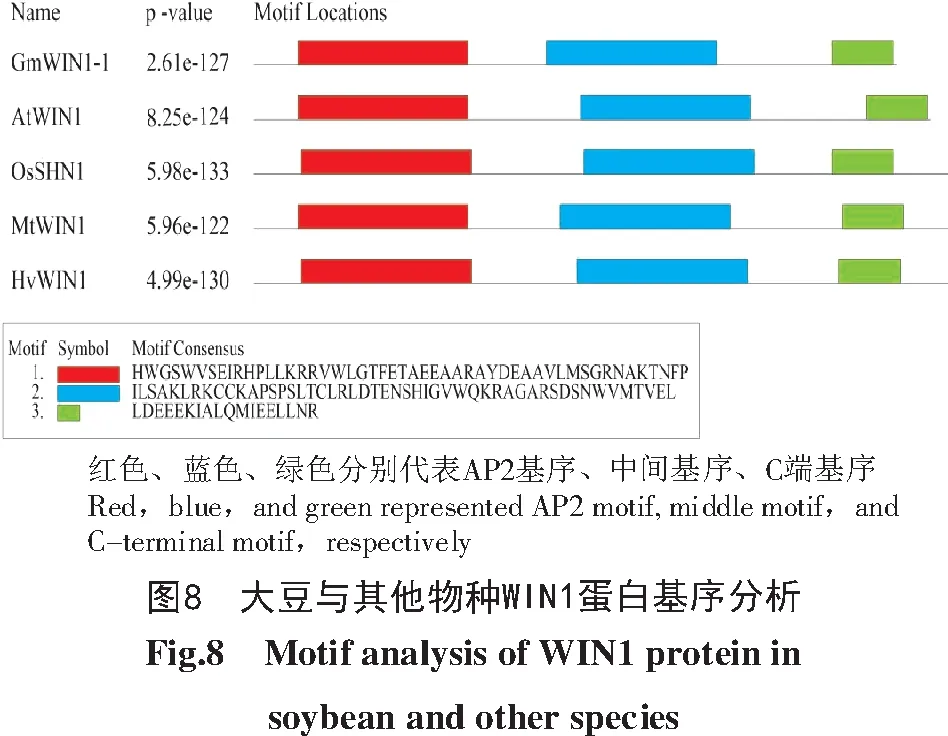
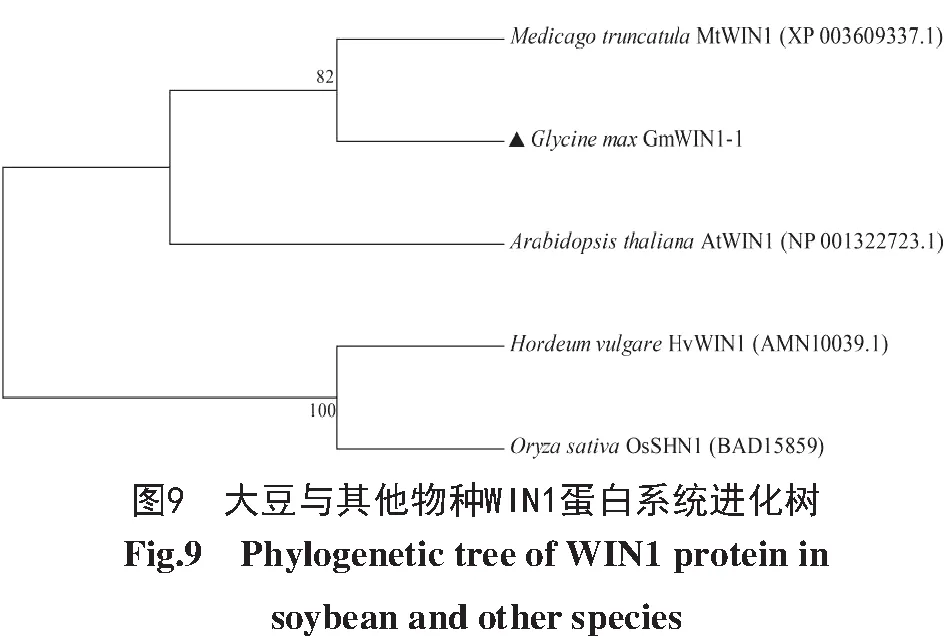
通过DNAMAN软件对GmWIN1-1、AtWIN 1、OsSHN1、MtWIN1、HvWIN1蛋白进行氨基酸序列比对,结果如图7所示,GmWIN1-1与其他物种WIN 1蛋白序列长度为189~213个氨基酸,GmWIN1-1与AtWIN1的相似度最高(63.32%)。基序分析结果如图8所示,在N端有一段AP2保守基序(AP2 Domain),此外,还发现中间基序(Middle motif,mm)和C端基序(C-terminus motif,cm)。
通过MEGA 7.0软件对GmWIN1-1和其他植物WIN 1蛋白进行多序列系统进化分析,结果如图9所示,HvWIN1与OsSHN1具有较高的亲缘关系,其次是GmWIN1-1与MtWIN1具有较高的亲缘关系,这些成对的蛋白可能具有共同的祖先和相似的生物学功能。
2.5 大豆GmWIN1-1启动子顺式元件分析
通过在线软件PlantCARE预测GmWIN1-1起始密码子前2 000 bp序列的顺式作用元件,结果如表4所示,GmWIN 1-1启动子中含有4个脱落酸元件、6个厌氧诱导元件、2个干旱响应元件、4个光反应元件、1个赤霉素反应元件、1个myb结合位点,推测GmWIN1-1可能受干旱胁迫的调控。
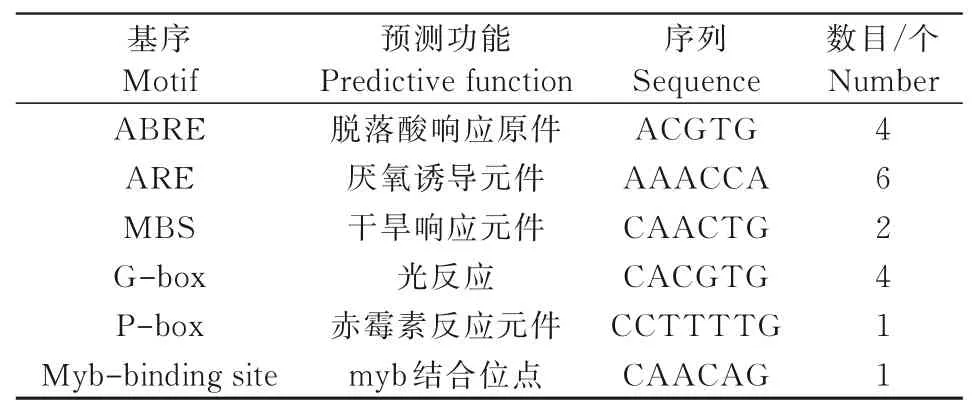
表4 GmWIN1-1启动子核心元件预测Tab.4 Prediction of GmWIN1-1 promoter core elements
2.6 大豆Gm WIN1-1在不同组织中的表达模式分析
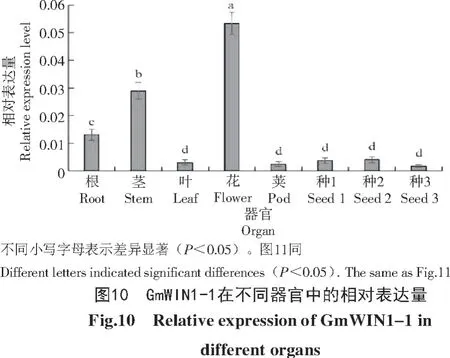
选取大豆不同器官和不同时期的种子为试验材料,检测转录因子GmWIN 1-1的表达谱。qRTPCR结果如图10所示,GmWIN1-1表达量最高的器官是花,分别是茎和根中表达量的1.7倍和5倍,而在其他组织中的表达量极低。
2.7 干旱胁迫下大豆幼苗表型和GmWIN1-1表达模式分析
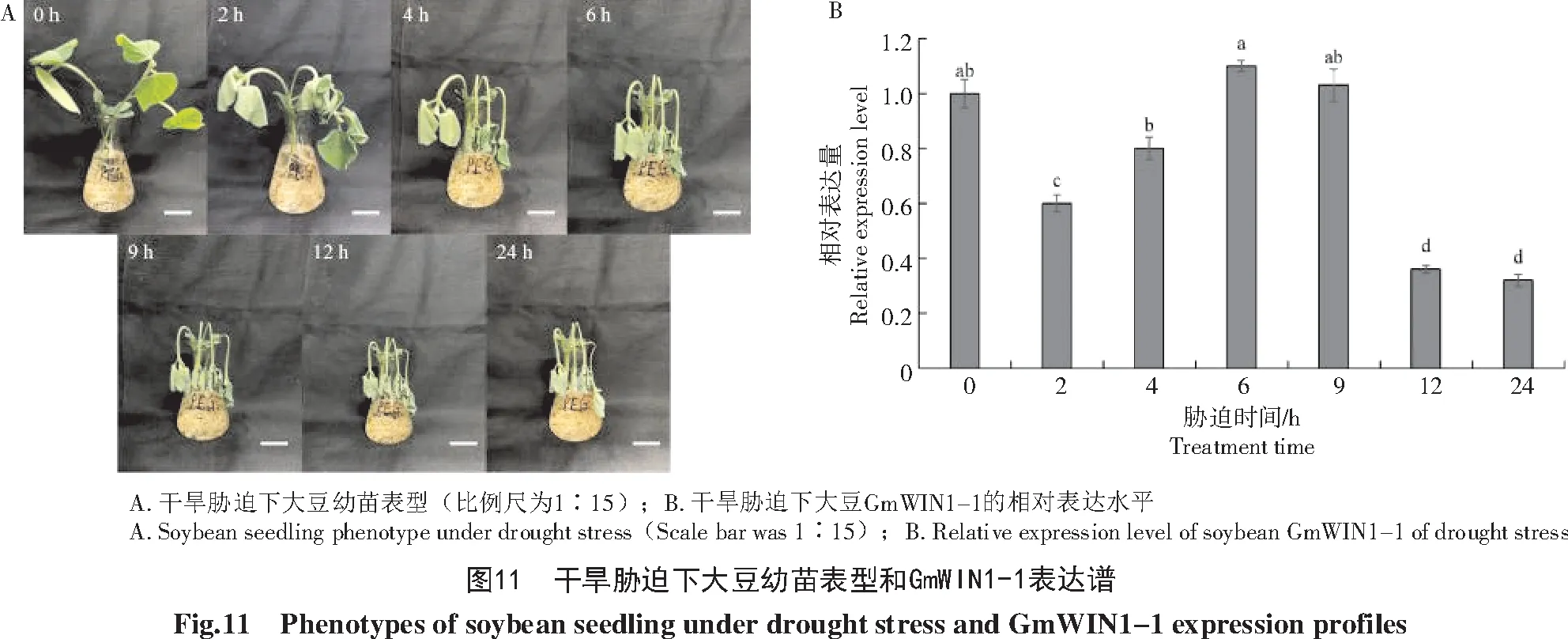
根据启动子核心作用元件预测,推测GmWIN1-1可能受干旱胁迫诱导。由图11-A可知,干旱胁迫处理导致大豆幼苗发生严重萎蔫。qRT-PCR检测结果表明(图11-B),与未处理对照株相比,GmWIN1-1的表达量有明显的变化,表现为小幅度先下降再上升又下降的趋势,在6 h达到最高值。这些结果显示,GmWIN1-1可能参与大豆幼苗干旱胁迫应答。
3 结论与讨论
分析大豆脂质合成、代谢和逆境调控机制将为提高大豆产量提供新的理论依据。鉴于油脂生物合成、代谢和逆境调控网络的复杂性质,已有研究发现,WRI1、WRKY和MYB等转录因子通过同时调节众多基因发挥重要作用[20-22]。本试验所研究的转录因子WIN1是蜡生物合成过程中的关键调节因子,近年来研究发现,该转录因子与甘蓝型油菜中的油积累和盐胁迫有关,但在大豆脂质积累和非生物胁迫响应中的作用尚不明确。
本研究通过Blast比对,获得转录因子GmWIN 1-1,由189个氨基酸构成,是一个单体蛋白。蛋白高级结构分析发现,GmWIN1-1蛋白的二级结构中无规则卷曲所占比例最多,推测其可能连接其他二级结构元件;蛋白的三级结构与模板蛋白5wx9.1相似性为45%;多序列比对发现,大豆GmWIN 1-1与其他物种WIN1不仅在N端具有1个AP2功能结构域,还分别具有1个中间基序和C端基序;系统发育树分析发现,GmWIN1-1与MtWIN 1的亲缘关系较近,可能是由于它们属于同一亚科(蝶形花亚科)。通过以上生物信息学分析,推测大豆GmWIN 1-1蛋白应具有与其他物种一样的WIN1活性。
本研究发现,GmWIN 1-1在花中的表达量最高。类似地,在许多高等植物的花蕾中也检测到WIN1具有高表达。已发现TAG占花粉质量的30%~40%,因此,推测TAG参与的有性生殖可能与WIN1有关,但是WIN1转录因子在花粉中的具体作用尚不清楚,仍需进一步试验研究[23-24]。在本研究中发现,GmWIN1-1参与大豆幼苗的干旱胁迫响应。此前,已有研究发现,BnWIN1过表达增加了油菜种子的油含量,同时转基因植物的盐胁迫耐受性增强[13]。尽管AtWIN1过表达导致了拟南芥的生长迟缓和种子油变化,但它导致蜡质生物合成和耐旱性增强[15],显然,不同植物物种在各种生物过程中的功能存在差异。基因对非生物胁迫的响应可能是由启动子本身引起,也可能与启动子相互作用的转录因子有关[25-26]。已有研究表明,在拟南芥中MYB106调控WIN1基因表达,转录因子MYB家族主要参与植物逆境胁迫,这也可能是GmWIN1-1响应干旱胁迫的原因之一[22]。在大豆中转录因子MYB是否调控基因GmWIN 1-1有待进一步的试验验证。
本研究鉴定获得1个大豆GmWIN1-1转录因子,通过生物信息学预测了GmWIN1-1蛋白理化性质及功能。GmWIN1-1在花中表达最高,其基因启动子含有多个逆境响应顺式元件。GmWIN1-1显著响应干旱胁迫,可能介导大豆幼苗胁迫应答调控。

