烟草C4H2基因的克隆与表达特性分析
刘晨,王祯,朱先约,王文婷,黄申,翟玉俊
1.甘肃烟草工业有限责任公司 技术研发中心,甘肃 兰州 730050;2.郑州轻工业大学 食品与生物工程学院,河南 郑州 450001
0 引言
烤烟致香前体物质种类繁多,多酚类化合物尤为重要,在一定程度上决定着烤烟的香气风格[1];同时,在烟叶生长、醇化和吸食燃烧过程中,其黄酮类化合物芸香苷的含量同样会直接影响烤烟的香气质量[2]。有研究表明,黄酮类化合物是影响烟草内在品质最为关键的因素之一,其含量大小对植株生长发育过程中所参与的防御、抗逆机制起到至关重要的作用[3-5]。
肉桂酸-4-羟化酶(cinnamate-4-hydroxylase,C4H)是多酚类化合物苯丙烷代谢途径中的关键酶,其作用是将苯丙氨酸催化为香豆酸,香豆酸再经过4-香豆酸辅酶A连接酶(4-coumaroyl CoA Ligase,4CL)处理,进一步生成香豆酰辅酶A。研究表明,植物中黄酮类化合物、木质素、芳香族类化合物合成等多条代谢途径会随着C4H蛋白质活性和转录丰度的变化而发生变化[6]。大豆中C4H 蛋白的减少会直接导致苯丙烷类物质含量明显降低,木质化进程受阻,严重干扰植物正常的生长发育[7]。因此,C4H蛋白在植物细胞中的含量变化会对植株生长发育过程中木质素和黄酮类物质合成的多条代谢支路产生直接影响[8]。
目前,C4H 蛋白家族成员中的C4H2基因已在拟南芥、大豆、桂花等多种植物中进行了克隆研究[9-12]。于利等[13]利用同源克隆技术成功从烟草中克隆出C4H基因家族,比较了C4H1与C4H2在HD和K326两个烟草品种各组织器官及不同生育期中部叶中的表达差异性。但关于C4H2基因在烟草中的遗传组成、表达特性和作用方式等更为细致、完整的研究尚未见报道,其基因表达量与烟草中黄酮含量的相关性也有待研究。
鉴于此,本文拟通过对烟草C4H2基因进行克隆、序列分析,进行原核表达载体构建、纯化,实现其体外融合表达并进行表达检测,以探究在激素诱导调控下不同组织NtC4H2(烟草C4H2)基因的表达水平与总黄酮含量变化趋势的相关性,为该基因在烟草黄酮类化合物生物合成中的调控提供理论基础。
1 材料与方法
1.1 材料和仪器
中烟202及其无菌幼苗,来自甘肃烟草工业有限责任公司分子生物学实验室。
主要仪器:QIAcube核酸提取仪、QIAxceL Advanced全自动电泳分析仪,德国Qiagen公司产;Qubit荧光定量仪,美国 Thermo Fisher Scientific 公司产;LightCycler 96荧光定量PCR仪,美国 Roche公司产;水平电泳仪、Geldoc EZ凝胶成像系统,美国BIO-RAD公司产;PCR仪、离心机、德国Eppendorf公司产;MiniSeq高通量测序平台,美国Illumina公司产;HD3100超声波细胞破碎仪,德国 WIGGENS公司产;Cary60紫外分光光度计,美国 Agilent公司产。
主要试剂:RNeasy Plant Mini Kit,德国Qiagen公司产;1st Stand cDNA Synthesis Kit、Ex Taq Hot Start Version、PCR Mix,日本TaKaRa公司产;Mini Seq High Output Library Prep Kit,美国Illumina公司产;EDTA,中国医药集团有限公司产;胰蛋白胨、酵母抽提物,英国Oxoid公司产;IPTG,生工生物工程(上海)股份有限公司产。
1.2 实验方法
1.2.1 总RNA的提取与cDNA合成总 RNA 的提取。称取0.2 g中烟202无菌幼苗叶片组织,加无菌水清洗;液氮研磨;加入1 mL TRizol,混匀转移至1.5 mL EP管中;加200 μL 氯仿,混匀,12 000 r/min离心15 min;移取上清,加600 μL 异丙醇,充分混匀,于-20 ℃静置45 min后,12 000r/min离心15 min;弃上清,加1 mL RNA专用体积分数为75%的预冷乙醇,混匀,12 000 r/min离心10 min;室温下静置10~15 min,使RNA 适度干燥;用不含RNase的去离子水溶解,取2 μL 测定浓度。
cDNA合成。合成反应体系:5×gDNA Eraser Buffer 2 μL,gDNA Eraser 1 μL,RNA 0.5 μg,Nuclease-free water补足10 μL;反应参数为42 ℃、2 min。逆转录体系:去基因组反应液10 μL,5×primer Script Buffer 4 μL,RT Enzyme Mix1 1 μL,RT primer 1 μL,Nuclease-free water补足20 μL;反应参数为37 ℃、60 min,85 ℃、5 s。以得到的cDNA为模板,进行后续PCR扩增。
1.2.2 烟草C4H2-CDS区的克隆根据NCBI马铃薯C4H2基因序列(ABC69 046.1)筛选出CDS区序列,使用DNAStar软件设计特异性引物,引物序列如表1所示。

表1 引物序列Table 1 Sequences of primers used in the NtC4H2 cloning
PCR扩增体系:cDNA模板 5 μL,Primer Mix 2 μL,LA TAQ PCR Mix 10 μL,Nuclease-free water 3 μL,补充dd H2O至30 μL。PCR扩增程序:95 ℃、3 min;95 ℃、30 s,55 ℃、40 s,72 ℃、60 s,40 cycle;72 ℃、10 min;4 ℃保存。将上述目标CDS扩增产物电泳割胶回收后进行TA克隆,与大肠杆菌Top10连接、转化、筛选阳性克隆。使用MiniSeq High Output Library Prep Kit 试剂盒,在IlluminaMiniSeq 高通量测序平台上进行测序。
1.2.3 生物信息学分析利用DNAMAN 7分析预测NtC4H2基因编码的蛋白并进行同源序列比对;ProtParam和ProtScaLe用于氨基酸理化性质和蛋白质亲/疏水性分析;SignalP用于分析蛋白是否含有信号肽;TMHMMserver2.0进行跨膜结构域的分析和预测;PredictProtein和CD search对蛋白质的保守域和功能位点进行分析;SOPMA和SWISS-MODEL分别用于蛋白质二级和三级结构的分析、预测。
1.2.4NtC4H2基因原核表达载体的构建根据NtC4H2基因的测序结果和生物信息学分析结果,将鉴定为阳性克隆的菌落进行T-C4H2-CDS质粒抽提,并与pET22b质粒分别进行双酶切。酶切体系为:质粒1 μg;10×H 3 μL;XhoⅠ1 μL;EcoRⅠ1 μL;dd H2O补齐至30 μL。分别把双酶切后的载体pET22b和C4H2-CDS片段割胶回收,用T4 DNA Ligase将双酶切后的载体片段和目的基因片段于16 ℃连接2 h,将连接的产物进行大肠杆菌感受态细胞转化后,均匀涂布在LB平板 (含50 μg/mL氨苄青霉素,下同)上,37 ℃倒置培养12 h,挑单克隆摇菌提取质粒,用EcoRⅠ和XhoⅠ对得到的pET22b-C4H2-CDS质粒进行双酶切鉴定,通过酶切鉴定出正确的克隆并进行测序。
1.2.5 重组质粒在大肠杆菌中的诱导表达及纯化挑取3个含pET22b-C4H2-CDS质粒的BL21(DE3)菌体单斑至2 mL LB中37 ℃过夜培养。培养后将菌液与水按1∶50的体积比稀释后,取0.1 mL稀释菌液加入到含5 mL LB培养基的50 mL三角瓶中,37 ℃振荡培养至OD600为0.6 ~ 0.8。然后加入1 mM/L的IPTG诱导剂30 ℃过夜培养。诱导后,取菌液1 mL,12 000 r/min离心30 s,收获沉淀,用5×蛋白Loading buffer重悬,混匀,100 ℃水浴10 min,然后进行聚丙烯凝胶电泳分析。适度扩大培养体积,使用超声裂解菌体,裂解后离心、取沉淀,溶于含有8 mol/L 尿素的结合缓冲液中,采用Ni-Agarose His标签蛋白纯化试剂盒纯化重组蛋白。
1.2.6NtC4H2基因的表达特性及酶活性测定
RT-PCR按SYBR Premix Ex Taq试剂盒的操作说明进行。以26 s作为内参。反应体系:SYBR Green Mix 10 μL,Nuclease-free water 3 μL,Primer Mix 2 μL,cDNA 5 μL,终体积20 μL。反应程序:95 ℃、3 min;95 ℃、30 s,60 ℃、30 s,72 ℃、30 s,40 cycle。每份样品设6次重复,采用比较CT值的2-ΔΔCT方法分析基因的表达量[14]。肉桂酸-4-羟化酶活性测定参照文献[15]进行,测定波长为340 nm,OD值每1 h变化0.01为一个酶活性单位/U。
1.2.7NtC4H2基因的诱导表达分析及黄酮类物质的测定采用RT-PCR分析经茉莉酸甲酯(MEJA)分别处理0 h、4 h、12 h、24 h、48 h、72 h的上部叶NtC4H2基因表达量,每份样品设6次重复。采用紫外分光光度法测定MEJA诱导后的各上部叶片总黄酮含量,以芦丁为标准品绘制标准曲线并计算回归方程,重复3次,实验数据用Origin 9.0进行单因素方差分析[16-17]。
2 结果与讨论
2.1 NtC4H2基因的克隆及测序结果分析
NtC4H2基因的PCR扩增结果如图1所示,其中,M为DNA Marker,1、2为NtC4H2基因扩增结果。由图1可知,NtC4H2基因序列长度为1500 bp左右,对割胶回收后的基因片段进行测序,得到序列长度为1521 bp,NtC4H2基因序列全长如图2所示。将得到的基因序列与Gene Bank中已登录的普通烟草(Nicotianatabacum/common tobacco)C4H2基因序列(DQ350353.1)进行比对,显示相似度达94.67%。因此可以确定得到的基因序列为C4H2基因序列。

图1 NtC4H2基因的PCR扩增结果Fig.1 PCR amplification of NtC4H2 gene

图2 NtC4H2基因序列全长Fig.2 Full length of NtC4H2 gene sequence
2.2 NtC4H2蛋白的生物信息学结果分析
烟草NtC4H2蛋白与其他植物C4H蛋白的多序列比对结果如图3所示,其中,红框为P450保守序列区域,下划线为特征性底物结合位点。由图3可知,NtC4H2蛋白与美花烟草(Nictianasylvestris)C4H蛋白(XP-009766429.1)、普通烟草C4H2蛋白、矮牵牛(Petuniaxhybrida)PhC4H2蛋白(F1B283.1)相似性最高,达98%;与番茄(Solanumpennellii)C4H蛋白(XP_015078931.1)、龙葵(Solanumnigrum)C4H蛋白(QIC52990.1)、马铃薯(Solanumtuberosum)C4H蛋白(ABC69046.1)等相似度达85%以上。烟草NtC4H2蛋白的系统发育分析结果如图4所示。由图4可知,美花烟草、普通烟草、矮牵牛、番茄、龙葵、马铃薯、枸杞(Lyciumchinense)、辣椒(Capsicumannuum)、大花牵牛(Ipomoeanil)的C4H蛋白与烟草NtC4H2蛋白均处于同一进化支,表明其亲缘关系较近。烟草NtC4H2蛋白二级结构的分析与预测结果如图5所示。由图5可知,NtC4H2蛋白符合细胞色素P450结构域特征,具有P450保守序列,是细胞色素P450超家族成员;NtC4H2蛋白序列中共有20个功能位点,酰胺化位点1处、酰基化位点6处,糖基化、蛋白激酶C磷酸化、酪蛋白激酶II磷酸化位点分别为2处、7处、4处;有5个特征性底物结合位点(substrate recognition sites)SRS1、SRS2、SRS4、SRS5和SRS6,其中序列241和277处不含二硫键[18]。

图3 烟草NtC4H2蛋白与其他植物C4H蛋白的多序列比对结果Fig.3 Multiple comparison of amino acid sequence between NtC4H2 protein in tobacco and C4H protein in other plant species
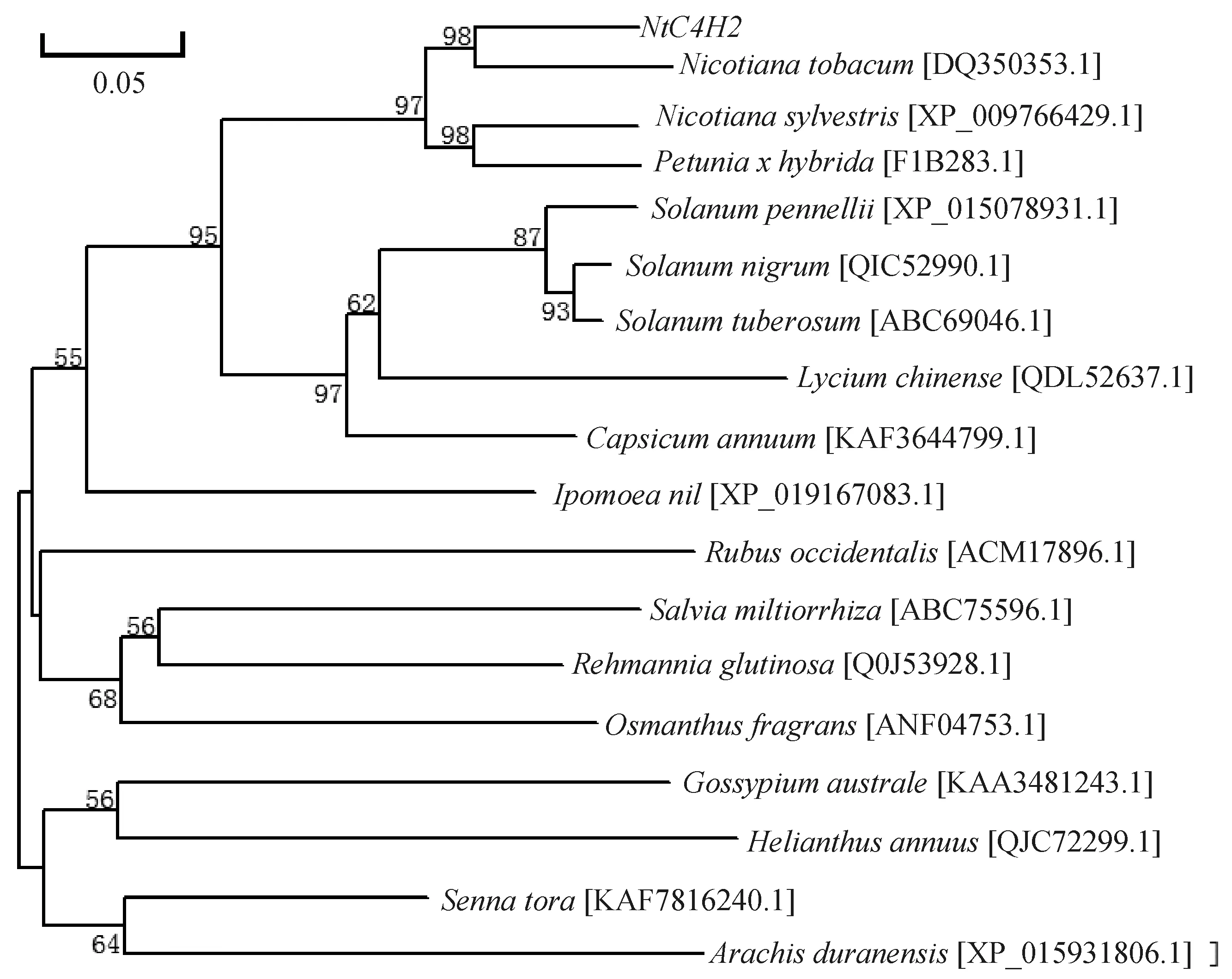
图4 烟草NtC4H2蛋白的系统发育分析结果Fig.4 Phylogenetic tree of NtC4H2 protein in tobacco
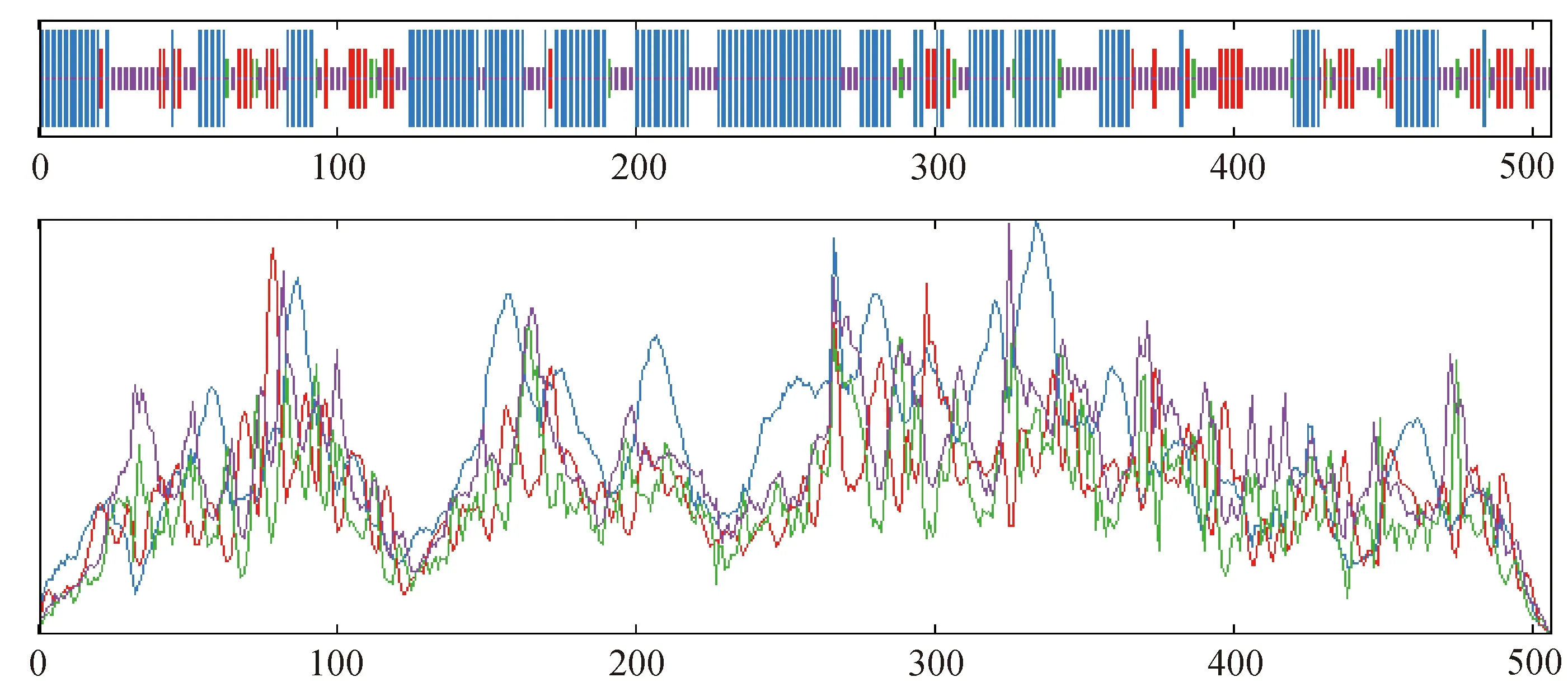
图5 烟草NtC4H2蛋白二级结构的分析与预测结果Fig.5 Analysis and prediction of secondary structure of NtC4H2 protein
预测显示其分子式为C2660H4204N722O727S16,相对分子质量和理论pI等电点值分别为58.44 kD和9.26,总原子数8329个,由506个氨基酸编码其蛋白质,带正、负电荷的氨基酸残基(Arg+Lys)、(Asp+Glu)分别为72个和62个,其中亮氨酸(Leu)含量最高,达11.1%;其次是缬氨酸(Val)和谷氨酸(Glu)均为7.7%;半胱氨酸(Cys)含量达到最低,仅为0.4%,这种氨基酸比例可能与NtC4H2蛋白的功能结构和酶学特性有关。分析表明这种蛋白不稳定,系数为46.21,其半衰期30 h、脂肪系数为96.66。对其亲/疏水性的分析表明NtC4H2蛋白为亲水蛋白,总平均吸水性为-0.264。
信号肽预测显示NtC4H2蛋白有信号肽的概率是0.048 9,表明该蛋白质C、Y、S的值均低于0.2,说明其不含信号肽。该蛋白在N末端第5位到第24位氨基酸区域组成了1个跨膜区,且在膜外,跨膜区域占比3.95%。蛋白质二级结构预测、分析结果显示:烟草NtC4H2蛋白中参与α螺旋的氨基酸(蓝色)、延伸链(红色)、β转角的氨基酸(绿色)和无规则卷曲的氨基酸(黄色)分别有240个、74个、26个、166个,它们的占比分别达47.43%、14.62%、5.14%和32.81%。
烟草NtC4H2蛋白质三级结构预测以数据库中高粱(Sorghumbicolor)C4H2蛋白结构为模板,结果如图6所示。由图6可知,预测空间结构一致性达75.5%,共涵盖了32~503个氨基酸,相似度为0.54,覆盖度为0.98,三级结构总体评价0.86,Qmean为-1.99。根据预测结果显示,烟草NtC4H2蛋白质三级空间结构的氨基酸数目与和生物学功能与二级结构相一致,可能以单体的形式在植株中发挥作用。
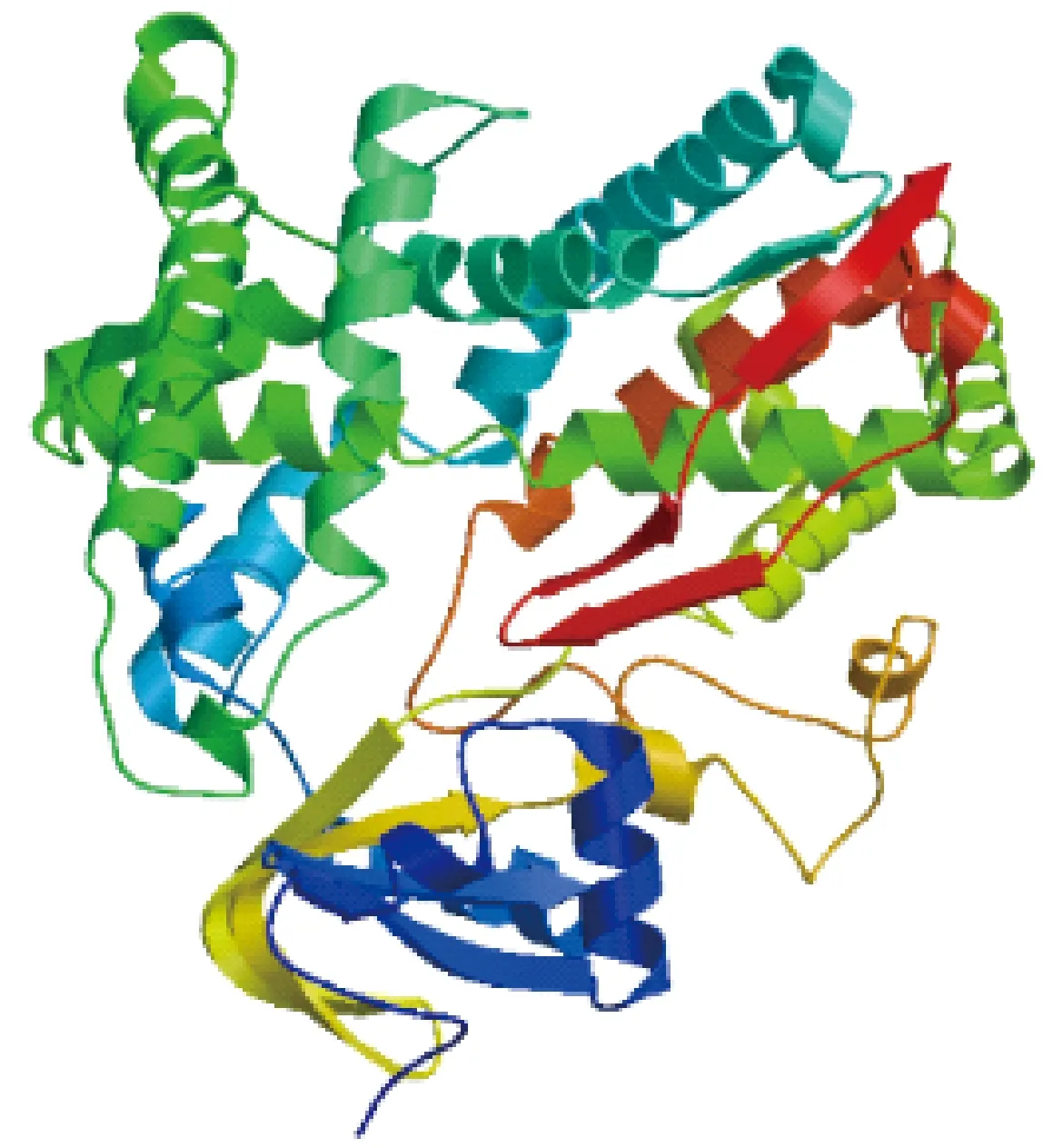
图6 烟草NtC4H2蛋白三级结构预测结果Fig.6 Prediction of tertiary structure of NtC4H2 protein
2.3 烟草NtC4H2原核表达载体的构建结果分析
烟草NtC4H2原核表达载体双酶切鉴定结果如图7所示,其中,M为DNA Marker,1为双酶切鉴定结果。由图7可知,载体条带和目的基因条带大小分别约为5000 bp和1500 bp。将双酶切鉴定正确的单克隆进行测序,结果显示重组质粒pET-22b-C4H2-CDS中NtC4H2基因的序列与目的基因中的CDS区序列一致,并且未出现碱基突变、插入缺失等情况,表明原核表达载体pET-22b-C4H2-CDS构建成功。
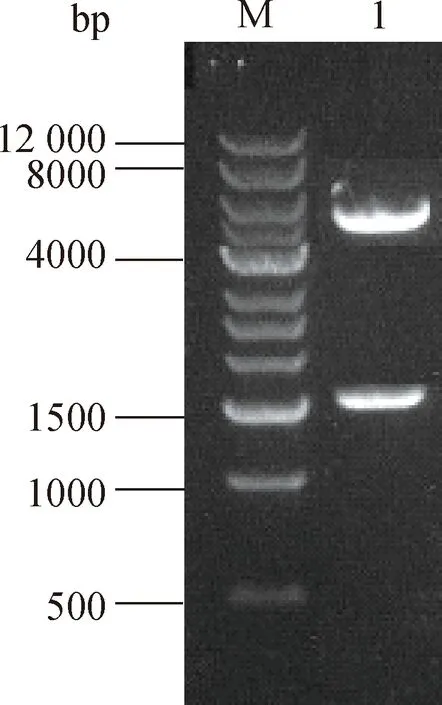
图7 烟草NtC4H2原核表达载体双酶切鉴定结果Fig.7 Identification of tobacco expression vector pET-22b-C4H2-CDS with double digestion
2.4 烟草NtC4H2重组蛋白的原核表达与纯化结果分析
诱导前后大肠杆菌总蛋白 SDS-PAGE分析结果如图8所示,其中,M为Protein marker;1、3、5为诱导前;2、4、6为诱导后;箭头表示NtC4H2重组蛋白。由图8可知,经IPTG诱导后在约70 kD处出现较明显的目的蛋白条带。NtC4H2蛋白在进行原核表达时,其蛋白N-末端会与pET-22b载体的标签序列(His-Tag)进行一定的融合,其分子质量大小约为75 kD,这与试验结果保持一致。含pET-22b空载体的菌株经过IPTG诱导后,未在70 kD处出现条带。
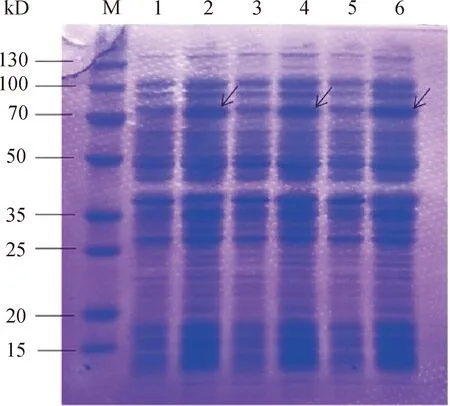
图8 诱导前后大肠杆菌总蛋白SDS-PAGE分析结果Fig.8 SDS-PAGE analysis of recombinant NtC4H2 protein
重组蛋白纯化分析结果如图9所示,其中,M为Protein marker;1为纯化前;2为纯化后;箭头表示NtC4H2重组蛋白。由图9可知,NtC4H2蛋白在大肠杆菌BL21菌株中表达,并获得纯化NtC4H2重组蛋白。重组蛋白NtC4H2主要以不溶性包涵体形式存在,这可能是由于原核表达中目的蛋白经常发生错误的折叠,聚集发展为包涵体所导致;大肠杆菌在进行表达时没有NADPH-细胞色素P450还原酶来催化C4H2蛋白,这也会造成CYP450蛋白失活后以包涵体的形式存在。试验中通过重组蛋白上的表达序列标签,利用Ni柱即可纯化回收目的蛋白,靶蛋白通常占细胞总蛋白的50%以上。虽然有一定比例的蛋白以可溶的形式存在,但多达95%(甚至可以更多)的蛋白则在包涵体中。包涵体的形成是靶蛋白高表达的标志,通常可以免于蛋白酶的水解破坏作用。
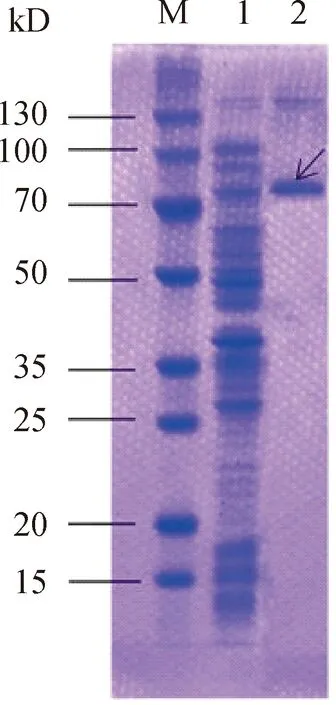
图9 重组蛋白纯化分析结果Fig.9 SDS-PAGE analysis of the purified recombinant protein
2.5 烟草NtC4H2基因的表达特征及酶活性测定结果分析
烟草NtC4H2基因在不同组织中的表达分析及酶活变化如图10所示。由图10a)可知,NtC4H2基因在各个组织中的表达丰度存在较大差异,在烟草幼苗上部叶中相对表达量最大,为28.7;下部叶表达量最小,为20.7;相对表达量由少至多依次为下部叶<茎<中部叶<根<上部叶。由图10b)可知,酶活性变化趋势与NtC4H2基因在不同组织中的表达水平一致。
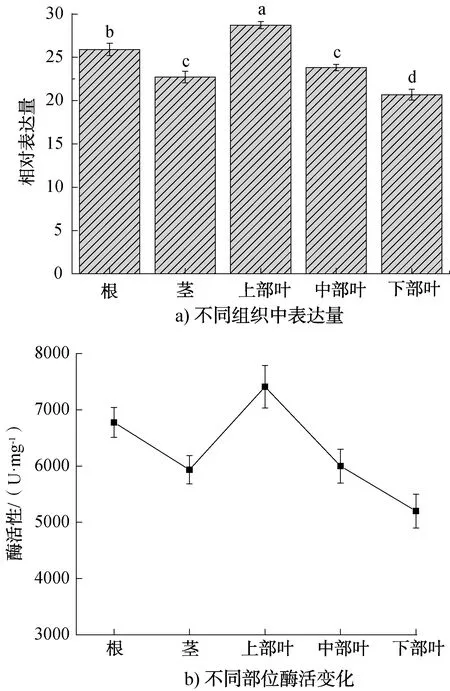
图10 烟草NtC4H2基因在不同组织中的表达分析及酶活变化Fig.10 Expression analysis of NtC4H2 gene in different tissues and enzyme activity
于利等[13]对HD、K326 两个烟草品种不同部位的组织表达特性对比后发现,C4H2基因在HD根部的表达水平最高,下部叶表达水平最低,整体表达情况为为下部叶<上部叶<中部叶<根,而K326则表现为中部叶<下部叶<根<上部叶。这些结论与本研究结果对比显示,中烟202中NtC4H2基因的表达模式、表达量与HD、K326均存在一定差异。这种差异的产生一方面可能是植株品种间的差异造成的,另一方面则与试验植株所处不同生命阶段对其木质化进程相关。木质素是植物细胞壁的组成成分之一,植物木质化进程是指木质素在植物细胞壁中大量沉淀、积累。有研究表明C4H蛋白会与其他酶形成多酶复合体的构造,这种构造有助于控制木质素的生成[19-20]。当植株随着自身生长发育对于木质素的需求量逐渐增加时,其基因表达量也会发生变化。本试验烟草植株处于生命活动初期,是植株快速生长的阶段。试验结果显示上部叶中NtC4H2基因含量高于中部和下部,这可能由于幼苗期植株在顶端优势的作用下经过分生组织不断的细胞分裂、分化、伸长,顶部细胞壁加厚,合成大量木质素,导致植株快速生长、加粗。这一系列组织变化过程同时伴随烟草下部叶中细胞增殖和伸长停止,大量细胞壁会同时出现沉积现象,从而使处于下部叶中的细胞木质化能力减弱[21-23]。这些研究与本试验结果一致,即下部叶中NtC4H2基因表达量可能低于上部、中部叶。与此同时,有研究[24]表明,大蒜幼苗中C4H的转录在根中最高,在茎中却很低。推测可能是由于大蒜中苯丙烷类物质在根中进行了大量合成、积累后转运到茎中。这也与本试验中NtC4H2基因定量检测结果一致,即根中的表达量相对高于茎中。
2.6 MEJA诱导表达及黄酮类物质的测定结果分析
上部叶中NtC4H2基因在茉莉酸甲酯激素处理下的表达分析结果如图11所示。由图11可知,经过MEJA诱导后,在不同采样时间内NtC4H2基因表达量均有明显波动。在前48 h的采样时间内,除4 h表达量略有下降外,之后的3个采样时间点表达量均呈现缓慢升高趋势。24 h表达量为0 h表达量的1.36倍,在48 h时NtC4H2基因的表达量达到最大值,是0 h表达量的1.58倍。72 h后NtC4H2的表达量又呈现出回落趋势。
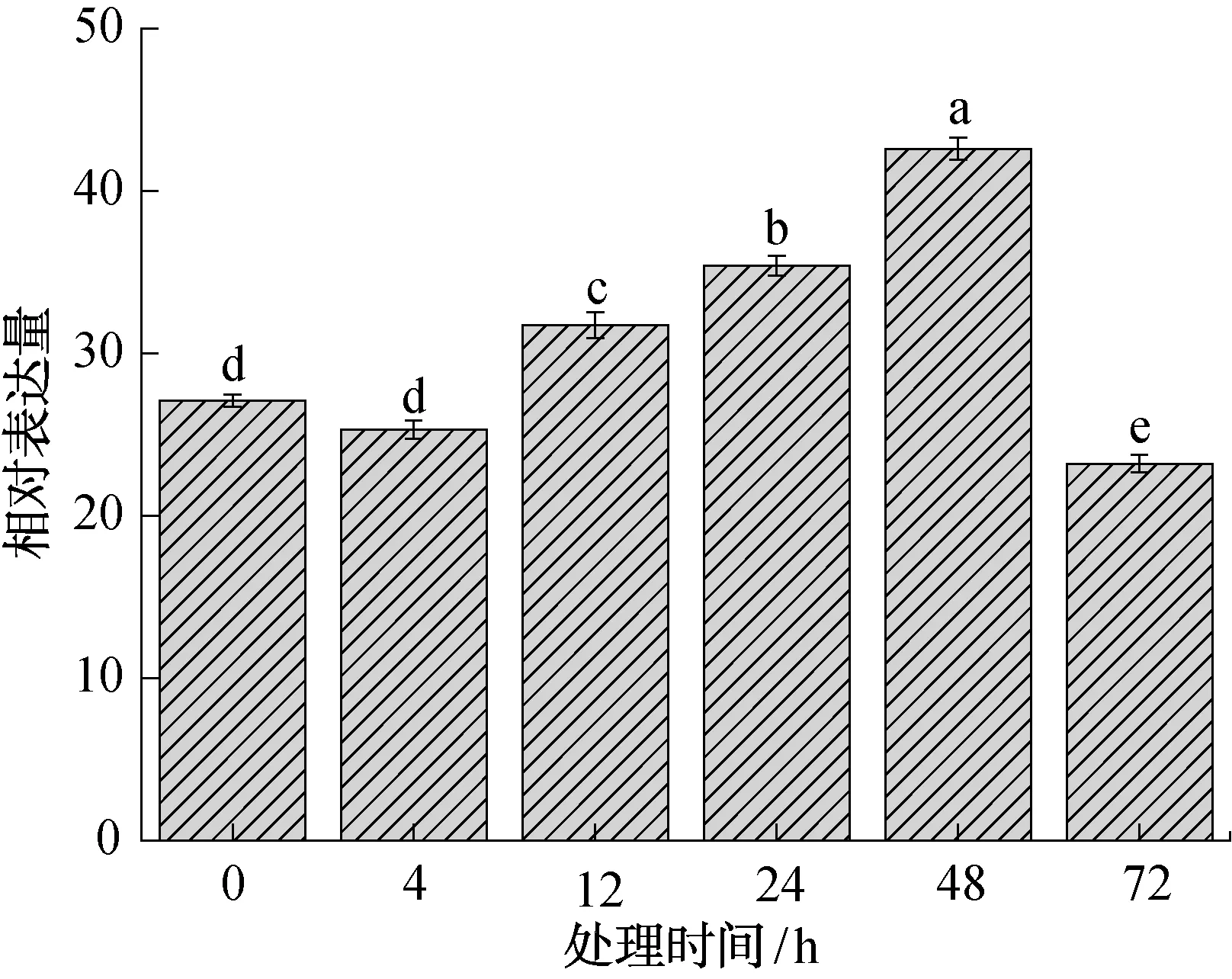
图11 上部叶中NtC4H2基因在茉莉酸甲酯激素处理下的表达分析结果Fig.11 Expression analysis of NtC4H2 gene in upper leaves treated with MEJA
芦丁标准曲线及不同时间茉莉酸甲酯处理上部叶中黄酮含量分析结果如图12所示。由图12可知,经MEJA诱导后NtC4H2的表达模式可能与叶中黄酮的积累有关,对照组在6个采样时间点中黄酮含量没有明显变化,而MEJA处理组在4 h时黄酮含量升高至9.34 mg/g DW,比0 h时升高了27.78%;在12 h时黄酮含量比4 h略有降低,为8.81 mg/g DW。在24 h时黄酮含量升高至9.96 mg/g DW;48 h时达到峰值,为13.19 mg/g DW,比对照组提高80.19%。当MEJA处理72 h后,黄酮含量开始下降,为6.47 mg/g DW,比对照组下降了11.49%。MEJA处理组黄酮含量总体变化趋势呈现先升高后下降的态势。
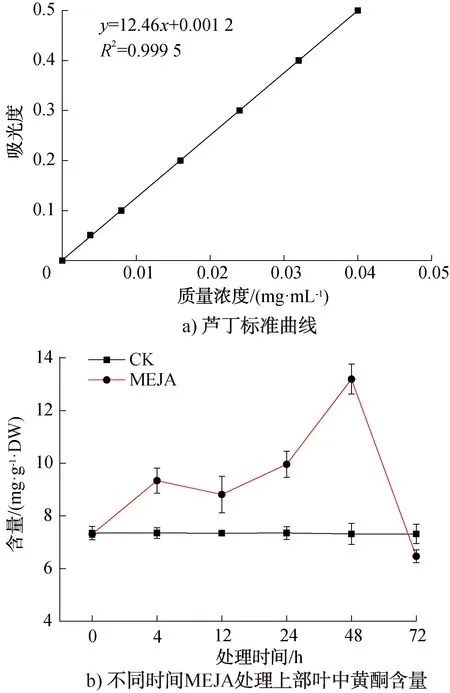
图12 芦丁标准曲线及不同时间茉莉酸甲酯处理上部叶中黄酮含量分析结果Fig.12 The standard curve of rutin and analysis of flavonoid content in upper leaves treated with MEJA at different time
MEJA是植物体内广泛存在的激素,其作为信号源参与到植物的各个抗逆过程。MEJA也会增加植物次生代谢产物的积累,它可以诱导合成三萜类化合物,同时提高黄酮类物质含量[25-27]。研究表明,短期胁迫有利于黄酮类化合物的合成和积累,有利于提高 PAL 和 C4H 等酶的活性[28]。M.H.Ibrahim等[29]研究发现,过高的施氮量会使C4H酶活性适度下调,使得一些黄酮类化合物的含量随之下降;黄利娜等[30]研究与其结果一致,即外源NO处理会抑制莲雾果实中C4H表达水平和木质素的积累。而王爱华等[31]研究表明,在烤烟的上部叶片中,施加适量的纯氮,在一定程度上可以使C4H 酶活性以及黄酮类化合物的含量有效增加。同时在转DfC4H基因香鳞毛蕨T1代植株中,黄酮类化合物合成途径的终产物花色素苷的含量明显高于野生型[32]。冯艺川等[33]研究膜荚黄芪AmC4H2基因时发现,在根、茎、叶中该基因的表达趋势与毛蕊异黄酮及其糖苷的含量基本一致,因此推测其参与了毛蕊异黄酮及其糖苷的生物合成。这些研究结果都与本试验结果一致。当烟草植株检测到外界MEJA激素信号时,由信号传导开启自身抗逆机制,体内次生代谢产物开始逐步积累以抵御和适应外界的不良环境。本研究通过检测经MEJA诱导不同时间后烟草上部叶中NtC4H2基因的表达量和黄酮含量,发现基因表达规律与黄酮含量变化趋势相同。验证了基因NtC4H2与烟草植株黄酮类物质的生物合成具有一定相关性。
3 结论
本文从烟草中克隆出长度为1521 bp(CDS)的NtC4H2基因,经分析显示共编码506个氨基酸,与美花烟草C4H蛋白、普通烟草C4H2蛋白和矮牵牛C4H2蛋白相似性最高达98%;与番茄、龙葵、马铃薯等植物C4H蛋白相似度达85%以上。NtC4H2蛋白是细胞色素P450 超家族成员,具有P450保守序列,有1个跨膜区,为不稳定亲水蛋白,二级结构主要由α螺旋、延伸链、β转角和无规则卷曲组成。通过构建pET-22b-C4H2-CDS表达载体,重组、纯化了NtC4H2蛋白,重组NtC4H2蛋白主要以不溶性包涵体的形式存在于表达细菌中。NtC4H2基因在烟草不同组织中进行表达,C4H2酶活性的大小与基因的表达水平一致,依次为下部叶<茎<中部叶<根<上部叶。不同组织表达量与诱导表达分析显示,经MEJA诱导后NtC4H2基因在烟草上部幼叶中的表达量呈先高升后降低的趋势,在48 h时表达量达到峰值且与叶中黄酮物质的积累呈正相关。

