大孔树脂纯化苜蓿总黄酮及纯化前后抗氧化能力比较
李 红, 李 波, 李晨阳, 杨 曌
(1.黑龙江省农业科学院畜牧兽医分院, 黑龙江 齐齐哈尔 161005; 2.齐齐哈尔大学生命科学与农林学院, 抗性基因工程与寒地生物多样性保护黑龙江省重点实验室, 黑龙江 齐齐哈尔 161006)

黄酮类化合物分离纯化的方法很多,其中大孔树脂是近十多年飞速发展的一类有机高分子聚合物吸附剂,能够吸附和分离大量有机物,具有污染低、稳定性高、选择性强、易操作等优点[7]。大孔树脂广泛应用于中草药活性成分的分离纯化研究方面,尤其在黄酮类成分中如香椿(Toonasinensis)黄酮类成分[8]、蒲公英(TaraxacummongolicumHand.-Mazz.)黄酮类化合物[9]和赶黄草(PenthorumchinensePursh)黄酮成分[10]等分离纯化的研究。关于紫花苜蓿黄酮类化合物的纯化、抗氧化活性已有相关研究[11-12],但对紫花苜蓿总黄酮的提取、纯化及其抗氧化活性[13]研究鲜见报道,对苜蓿总黄酮的纯化和纯化前后的抗氧化活性更是有待完善。
为了充分利用紫花苜蓿资源,本研究采用超声波辅助提取的方式提取了苜蓿总黄酮,大大缩短了苜蓿总黄酮的提取时间,通过确定的超声波辅助提取苜蓿总黄酮的最佳条件[14],并且利用大孔树脂对所获得的总黄酮进行了纯化,分析纯化前后的苜蓿总黄酮的抗氧化能力,为紫花苜蓿的综合利用提供了科学依据。
1 材料与方法
1.1 试验材料
取试验基地种植2年的‘龙牧801’紫花苜蓿,于7月份盛花期收割其地上部分茎叶,置于避光通风处自然阴干,筛去草棒、枯草等杂质,后用高速多功能粉碎机将干草粉碎成草粉,置于密封盒内避光保存备用。
1.2 苜蓿总黄酮粗提取物的制备
前期试验采用超声波辅助提取苜蓿总黄酮,得到最优条件为物料比1∶40(g·mL-1)、超声功率180 W、超声时间 40 min、乙醇体积分数 60%,提取液真空抽滤后用等体积石油醚多次萃取去除叶绿素等杂质,收集萃取后的滤液,用旋转蒸发仪进行减压蒸发,直至滤液无乙醇味。收集减压蒸发完毕后的滤液,用体积分数为 60% 的乙醇重新定容至 50 mL备用,所得液体即为超声波辅助提取法苜蓿总黄酮粗提液。
1.3 总黄酮含量测定与标准曲线的制作
1.3.1苜蓿总黄酮含量的测定 采用NaNO2-Al(NO3)3显色法[13]。移取 5.0 mL样品液于 25.0 mL具塞刻度试管,加 5 mL 60% 的乙醇和 5% 亚硝酸钠溶液 1.0 mL静置 6 min,再加入 10% 硝酸铝溶液 1.0 mL再静止 6 min,再向其中加入1 mol·L-1氢氧化钠溶液 10.0 mL静置 15 min,后用蒸馏水定容至25 mL,同时用 60% 乙醇作空白对照,于 510 nm测定吸光值。
1.3.2标准曲线的绘制 参考荆常亮[13]方法建立标准曲线方程。用体积分数 60% 乙醇溶液配制成 0.2 mg·mL-1芦丁标准品溶液,分别移取标准溶液(0.0,1.0,2.0,3.0,4.0,5.0 和 6.0 mL) 于10.0 mL具塞试管中,用蒸馏水定容至 5.0 mL。采用1.3.1方法测定吸光值,建立标准曲线方程y =13.893x-0.005 9(R2=0.997 3),式中x表示芦丁质量浓度,y表示吸光值,芦丁标准溶液在 0.00~0.48 mg·mL-1范围内线性关系良好。
1.4 大孔树脂预处理
参考许中畅等[15]方法。用 95%乙醇溶液震荡浸泡 24 h(摇床设置参数为25℃,120 r·min-1,使大孔树脂和乙醇充分接触并去除气泡),采用湿法装柱的方式将泡好的大孔树脂装入玻璃层析柱(Φ30 mm×300 mm)中,用 95% 乙醇淋洗树脂柱,直至流出液澄清透明无浑浊为止。然后分别用 4 BV的4%NaOH溶液碱洗(后用去离子水淋洗过柱,当流出液pH值≤9.0 时停止水洗)和 4% HCl溶液酸洗(后用去离子水淋洗过柱,当流出液pH值≥6.0 时停止水洗)淋洗大孔树脂,后用 95% 乙醇浸泡层析柱内树脂 2 h,相同的乙醇过柱清洗(碱液、酸液和乙醇总用量为3~4 BV,以1 BV·h-1流速),最后用去离子水洗至中性,在树脂床上层保留一定液面防止干柱,备用。
1.5 大孔树脂静态吸附与解吸附试验
1.5.1树脂的筛选 分别称取预处理好的树脂1.0 g,加入 0.1 mg·mL-1粗提液 50 mL,25℃,120 r·min-1下震荡吸附 24 h后过滤,测定滤液总黄酮质量浓度,即为吸附平衡液总黄酮质量浓度;收集上述饱和吸附的树脂,用蒸馏水冲洗树脂表面残留的总黄酮,置于100 mL三角瓶中加入50 mL体积分数 60% 乙醇,在 25℃,120 r·min-1下解吸附 24 h后过滤,测量滤液中总黄酮质量浓度。按公式计算吸附量、吸附率、解吸量和解吸率。
式中,Q1为吸附量(mg·g-1),E1为吸附率(%),Q2为解吸量(mg·g-1),E2为解吸率,C0为最初样液总黄酮浓度(mg·mL-1),Ce为吸附后平衡液总黄酮浓度(mg·mL-1),V0为待纯化母液体积(mL),Cd为解吸附洗脱液中总黄酮浓度(mg·mL-1),V2为解吸附洗脱液体积(mL),M为湿重树脂的质量(g)。
1.5.2静态吸附曲线测定 选择吸附和解吸附效果最好的大孔树脂,称取3.0 g置于100 mL三角瓶中,加入 0.1 mg·mL-1粗提液 50 mL,在25℃,120 r·min-1下振荡吸附3 h,每隔0.5 h吸取5 mL,测定总黄酮含量,计算并绘制静态吸附动力学曲线。
1.6 D101大孔树脂纯化苜蓿总黄酮上样条件的优化及验证试验
1.6.1吸附液pH值 称取5份2.0 g湿重大孔树脂置于锥形瓶中,分别加入浓度为0.1 mg·mL-1总黄酮20 mL,设置pH值为3.0,4.0,5.0,6.0和7.0,在25℃,120 r·min-1下震荡吸附12 h后测定总黄酮质量浓度,并计算吸附率。
1.6.2上样液质量浓度 将1.0 mg·mL-1总黄酮母液用蒸馏水配制成总黄酮质量浓度为0.2,0.4,0.6,0.8和1.0 mg·mL-1的上样液,根据最优pH参数调节上样液pH值,上样体积为2 BV,将上样液装入树脂柱中后以1 BV·h-1的流速进行吸附,收集流出液,根据上样液原始浓度和流出液浓度计算吸附率及解吸附率。
1.6.3上样液体积 将1.0 mg·mL-1总黄酮母液用蒸馏水配制成0.8 mg·mL-1,并调成最优pH值即为待上样液,以1 BV·h-1流速进行吸附,分别收集并测定吸附液体积达到1 BV,2 BV,3 BV和4 BV时总黄酮质量浓度,并计算吸附率。
1.6.4验证试验 根据上述试验选择最适宜苜蓿总黄酮的大孔树脂,并按照上述筛选的吸附液pH值、上样液质量浓度和上样液体积最适条件进行验证试验,重复 3次平均值,根据吸附流出液及洗脱液OD值计算吸附率及解吸率。洗脱液用旋转蒸发仪减压蒸发至膏状,置于坩埚中用电炉烤干至恒重,按公式计算大孔树脂吸附纯化后苜蓿总黄酮纯度。

式中,C为上样液中总黄酮浓度(mg·mL-1),V为上样液体积(mL),M1为烘干后干粉质量(mg)。
1.7 粗制和纯化的苜蓿总黄酮抗氧化活性测定
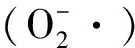
1.8 数据的处理与分析
试验数据用SPSS 19.0和Excel软件进行统计分析,采用单因素方差分(Anova)比较不同处理间的差异显著性,P<0.05时有统计学意义。
2 结果与分析
2.1 4种大孔树脂吸附及解吸附效果对比
大孔树脂的孔径和比表面积影响其对活性成分的“吸附-解吸”性能,二者呈负相关。4种大孔树脂对苜蓿总黄酮的吸附和解吸附效果见表1,在相同条件下,这4种大孔树脂对苜蓿总黄酮都有一定的“吸附-解吸”能力,其静态吸附率排序为AB-8>D101>HPD100>HPD600,D101和AB-8与HPD100,HDP600之间存在显著差异(P<0.05);其静态解吸率排序为D101>AB-8>HPD100>HPD600,D101,AB-8与HPD100和HDP600之间存在显著差异(P<0.05),这可能是因为AB-8和D101大孔树脂结构与理化性质决定的,利于苜蓿总黄酮的吸附和洗脱,综合考虑吸附率和解吸率,D101大孔树脂是纯化苜蓿总黄酮较为理想的树脂。
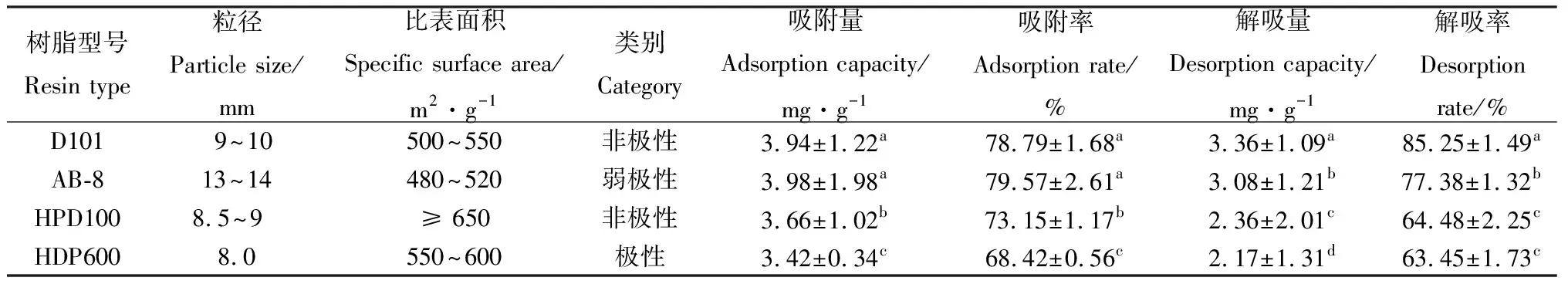
表1 4种大孔树脂吸附及解吸附效果对比Table 1 Comparison of adsorption and desorption effects of four macroporous resins
2.2 D101大孔树脂静态吸附曲线
D101大孔树脂对苜蓿总黄酮的静态吸附量和提取液总黄酮含量变化见图1。在吸附前2 h,苜蓿总黄酮的吸附量随着时间增加而上升,2 h后上升速率降低,吸附量趋于平缓,吸附2 h平均吸附量为0.72 mg·g-1,比第3小时降低0.03 mg·g-1,再增加吸附时间其吸附量变化不显著,说明D101大孔树脂对苜蓿总黄酮吸附性能较好,吸附2 h左右基本达到吸附饱和值。D101大孔树脂对苜蓿总黄酮的吸附为快速平衡型,初始总黄酮质量浓度为0.1 mg·mL-1,2 h后基本达到平衡,对苜蓿总黄酮具有良好的吸附动力学特性,该树脂对苜蓿总黄酮有良好的吸附特性,适于分离纯化苜蓿总黄酮。

图1 D101大孔树脂静态吸附曲线Fig.1 Static adsorption curve of D101 macroporous resin
2.3 动态试验条件的确定
2.3.1上样液pH值的确定 由图2A可知,D101大孔树脂对苜蓿总黄酮的吸附率随上样液pH值增加而减小,这是因为苜蓿总黄酮含有多羟基酚类而表现为弱酸性,当pH值为3.0时吸附率最高为69.63%,而碱性环境时俘获的质子会使总黄酮自由基上的氢解离为酸根离子,减弱与树脂的结合力,导致对总黄酮吸附率下降,在pH值为7.0时吸附率最低为32.30%,不同pH值的上样液对苜蓿总黄酮的吸附率产生显著差异(P< 0.05)。因此本试验中当pH值为3.0时D101大孔树脂对苜蓿总黄酮吸附效果最佳。
2.3.2上样液质量浓度的确定 由图2B可知,随着上样液质量浓度的增加,大孔树脂对苜蓿总黄酮的吸附率呈先升后降的趋势,在总黄酮质量浓度为0.8 mg·mL-1上柱时,吸附率最大为92.27%,超过此质量浓度后吸附效果下降,因为上样液质量浓度偏高,会发生提早泄漏现象,导致处理量下降;总黄酮质量浓度为0.2 mg·mL-1上柱时,吸附率最低,上样液质量浓度偏低,吸附不充分,降低了吸附率,上样液质量浓度为0.4和0.6 mg·mL-1与其它浓度间比较苜蓿总黄酮的吸附率差异显著(P<0.05)。
2.3.3上样液体积的确定 由图2C可知,在上样液体积为1 BV,2 BV,3 BV和4 BV时,随着上样液体积增加吸附率呈下降的变化趋势,当上样体积为2 BV时吸附率最大为93.62%,超过2 BV后吸附率剧烈下降,可能是上样体积在2~3 BV之间时发生了泄漏,影响吸附效果,当上样体积为2 BV时D101大孔树脂吸附效果比较好,上样液体积为1和2 BV时苜蓿总黄酮的吸附率显著高于上样体积为3和4 BV(P< 0.05)。

图2 上样液条件对苜蓿总黄酮吸附率的影响Fig.2 Effect of sample loading conditions on adsorption rate of total flavonoids from alfalfa
2.4 苜蓿总黄酮纯化工艺验证
以D101大孔树脂对苜蓿总黄酮进行纯化,在确定的上样液pH值为3,上样液质量浓度为0.8 mg·mL-1,上样体积为2 BV的纯化参数条件下,经过3次重复试验,对纯化条件进行验证(表2)。流出液吸附率平均值为92.72%,洗脱液解析率平均值为75.99%,较控制单一因素的纯化效果为好。

表2 纯化工艺验证Table 2 Validation test data
洗脱液干燥至粉末状后称重,3组重复试验的苜蓿总黄酮纯度平均值为31.46%,可有效去除了其中杂质,因此D101大孔树脂对苜蓿总黄酮的纯化工艺可行,但该结果所得纯度比较低,可进一步采用聚氨酰树脂纯化以提高苜蓿总黄酮粗提液的纯度。
2.5 苜蓿总黄酮纯化前后抗氧化能力比较
2.5.1清除DPPH·能力 由图3A可知,苜蓿总黄酮粗提物与纯化物都具有较强的清除DPPH·能力,随苜蓿总黄酮质量浓度的增加而增大。当粗提物、纯化物和VC的浓度为0.2 mg·mL-1时,对DPPH·的清除率分别为81.53%,88.54%和93.23%,粗提物、纯化物和VC的浓度为1.0 mg·mL-1时,较浓度为0.2 mg·mL-1对DPPH·的清除率分别增加了12.46%,5.60%和2.94%。相同质量浓度下纯化物均促进了对DPPH·的清除能力,但对DPPH·的清除率均低于VC,纯化物总黄酮质量浓度1.0 mg·mL-1较相同浓度下的VC对DPPH·的清除率减少了2.58%,差异不显著。
2.5.2清除ABTS+·能力 由图3B可知,苜蓿总黄酮粗提物与纯化物都具有较强的清除ABTS+·能力,随苜蓿总黄酮质量浓度的增加而增大。当粗提物、纯化物和VC的浓度为0.2 mg·mL-1时,对ABTS+·的清除率分别为74.63%,81.74%和95.29%,粗提物、纯化物和VC的浓度为1.0 mg·mL-1时,较浓度为0.2 mg·mL-1对ABTS+·的清除率分别增加了14.08%,13.11%和0.63%。相同浓度下纯化物均促进了对ABTS+·的清除能力,但对ABTS+·的清除率均低于VC,纯化后总黄酮质量浓度1.0 mg·mL-1较相同浓度下的VC对ABTS+·的清除率减少了1.93%,差异不显著。

图3 纯化前后总黄酮和Vc对自由基清除能力Fig.3 Free radical scavenging ability of total flavonoids before and after purification and Vc
2.5.3清除·OH能力 由图3C可知,苜蓿总黄酮粗提物与纯化物都具有较强的清除·OH基能力,随苜蓿总黄酮质量浓度的增加而增大。当粗提物、纯化物和VC的浓度为0.2 mg·mL-1时,对·OH的清除率分别为26.18%,66.52%和77.94%,粗提物、纯化物和和VC的浓度为1.0 mg·mL-1时,较浓度为0.2 mg·mL-1对·OH的清除率分别增加了241.60%,40.57%和11.70%。在纯化前后总黄酮质量浓度低于0.6 mg·mL-1时,其对·OH的清除率低于VC,但当总黄酮质量浓度为0.8 和1.0 mg·mL-1时,纯化后的总黄酮对·OH的清除率高于VC,分别增加了3.52%和6.90%。

3 讨论
3.1 大孔树脂对苜蓿总黄酮纯化效果的影响
大孔树脂在植物生物活性成分分离纯化研究中具有良好的吸附性和反复利用等特点,通过物理作用将黄酮类物质吸附在自身孔隙中,从而达到有效分离纯化的目的[16]。前人在纯化苜蓿总黄酮的研究中,选择了具有不同性质的大孔树脂,陈佩佩和荆常亮认为苜蓿总黄酮的纯化中,AB-8和D101大孔树脂有较好的吸附和解吸附效果,对苜蓿总黄酮的纯化效果比较好,与本研究在大孔树脂筛选的结果基本一致;本研究筛选的苜蓿总黄酮上样液质量浓度为0.8 mg·mL-1,与他们在上样液质量浓度为0.528 mg·mL-1和0.6 mg·mL-1有较大的差异;上样体积选择上,不同的学者研究结果差异比较大,荆常亮选择了4 BV和陈佩佩选择了3 BV,而本研究筛选的结果为2 BV,试验发现过高的上样体积影响了吸附的效果,流速越慢越利于树脂吸附苜蓿总黄酮;在上样液pH值选择上,与前人的研究所选pH值多为3~4结果一致,说明紫花苜蓿总黄酮这种弱酸性物质在酸性环境中有很好的吸附效果[17]。本研究在确定上样液质量浓度为0.8 mg·mL-1,上样体积为2 BV,上样液pH值为3的纯化参数条件下,苜蓿总黄酮纯度可达到 31.46%,与荆常亮用AB-8大孔吸附树脂富集紫花苜蓿总黄酮后纯度可达33.03% 结果相近,与陈佩佩纯化获得纯化率48.52%差异比较大,苜蓿总黄酮的分离纯化过程中受各种因素的影响,导致人们在纯化苜蓿总黄酮时产生较大的差异。
3.2 苜蓿总黄酮对自由基清除能力的影响


4 结论


