高温胁迫对化学感受蛋白在家蚕中肠与脂肪体中基因表达的影响
肖 阳,李庆荣,邢东旭,杨 琼
(广东省农业科学院蚕业与农产品加工研究所,广州 510610)
0 引言
昆虫为小型变温动物,保持和调节体温的能力有限,当环境温度超出一定范围时,其生命活动将会受到严重影响,甚至可能引起死亡。高温主要通过降低体内含水量[1]、改变细胞内离子浓度[2]、破坏细胞结构[3]、影响糖脂代谢[4]和生物大分子的结构与功能[5-6]等方面对昆虫造成影响。在高温环境的刺激下,部分昆虫会启动体内对高温的生理防卫机制,比如夏滞育[7]、水分散失[8]、耐高温相关基因的诱导表达[9]以及抗氧化酶活性的诱导增强[10]等。
华南蚕区地处热带亚热带气候环境,极端高温天气频发。高温季节养蚕极易造成严重的损失,因此耐高温家蚕品种在本蚕区的蚕业生产中有着极大的需求。多年以来,华南家蚕抗逆性品种选育技术以传统杂交育种为主[11],育种周期长,且难以突破抗逆性状与产量质量性状之间“此消彼长”的矛盾,亟需在传统育种技术的基础上逐渐向周期短、针对性强的分子育种转型。然而目前耐高温相关基因的机理机制尚不清晰,严重影响了家蚕育种新技术的发展。
化学感受蛋白(Chemosensory proteins,CSPs)是昆虫体内的一类小分子量结合蛋白,在不同物种之间CSPs的序列高度保守,其广泛熟知的功能是作为信息素/气味分子的转运蛋白[12],参与昆虫嗅觉感受的初始过程[13]。CSPs最早在果蝇的触须中被发现和鉴定[14-15],由于触须为昆虫的主要信息感受器官,因此很长时间以来CSPs被认为其功能仅与昆虫的化学信息感受过程有关[16],然而越来越多的证据表明CSPs在多个非化学感受器官也发生表达,在昆虫体组织中分布广泛[17-18],且受微生物感染诱导发生显著性表达变化[19],在耐药性种群中表达水平显著高于敏感性种群[20]。Gong等[21]利用家蚕基因组数据库分析鉴定了18个家蚕CSPs候选基因,发现其在触角、头、胸、腿、翅膀、睾丸、卵巢等多个家蚕组织中均存在不同程度的表达。邓培渊等[22]对BmCSP8在不同发育时期的表达模式进行分析,发现其从家蚕1龄幼虫期就开始表达,其表达持续了幼虫的整个发育过程。由这些已报道的时空表达结果推测BmCSPs可能具有多样化的生理功能,而不仅限于作为化学感受过程中的转运蛋白。在前期研究中,本课题组通过高通量表达谱测序进行差异表达基因分析,筛选到与家蚕高温耐受相关的BmCSPs[23-24],并对其在家蚕物理屏障表皮中的表达进行了分析[25]。
本实验对高温诱导条件下家蚕的消化吸收组织中肠、能量储存组织脂肪体中的BmCSPs基因表达变化进行分析,旨在探讨BmCSPs基因在家蚕高温耐受中的作用,为深入研究家蚕的高温耐受机理以及家蚕抗性育种提供线索和依据。
1 材料与方法
1.1 供试家蚕品种与主要试剂
供试家蚕品种为本实验室通过定向选育获得的高温耐受品系932G。主要试剂:Trizol Reagents(Invitrogen公司)、Evo M-MLV Plus 1st Strand cDNA Synthesis Kit(AG11615,Accurate Biotechnology,Hunan,Co.,Ltd)和SYBR Green Premix Pro Taq HS qPCR Kit(AG11701,Accurate Biotechnology,Hunan,Co.,Ltd)。实验在广东省农业科学院蚕业与农产品加工研究所家蚕与微生物研究室于2020年5—9月开展。
1.2 方法
1.2.1 家蚕幼虫高温胁迫与取材 实验设置高温胁迫组(高温组)和常温对照组(对照组)。高温组处理:将供试家蚕品种的幼虫在常规条件下饲养至5龄第2天时,转至温度35±0.5℃、RH 85%±2%的人工气候培养箱中进行饲养。对照组处理:将供试家蚕品种的幼虫在常规条件下饲养至5龄第2天时,转至温度27±0.5℃、RH 75%±2%的人工气候培养箱中继续饲养。分别于高温胁迫1、6、18和36 h解剖家蚕取其中肠和脂肪体组织,以每3头家蚕的中肠或脂肪体作为1个样品。每次取样均设3次重复,样品收集后置于-80℃保存备用。
1.2.2 家蚕总RNA的提取与反转录 通过Trizol法提取家蚕中肠和脂肪体样品的总RNA,在BioTek SynergyTMLX多功能微孔板检测仪上测定OD260/OD280的值和RNA样品浓度,根据Evo M-MLV Plus 1st Strand cDNA Synthesis Kit试剂盒使用说明书将抽提的RNA反转录成cDNA。取OD260/OD280比值在1.80~2.00之间的样品,用于荧光定量PCR检测。
1.2.3 引物设计与合成 分别从家蚕基因组数据库(https://silkdb.bioinfotoolkits.net/main/species-info/-1)和GenBank数据库(https://www.ncbi.nlm.nih.gov/genbank/)获得了16个BmCSPs的CDS序列。以sw22934为内参基因、BmCSPs为靶标基因,利用Primer Premier 5.0软件设计特异引物(表1)。引物由北京六合华大基因科技有限公司合成。
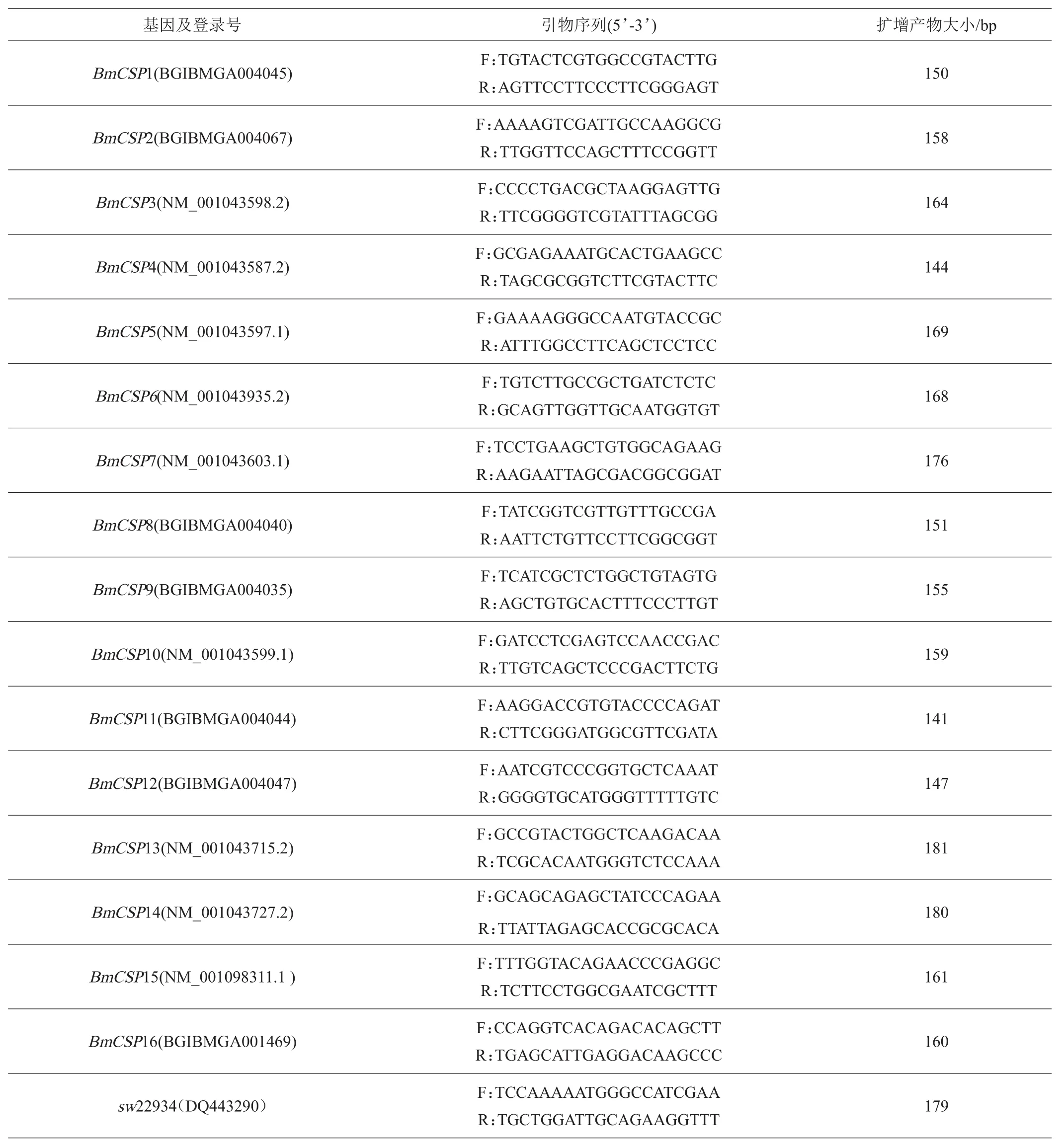
表1 实时荧光定量PCR扩增引物
1.2.4 荧光定量PCR检测 荧光定量PCR方法参照SYBR Green Premix Pro Taq HS qPCR Kit试剂盒操作说明进行。反应总体系20 μL,采用的两步法PCR反应程序为:95℃预变性30 s;95℃变性5 s,60℃退火与延伸30 s,40个循环。通过Bio-Rad CFX Connect实时荧光定量PCR系统进行PCR扩增和基因相对表达量分析,每个样品设置3个重复,根据2-△△Ct法计算目的基因的相对表达量[26]。
1.2.5 聚类与统计分析 利用MEGA软件对BmCSPs基因序列进行聚类分析,通过Excel 2010进行数据处理与作图,采用SPSS Statistics 19的t检验方法对BmCSPs基因表达量在高温组与对照组之间的差异显著性进行分析。
2 结果与分析
2.1 BmCSPs序列聚类分析
对GenBank中检索到的16个家蚕化学感受蛋白家族成员基因进行序列相似性分析。聚类分析结果(图1)显示,16个BmCSPs基因主要聚为2个大类,第1类包含成员较多,有BmCSP1、BmCSP2、BmCSP3、BmCSP4、BmCSP5、BmCSP6、BmCSP7、BmCSP9、BmCSP10、BmCSP12、BmCSP13及BmCSP14,第2类包括BmCSP8、BmCSP11、BmCSP15和BmCSP16。
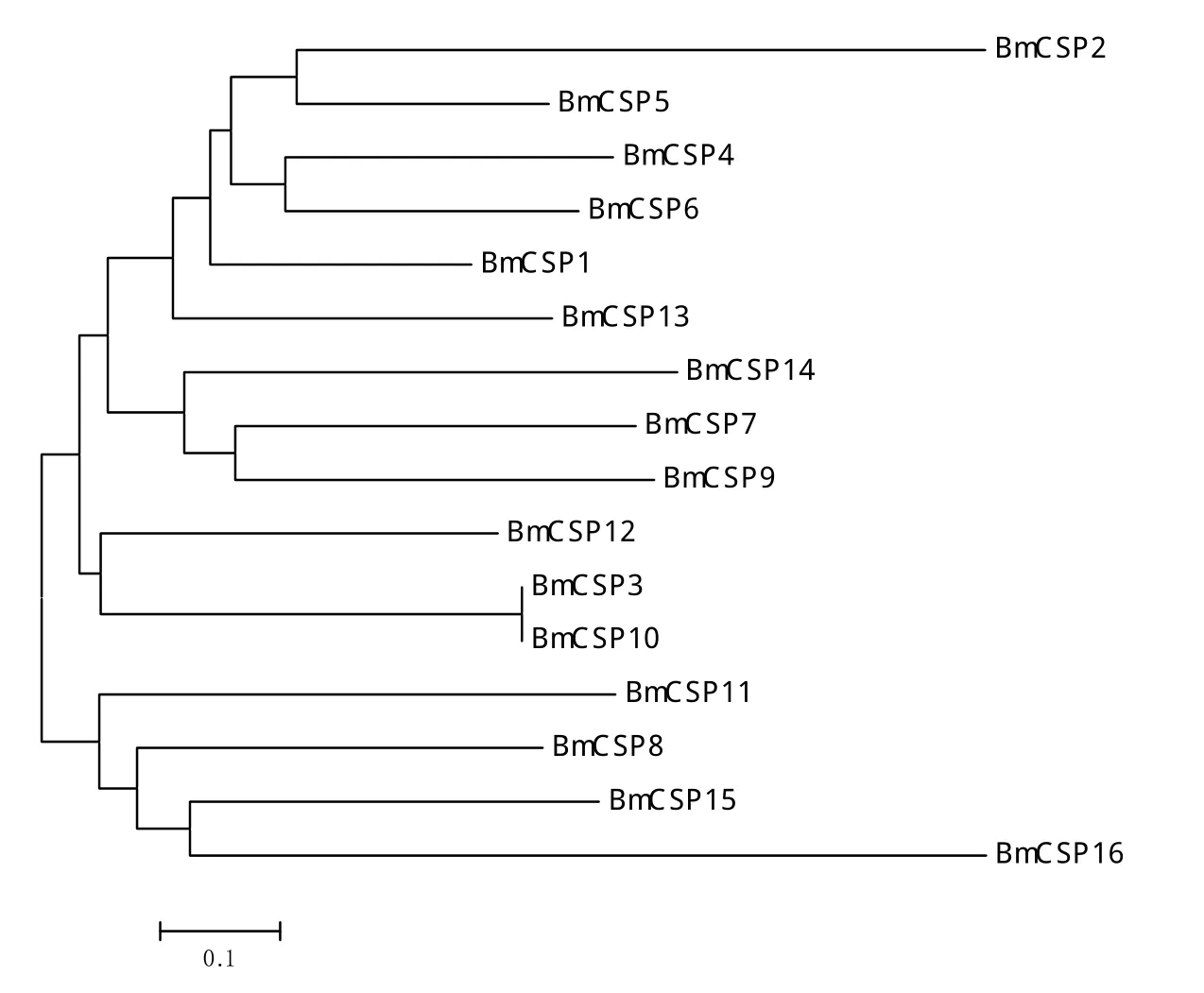
图1 BmCSPs基因CDS序列相似性聚类分析
2.2 高温胁迫下BmCSPs在家蚕中肠组织中的表达
通过荧光定量PCR检测方法,对16个BmCSPs在高温胁迫后不同时间点(1、6、18、36 h)中肠组织中的表达变化情况进行定量分析。在实验设置的时间范围内,除BmCSP2以外的全部基因均能在中肠组织中检测到表达。BmCSP1、BmCSP3、BmCSP4、BmCSP8和BmCSP10的相对表达量在高温组与对照组之间无显著差异,即在高温胁迫前后其表达未发生显著变化。BmCSP11、BmCSP15的相对表达量在高温胁迫后所有时间点均比对照组上调,部分时间点上调显著或极显著,表明高温胁迫对其表达可能具有一定的促进作用。BmCSP6、BmCSP7、BmCSP9和BmCSP14的相对表达量在高温胁迫后整体比对照组下调,部分时间点出现显著下调,表明其表达可能受到高温胁迫的抑制。BmCSP5和BmCSP13在高温胁迫后相对表达量呈现随时间延长而下降的趋势;BmCSP12的表达量随胁迫时间延长呈现先升高后降低的趋势,在胁迫18 h时表达量出现峰值;BmCSP16受胁迫后的表达量变化则未呈现明显的规律(图2)。
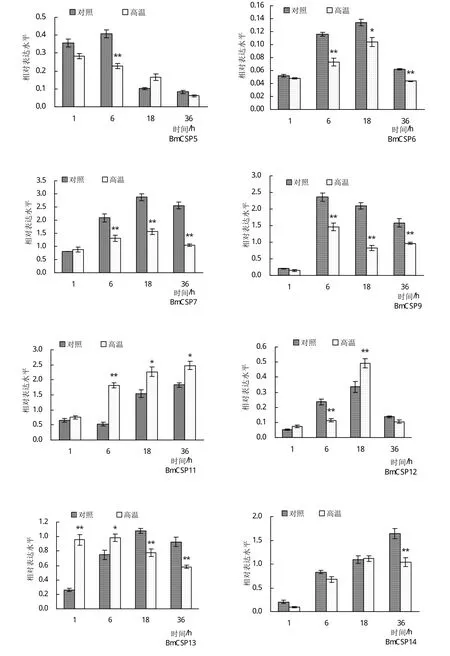
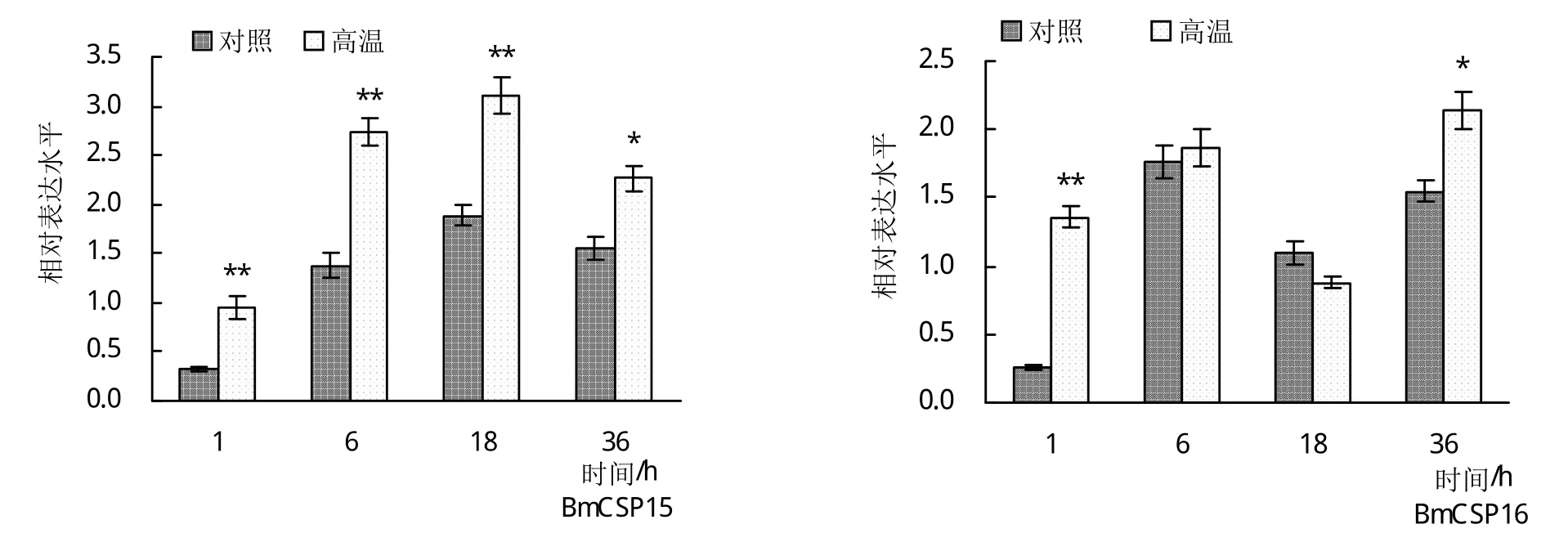
图2 高温胁迫不同时间5龄家蚕中肠中BmCSPs的表达变化
2.3 高温胁迫下BmCSPs在家蚕脂肪体组织中的表达
对16个BmCSPs在高温胁迫后不同时间点(1、6、18、36 h)脂肪体组织中的表达变化情况进行定量分析。BmCSP2基因的表达情况与在中肠组织中类似,表达量过低,无法检测到其表达值,其余15个基因在脂肪体中均能检测到表达。BmCSP11的相对表达量在高温组与对照组之间无显著差异,即在高温胁迫前后其表达未发生显著变化。BmCSP13、BmCSP15的相对表达量在高温胁迫后整体比对照组有所上调,部分时间点上调显著,表明其表达可能受到高温胁迫的刺激影响。BmCSP5在高温组的所有时间点均比对照组下调;BmCSP7、BmCSP9和BmCSP14变化规律相似,在1 h时高温组的相对表达量比对照组上调,而后绝大部分时间点均比对照组下调;BmCSP6在高温组的相对表达量在6 h、18 h比对照组显著下调,其在高温组所有时间点的相对表达量都极低。BmCSP5、BmCSP6、BmCSP7、BmCSP9和BmCSP14的高温组均在部分时间点比对照组出现显著性下调,表明高温胁迫可能对其表达具有一定的抑制作用。BmCSP8的表达量呈现随高温胁迫时间的延长而逐渐上升的趋势,BmCSP1和BmCSP10的表达量随胁迫时间延长而下降,BmCSP3、BmCSP4和BmCSP12的表达量随胁迫时间延长呈现先升高后降低的趋势,而BmCSP16随胁迫时间延长呈现先降低后升高的趋势(图3)。
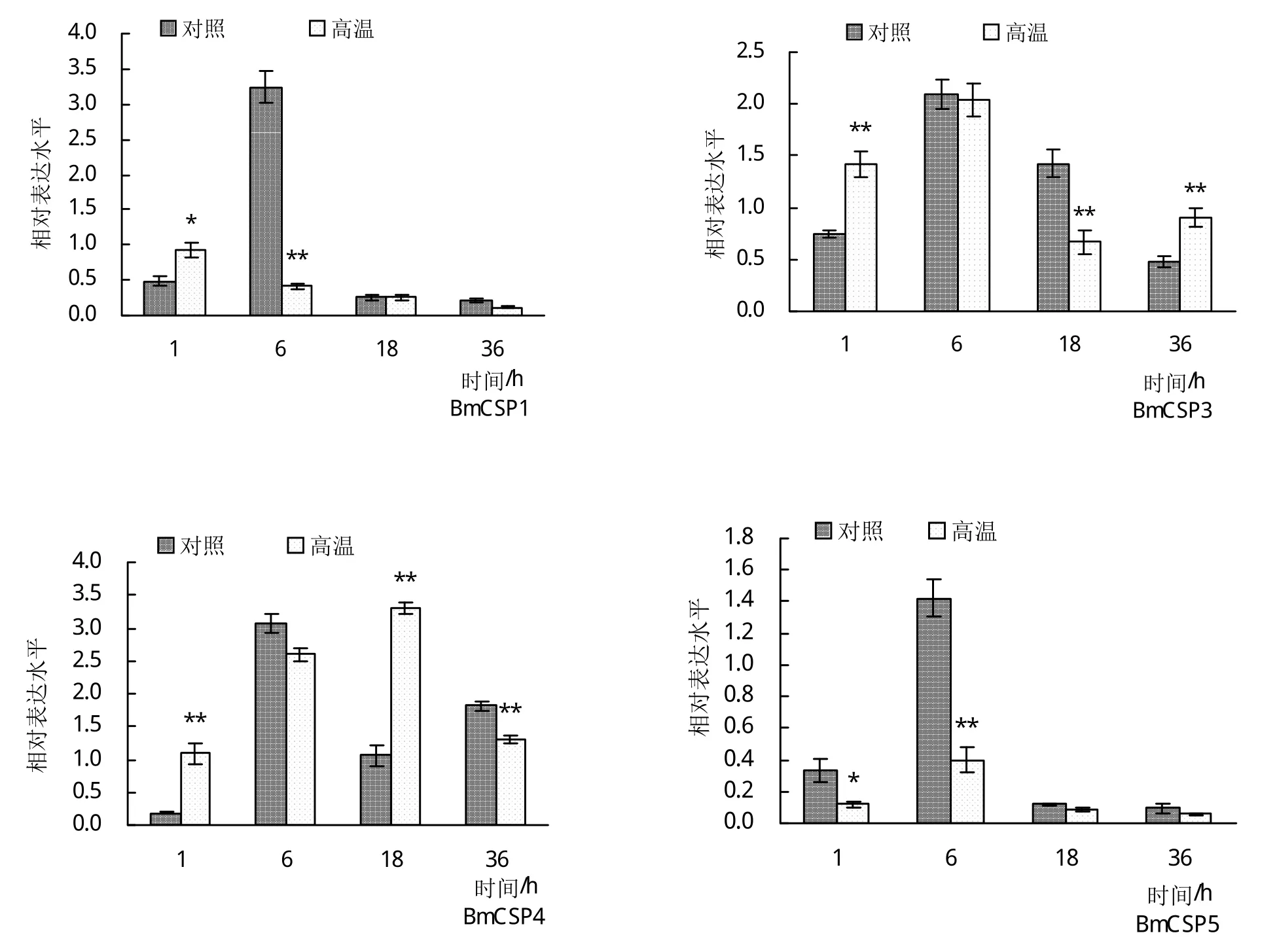
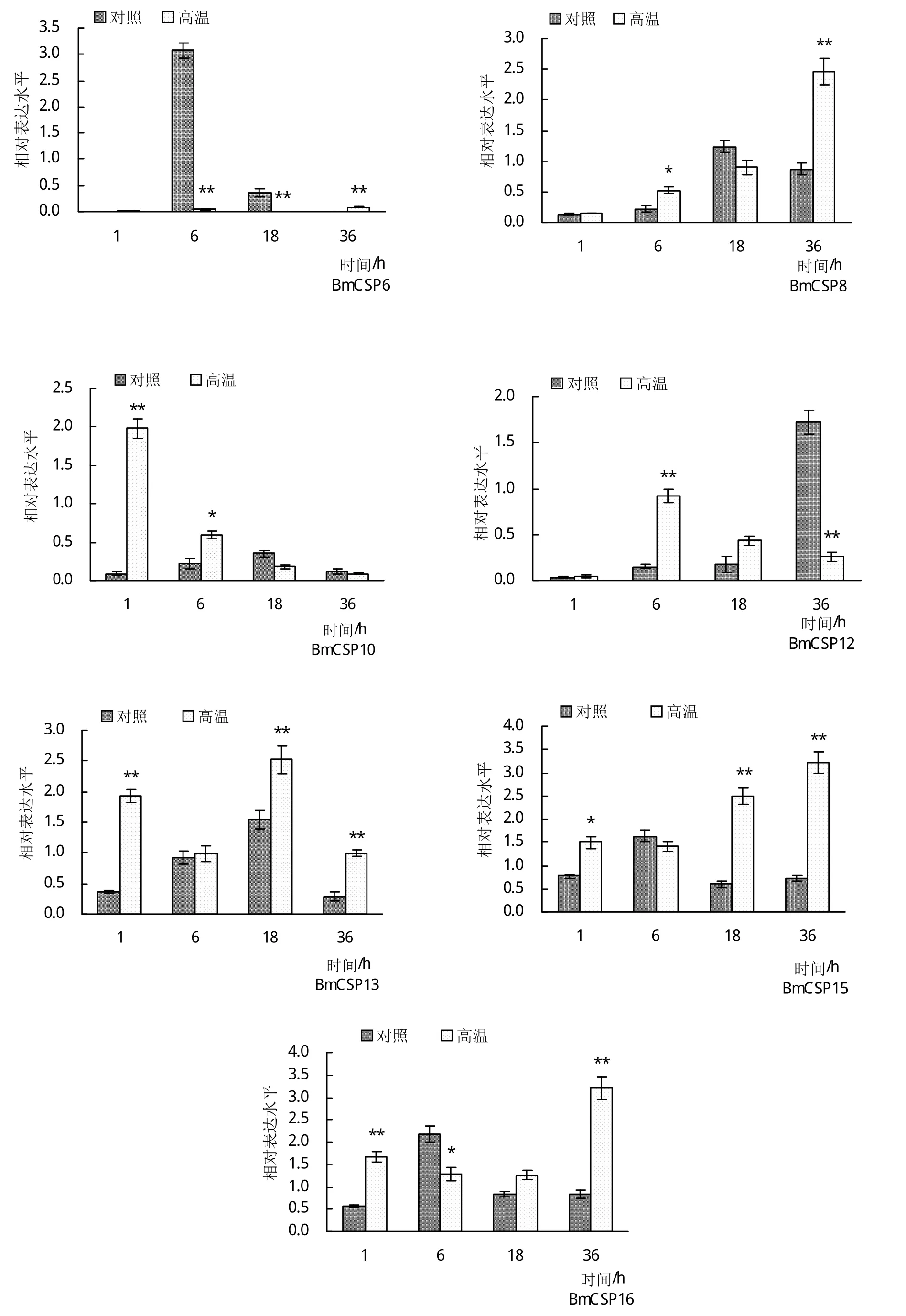
图3 高温胁迫不同时间5龄家蚕脂肪体中BmCSPs的表达变化
3 讨论
3.1 环境温度对昆虫的影响
温度是所有的气象因素中对昆虫影响最显著的,在合适的温度范围内昆虫的生长发育通常随温度的升高而加速[27],而超出一定的温度范围则会使昆虫的生理生化活动紊乱,极端低温或高温都可引起昆虫的死亡。美国白蛾的越冬蛹受到-10℃低温胁迫30 h后全部死亡[28],梨小食心虫在受到38℃高温胁迫48 h后,其成虫的死亡率高达90%以上[29]。昆虫受到高温胁迫后,机体发生一系列复杂的生理变化。36℃高温处理后的家蚕5龄幼虫血淋巴中蜕皮激素(20E)含量显著升高,20E的多个响应基因转录水平均发生上调,并使Akt磷酸化水平提高,激活下游的CncC/keap 1途径,Cyp302a1等20E合成相关基因的转录水平也相应上调[30]。
3.2 昆虫对高温的响应机制
在长期的进化过程中,不少昆虫已经形成应对高温环境的自我保护策略,如诱导产生热激蛋白,使昆虫体内的其他蛋白免受高温的破坏[31-32];发生抗氧化反应,清除高温胁迫产生的过量活性氧(ROS)[33]等等。除此之外还存在众多对高温胁迫进行响应的其他基因,比如莲草直胸跳甲[34]、美洲斑潜蝇[35]在受到高温胁迫后,体内多个P450基因发生了显著性差异表达。鲍忠赞等[36]通过对5龄雌蚕SAGE文库的构建与分析,在高温处理组与常温组之间共获得1062个差异表达基因,其中保幼激素甲基转移酶、免疫相关的蛋白前体、RNA解旋酶等基因的表达差异最为显著。本课题组Li[23]通过对高温耐受性家蚕品种与敏感性品种在高温胁迫前后的转录组分析,筛选到谷胱甘肽转移酶、钙离子结合蛋白、保幼激素二醇激酶、化学感受蛋白等与家蚕高温胁迫相关的基因,并进一步对高温胁迫前后的家蚕表皮组织中化学感受蛋白表达进行了检测。
3.3 BmCSPs响应高温胁迫的表达模式
本研究通过对家蚕中肠和脂肪体组织中BmCSPs响应高温胁迫的表达模式分析结果发现,BmCSPs在两个组织中的表达变化有相似之处,但也存在差别。BmCSP15在两个组织中受高温胁迫的大部分时间点均出现上调,而BmCSP7、BmCSP9和BmCSP14则在两个组织中均出现下调,推测BmCSP15与家蚕对高温的耐受性密切相关,BmCSP7、BmCSP9和BmCSP14与高温敏感性相关。基因表达量检测结果与基因CDS序列的聚类结果大体上吻合,推测BmCSPs基因序列的差异性可能是引起其表达差异性的原因之一。李庆荣等[25]对家蚕表皮组织中8个BmCSPs基因表达水平的检测结果中,BmCSP8和BmCSP15的表达水平受高温胁 迫 后 显 著 上 调,BmCSP1、BmCSP4、BmCSP6、BmCSP7、BmCSP9和BmCSP11的表达则没有发生显著变化,这与本实验结果有一定的差异,说明BmCSPs在中肠组织、脂肪体组织与表皮组织中的表达变化均不相同,其表达特点具有组织特异性。本实验结果在前人的研究基础上再次证实BmCSPs基因不仅在家蚕的感受器官中表达,也在其他组织部位广泛表达,其功能可能涉及家蚕生长发育中的多个方面。BmCSPs基因究竟如何发挥其在高温应答中的功能还有待进一步研究。
4 结论
本研究通过荧光定量PCR检测,对16个BmCSPs在35℃高温胁迫前后的家蚕中肠和脂肪体组织中的表达进行分析,发现大多数BmCSPs成员在高温胁迫下发生了转录水平的变化,其中BmCSP15在两个组织中多数时间点均表达上调,而BmCSP7、BmCSP9和BmCSP14在两个组织中均表达下调,推测BmCSP15与家蚕对高温的耐受性密切相关,BmCSP7、BmCSP9和BmCSP14与对高温的敏感性相关。BmCSPs基因按序列相似性可聚为2大类,基因转录水平的检测结果与基因序列聚类结果大致吻合。该结果可望为家蚕高温耐受机理的阐明及耐高温品种选育提供参考。

