基于JAK/STAT信号通路探讨连花清瘟颗粒对甲型H1N1流感病毒性肺炎小鼠肺组织的保护作用及机制*
樊高薇,薛敬东,李警卓
陕西省中医医院急诊科,陕西西安 710003
作为威胁人类健康的传染性疾病之一,流行性感冒(简称流感)不仅发病率高,同时还有高传染率、高病死率的特点,尚不能得到有效控制。我国是流感高发国家之一,我国流感病死率较高,1997年暴发的H5N1流感病死率高达66%~80%[1];2009年新型甲型H1N1流感暴发,因其发病急,传播范围广,影响了全球200多个国家和地区;目前流感的治疗方式主要为抗病毒治疗,疫苗接种的保护率低,且成本较高[2-3]。甲型H1N1流感病毒已经成为引起重症肺炎的病原体之一,而且甲型H1N1流感病毒感染导致的重症肺炎往往容易进展为急性呼吸窘迫综合征[2-4],因此,开展抗甲型H1N1流感病毒药物的研究仍具有重要意义。临床常将连花清瘟颗粒用于上呼吸道感染的治疗,在新型冠状病毒肺炎疫情发生后,连花清瘟颗粒也被用来预防及治疗新型冠状病毒肺炎,并且取得了较好的治疗效果,其可以广谱抗病毒,通过调节多种信号通路抑制病毒对细胞的侵袭。研究发现,在甲型H1N1流感病毒入侵机体的早期,机体会应激产生干扰素,干扰素可与细胞膜特异性受体(IFNAR)结合[5],激活Janus激酶(JAK)/信号转导及转录激活因子(STAT)信号通路,使肺炎加重[6],本研究旨在基于JAK/STAT信号通路,探究连花清瘟颗粒对甲型H1N1流感病毒性肺炎小鼠肺组织的保护效果及作用机制。
1 材料与方法
1.1标本来源 SPF级4~6周龄雌性BALB/c小鼠购自广东省医学实验动物中心,动物许可证号为SCXK(粤)2019-0035,动物质量合格证号为44007200052444。甲型流感病毒A/FM/1/47(H1N1)购自中国药品生物制品检定所。
1.2仪器与试剂 连花清瘟颗粒购自石家庄以岭药业股份有限公司;RNA提取试剂盒、反转录-PCR试剂盒购自Thermo Fisher公司;实时荧光定量PCR(qPCR)试剂盒购自TaKaRa公司;4%多聚甲醛购自Sigma公司;乙醚购自国药化学试剂有限公司;高效RIPA组织裂解液、蛋白酶抑制剂、BSA封闭液、ECL化学发光试剂盒均购自北京索莱宝科技有限公司;小鼠IgG检测试剂盒(ELISA)购自南京建成生物工程研究所;蛋白检测试剂盒(BCA法)购自北京索莱宝科技有限公司;JAK1、STAT3酶标兔多克隆抗体购自Sigma公司。二级生物安全柜购自Thermo Fisher公司;BSA223S电子天平购自Sartorius公司;ABI 7500 Real-Time PCR仪购自Applied Biosystems公司;倒置显微镜购自Leica公司;垂直电泳仪、半干转印仪购自Bio-Rad公司;全自动数码凝胶/化学发光图像分析系统购自上海天能科技有限公司;超纯水仪购自ELGA公司;组织匀浆机购自天根生化科技(北京)有限公司;Tecan Infinite®200 Pro多功能酶标仪购自Tecan公司;CUT5062型石蜡旋转式切片机购自SLEE公司;电热恒温鼓风干燥箱购自Thermo Fisher公司。
1.3方法
1.3.1甲型H1N1流感病毒性肺炎小鼠模型的建立 将病毒原液稀释至1、10、100、1 000、10 000倍,每个稀释倍数对应10只小鼠,通过滴鼻感染小鼠,每只小鼠感染病毒量为20 μL,观察10 d后各组小鼠的存活情况。另取25只小鼠,每个稀释倍数对应5只,通过滴鼻感染小鼠,感染5 d后将小鼠用乙醚麻醉,然后摘下眼球,尽量流干血液,断颈处死,解剖后取出全肺,用磷酸盐缓冲液(PBS)清洗后吸干表面水分,称取肺湿重,60 ℃烘箱内放置24 h,称取肺干重,根据肺湿干重比评价小鼠肺水肿情况,肺湿干重比值越大,肺水肿越严重。同时,取5只小鼠纳入NC组,用同体积的生理盐水滴鼻,5 d后称取肺干重、湿重,计算肺湿干重比。根据造模病毒稀释倍数选择原则,模型鼠应选择有较低存活率(低于50%),同时肺湿干重比显著高于NC组的小鼠。
1.3.2分组及给药干预 将30只小鼠随机分为模型组(H1N1组)、连花清瘟颗粒组(LC组)、对照组,每组10只。将H1N1组、LC组小鼠用乙醚轻度麻醉后,用1.3.1确定稀释倍数的造模病毒液滴鼻感染小鼠,对照组用同体积的生理盐水滴鼻。根据连花清瘟颗粒的说明书,按5 g/kg的给药剂量,将连花清瘟颗粒溶解后对LC组小鼠进行灌胃给药5 d,然后再进行H1N1流感病毒液滴鼻造模,感染5 h后继续给药5 d;在LC组给药的同时,对照组、H1N1组灌胃同体积生理盐水。
1.3.3小鼠健康状态观察 自感染病毒后,观察H1N1组、LC组、对照组小鼠健康状态,包括毛发是否顺滑,精神状态,是否有咳嗽、呼吸困难等。
1.3.4肺组织JAK1、STAT3 mRNA表达水平检测 感染病毒后5 d,将H1N1组、LC组、对照组小鼠用乙醚麻醉后进行解剖,取小鼠右肺组织约3 cm3,迅速放入无菌EP管中,液氮处理15 min,转移至-80 ℃保存备用。根据RNA提取试剂盒说明书提取总RNA,根据反转录-PCR试剂盒说明书进行反转录,得到cDNA,用qPCR检测JAK1、STAT3 mRNA的表达水平,内参基因为β-actin。JAK1正向引物5′-GCCAGTGCCCTGAGTTACTT-3′,反向引物5′-GTCTGGATCTTGCCTGGTCA-3′;STAT3正向引物5′-TGTGTGACACCATTCATTGATGC-3′,反向引物5′-TGCCCAGATTGCCCAAAGAT-3′。反应体系:qPCR SuperMix 10 μL,正向引物、反向引物各0.4 μL,cDNA模板1 μL,加纯水至反应体系总体积为20 μL。反应条件:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,共40个循环。用2-ΔΔCt方法计算表达水平。
1.3.5肺病理组织观察 取LC组、H1N1组、对照组小鼠左肺组织约3 cm3(避免镊子划伤组织),将组织固定于4%多聚甲醛内,24 h后更换多聚甲醛,按照常规方法对组织进行石蜡包埋、切片、苏木精-伊红染色(HE染色),显微镜下观察病理变化。
1.3.6肺组织JAK1、STAT3蛋白表达水平检测 称取对照组、LC组、H1N1组小鼠肺组织各50 mg,加入300 μL提前配制的组织裂解液,匀浆机内充分搅匀,10 000×g离心10 min,吸取上清液,采用BCA法检测蛋白,调节水平至100 mg/mL,SDS-PAGE电泳后进行转膜,BSA封闭液封闭,孵育抗体,采用化学发光(ECL)试剂盒检测JAK1、STAT3蛋白表达水平。
1.3.7血清IgG水平检测 将对照组、LC组、H1N1组小鼠摘取眼球后取血,4 ℃冰箱内静置过夜,11 800×g离心10 min,吸取上清液,按照小鼠IgG检测试剂盒(ELISA)说明书检测血清IgG水平。
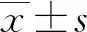
2 结 果
2.1不同稀释倍数病毒液感染后小鼠存活率变化 感染10 d后,NC组无死亡,存活率为100%;稀释倍数为1的病毒液感染的小鼠全部死亡,存活率为0%;稀释倍数为10、100的病毒液感染的小鼠存活率均为10%;稀释倍数为1 000的病毒液感染的小鼠存活率为20%;稀释倍数为10 000的病毒液感染的小鼠存活率为70%,根据小鼠存活率,可将10、100、1 000作为造模备选稀释倍数。
每天统计不同稀释倍数病毒液感染小鼠和NC组小鼠的死亡数,稀释倍数为1的病毒液感染的小鼠第5天开始出现死亡,存活率持续下降,第9天存活率为0%;稀释倍数为10、100、1 000的病毒液感染的小鼠第6天开始出现死亡,存活率持续下降;稀释倍数为10 000的病毒液感染的小鼠第7天开始出现死亡,存活率一直保持较高水平,见图1;因此,可在病毒感染第5天,保证小鼠未死亡的前提下观察各项指标。
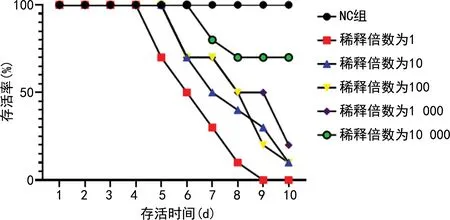
图1 不同稀释倍数病毒液感染的小鼠及NC组小鼠存活率变化情况
2.2不同稀释倍数病毒液感染5 d后小鼠肺湿干重比 感染5 d后,与NC组比较,稀释倍数为1、10、100的病毒液感染的小鼠肺湿干重比明显升高,差异有统计学意义(P<0.05)。根据造模病毒稀释倍数选择原则,最终选用稀释倍数为100的病毒液进行造模,见表1。
2.3小鼠健康状态观察 对照组小鼠毛发顺滑、光亮,精神状态正常,无咳嗽、呼吸困难;H1N1组小鼠毛发凌乱、暗淡,精神萎靡,伴有咳嗽、呼吸困难;LC组小鼠毛发凌乱、暗淡,精神萎靡,但咳嗽症状相较于H1N1组有所改善。

表1 不同稀释倍数病毒液感染5 d后小鼠肺湿干重比与NC组比较
2.43组肺组织JAK1、STAT3 mRNA的表达水平比较 与对照组比较,H1N1组、LC组JAK1、STAT3 mRNA表达水平明显升高,而相较于H1N1组,LC组JAK1、STAT3 mRNA表达水平明显降低,差异有统计学意义(P<0.05),见图2。
2.5肺组织病理学变化 对照组小鼠肺组织正常,见图3A;H1N1组小鼠肺组织出现充血、水肿现象,同时发生弥漫性炎症细胞浸润,伴有上皮细胞脱落、坏死,发现支气管上皮细胞变形,见图3B;LC组小鼠相较H1N1组小鼠肺组织水肿、充血现象减轻,炎症细胞浸润明显减少,肺部病变得到缓解,但仍有局部肺泡间隔增厚,见图3C。
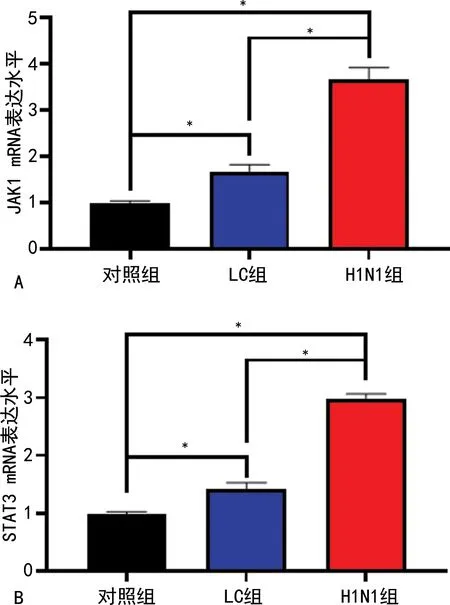
注:A为3组JAK1 mRNA表达水平比较;B为3组STAT3 mRNA表达水平比较;*P<0.05。
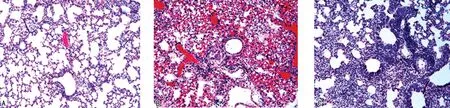
注:A为对照组小鼠典型肺组织切片HE染色结果;B为H1N1组小鼠典型肺组织切片HE染色结果;C为LC组小鼠典型肺组织切片HE染色结果。
2.63组肺组织JAK1、STAT3蛋白表达水平比较 与对照组比较,H1N1组小鼠肺组织JAK1、STAT3蛋白表达水平明显升高,差异有统计学意义(P<0.05),而LC组小鼠肺组织JAK1、STAT3蛋白表达水平略高于对照组,但差异无统计学意义(P>0.05),见图4、5。
2.73组血清IgG水平比较 H1N1组小鼠血清IgG水平[(2.75±0.55)ng/mL]明显高于对照组[(1.15±0.23)ng/mL],LC组小鼠血清IgG水平为(8.44±0.68)ng/mL,明显高于对照组、H1N1组,差异有统计学意义(P<0.05)。
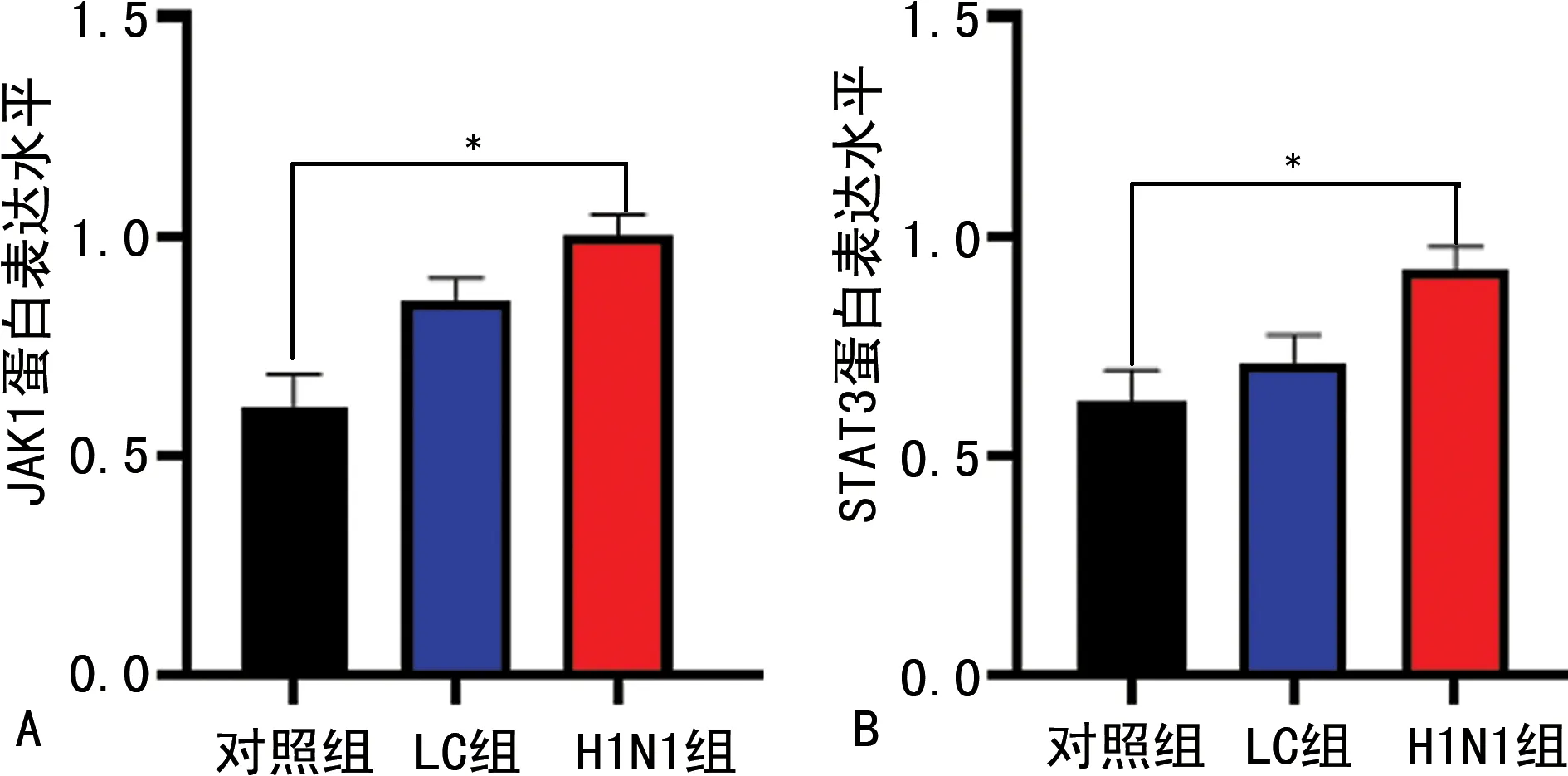
注:A为3组肺组织JAK1蛋白表达水平比较;B为3组肺组织STAT3蛋白表达水平比较;*P<0.05。
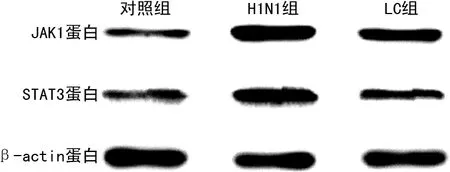
图5 3组肺组织JAK1、STAT3蛋白Western blot图
3 讨 论
使用连花清瘟颗粒治疗流感具有一定效果。有研究发现,服用连花清瘟颗粒可有效抵抗甲型H3N2流感病毒感染,发挥预防作用[7];还有研究以甲型H1N1流感病毒感染的BALB/c小鼠为研究对象,发现服用奥司他韦与连花清瘟颗粒均对感染小鼠的肺指数提升有明显的抑制作用[8]。通过查询PubChem数据库,发现连花清瘟颗粒在体内发挥作用时可涉及细胞对外部刺激反应的抑制、细胞凋亡、细胞信号传导等方面相关的140个靶蛋白,相关蛋白主要为蛋白激酶B、胱天蛋白酶3、丝裂原活化蛋白激酶1、肿瘤因子P53等[9]。同时研究发现,连花清瘟颗粒可提高小鼠体内CD4+水平,可提高小鼠血清干扰素-γ的表达,增强小鼠巨噬细胞的吞噬功能,从而提高小鼠免疫功能[10]。临床研究发现,连花清瘟颗粒可缓解患者咳嗽、呼吸困难等临床症状,对流感的治疗效果好,尤其在发病早期可以明显减轻患者临床症状,且效果优于一般中成药;而在治疗甲型H1N1流感病毒感染方面,连花清瘟颗粒效果显著,不良反应少,安全性更高,同时还可作为预防用药[11-14]。本研究结果显示,使用连花清瘟颗粒干预后,甲型H1N1流感病毒性肺炎小鼠咳嗽、呼吸困难等临床症状得到改善,肺组织切片镜检显示炎症细胞浸润明显减少,水肿及充血现象得到缓解,说明连花清瘟颗粒可有效保护小鼠肺组织。同时,LC组小鼠血清IgG水平为(8.44±0.68)ng/mL,明显高于对照组、H1N1组,提示使用连花清瘟颗粒治疗可以增强小鼠免疫功能。
探讨连花清瘟颗粒治疗甲型H1N1流感病毒性肺炎的相关机制具有重要意义。JAK/STAT通路在甲型H1N1流感病毒性肺炎的进展中起着重要作用[5-6]。JAK1、STAT3蛋白是JAK/STAT信号通路的主要蛋白,研究发现,脾脏中具有丰富的JAK1、STAT3蛋白,一旦JAK/STAT信号通路被激活,可直接及间接促进肿瘤坏死因子-α等炎症因子的产生,导致炎症发生[15-16]。此外,STAT3的高表达直接参与了皮肤病的发生,如有研究发现,银屑病患者STAT3蛋白的表达显著上调[17];荨麻疹患者JAK/STAT信号通路被激活,经过有效治疗后,STAT3 mRNA表达水平显著下降,基因沉默JAK/STAT信号通路后,患者炎症症状减轻[15,18]。JAK1是非受体酪氨酸激酶;STAT3是STAT家族一员,参与癌细胞的活化与增殖[19]。有研究指出,抑制STAT3的表达后,线粒体内氧化磷酸化活性被抑制,组胺分泌减少,因此,近年来STAT3常作为研究过敏性疾病治疗的新靶点[20]。本研究观察小鼠肺组织JAK1、STAT3的基因转录及表达水平发现,采用连花清瘟颗粒干预后甲型H1N1流感病毒性肺炎小鼠肺组织JAK1、STAT3 mRNA表达水平均明显降低,提示该药物可能通过抑制JAK/STAT信号通路发挥增强小鼠免疫力,降低炎性反应水平,保护小鼠肺组织的作用。连花清瘟颗粒在抗流感病毒感染方面有强大功效,在体外实验中还可抑制流感杆菌,而且由于作用靶点多,所以不易产生耐药性,其联合奥司他韦治疗对降低乙型流感病毒感染小鼠肺指数的作用优于奥司他韦单独治疗[21]。
综上所述,连花清瘟颗粒可以抑制甲型H1N1流感病毒性肺炎小鼠体内JAK/STAT信号通路,增强小鼠免疫力,减少小鼠肺组织损伤。

