亚油酸乙醇胺诱导番茄对灰葡萄孢抗性的作用及机制
邵淑君,胡璋健,师恺
亚油酸乙醇胺诱导番茄对灰葡萄孢抗性的作用及机制
邵淑君,胡璋健,师恺
浙江大学农业与生物技术学院,杭州 310058
灰葡萄孢()引起的灰霉病是危害番茄()的重要病害之一,防治不及时可造成30%—40%减产。目前生产上多以化学防治为主,但存在农产品安全及环境污染的风险。-酰基乙醇胺(NAE)是植物体内天然存在的一类脂质生物活性化合物,其在哺乳动物中具有多种免疫功能,但其在植物免疫中的作用和机制尚不清楚。【】探讨-酰基乙醇胺在诱导番茄对灰葡萄孢防御中的作用,为研发番茄灰霉病绿色防控技术提供依据。将灰葡萄孢分别接种在含有硬脂酰乙醇胺(NAE 18:0)、亚油酸乙醇胺(NAE 18:2)、廿二碳五烯酸乙醇胺(NAE 22:5)的培养基上,观察灰葡萄孢的生长情况。在此基础上,以番茄‘Moneymaker’植株为材料,硬脂酰乙醇胺、亚油酸乙醇胺、廿二碳五烯酸乙醇胺外源处理番茄叶片后接种灰葡萄孢,统计病情指数,测定荧光参数。采用qRT-PCR技术明确亚油酸乙酰胺处理后番茄叶片灰葡萄孢的相对表达量,进一步测定番茄叶片中主要抗病基因、-、、、等的相对表达量及茉莉酸(jasmonic acid,JA)、水杨酸(salicylic acid,SA)、乙烯(ethylene,ETH)、脱落酸(abscisic acid,ABA)、生长素(indoleacetic acid,IAA)含量。并以乙烯信号转导突变体植株()及对照植株Pearson(PB)为材料,在外源亚油酸乙酰胺处理后接种灰葡萄孢,测定番茄叶片叶绿素荧光参数和灰葡萄孢的相对表达量。体外培养试验结果表明灰葡萄孢生长并不受外源-酰基乙醇胺的影响,外源施用-酰基乙醇胺能显著提高番茄植株对灰霉病的抗性,缓解由灰葡萄孢侵染导致的番茄叶片光系统II实际光化学效率(ΦPSII)的下降。3种-酰基乙醇胺中,亚油酸乙醇胺施用后番茄叶片灰霉病病情指数下降最为明显,灰葡萄孢的相对表达量下调60%,其诱导灰霉病抗性效果最佳。番茄植株接种灰葡萄孢后抗性基因、-、、的表达水平均有不同程度上调。外源亚油酸乙醇胺处理使得番茄响应灰葡萄孢接种后、、的表达进一步增强,其中乙烯合成基因的表达水平最高。番茄植株接种灰葡萄孢后叶片水杨酸、茉莉酸、生长素和乙烯含量增加,但外源亚油酸乙醇胺处理并接种灰葡萄孢后只有乙烯含量显著增加。进一步研究发现,番茄乙烯突变体植株中,外源亚油酸乙醇胺对灰葡萄孢的抗性诱导作用显著受到抑制。外源施用亚油酸乙醇胺能够提高番茄内源光合效率和抗病基因的表达及内源激素乙烯的含量,增强番茄植株对灰霉病的抗性,推测其诱导抗性作用可能与乙烯信号路径相关。
番茄;-酰基乙醇胺;亚油酸乙醇胺;灰霉病;灰葡萄孢;乙烯
0 引言
【研究意义】番茄()是世界性栽培蔬菜,作为模式作物,被广泛用于生长发育、果实品质、逆境响应等研究[1]。番茄产量和品质很大程度上受栽培期间病虫害的影响[2]。其中由灰葡萄孢()引起的灰霉病是番茄生产中的重要病害,在我国各番茄种植地均有发生,感病后的番茄产量会降低30%—40%。-酰基乙醇胺(NAE)作为一种天然的活性物质,深入研究其在诱导番茄对灰霉病抗性中的作用及内在机制,对于植物源生物农药的开发具有重要意义。【前人研究进展】20世纪50年代,人们最早在大豆卵磷脂和花生粕的成分中发现了-酰基乙醇胺[3],后续在其他植物中也发现-酰基乙醇胺的存在[4]。-酰基乙醇胺是一类功能多样的脂类信号物质,由一个酰胺键连接到乙醇胺的脂肪酸组成,根据其酰基链的碳数(C12—C18)和不饱和双键数目(0—3)进行分类[5-6]。-酰基乙醇胺普遍存在于植物中,其种类及含量因植株器官、植物种类和生理条件而异,长链-酰基乙醇胺(C16—C18)是植物中主要的-酰基乙醇胺类型,主要由亚油酰乙醇胺(NAE 18:2)、NAE 18:1和NAE 16:0组成。其中亚油酰乙醇胺含量最多,在植株的生长发育中发挥着重要作用[5,7-8]。-酰基乙醇胺不仅参与种子萌发[9-11]、幼苗生长[12]、花器官衰老[13],也可能参与植物细胞防御信号转导系统[8]。1998年,研究人员发现用真菌诱导子木聚糖处理,会引起烟草悬浮细胞培养液中-酰基乙醇胺含量积累[14]。之后-酰基乙醇胺研究中的一个重大突破是成功在拟南芥植株中克隆到一种-酰基乙醇胺的水解酶——脂肪酸酰胺水解酶(FAAH),过表达拟南芥植株中的病害防御基因、激素合成及信号转导基因的表达量均低于野生型植株,降低了对细菌性病原体的抗性[15]。-酰基高丝氨酸内酯(AHL)是革兰氏阴性菌群信号感应家族中的一员,是-酰基乙醇胺类似物。研究发现AHL能够增强植株对生物与非生物逆境的抗性[16],其中-癸酰基高丝氨酸内酯(DHL)作为AHL的一员,能够诱导番茄植株的免疫系统来保护植物免受灰葡萄孢的侵染[17]。【本研究切入点】越来越多的研究证明环境友好型物质-酰基乙醇胺在植株生长发育及抗病性中发挥着重要作用,但外源施用-酰基乙醇胺是否能够有效提高番茄植株对灰霉病的抗性及机制尚不清楚。【拟解决的关键问题】通过对灰葡萄孢接种植株表型及光合特性的测定,探究-酰基乙醇胺对番茄灰霉病抗性的影响。进一步利用qRT-PCR以及HPLC技术分析外源施用亚油酰乙醇胺对番茄植株内源抗病基因表达、激素含量的影响,并结合激素突变体植株外源施用亚油酰乙醇胺对其灰霉病抗性的影响,探讨亚油酰乙醇胺提高灰霉病抗性的内在机制,为番茄作物病害绿色防控提供参考。
1 材料与方法
试验于2018—2020年在浙江大学蔬菜研究所植物生长室及实验室完成。
1.1 试验材料及N-酰基乙醇胺处理
1.1.1 试验材料 供试番茄材料为野生型植株Moneymaker、乙烯信号转导突变体植株()及野生型植株Pearson(PB)。利用这3种番茄材料分别开展两组试验:第1组利用不同-酰基乙醇胺处理野生型植株Moneymaker后接种灰葡萄孢;第2组用亚油酰乙醇胺处理和PB植株后接种灰葡萄孢。以上3种番茄材料均在种子温汤浸种后,播种在含有基质(草炭、蛭石和珍珠岩比例为6﹕3﹕1)的栽培钵中,并置于浙江大学蔬菜研究所植物生长室中生长,其生长条件为昼夜温度24℃/21℃,相对湿度70%—80%,光周期12 h/12 h,平均光强600 μmol·m-2·s-1。
1.1.2-酰基乙醇胺处理 硬脂酰乙醇胺(NAE 18:0)、亚油酰乙醇胺(NAE 18:2)、廿二碳五烯酸乙醇胺(NAE 22:5)均购自SIGMA公司,原药在配置过程中直接用ddH2O稀释至80 μmol·L-1。待番茄长至五叶一心时,选取大小、长势一致的植株进行-酰基乙醇胺全株喷施处理。处理组分别用上述3种-酰基乙醇胺(80 μmol·L-1)喷施两次,间隔24 h,对照组用ddH2O处理。不同-酰基乙醇胺、ddH2O处理48 h后接种浓度为2×105孢子/mL灰葡萄孢,接种采用喷施法。
1.2 试验方法
1.2.1 灰葡萄孢孢子培养及接种 灰葡萄孢培养用V8培养基(36% V8果汁(Campbell Soup Co.,Camden,NJ,USA),0.2 g·L-1CaCO3,15 g·L-1琼脂)、PDA培养基(4 g·L-1马铃薯淀粉,20 g·L-1葡萄糖,15 g·L-1琼脂)和对照培养基(ddH2O,15 g·L-1琼脂)在25℃避光条件下培养15 d左右。待培养皿内长满菌丝后,将菌丝块放入重悬液(2%胰蛋白胨,4%麦芽糖)分离过滤得到孢子,并稀释浓度至2×105孢子/mL[18]。将孢子悬浮液均匀喷施在整株叶片上,以喷施重悬液作为空白对照。接种后的番茄植株置于相对湿度100%、光周期12 h/12 h、光强600 μmol·m-2s-1、温度25℃的环境下3—4 d后观察发病情况。
1.2.2 番茄植株病情调查方法 番茄叶片接种灰葡萄孢3 d后,观察不同处理下番茄植株灰霉病的病情,病害分级标准参照蔡银杰等[19]的方法,根据病斑面积占叶面积百分比分为5级。0级:0;1级:0.1%—10%;2级:10.1%—30%;3级:30.1%—70%;4级:>70%。病情指数计算公式:病情指数=[∑(各级叶数×该级指数)/(调查总叶数×最高级别数)]×100。
1.2.3 叶绿素荧光成像分析 叶绿素荧光使用Imaging-PAM调制荧光成像系统(IMAG-MAXI;Heinz Walz,Germany)进行测定。植株暗适应20 min后,光化光强度和饱和光强度分别设为280和4 000 μmol·m-2·s-1,光系统Ⅱ实际光化学效率计算公式为ΦPSII=(Fm’-F)/ Fm’[20]。
1.2.4 植物叶片总RNA提取和qRT-PCR检测 使用RNA提取试剂盒(Tiangen,China)提取接种灰葡萄孢后24 h的叶片总RNA,使用Fermentas RevertAidTMfirst Strand cDNA Synthesis kit合成cDNA第一链。使用iCycler iQ Multicolor实时定量PCR检测系统仪器(LightCycler 480 II,SwissConfederation)完成qRT-PCR,参照说明书进行操作。
PCR反应体系:10 μL iQTMSYBR Green Supermix,2 μL cDNA,0.4 μL前、后引物(10 μmol·L-1),7.2 μL ddH2O。PCR反应程序:95℃预变性5 min;95℃变性15 s,58℃退火45 s,40个循环。使用Primer 5.0根据SGN上的番茄基因序列设计引物(表1),数据采用2-∆∆CT法进行分析[21]。
1.2.5 植物内源激素含量测定 茉莉酸(jasmonic acid,JA)、水杨酸(salicylic acid,SA)、脱落酸(abscisic acid,ABA)和生长素(indoleacetic acid,IAA)定量测定参照WU等[22]的方法,采用液相色谱质谱串联系统进行分析(Agilent 6460,Agilent Technologies,USA)。在叶片提取过程中,样品加入D5-JA、D4-SA、D6-ABA和 D6-IAA(OlChemlm,Czechia)作为内参。
乙烯(ethylene,ETH)含量测定方法:每个处理取4棵长势一致植株的叶片密封在1 L橡胶平顶烧瓶中,室温放置1 h后用注射器从每个烧瓶中抽取出1 mL顶部气体,使用配备1.5 m×4 mm的氧化铝玻璃柱的气相色谱仪(Philips,UNICAM pro. GC)测定。进样器、检测器和过柱温度分别设定为130、130和200℃。

表1 qRT-PCR特异性引物
1.3 数据统计与分析
试验结果均为3次重复的平均值,利用Microsoft Excel 2016整理数据;运用SAS 9.1 Tukey法进行差异显著性分析;运用Origin 2018进行图形绘制。
2 结果
2.1 N-酰基乙醇胺对体外培养灰葡萄孢菌丝生长的影响
将相同大小的灰葡萄孢菌丝块分别接种在含有80 μmol·L-1硬脂酰乙醇胺(NAE 18:0)、亚油酰乙醇胺(NAE 18:2)、廿二碳五烯酸乙醇胺(NAE 22:5)的V8培养基、PDA培养基以及对照培养基上,于25℃避光培养15 d。结果表明,在避光条件下培养9 d,添加3种-酰基乙醇胺并未对V8培养基和PDA培养基上的灰葡萄孢生长有明显的影响。在V8培养基上培养的菌落紧致均一,而在PDA培养基上培养的菌落整体表现疏松,分块不均一(图1)。因此,-酰基乙醇胺本身并不影响灰葡萄孢的生长,且V8培养基最适宜灰葡萄孢生长。
2.2 外源施用N-酰基乙醇胺对番茄灰霉病抗性的影响
为了探究-酰基乙醇胺在诱导番茄对灰霉病抗性中的作用,进行了-酰基乙醇胺预处理番茄植株叶片后接种病原菌试验。一般情况下,植株遭到病原菌侵染会对其光合系统造成不可逆的损害,因此通过测定叶片ФPSII来评估病害的严重程度[23]。由图2可以看出,接种灰葡萄孢的叶片ΦPSII值降低,而外源施用-酰基乙醇胺能够明显缓解因病原菌侵染导致的ΦPSII下降,这与灰葡萄孢的相对表达量一致。同时外源施用-酰基乙醇胺后,植株病情指数降低至1.2—3。因此,在硬脂酰乙醇胺(NAE 18:0)、亚油酰乙醇胺(NAE 18:2)、廿二碳五烯酸乙醇胺(NAE 22:5)处理下,番茄植株对灰霉病的抗性增强,尤以亚油酰乙醇胺处理对番茄灰霉病的抗性最强。

图1 外源N-酰基乙醇胺处理对体外培养中灰葡萄孢菌丝生长的影响
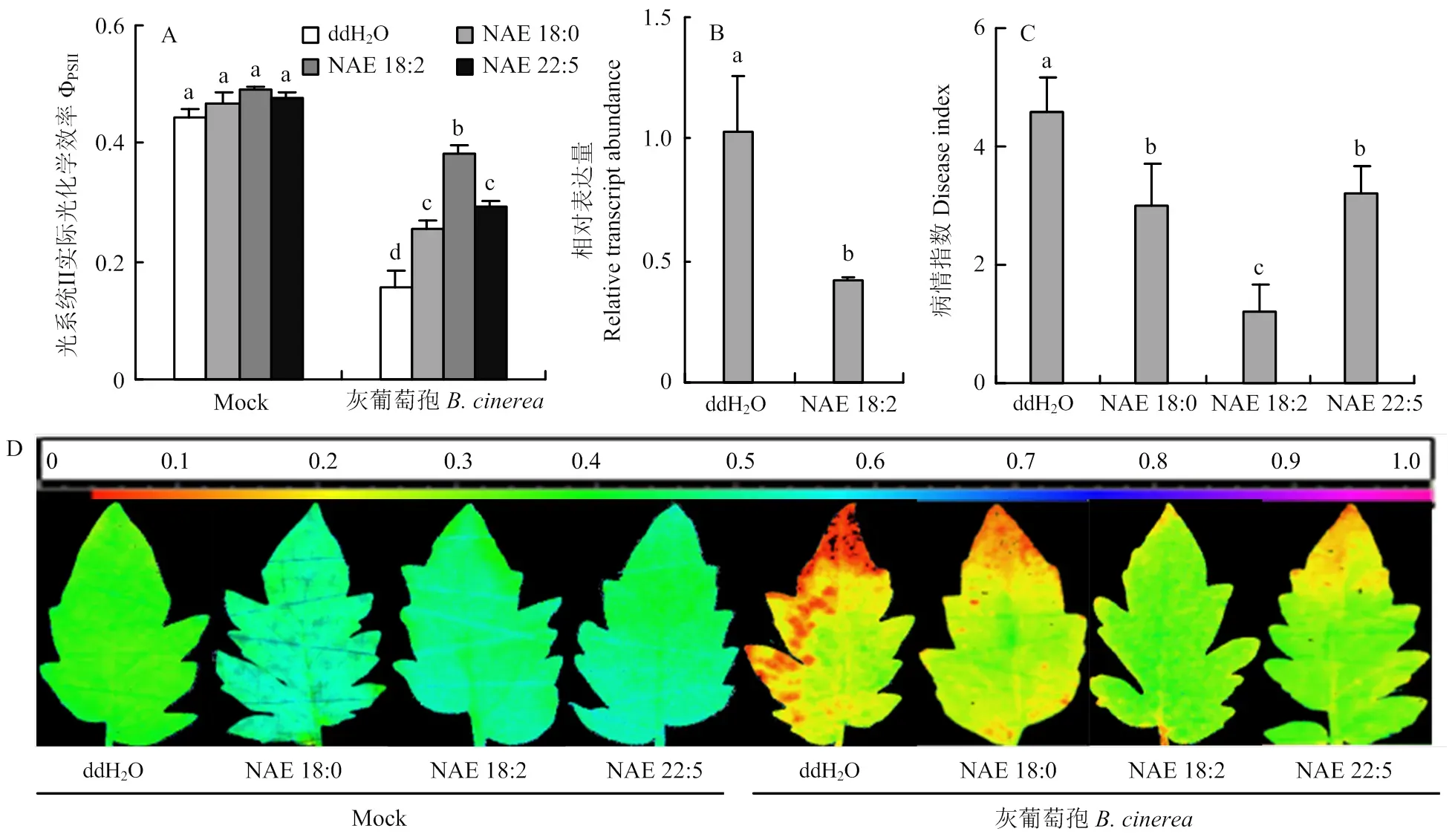
A:番茄叶片光系统II实际光化学效率Photosystem II photochemical efficiency (ΦPSII);B:番茄叶片灰葡萄孢Actin表达量B. cinerea Actin relative expression of tomato leaves;C:病情指数Disease index;D:ΦPSII成像图Imaging of ΦPSII
2.3 外源施用亚油酰乙醇胺对番茄叶片中抗性相关基因表达及激素含量的影响
为了探究亚油酰乙醇胺诱导的抗病性是否与内源激素信号路径有关,检测了接种灰葡萄孢24 h后番茄植株中主要抗病信号路径茉莉酸信号相关基因、水杨酸信号相关基因-和、脱落酸信号路径相关基因信号路径相关基因和的表达量。结果表明,植株接种灰葡萄孢24 h后、-、、、相对表达量表现不同程度上调,但在外源亚油酰乙醇胺处理后接种灰葡萄孢的番茄植株中-、的表达量与对照组相比无显著差异,而、和的表达量则有所增强,尤以乙烯合成基因的表达量增幅最大(图3-A)。
接种灰葡萄孢36 h后番茄植株叶片中激素含量测定结果表明,茉莉酸、水杨酸和生长素的含量均显著上升,但在亚油酰乙醇胺处理下茉莉酸、水杨酸、生长素的含量反而受到不同程度的抑制,脱落酸含量无显著变化,乙烯含量显著增加(图 3-B、3-C)。
2.4 亚油酸乙醇胺对乙烯信号转导突变体番茄灰霉病抗性的影响
鉴于亚油酸乙醇胺能提高乙烯途径基因的转录表达和乙烯含量,进一步利用亚油酸乙醇胺预处理乙烯信号转导突变株及野生型植株PB后接种灰葡萄孢,接种24 h后对其表型进行分析。结果表明,野生型植株PB叶片的发病情况得到了有效缓解,ΦPSII值显著提高,灰葡萄孢的相对表达量降低了60%。而突变体植株叶片的发病情况与对照无明显差异,ΦPSII值及灰葡萄孢的相对表达量均无明显变化(图4),表明亚油酸乙醇胺诱导的抗病性依赖于乙烯信号通路。
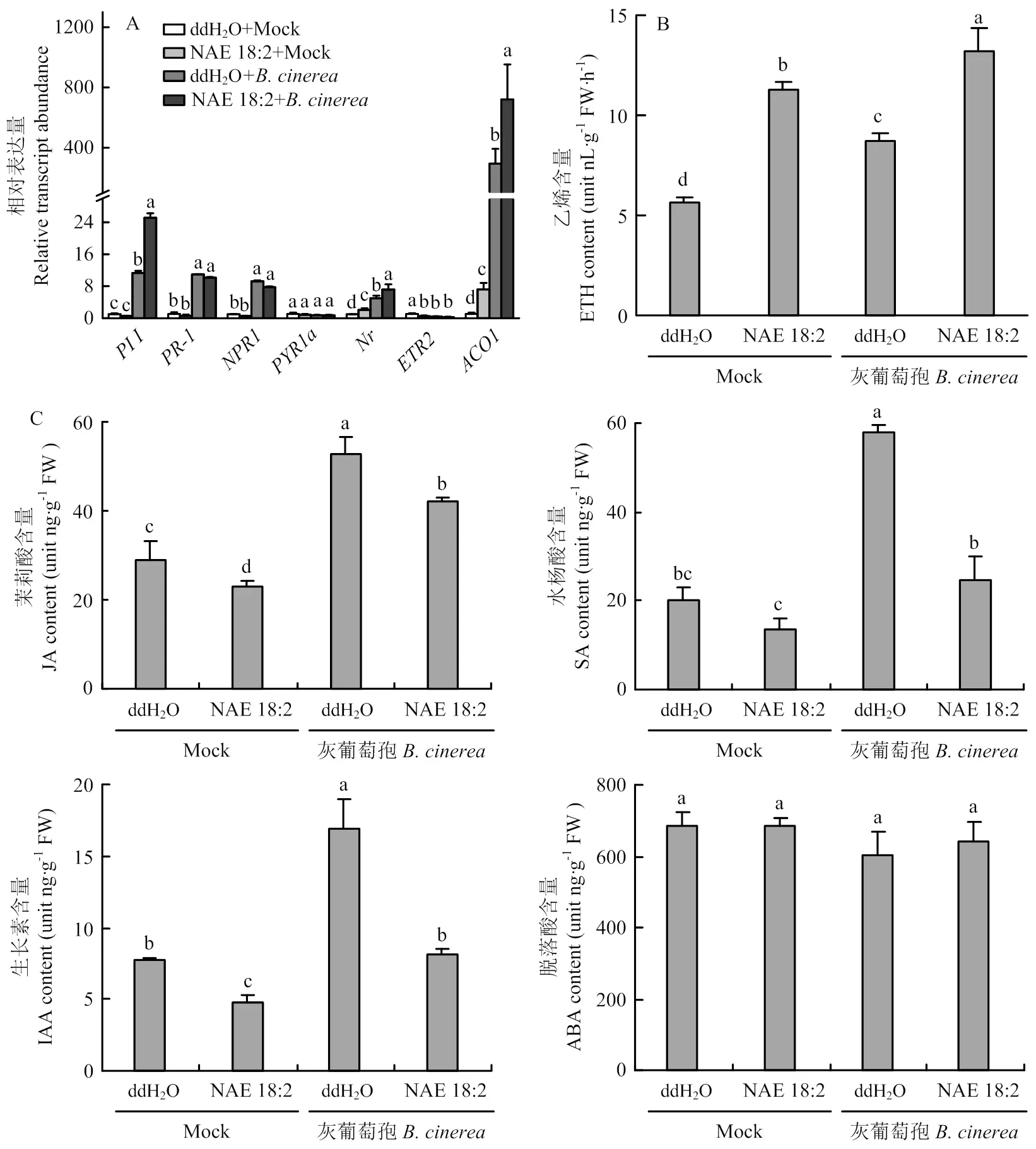
图3 外源施用亚油酸乙醇胺对番茄叶片中抗病基因表达(A)和内源激素含量(B、C)的影响
3 讨论
3.1 N-酰基乙醇胺对植株的抗性诱导作用
-酰基乙醇胺的功能以及代谢在动物中已有大量的研究,研究最为广泛的-花生四烯乙醇胺(NAE 20:4)能够与受体结合,触发一系列信号转导事件,从而调节动物的痛觉、能量平衡、恐惧、食欲、记忆等多种生理和行为过程[24]。进一步研究发现,这些脂肪酸酰胺也是植物体的内源成分,其积累和代谢在植株生长发育及免疫等方面发挥着重要的作用。例如,当烟草叶片受到真菌激发子刺激时,-酰基乙醇胺的水平上升10—50倍,暗示其可能在植株免疫中发挥一定的调控作用[15]。植物中-酰基乙醇胺能够参与种子萌发、叶绿体发育等生长发育调控[25-26],但对病原菌的响应及调控机制尚不清楚。本研究发现,3种-酰基乙醇胺均能提高番茄植株对灰霉病的抗性,其中亚油酸乙醇胺的抗性诱导效果最好,亚油酸乙醇胺处理下的番茄接种灰葡萄孢后,其灰葡萄孢的生长量与对照组ddH2O处理相比下降了60%(图2)。目前生产上防治灰霉病主要依靠化学药剂,已陆续检测到番茄灰霉病对腐霉利等药剂产生不同程度的抗药性,防治效果显著下降[27]。因此,寻找化学合成农药的新替代品已经成为科学研究的一个重要方向。本研究发现亚油酸乙醇胺对番茄灰霉病诱导抗性效果最佳,其类似物DHL已被证实能够诱导番茄植株的系统抗性来保护植物免受灰葡萄孢的侵染[17]。这些活性物质的发现以及未来的开发应用将有助于病害的绿色防控。
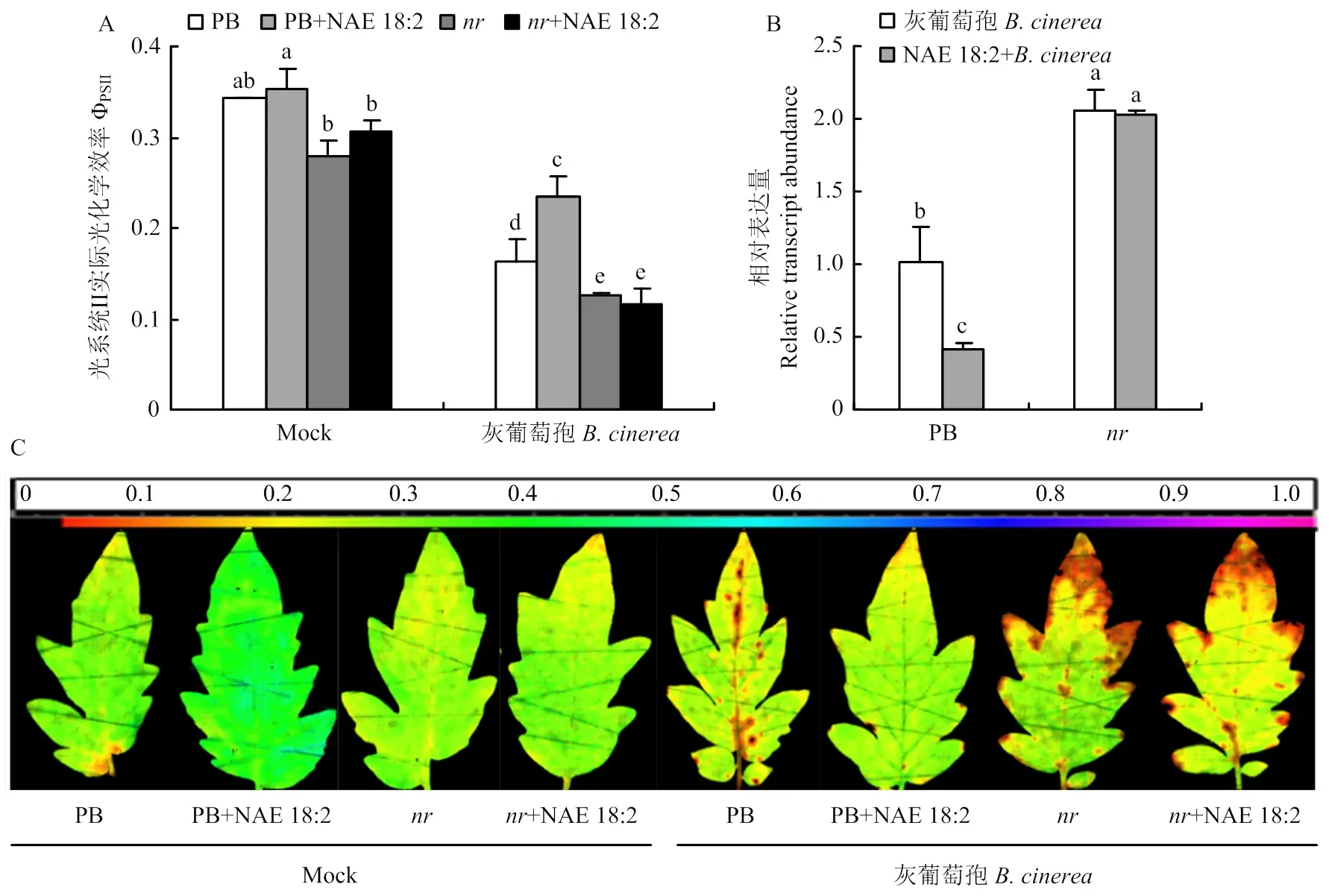
A:番茄叶片光系统II实际光化学效率Photosystem II photochemical efficiency (ΦPSII);B:番茄叶片灰葡萄孢Actin表达量B. cinerea Actin relative expression of tomato leaves;C:番茄叶片ΦPSII成像图 Imaging of ΦPSII
3.2 N-酰基乙醇胺诱导植株抗性与激素途径的关系
植物免疫调控离不开植物激素,灰葡萄孢的侵染提高了植物体内乙烯、茉莉酸、水杨酸、脱落酸含量,保持激素调控网络的内在平衡是植株免疫的关键[28]。本研究中,番茄植株受灰葡萄孢侵染后,其乙烯、茉莉酸、水杨酸含量均有一定程度提高,与前人研究结果一致。但在亚油酸乙醇胺处理下,番茄叶片中乙烯含量显著升高,茉莉酸、水杨酸、生长素的含量反而受到了不同程度的抑制,而脱落酸含量无显著差异(图3)。有研究报道,植株提高对死体营养型病原菌抗性主要依赖于茉莉酸和乙烯信号路径[29-30],水杨酸和脱落酸在植物对灰霉病的抗性中作用复杂,其可能和植物的种类、灰葡萄孢侵染的阶段、受侵染的组织等相关[31]。大量研究已证明,乙烯合成途径关键酶ACO基因表达量提高是乙烯产生增加的重要指标[32-33],植株遭受病原菌侵染后,乙烯合成途径被激活,产生大量乙烯[34-35],随着乙烯水平的上升,下游抗性相关基因的表达也增强[36-37]。本研究中番茄植株在外源施用亚油酸乙醇胺并接种病原菌后,乙烯信号路径相关基因大量表达(图 3-A),与已经报道的免疫反应模式一致。已有研究表明拟南芥乙烯不敏感(、)和乙烯受体()突变体因改变了乙烯信号而导致其对灰葡萄孢的敏感性,过表达则增强了拟南芥植株对灰葡萄孢的抗性[38],番茄蛋白激酶TPK1b介导了乙烯信号路径参与的防御作用[39],这些结果均表明,乙烯信号通路在植株对灰霉病的防御中发挥着重要作用。本研究发现,在番茄乙烯信号转导突变体植株上外源施用亚油酸乙醇胺后再接种病原菌,削弱了亚油酸乙醇胺对灰葡萄孢的抗性作用(图4),推测亚油酸乙醇胺诱导的抗病性依赖于乙烯信号通路。
研究表明,乙烯和茉莉酸信号通路在灰霉病抗性中具有协同作用,乙烯和茉莉酸信号通路是相互关联的,茉莉酸甲酯(MeJA)能够诱导的表达,导致乙烯生成增加[28]。本试验中番茄植株在外源施用亚油酸乙醇胺后接种灰葡萄孢,叶片中乙烯含量显著增加,茉莉酸含量反而受到了一定程度的抑制,但较未接种灰葡萄孢的对照组相比,乙烯、茉莉酸含量均显著升高,且茉莉酸信号通路基因的转录表达上调(图3),可能也是乙烯/茉莉酸协同防御的一种表现。因此,在未来的研究中,还需要对茉莉酸信号通路及两者的调控网络展开进一步研究。
4 结论
外源施用亚油酸乙醇胺能够显著提高番茄光合作用和抗病基因的表达及内源激素乙烯的含量,有效诱导番茄植株对灰霉病的抗性。
[1] PANTHEE D R, CHEN F. Genomics of fungal disease resistance in tomato. Current Genomics, 2010, 11(1): 30-39.
[2] SINGH V K, SINGH A K, KUMAR A. Disease management of tomato through PGPB: current trends and future perspective. 3 Biotech, 2017, 7: 255.
[3] KUEHL F, JACOB T, GANLEY O, ORMOND R, MEISINGER M. The identification of-(2-hydroxyethyl)-palmitamide as a naturally occurring anti-inflammatory agent. Journal of the American Chemical Society, 1957, 79(20): 5577-5578.
[4] CHAPMAN K D, VENABLES B, MARKOVIC R, BLAIR R W, BETTINGER C.-acylethanolamines in seeds. Quantification of molecular species and their degradation upon imbibition. Plant Physiology, 1999, 120(4): 1157-1164.
[5] VENABLES B J, WAGGONER C A, CHAPMAN K D.- acylethanolamines in seeds of selected legumes. Phytochemistry, 2005, 66(16): 1913-1918.
[6] BLANCAFLOR E B, CHAPMAN K D. Similarities between endocannabinoid signaling in animal systems and-acylethanolamine metabolism in plants//BALUSKA F, MANCUSO S, VOLKMANN D. Communication in Plants: neuronal aspects of plant life. Florence, Italy: Springer, 2006: 205-219.
[7] CHAPMAN K D. Occurrence, metabolism, and prospective functions of-acylethanolamines in plants. Progress in Lipid Research, 2004, 43(4): 302-327.
[8] TRIPATHY S, VENABLES B, CHAPMAN K D.-acylethanolamines in signal transduction of elicitor perception. Attenuation of alkalinization response and activation of defense gene expression. Plant Physiology, 1999, 121(4): 1299-1308.
[9] BLANCAFLOR E B, HOU G, CHAPMAN K D. Elevated levels of-lauroylethanolamine, an endogenous constituent of desiccated seeds, disrupt normal root development inseedlings. Planta, 2003,217(2): 206-217.
[10] MOTES C M, PECHTER P, YOO C M, WANG Y S, CHAPMAN K D, BLANCAFLOR E B. Differential effects of two phospholipase D inhibitors, 1-butanol and-acylethanolamine, oncytoskeletal organization andseedling growth. Protoplasma, 2005,226(3/4): 109-123.
[11] TEASTER N D, MOTES C M, TANG Y H, WIANT W C, COTTER M Q, WANG Y S, KILARU A, VENABLES B J, HASENSTEIN K H, GONZALEZ G, BLANCAFLOR E B, CHAPMAN K D.- acylethanolamine metabolism interacts with abscisic acid signaling inseedlings.ThePlant Cell, 2007, 19(8): 2454-2469.
[12] KIM S C, KANG L, NAGARAJ S, BLANCAFLOR E B, MYSORE K S, CHAPMAN K D. Mutations infatty acid amide hydrolase reveal that catalytic activity influences growth but not sensitivity to abscisic acid or pathogens. The Journal of Biological Chemistry, 2009, 284(49): 34065-34074.
[13] ZHANG Y, GUO W M, CHEN S M, HAN L, LI Z M. The role of-lauroylethanolamine in the regulation of senescence of cut carnations (). Journal of Plant Physiology, 2007, 164(8): 993-1001.
[14] CHAPMAN K D, TRIPATHY S, VENABLES B, DESOUZA A D.-acylethanolamines: formation and molecular composition of a new class of plant lipids. Plant Physiology,1998, 116(3): 1163-1168.
[15] KANG L, WANG Y S, UPPALAPATI S R, WANG K, TANG Y, VADAPALLI V, VENABLES B J, CHAPMAN K D, BLANCAFLOR E B, MYSORE K S. Overexpression of a fatty acid amide hydrolase compromises innate immunity in. The Plant Journal, 2008, 56(2): 336-349.
[16] SHRESTHA A, SCHIKORA A. AHL-priming for enhanced resistance as a tool in sustainable agriculture. FEMS Microbiology Ecology, 2020, 96(12): fiaa226.
[17] HU Z J, SHAO S J, ZHENG C F, SUN Z H, SHI J Y, YU J Q, QI Z Y, SHI K. Induction of systemic resistance in tomato againstbydecanoyl-homoserine lactone via jasmonic acid signaling. Planta, 2018, 247(5): 1217-1227.
[18] EL OIRDI M, ABD EL RAHMAN T, RIGANO L, EL HADRAMI A, RODRIGUEZ M C, DAAYF F, VOJNOV A, BOUARAB K.manipulates the antagonistic effects between immune pathways to promote disease development in tomato. The Plant Cell, 2011, 23(6): 2405-2421.
[19] 蔡银杰, 周小林, 杨献娟, 曹均尧, 冒锦富. 大棚番茄灰霉病发生的影响因子初步研究. 中国植保导刊, 2007, 27(10): 21-23.
CAI Y J, ZHOU X L, YANG X J, CAO J Y, MAO J F. A preliminary analysis on the factors affectingin green house. China Plant Protection, 2007, 27(10): 21-23. (in Chinese)
[20] SUN Y J, GENG Q W, DU Y P, YANG X H, ZHAI H. Induction of cyclic electron flow around photosystem I during heat stress in grape leaves. Plant Science, 2017, 256: 65-71.
[21] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod. Methods, 2001, 25(4): 402-408.
[22] WU J Q, HETTENHAUSEN C, MELDAU S, BALDWIN I T. Herbivory rapidly activates MAPK signaling in attacked and unattacked leaf regions but not between leaves of. The Plant Cell, 2007, 19(3): 1096-1122.
[23] ZHANG S, LI X, SUN Z H, SHAO S J, HU L F, YE M, ZHOU Y H, XIA X J, YU J Q, SHI K. Antagonism between phytohormone signalling underlies the variation in disease susceptibility of tomato plants under elevated CO2. Journal of Experimental Botany, 2015, 66(7): 1951-1963.
[24] ALGER B E. Endocannabinoids: getting the message across. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(23): 8512-8513.
[25] KILARU A, TAMURA P, ISAAC G, WELTI R, VENABLES B J, SEIER E. CHAPMAN K D. Lipidomic analysis of- acylphosphatidylethanolamine molecular species insuggests feedback regulation by-acylethanolamines. Planta, 2012, 236(3): 809-824.
[26] KEEREETAWEEP J, BLANCAFLOR E B, HORNUNG E, FEUSSNER I, CHAPMAN K D. Ethanolamide oxylipins of linolenic acid negatively regulatesseedling development. The Plant Cell, 2013, 25(10): 3824-3840.
[27] 杜颖, 付丹妮, 邹益泽, 白雪松, 姜震, 程攻, 纪明山, 祁之秋. 2017年辽宁省番茄灰霉菌对腐霉利的抗药性现状及机制研究. 中国蔬菜, 2018(1): 58-65.
DU Y, FU D N, ZOU Y Z, BAI X S, JIANG Z, CHENG G, JI M S, QI Z Q. Studies on drug resistance of tomatoto procymidone at Liaoning Province in 2017. China Vegetables, 2018(1): 58-65. (in Chinese)
[28] ABUQAMAR S, MOUSTAFA K, TRAN L S. Mechanisms and strategies of plant defense against. Critical Reviews in Biotechnology, 2017, 37(2): 262-274.
[29] BROOKS D M, BENDER C L, KUNKEL B N. Thephytotoxin coronatine promotes virulence by overcoming salicylic acid-dependent defences in. Molecular Plant Pathology, 2005, 6(6): 629-639.
[30] GRANT M, LAMB C. Systemic immunity. Current Opinion in Plant Biology, 2006, 9(4): 414-420.
[31] 张燕, 夏更寿, 赖志兵. 植物抗灰霉病分子机制的研究进展. 生物技术通报, 2018, 34(2): 10-24.
ZHANG Y, XIA G S, LAI Z B. Rencent advances in molecular mechanisms of plant responses against. Biotechnology Bulletin, 2018, 34(2): 10-24. (in Chinese)
[32] KENDE H. Ethylene biosynthesis. Annual review of plant physiology and plant molecular biology, 1993, 44: 283-307.
[33] YANG S F, HOFFMAN N E. Ethylene biosynthesis and its regulation in higher plants. Annual Review of Plant Physiology, 1984, 35: 155-189.
[34] BROEKAERT W F, DELAURE S L, DE BOLLE M F C, CAMMUE B P A. The role of ethylene in host-pathogen interactions. Annual Review of Phytopathology, 2006, 44: 393-416.
[35] TSUCHISAKA A, YU G X, JIN H L, ALONSO J M, ECKER J R, ZHANG X M, GAO S, THEOLOGIS A. A combinatorial interplay among the 1-aminocyclopropane-1-carboxylate isoforms regulates ethylene biosynthesis in. Genetics, 2009, 183(3): 979-1003.
[36] PENNINCKX I A, THOMMA B P, BUCHALA A, METRAUX J P, BROEKAERT W F. Concomitant activation of jasmonate and ethylene response pathways is required for induction of a plant defensin gene in., 1998, 10(12): 2103-2113.
[37] COHN J R, MARTIN G B.pv.type III effectors AvrPto and AvrPtoB promote ethylene-dependent cell death in tomato., 2005, 44(1): 139-154.
[38]
[39]
The role and mechanism of Linoleyl ethanolamide in Plant resistance againstin tomato
SHAO Shujun, HU Zhangjian, SHI Kai
College of Agriculture and Biotechnology, Zhejiang University, Hangzhou 310058
【】Gray mold caused byis one of the important diseases of tomato and causes significant yield losses up to 30%-40%. Nowadays, chemical pesticide is usually used in tomato production, which is effective but increases the risk of food safety and results in environmental pollution.-acylethanolamines (NAEs) are a kind of naturally lipid bioactive compounds in plants, which have been identified to have a variety of immune functions in mammals, however, its function and the underlying mechanism in plant immunity are still unclear.】The objective of this study is to investigate the effects of NAEs on tomato plant defense againstinfection, and to provide a basis for the development of green control technology of tomato gray mold.】Thewas cultured in medium containing NAE 18:0, NAE 18:2, NAE 22:5, respectively, to evaluate their effects ongrowth. Tomato ‘Moneymaker’ plants were infected bywith or without exogenous NAE 18:0, NAE 18:2, NAE 22:5, and disease index and fluorescence parameters of tomato leaves were measured. qRT-PCR was used to analyze the relative gene expression ofin tomato leaves that infected bywith or without NAE 18:2 treatment. Transcript abundance of defense-related genes (e.g.,-,,,,), and contents of plant hormones (e.g.JA, SA, ETH, ABA, IAA) were measured. Fluorescence parameters of tomato leaves and the relative gene expression ofwere analyzed in ethylene-insensitive mutant infected bywith NAE 18:2.【】The growth ofwas not affected by exogenous NAEs treatment duringculture. Exogenous application of NAEs could significantly improve the resistance of tomato plants to, and alleviate the decrease of photosystem II photochemical efficiency (ΦPSII) caused byinfection. NAE 18:2 had the best effect on tomato plant defense againstamong the NAEs, which obviously reduced the disease index and thetranscript level ofby 60%. The expression levels of,-,,andcould be induced byinfection but not by NAE 18:2 treament. The expression levels of,andwere up-regulated when plants were pre-treated by NAE 18:2 beforeinfection, and the expression level ofwas the highest. Compared to the control, the contents of SA , JA, IAA and ETH in the leaves were increased significantly afterinfection, while only the contents of ETH were further increased when pre-treated by NAE 18:2. Moreover, exogenous NAE 18:2 pre-treatment could not improve the defense againstin the ETH-insensitive.【】Exogenous NAE18:2 treatment can increase leaf photosynthesis, transcript abundance of defense-related genes, and the content of plant hormone ETH. It induce the resistance of tomato plants to gray mold, which may depend on the ETH signaling pathway.
tomato;-acylethanolamines (NAE); linoleyl ethanolamide (NAE 18:2);gray mold;; ethylene (ETH)

10.3864/j.issn.0578-1752.2022.09.007
2021-11-06;
2021-12-10
国家自然科学基金(32172650)、浙江省重点研发计划(2021C02040)
邵淑君,E-mail:ssjun@zju.edu.cn。通信作者师恺,E-mail:kaishi@zju.edu.cn
(责任编辑 岳梅)

