苦荞愈伤遗传转化体系的优化及用于FtCHS1的过表达分析
赵海霞,肖欣,董玘鑫,吴花拉,李成磊,吴琦
苦荞愈伤遗传转化体系的优化及用于的过表达分析
赵海霞,肖欣,董玘鑫,吴花拉,李成磊,吴琦
四川农业大学生命科学学院,四川雅安 625014
【】建立和优化苦荞愈伤组织遗传转化体系,为苦荞基因功能验证及分子育种提供研究工具。以苦荞品种“西荞二号”为材料,对苦荞愈伤遗传转化条件进行优化,包括苦荞外植体类型、诱导愈伤的激素比例、继代培养基的激素比例及农杆菌类型。利用苦荞类黄酮生物合成关键酶基因的过表达验证优化后的遗传转化体系。通过PCR筛选和荧光观察鉴定阳性株系,采用紫外分光光度法和高效液相色谱法(high performance liquid,HPLC)测定花青素及黄酮醇支路代谢物含量,使用实时荧光定量PCR分析类黄酮合成相关基因的表达,比较过表达愈伤组织与对照组的差异。苦荞诱导愈伤组织的最佳外植体为下胚轴,其最适诱导培养基为MS+0.8 mg·L-16-BA+3.5 mg·L-12,4-D,诱导率达72%;最优继代培养基为MS+3 mg·L-16-BA+1 mg·L-1KT,愈伤组织增殖率与增殖系数分别为98%和1.09;转化过程中的最佳农杆菌是GV3101,转化效率达31.3%;过表达愈伤组织中,花青素、芦丁和杨梅素的含量显著高于对照(<0.05),山奈酚和槲皮素的含量极显著高于对照组(<0.01);外源的过表达对转基因愈伤组织中5个内源同源基因的表达水平没有影响(>0.05),而、、、、和等黄酮合成途径关键酶基因均上调表达(<0.05)。此外,特异性正调控黄酮醇合成的转录因子基因和上调表达,而花青素合成抑制子基因的表达降低(<0.05)。建立了苦荞愈伤组织遗传转化体系,过表达的苦荞愈伤组织通过上调黄酮合成相关基因的表达增加类黄酮物质的积累。
苦荞;愈伤组织;遗传转化;查尔酮合酶基因
0 引言
1 材料与方法
1.1 植物材料及生长条件
苦荞品种“西荞二号”由西昌学院王安虎教授惠赠。用75%酒精和0.1%氯化汞消毒苦荞种子,置于1/2 MS培养基(0.7%琼脂、2.37 g·L-1MS和3%蔗糖,pH=5.8)上,在光照培养箱中培养10—12 d(光照培养12 h,暗培养12 h,光照强度2.0 klx,25℃),获得苦荞幼苗。
1.2 苦荞愈伤组织的诱导
选择生长良好的苦荞幼苗子叶和下胚轴(距子叶节及根各1 cm的中段部分)作为外植体,子叶/下胚轴切成0.5 cm×0.5 cm小片/0.5 cm小段,置于25种不同激素配比的MS培养基(MS+0.2—1.0 mg·L-16-BA+2.0—4.0 mg·L-12,4-D)上诱导愈伤组织(电子附表1),共5个重复,每个重复10个外植体,并于第10天统计诱导率。成功诱导愈伤组织后,置于9种继代培养基(MS+2.0—4.0 mg·L-16-BA+1.0—3.0 mg·L-1KT)上培养(电子附表1),共3个重复,每个重复20个愈伤组织,观察其生长增殖情况,于第25天统计增殖率和增殖系数。上述试验均在光照16 h/黑暗8 h,25℃条件下进行。
愈伤组织诱导率=愈伤组织形成数/所有外植体×100%;
愈伤组织增殖率=可增殖的愈伤组织总数/所有愈伤组织×100%;
增殖系数=增殖后重量/增殖前重量。
1.3 菌液的制备及侵染
为了探究不同种类根癌农杆菌对转化率的影响,分别以根癌农杆菌株系GV3101和C58C1侵染外植体。将根癌农杆菌(已转入pCHF3-YFP质粒)在含80 mg·L-1抗生素(利福平/壮观霉素)的YEB固体培养基(1.5%琼脂),28℃黑暗养2 d。根据pCHF3-YFP载体MCS两端序列设计引物MYFP-F/MYFP-R(电子附表2),通过菌落PCR鉴定阳性克隆。将单一阳性农杆菌菌株接种于20 mL YEB液体培养基中,添加80 mg·L-1抗生素(利福平/壮观霉素),28℃振荡(180 r/min)培养。当根癌农杆菌OD600=1.5时,取1 mL菌液,置于添加80 mg·L-1抗生素(利福平/壮观霉素)50 mL YEB液体培养基中扩培至OD600=0.6。扩培后的农杆菌菌液离心(4 000 r/min)5 min,用1/2 MS液体培养基(含200 mmol·L-1乙酰丁香酮)重悬至OD600=0.3。用重悬菌液侵染苦荞子叶/下胚轴20 min,将外植体置于滤纸上,30 s吸干侵染液,移至MS愈伤诱导培养基,25℃黑暗培养3 d。后用无菌水(含300 mg·L-1头孢噻肟)清洗子叶/下胚轴3—5次,滤纸吸干多余水分,置于MS愈伤诱导培养基(含300 mg·L-1头孢噻肟)培养10 d。
1.4 阳性愈伤组织的筛选及鉴定
将诱导出的愈伤组织移至MS继代培养基(含50 mg·L-1卡那霉素)培养,无菌培养30 d,其间每隔15 d更换培养基,并淘汰褐化愈伤组织。待愈伤组织直径达3—5 cm时,通过CTAB法提取苦荞愈伤组织的基因组DNA[18]。使用特异性引物MYFP-F/ MYFP-R通过PCR鉴定阳性愈伤组织(电子附表1)。同时,在蓝色激发光(420—485 nm)条件下,通过荧光显微镜(奥林巴斯BX53)观察愈伤组织的YFP信号。
转化率=阳性愈伤组织数/所有外植体×100%。
如图3所示,LPS刺激能显著造成Caco-2细胞中MLCK 的转录水平升高(p<0.05)。而辣木多肽能够抑制模型细胞中MLCK的转录水平。与模型组相比,高浓度(100 μg/mL和150 μg/mL)的辣木多肽可显著抑制MLCK的 mRNA转录水平(抑制率分别为 28.0%和31.3%)。肌球蛋白轻链激酶(MLCK)能够通过促肌球蛋白轻链(MLC)的磷酸化使其参与肌动蛋白收缩,引发细胞骨架重排,破坏细胞TJ结构,最终造成细胞间通透性增高[21]。抑制肠上皮细胞中MLCK的过度活化,对于维持肠上皮细胞屏障和细胞间紧密连接的重要作用[22]。
1.5 苦荞过表达FtCHS1愈伤组织的制备
基于苦荞基因组和转录组数据[2],设计特异性引物(FtCHS1-F-KpnⅠ/FtCHS1-R-ScalⅠ),以苦荞叶cDNA为模板,通过RT-PCR扩增获得()的开放阅读框(open reading frame,ORF,电子附表2),并将其克隆到pCHF3-YFP质粒中。参照1.3方法,使用含有pCHF3--YFP质粒的根癌农杆菌侵染下胚轴,并参照1.4方法鉴定阳性愈伤组织。含有空白/空载体(pCHF3-YFP)根癌农杆菌作为试验对照组。
1.6 HPLC法测定愈伤组织中黄酮醇含量
将苦荞愈伤组织(1 g)经液氮冷冻10 min,研磨成细粉。用50 ml甲醇萃取2次,4℃保存24 h。60℃干燥后,加入10 mL甲醇,用0.45 µm有机滤膜过滤收集滤液,并加入2倍体积的甲醇稀释。使用安捷伦1260型高效液相色谱仪(长沙科美分析仪器有限公司),采用高效液相色谱法(high performance liquid chromatography,HPLC)分析槲皮素、山奈酚、杨梅素和芦丁等黄酮醇的含量,色谱柱为C18(250×4.6 mm,5 μm),柱温30℃,检测波长为260 nm,进样体积为20 µL,流速为1 mL·min-1。流动相A为乙腈,流动相B为水。梯度洗脱条件为0—20 min,乙腈从40%逐步上调至65%,水从60%逐步下调至35%。槲皮素、山奈酚、杨梅素和芦丁的标品购自南京源植生物技术有限公司。
1.7 愈伤组织中花青素的测定
将新鲜愈伤组织液氮冷冻研磨成粉,取2 g粉末溶于10 mL酸性甲醇(1%盐酸,v/v)。100 r/min,25℃黑暗振荡18 h。4℃12 000 r/min离心15 min后,取5 mL上清液转移到新离心管中。加入5 mL去离子水和3 mL氯仿,4℃ 9 000 r/min离心5 min,取5 mL上清液转移到新离心管中。测定样品530和657 nm吸光值。计算公式如下:花青素含量=(A530-0.25×A657)×M-1(A530为530 nm吸光值,A657为657 nm吸光值,M单位为g),每个样品3个独立生物学重复。
1.8 愈伤组织中类黄酮合成相关基因的表达量测定
使用RNeasy Plant Mini试剂盒(Aidlab Biotech,Beijing,China)提取苦荞愈伤组织总RNA,使用ReverTra Ace(Toyobo,Osaka,Japan)反转录为cDNA。利用实时荧光定量PCR测定类黄酮合成及其调节基因的表达水平,包括5个苦荞FtCHSs同源基因(、、、和、(GenBank:KF831243)、(GenBank:JF274262)、(GenBank:JX401285)、(GenBank:KJ094503)、(GenBank:GU169468)、(GenBank:LC216399)、(GenBank:MK128409)[19]、[20]和[21](GenBank:MT333222.1)。使用Premier5软件设计上述基因引物,管家基因(GenBank:HM628903)作为内参基因(电子附表2)。使用SYBR Premix EX Taq试剂盒(TaKaRa,Japan)及CFX Connect系统进行qRT-PCR。反应条件为95℃ 3 min;95℃ 15 s,60℃ 15 s,72℃ 20 s,40个循环。使用2−ΔΔCT法进行数据分析。
2 结果
2.1 不同激素组合及不同外植体对苦荞愈伤组织诱导率的影响
参考之前报道的方法[22],以25种不同激素组合诱导苦荞下胚轴和子叶产生愈伤组织(图1)。处理组C19(MS+0.8 mg·L-16-BA+3.5 mg·L-12,4-D)、C20(MS+0.8 mg·L-16-BA+4 mg·L-12,4-D和C22(MS+1 mg·L-16-BA+2.5 mg·L-12,4-D)可获得更多的愈伤组织(<0.05),愈伤组织诱导率分别达到72%、66%和66%(图1)。与下胚轴相比,苦荞子叶的诱导率更低(0—6%)。
以上结果表明,下胚轴是苦荞愈伤组织诱导的最佳材料,故下胚轴被用于后续试验。上述3种处理均可用于确定不同农杆菌菌株对愈伤组织诱导的影响。

C1—C25:25种不同愈伤诱导激素组合(电子附表1);不同字母代表差异显著(P<0.05),误差棒表示±SDs。下同
2.2 苦荞愈伤组织继代培养
为了获得足够的愈伤组织材料进行后续试验,设置S1—S9共9组添加了不同激素配比的培养基进行愈伤组织的继代培养[9](电子附表1)。继代培养5 d后,整个愈伤组织开始膨胀(图2-A)。继代25 d后统计增殖率及增殖系数。结果表明,处理组S4在继代培养25 d后具有最高的增殖率(98%)和增殖系数(1.09),其余各组增殖系数和增殖率显示出相同的变化趋势(图2-B和图2-C)。由此可知,处理组S4(MS+3 mg·L-16-BA+1 mg·L-1KT)所用激素组合是愈伤组织继代培养的最佳配比。
2.3 不同根癌农杆菌对愈伤组织诱导的影响
含pCHF3-YFP质粒的2种根癌农杆菌菌株GV3101和C58C1用于苦荞下胚轴侵染,使用处理组C19、C20和C22的激素组合对侵染过的外植体进行愈伤诱导并在处理组S4的条件下继代筛选(电子附表1)。结果显示,在6个处理中,农杆菌GV3101侵染下胚轴的转化率最高,达31.3%,且侵染后的下胚轴色泽健康呈淡黄色(图3-A)。农杆菌C58C1侵染过的下胚轴,则表现出较低的转化率(16%—24%),下胚轴产生明显褐化(图3-A和图3-B)。
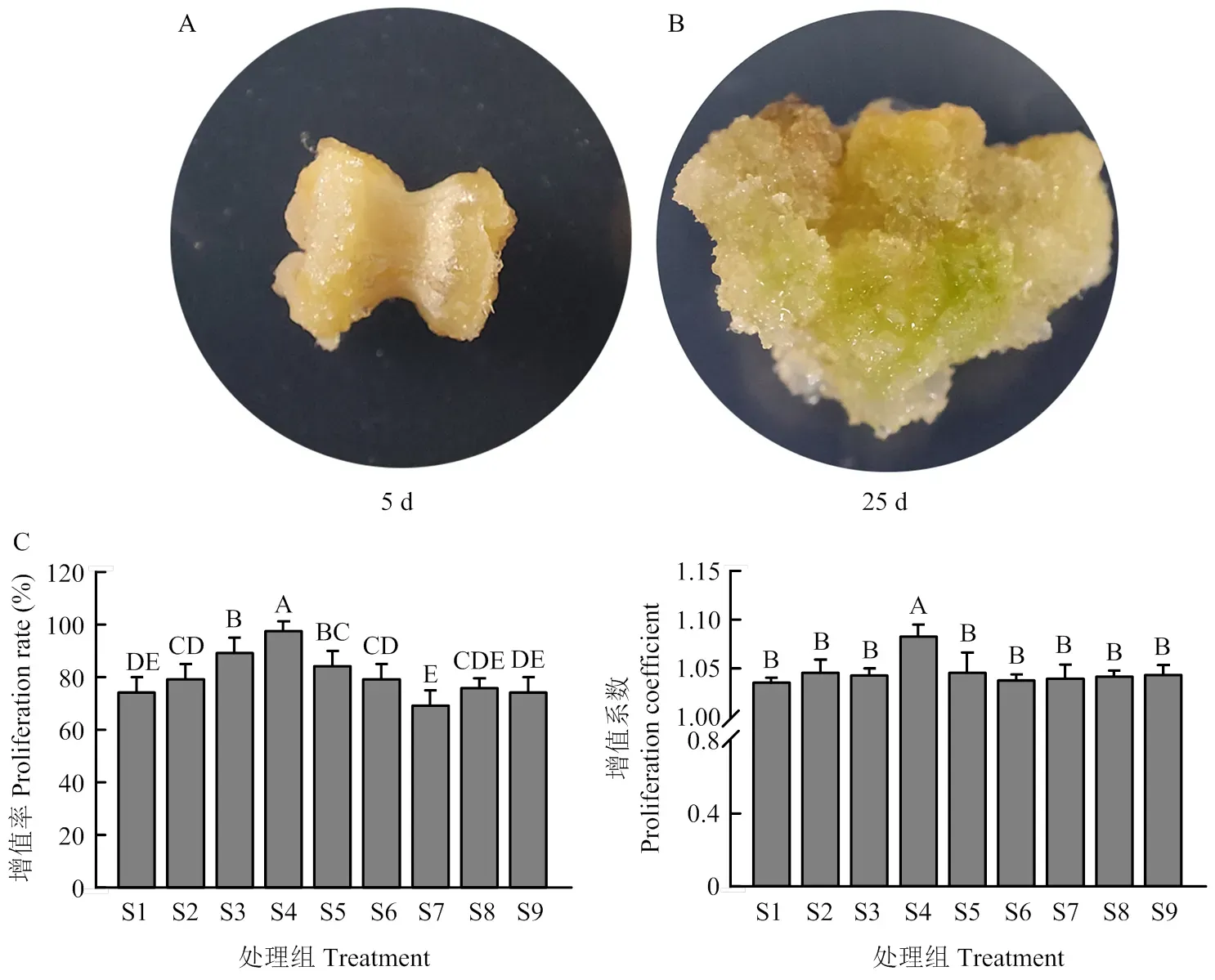
A:在继代培养处理组S4条件下培养5和25 d的愈伤组织;B:不同继代条件下的愈伤组织增殖率;C:不同处理后的愈伤组织增殖系数。S1—S9:9种不同继代激素组合(电子附表1)

A:农杆菌GV3101/C58C1侵染下胚轴7 d后表型;B:C19、C20和C22 3种处理下的转化率
因此,选择农杆菌GV3101作为苦荞外植体侵染菌株,以处理组C19诱导条件诱导愈伤组织,在处理组S4条件下继代可作为遗传转化体系的优化方案。
2.4 苦荞FtCHS1的克隆及转基因苦荞愈伤组织的获得
从苦荞叶cDNA中扩增出约1.2 kb的ORF(已去除终止密码子),构建植物表达载体pCHF3--YFP(图4-A)。用含有pCHF3--YFP质粒的农杆菌GV3101侵染下胚轴,在C19(3.5 mg·L-12,4-D+0.8 mg·L-16-BA)条件下培养7 d,其中,转基因组在愈伤组织诱导阶段呈现明显的红色(图4-B)。当愈伤组织直径达3—5 cm时,采用特异性PCR引物(MYFP-F/MYFP-R)鉴定7个株系,结果均为阳性(图4-C)。在荧光显微镜下,与对照组相比,试验组呈现明显的黄色荧光(图4-D)。经荧光定量PCR检测外源的表达水平,筛选出表达量最高的#1、#3和#6等3个株系用于后续试验(图4-F)。在继代培养期间,试验组和对照组之间的增殖率无明显差异(图4-E,>0.05),但后15 d转基因愈伤组织的增殖系数高于对照组(图4-G)。

A:pCHF3-FtCHS1-YFP结构图;B:GV3101农杆菌侵染下胚轴侵染5 d后表型,#1、#2和#3为不同株系;C:转基因愈伤组织的PCR鉴定;D:愈伤组织荧光检测;E:不同愈伤组织增殖率;F:转基因愈伤组织和对照组愈伤组织中FtCHS1表达量;G:继代培养0—5 d、10—15 d、15—20 d和20—25 d愈伤组织增殖系数。**P<0.01;*P<0.05。下同
2.5 过表达FtCHS1对苦荞黄酮含量的影响
为了确定过表达对愈伤组织中类黄酮含量的影响,测定黄酮醇和花青素的积累情况。结果表明,在转基因愈伤组织中,槲皮素和山奈酚含量极显著高于对照组(<0.01),芦丁和杨梅素含量也较对照组有所增加(<0.05,图5-A)。此外,所有阳性株系中的花青素含量也比对照组高约40%(<0.05,图5-B)。

A:转基因愈伤组织中黄酮醇(芦丁、山奈酚、槲皮素和杨梅素)含量的测定;B:测定转基因愈伤组织中花青素含量
2.6 过表达FtCHS1对苦荞黄酮合成相关基因的影响
基于荧光定量PCR的基因表达水平分析,表明过表达的外源对其同源基因的表达没有显著影响(>0.05,图6-A),但影响了其他黄酮合成相关基因的表达。其中,黄酮醇合成支路关键酶基因和的表达水平显著高于对照组(<0.01),、3和花青素支路的表达也显著上调(<0.05),但的表达却被下调(<0.05,图6-B)。此外,还对归属转录因子R2R3-MYB家族SG7亚组中的黄酮醇特异性正转录因子基因和的表达均显著上调增加(<0.05,<0.01),而归属SG4亚组中花青素抑制性转录因子基因的表达显著下调(<0.05,图6-C)。说明从转录水平上支持了过表达转基因愈伤组织中黄酮含量的变化结果。
3 讨论
3.1 建立苦荞愈伤遗传转化体系的重要性
苦荞富含黄酮且耐贫瘠,是研究黄酮代谢分子机制及逆境响应的理想植物。因此,利用苦荞基因开展相关研究的报道并不少见,如、和等的异位表达可调控烟草或拟南芥中类黄酮的合成[5, 19-20],、及等基因转入拟南芥后增强了其对干旱和盐的耐受性[6, 23-24]。但此类研究多在异源植物中进行,难以反映这些基因在苦荞中的真实生物学效应。因此,回归苦荞进行基因功能验证,一直是苦荞研究工作者所急于攻克的难点,而建立稳定的遗传转化体系就是突破的关键。得益于毛状根技术的发展,基于毛状根的遗传转化体系逐渐成为研究苦荞基因的常用工具[25-27]。但毛状根分化潜力低,难以据此获得完整植株。而愈伤组织作为一种具有多能性或全能性的细胞团,较毛状根而言更具分化潜力,以此建立遗传转化体系,不仅回归了本植物,还可降低后续转基因植株获取难度。
3.2 影响苦荞愈伤组织遗传转化的因素
本研究优化了苦荞愈伤组织的遗传转化条件。苦荞下胚轴的愈伤组织诱导率高于子叶,这与前人研究相符[28]。激素配比是诱导愈伤组织形成的关键,不同苦荞品种对激素的敏感程度可能存在差异,从而导致不同苦荞品种的最佳愈伤组织诱导激素组合不同[29]。本研究以苦荞“西荞二号”下胚轴为外植体时,在MS培养基中添加0.8 mg·L-16-BA及3.5 mg·L-12,4-D时,可达到最佳的诱导效果,继代培养基里6-BA与KT含量分别为3和1 mg·L-1时,愈伤组织增殖效果最好,有别于前人报道的九江苦荞及园子荞[11, 28]。此外,不同农杆菌菌株会根据目标植物种类的不同,表现出不同的毒性强弱,从而导致侵染效率的差异[30]。例如,小果咖啡中GV3101菌株侵染效率高于LBA4404菌株[31],苹果中EHA101菌株侵染效率优于LBA4404菌株和C58C1菌株[32]。本研究结果显示,GV3101菌株相较于C58C1菌株侵染效率更高,更适于苦荞的遗传转化。综上所述,本研究初步建立了稳定的苦荞愈伤组织遗传转化体系,并成功获得了过表达的阳性苦荞转基因愈伤组织。此外,先前的研究表明愈伤组织的再分化需要外源激素诱导,6-BA与IAA、NAA和KT的多种组合添加到分化培养基里可诱导苦荞愈伤组织芽的产生[10-11, 28]。但适用于本研究遗传转化体系的分化培养基还需进一步探索。

A:FtCHSs基因;B:类黄酮代谢分支酶基因;C:SG7亚家族转录因子基因和SG4类亚家族转录因子基因
A: FtCHSs gene; B: flavonoid metabolic branch enzyme genes; C: SG7 subfamily transcription factors genes and SG4-like gene subfamily transcription factor
图6 过表达愈伤组织中黄酮合成相关基因的表达量分析
Fig. 6 Expression analysis of flavonoid synthesis related genes in overexpressedcallus
3.3 FtCHS1促进类黄酮积累的机制
查尔酮合酶作为植物类黄酮合成途径中的第一个关键酶,在黄酮类化合物合成起重要作用[33-34]。本研究中,过表达转基因愈伤组织均增加了黄酮醇和花青素含量,、、和等其他黄酮合成途径酶基因也在转录水平显著增强,表明的过表达可以可通过调节上游代谢流量来促进下游黄酮醇和花青素的生物合成。查尔酮合酶基因的转录活性通常由转录因子调节,尤其是R2R3-MYB转录因子家族[35-36]。本研究表明,过表达还可以反向影响相关R2R3-MYB基因的表达水平,即分别上调正控黄酮醇合成SG7亚家族成员和下调负控花青素合成SG4亚家族成员的表达[21-22]。可见,过表达可能对苦荞黄酮代谢具有更为复杂的生物学效应,有待进一步深入解析。
4 结论
通过对苦荞愈伤组织遗传转化体系条件的优化,建立了稳定有效的转基因苦荞愈伤组织诱导体系。过表达的愈伤组织可以通过调节类黄酮相关基因的表达来促进黄酮醇和花青素的积累。
[1] ZHANG L J, LI X X, MA B, GAO Q, DU H, HAN Y H, LI Y, CAO Y H, QI M, ZHU Y X, LU H W, MA M C, LIU L L, ZHOU J P, NAN C H, QIN Y J, WANG J, CUI L, LIU H M, LIANG C Z, QIAO Z J. The tartary buckwheat genome provides insights into rutin biosynthesis and abiotic stress tolerance. Molecular Plant, 2017, 10(9): 1224-1237.
[2] ZHANG X M, ZHAO L, LARSON-RABIN Z, LI D Z, GUO Z H, NITABACH M N.sequencing and characterization of the floral transcriptome of(Poaceae: Bambusoideae). Plos One, 2012, 7(8): e42082.
[3] GAO F, YAO H P, ZHAO H X, ZHOU J, LUO X P, HUANG Y J, LI C L, CHEN H, WU Q. Tartary buckwheat FtMYB10 encodes an R2R3-MYB transcription factor that acts as a novel negative regulator of salt and drought response in transgenic. Plant Physiology and Biochemistry, 2016, 109: 387-396.
[4] ZHOU H, WANG K L, WANG F R, ESPLEY R V, REN F, ZHAO J N, OGUTU C, HE H P, JIANG Q, ALLAN A C, HAN Y P. Activator- type R2R3-MYB genes induce a repressor-type R2R3-MYB gene to balance anthocyanin and proanthocyanidin accumulation. New Phytologist, 2018, 221(4): 1919-1934.
[5] YAO P F, ZHAO H X, LUO X P, GAO F, LI C L, YAO H P, CHEN H, PARK S U, WU Q.FtWD40 functions as a positive regulator of anthocyanin biosynthesis in transgenic tobacco.Journal of Plant Growth Regulation, 2017, 36(3): 755-765.
[6] Lü B B, WU Q, WANG A H, LI Q, DONG Q X, YANG J J, ZHAO H X, WANG X L, CHEN H, LI C L. A WRKY transcription factor, FtWRKY46, from tartary buckwheat improves salt tolerance in transgenic. Plant Physiology and Biochemistry, 2020, 147: 43-53.
[7] Yamane Y. Induced differentiation of buckwheat plants from subcultured calluses. Japanese Journal of Genetics, 1974, 49(3): 139-146.
[8] LEE S Y, KIM Y KY, UDDIN M R, PARK N I, PARK S U. An efficient protocol for shoot organogenesis and plant regeneration of buckwheat (Moench.). Romanian Biotechnological Letters, 2009, 14(4): 4524-4529.
[9] Kwon S J, Han M H, Huh Y S, Roy S K, Lee C W, Woo S H. Plantlet regeneration via somatic embryogenesis from hypocotyls of common buckwheat (Moench.). Korean Journal of Crop Science, 2013, 58(4): 331-335.
[10] HAN M H, KAMAL A H, HUH Y S, JEON A Y, BAE J S, CHUNG K Y, LEE M S, PARK S U, JEONG H S, WOO S H. Regeneration of plantlet via somatic embryogenesis from hypocotyls of tartary buckwheat (). Australian Journal of Crop Science, 2011, 5(7): 865-869
[11] HOU S Y, SUN Z X, HU B L, WANG Y G, HUANG K S, XU D M, HAN Y H. Regeneration of buckwheat plantlets from hypocotyl and the influence of exogenous hormones on rutin content and rutin biosynthetic gene expression. Plant Cell Tissue and Organ Culture, 2015, 120(3): 1159-1167.
[12] Jovanka M D, Mirjana N, Slavica N, Radomir C. Agrobacterium-mediated transformation and plant regeneration of buckwheat (Moench.). Plant Cell Tissue & Organ Culture, 1992, 29(2): 101-108.
[13] KOJIMA M, ARAI Y, IWASE N, SHIROTORI K, SHIOIRI H, NOZUE M. Development of a simple and efficient method for transformation of buckwheat plants () using. Bioscience Biotechnology & Biochemistry, 2000, 64(4): 845-847.
[14] KIM H S, KANG H J, LEE Y T, LEE S Y, KO J A, RHA E S. Direct regeneration of transgenic buckwheat from hypocotyl segment by agrobacterium-mediated transformation. Korean Journal of Crop Science, 2001, 46(5): 375-379.
[15] Chen L H, Zhang B, Xu Z Q. Salt tolerance conferred by overexpression ofvacuolar Na(+)/H(+) antiporter gene AtNHX1 in common buckwheat (). Transgenic Research, 2008,17(1): 121-132.
[16] 丰明, 陈庆富, 葛维德, 薛仁风. 抗旱调控基因DREB2A转化辽荞5号的研究. 东北农业科学, 2019, 44(4): 29-36.
FENG M, CHEN Q F, GE W D, XUE R F. Research on the drought-resistant regulatory genes DREB2A transforming the ‘Liao 5 Buckwheat’. Journal of Northeast Agricultural Sciences, 2019, 44(4): 29-36. (in Chinese)
[17] 李占旗. 苦荞离体再生体系的建立和遗传转化研究[D]. 西安: 西北大学, 2007.
LI Z Q. Establishment of plant regeneration system and genetic transformation of tartary buckwheat[D]. Xian: Northwest University, 2007. (in Chinese)
[18] SUN X M, CHEN X, DENG Z X, LI Y D. A CTAB-assisted hydrothermal orientation growth of ZnO nanorods. Materials Chemistry & Physics, 2003, 78(1): 99-104.
[19] HUANG Y J, WU Q, WANG S, SHI J Q, DONG Q X, YAO P F, SHI G N, XU S X, DENG R Y, LI C L, CHEN H, ZHAO H X. FtMYB8 from tartary buckwheat inhibits both anthocyanin/proanthocyanidin accumulation and marginal trichome initiation. BMC Plant Biology, 2019, 19(1): 263.
[20] 高飞. 苦荞光应答转录因子FtMYB5对黄酮合成的调控[D]. 成都: 四川农业大学, 2017.
GAO F. Tartary buckwheat light-induced transcription factor FtMYB5 involved in flavonoid biosynthesis regualtion[D]. Chengdu: Sichuan Agricultural University, 2017. (in Chinese)
[21] YAO P E, HUANG Y J, DONG Q X, WAN M, WANG A H, CHEN Y W, LI C L, WU Q, CHEN H, ZHAO H X. FtMYB6, a Light-Induced SG7 R2R3-MYB transcription factor, promotes flavonol biosynthesis in tartary buckwheat (). Journal of Agricultural and Food Chemistry, 2020, 68(47): 13685-13696.
[22] 王成龙. 苦荞毛状根的诱导及高频再生体系的建立[D]. 成都: 四川农业大学, 2015.
WANG C L. Induction hairy roots and established high-frequency plant regeneration system tartary buckwheat (Gaertn.) [D]. Chengdu: Sichuan Agricultural University, 2015. (in Chinese)
[23] 王官凤, 吕兵兵, 王安虎, 赵海霞, 王晓丽, 吴琦, 陈惠, 李成磊. 苦荞抗旱相关转录因子基因FtWRKY10的克隆及功能鉴定. 农业生物技术学报, 2020, 28(4): 629-644.
WANG G F, Lü B B, WANG A H, ZHAO H X, WANG X L, WU Q, CHEN H, LI C L. Cloning and functional identification of drought resistance related transcription factor gene FtWRKY10 from tartary buckwheat (). Journal of Agricultural Biotechnology, 2020, 28(4): 629-644. (in Chinese)
[24] LI Q, WU Q, WANG A H, LV B B, DONG Q X, YAO Y J, WU Q, ZHAO H X, LI C L, CHEN H, WANG X L. Tartary buckwheat transcription factor FtbZIP83 improves the drought/salt tolerance ofvia an ABA-mediated pathway. Plant Physiology and Biochemistry, 2019, 144: 312-323.
[25] 伍小方, 高国应, 左倩, 赵辉, 张凯旋, 严明理, 周美亮. FtMYB1转录因子调控苦荞毛状根黄酮醇合成的机理研究. 植物遗传资源学报, 2020, 21(5): 1270-1278.
WU X F, GAO G Y, ZUO Q, ZHAO H, ZHANG K X, YAN M L, ZHOU M L. Deciphering the functional basis of FtMYB1 transcription factor in flavonol biosynthesis of tartary buckwheat hairy root. Journal of Plant Genetic Resources, 2020, 21(5): 1270-1278. (in Chinese)
[26] 卢晓玲, 何铭, 张凯旋, 廖志勇, 周美亮. 苦荞鼠李糖基转移酶基因的克隆与转化毛状根研究. 作物杂志, 2020(5): 33-40.
LU X L, HE M, ZHANG K X, LIAO Z Y, ZHOU M L. Study on the cloning and transformation of rhamnose transferasegene in tartary buckwheat. Crops, 2020(5): 33-40. (in Chinese)
[27] 翁文凤, 伍小方, 张凯旋, 唐宇, 江燕, 阮景军, 周美亮. 过表达提高苦荞毛状根黄酮积累及其耐盐性. 作物杂志, 2021(4): 1-9.
WENG W F, WU X F, ZHANG K X, TANG Y, JIANG Y, RUAN J J, ZHOU M L. The overexpression ofimproves accumulation of flavonoid in the hairy roots of tartary buckwheat and its salt tolerance. Crops, 2021(4): 1-9. (in Chinese)
[28] WANG C L, DONG X N, DING M Q, TANG Y X, ZHU X M, WU Y M, ZHOU M L, SHAO J R. Plantlet regeneration of tartary buckwheatGaertn.)tissue cultures. Protein and Peptide Letters, 2016, 23(5): 468-477.
[29] 侯思宇, 王欣芳, 杜伟, 冯晋华, 韩渊怀, 李红英, 刘龙龙, 孙朝霞.苦荞WOX家族全基因组鉴定及响应愈伤诱导率表达分析. 中国农业科学, 2021, 54(17): 3573-3586.
HOU S Y, WANG X F, DU W, FENG J H, HAN Y H, LI H Y, LIU L L, SUN Z X. Genome-wide identification of WOX family and expression analysis of callus induction rate in tartary buckwheat. Scientia Agricultura Sinica, 2021, 54(17): 3573-3586. (in Chinese)
[30] AHMAD F, DANNY G. Agroinfiltration of intact leaves as a method for the transient and stable transformation of saponin producingPlant Cell Reports, 2012, 31(8): 1517-1526.
[31] VARGAS-GUEPWARAL C, VARGAS-SESURA C, VILALTAVILALOBOS J, FERERALF P, GATIOAARIAS A. A simple and efficient agroinfiltration method in coffee leaves (L.): assessment of factors affecting transgene expression. 3 Biotech, 2018, 8(11): 471.
[32] BONDT A D, EGGERMONT K, PENWNCKX I, GODERIS I, BROEKAERT W F.Agrobacterium-mediated transformation of apple (Borkh.): an assessment of factors affecting regeneration of transgenic plants. Plant Cell Reports, 1996, 15(7): 549-554.
[33] FEINBAUM R L, AUSUBEL F M. Transcriptional regulation of thechalcone synthase gene. Molecular and Cellular Biology, 1988, 8(5): 1985-1992.
[34] KROL A R, LENTING P E, VEENSTRA J, MEER I M, KORS R E, GERATS A G, MOL J N M, STUITJE A R. An anti-sense chalcone synthase gene in transgenic plants inhibits flower pigmentation. Nature, 1988, 333(6176): 866-869.
[35] LOTKOWSKA M E, TOHGE T, FERNIE A R, XUE G P, BALAZADEH S, BERND M R. Thetranscription factor MYB112 promotes anthocyanin formation during salinity and under high light stress. Plant Physiology, 2015, 169(3): 1862-1880.
[36] SUN Z X, HU B L, HOU S Y, LIU R H, WANG L, HAO Y R, HAN Y H, ZHOU M L, LIU L L, LI H Y. Tartary buckwheat FtMYB31 gene encoding an R2R3-MYB transcription factor enhances flavonoid accumulation in tobacco. Journal of Plant Growth Regulation, 2020, 39(2): 564-574.
Optimization of callus genetic transformation system and its application inoverexpression in tartary buckwheat
ZHAO HaiXia, XIAO Xin, DONG QiXin, WU Huala, LI ChengLei, WU Qi
College of Life Science, Sichuan Agricultural University, Ya’an 625014, Sichuan
【】To develop a novel tool for functional verification and molecular breeding in tartary buckwheat, this study focused on establishing and optimizing an efficient callus genetic transformation system. 【】Callus induction factors including different explants, ratios of diverse growth regulators, andtypes were systematically evaluated using “Xiqiao No. 2” as the derived plant. We further overexpressed, a key enzyme gene involved in the biosynthesis of tartary buckwheat flavonoids in obtained calli to validate the optimized genetic callus transformation system. The positive transgenic lines were confirmed by PCR and fluorescent observation. Subsequently, the content of anthocyanins and metabolites in flavonol branch pathway were determined by UV spectrophotometry and High Performance Liquid Chromatography (HPLC), respectively. Furthermore, quantitative real-time PCR was performed to analyze expression levels of genes involved in flavonoid synthesis, in order to compare the differences between theoverexpressed calli and the control. 【】The optimal explant was hypocotyls and the optimal induction medium was the Murashige and Skoog (MS) medium supplemented with the addition of 0.8 mg·L-16-BA (6-Benzylaminopurine) and 3.5 mg·L-12,4-D (2,4-Dichlorophenoxyacetic acid). The induction rate of calli grown on the above medium reached up to 72%. Moreover, the optimized subculture medium containing MS with the additives of 3 mg·L-16-BA and 1 mg·L-1KT (Kinetin) increased the percentage and coefficient of callus proliferation to 98% and 1.09, respectively. Additionally, the bestin the transformation process was GV3101, and the transformation efficiency was up to 31.3%. The functional analysis ofoverexpressing in transgenetic calli demonstrated that: (1) the accumulations of kaempferol and quercetin in transgenic calli overexpressingwere dramatically higher than those in control groups (<0.01), and anthocyanin, rutin and myricetin contents were also remarkably higher (<0.05); (2) overexpression of the exogenousdid not affect the expression levels of 5 endogenous orthologous genesin the transgenic calli (>0.05), whereas genes encoding key enzymes of the flavonoid synthesis pathway, such as,,,,,and, were up-regulated (<0.05); (3)and, the transcription factor genes that specifically positively regulated the flavonol synthesis, were up-regulated, while, a suppressor gene of anthocyanin synthesis, was down-regulated (<0.05). 【】In this study, the callus genetic transformation system of tartary buckwheat was successfully established from “Xiqiao No. 2”.1 overexpression in the transgenic calli up-regulated genes related to flavonoid synthesis, resulting in flavonoids accumulation.
tartary buckwheat; callus; genetic transformation; chalcone synthase gene

10.3864/j.issn.0578-1752.2022.09.003
2021-11-01;
2021-12-30
国家自然科学基金面上项目(31871699)
赵海霞,E-mail:zhaohaixia@sicau.edu.cn。通信作者吴琦,E-mail:wuqi@sicau.edu.cn
(责任编辑 李莉)

