吸血昆虫生殖调控的分子机制
王雪丽, 李 珊, 吕向阳, 邹 振,*
(1.中国科学院动物研究所, 农业虫害鼠害综合治理研究国家重点实验室, 北京 100101;2.中国科学院大学, 生物互作卓越创新中心, 北京 100049)
大部分吸血昆虫具有刺吸式口器,不仅通过叮咬骚扰人类,而且在叮咬过程中吸食脊椎动物的血获取生长发育以及生殖所需营养,在节肢动物门昆虫纲中的双翅目、半翅目、虱目和蚤目中广泛分布,例如蚊虫、白蛉、蠓、猎蝽、虱子、跳蚤和臭虫等。它们这种特殊的吸血习性,使其成为传播虫媒病原微生物的媒介。近年来,通过吸血昆虫传播的疾病(例如:疟疾、丝虫病、登革热、黄热病、非洲锥虫病等)在全球的流行呈现迅速增长趋势,严重危害人类健康。此外,蜱虫虽然不属于昆虫,但是由于它们共同属于节肢动物且同样可以通过吸血传播一些人畜共患疾病(例如:莱姆病、森林脑炎等),因此关于蜱虫的相关研究在本文中也会涉及。
疟疾的首要媒介是冈比亚按蚊Anophelesgambiae,该病易于流行且传播迅速,是严重危害人体健康的虫媒传染病,撒哈拉以南非洲是疟疾的高频暴发区,疟疾死亡人数在全球占比最多。根据世界卫生组织《2019年世界疟疾报告》,2018年全球共有2.28亿疟疾患者,其中有40.5万人死亡,非洲区域占比94%。虽然我国疟疾疫情得到了有效控制,但是近年来随着对外贸易往来日益频繁以及“一带一路”战略的实施,我国的境外输入性疟疾病例仍然保持在较高的水平 (方志强等, 2019)。登革热由伊蚊传播,主要分布于热带和亚热带地区,在我国南方各重点省份尤为严重,2014年,广东暴发20年来最严重的登革热疫情,损失惨重 (孟凤霞等, 2015)。寨卡病毒也主要由伊蚊传播,先前感染寨卡病毒的病例只是偶有报道,随后在2007年报道了轻度的寨卡疫情,但并未受到重视。2013年,寨卡疫情迅速增加,2015年寨卡病毒感染病例首次出现在美洲,随后迅速蔓延到20多个国家或地区 (刘起勇, 2016; 郑爱华等, 2016; Liuetal., 2017)。除了蚊虫传播的疾病,由吸血昆虫舌蝇叮咬传播的非洲锥虫病也严重威胁到了约40个国家的数亿人群,而且每年都有新增病例 (杜金和朱明彦, 2015)。上述例证说明,经由吸血昆虫传播的虫媒疾病具有传播速度快、扩散面积广和危害重等特点,再加之近年来我国与国外的频繁交流以及对外出口贸易的飞速发展,使得虫媒传染病输入性病例不断增加,严重危害我国国民的健康,阻碍了我国经济发展,因此,对于吸血昆虫传播虫媒疾病的研究和控制成为普遍关注的焦点 (王燕红等, 2017)。
目前尽管部分虫媒传染病已经开发出针对性药物(如治疗疟疾的药物),但是仍有很多虫媒传染病的药物匮乏,例如针对查加斯病(Chagas disease)的药物。另外,虫媒病原对化学药物抗性不断增加,为虫媒病原的控制增加了难度。因此,在新型药物开发的同时,如果对吸血昆虫采取一定措施,比如通过解析吸血昆虫生殖调控的生物学基础,借助生物学的手段降低吸血昆虫的种群密度等,将会极大程度上降低虫媒传染病的扩散,既可从根本上预防疟疾、登革热、寨卡等传染病的传播,又可避免化学药物滥用造成的环境污染。昆虫内分泌调控的变态发育和生殖机制研究近年来取得了突破性进展,主要针对黑腹果蝇Drosophilamelanogaster、棉铃虫Helicoverpaarmigera、东亚飞蝗Locustamigratoria、赤拟谷盗Triboliumcastaneum和埃及伊蚊Aedesaegypti等。而吸血昆虫由于其非自发性生殖(anautogeny)这一特殊方式的影响,具有非常独特的生殖调控机制,本文总结了这方面的国内外研究进展。
1 保幼激素对吸血昆虫的生殖调控
保幼激素(juvenile hormone, JH)首先在长红锥蝽Rhodniusprolixus的研究中被发现,是类倍半萜烯类化合物,由昆虫脑后咽侧体合成,分泌进入血淋巴后作用于不同组织 (Davey, 1987)。最初发现其具有保持昆虫幼虫形态的功能而命名,随后一系列研究发现,在昆虫成虫阶段JH可以调控昆虫多种生理学功能,例如代谢、滞育、免疫和多态性等,尤其在雌性昆虫卵的发育及成熟过程中发挥重要作用 (Raikhel and Lea, 1991)。用外源JH或JH类似物处理蜱虫,不仅可以终止滞育,而且可以促进其卵黄发生和产卵 (Bassal and Roshdy, 1974),随后在长角血蜱Haemaphysalislongicornis中证实有JH存在 (云自厚等, 1992)。组织学实验证明,在猫蚤Ctenocephalidesfelis中,JH可以通过刺激唾液腺上皮细胞、中肠细胞和脂肪体细胞等的分化,增强成虫的血液消化以及卵黄原蛋白(vitellogenin, Vg)的合成能力来促进卵母细胞的成熟 (Meolaetal., 2001)。在非自发性生殖的蚊虫中,JH调控的Vg合成过程为其之后的吸血及产卵提供了必要条件,如果蚊虫羽化后将分泌JH的咽侧体切除,蚊虫将不会吸血及产卵 (Zhu and Noriega, 2016)。促咽侧体素(allatotropin)作为一种促进JH合成的神经肽,在尖音库蚊Culexpipiens中通过RNA干扰(RNA interference, RNAi)的方式将其基因敲低后,可以导致卵巢发育停止,使其处于一种类似滞育状态,而添加JH后这种现象被逆转 (Kangetal., 2014)。在埃及伊蚊中,利用RNAi将JH合成信号通路中的保幼激素酸甲基转移酶(juvenile hormone acid methyl transferase, JHAMT)编码基因敲低后,近一半的卵发育受到抑制 (Van Ekertetal., 2014)。
近年来,随着相关研究的不断推进,JH调控吸血昆虫生殖发育的分子机制也逐步得到解析。JH是脂溶性化合物,通过细胞膜进入胞内,与受体methoprene-tolerant (Met) 结合,JH/Met移位到核内后发挥生理功能 (Heetal., 2014, 2017)。Met是basic helix-loop-helix-Per-Arnt-Sim (bHLH-PAS)家族转录因子,需要与该家族另一个转录因子Taiman (Tai)形成异源二聚体才能转变为功能性转录因子,从而介导JH应答 (Charlesetal., 2011; Lietal., 2011; Zhangetal., 2011)。对Met基因进行RNAi后,能够极大地降低温带臭虫Cimexlectularius的产卵量 (Gujar and Palli, 2016)。同样在埃及伊蚊中,敲低Met导致卵泡生长明显受到抑制,这同咽侧体去除后的表型一致 (Zouetal., 2013; Royetal., 2018)。这些结果表明了JH及其受体Met在生殖过程中扮演了重要的角色。分子水平上,JH通过其受体Met调控了多种基因的表达,Met可以直接结合到下游基因启动子区的JH应答元件(JH response element, JHRE)上来介导基因激活 (Cuietal., 2014)。Krüppel-homolog1 (Kr-h1)和Hairy是典型的可被Met激活的靶基因 (Zhuetal., 2010; Songetal., 2014)。通过酵母双杂交和凝胶阻滞等实验进一步证明,严格控制埃及伊蚊羽化后发育期的光周期,JH还可以诱导Met与bHLH-PAS家族的另一个成员CYC形成复合体,从而激活Kr-h1和Hairy表达 (Shinetal., 2012)。除此之外,埃及伊蚊羽化后,Met还能够直接结合到核糖体蛋白合成相关基因启动子区,激活脂肪体中核糖体蛋白合成相关基因表达,促进卵黄原蛋白的产生以及卵巢的发育 (Wang JLetal., 2017)。然而,目前为止,关于Met介导的基因抑制大部分是通过间接的方式来完成的,需要其他中间抑制因子的参与,例如Met可以通过激活抑制因子Hairy及其共抑制子Groucho或者通过激活Kr-h1达到对下游基因抑制的目的 (Sahaetal., 2016)。同时,Hairy与Kr-h1还能够以协同的方式在JH/Met的基因抑制中共同发挥作用 (Sahaetal., 2019)。近期研究发现,JH可以通过膜受体进入胞内,通过磷脂酶C(phospholipase C, PLC)快速增加胞内二脂酰甘油(diacylglycerol, DAG)和钙离子浓度,从而激活蛋白激酶C(protein kinase, PKC)和钙/钙调蛋白依赖的蛋白激酶Ⅱ(Ca2+/calmodulin-dependent protein kinase Ⅱ, CaMKⅡ),最终磷酸化Met以及Tai,被磷酸化的Met/Tai异源二聚体可以增强与下游基因启动子区结合强度,从而调控基因表达 (Liuetal., 2015)。
2 蜕皮激素对吸血昆虫的生殖调控
20-羟基蜕皮激素(20-hydroxyecdysone, 20E)属于类固醇类激素,是昆虫发育过程中另一个重要的激素,在调控昆虫幼虫蜕皮变态和胚胎发生等生理过程中起着重要作用 (Raikhel and Lea, 1991; Riddiford, 1993)。在昆虫幼虫期,肽激素(prothoracicotropic hormone, PTTH)从脑中释放后激活RAS/ERK信号通路,促使前胸腺中蜕皮激素ecdysone (E)的合成(Gilbertetal., 2002; Rewitzetal., 2009)。然而在一些昆虫的成虫期,例如蚊虫成虫阶段,E主要在卵巢中合成,蚊虫吸血后刺激脑中神经内分泌组织产生促卵巢蜕皮激素分泌激素(ovarian ecdysteroidogenic hormone, OEH),OEH释放进入血淋巴后刺激卵巢合成和分泌E,进入脂肪体中转变为其活性形式20E (Hansenetal., 2014; Royetal., 2018)。20E可以激活卵黄原蛋白前体基因表达,卵黄原蛋白在脂肪体中合成加工后分泌运输到卵巢中,为发育的卵巢提供营养 (Attardoetal., 2005; Hansenetal., 2014)。在长红锥蝽血淋巴中,受节律调控的蜕皮激素滴度变化贯穿了卵的整个发育过程 (Cardinal-Aucoinetal., 2013)。由此可见,20E对卵的发育和成熟至关重要。
目前,20E调控吸血昆虫生殖发育的分子机制研究已经取得了重大突破,尤其在蚊虫中。20E在胞内的功能性受体为蜕皮激素受体(ecdysone receptor, EcR)和超气门蛋白(ultraspiracle, USP)形成的异源二聚体,两者都是核受体超家族成员,分别为脊椎动物法尼醇X受体(farnesoid X receptor, FXR)和类视黄醇X受体(retinoid X receptor, RXR)的直系同源物(King-Jones and Thummel, 2005),由DNA结合结构域(DNA binding domain, DBD)和配体结合结构域(ligand binding domain, LBD)组成。利用RNAi方法将20E受体基因EcR表达水平敲低后,埃及伊蚊产卵量显著降低 (Houetal., 2015),进一步证明20E对蚊虫生殖的重要性。EcR/USP异源二聚体在20E诱导下,结合到下游基因启动子区的蜕皮激素应答元件(ecdysone response element, EcRE)上,诱导靶基因表达。埃及伊蚊吸血后,20E滴度迅速升高,EcR与20E结合后,激活下游早期基因Broad-Z2,E74B和E75A表达,这些基因编码蛋白协同互作,结合到Vg启动子区的相应结合元件上从而启动晚期基因Vg表达,为发育的卵巢提供营养。在卵黄原蛋白发育末期,20E滴度降低,EcR激活Broad-Z4和HR3表达,两者可以及时地抑制Vg的过量表达;除此之外,近期研究表明,吸血后20E还可以通过EcR激活转录因子E93基因的表达而及时地调控Vg表达,这些现象都有利于起始蚊虫第2次生殖过程,使蚊虫生殖过程协调有序地完成(Mane-Padrosetal., 2012; Wangetal., 2021)。βFTZ-F1同样在生殖过程中起到重要作用。敲低βFTZ-F1后,无论是吸血刺激还是20E添加,蚊虫都不会诱导早期基因或Vg基因表达,表明该基因是20E下游启动蚊虫第2次生殖周期的关键因子(Zhuetal., 2006)。
3 营养因素对吸血昆虫的生殖调控
除了JH和20E,营养信号通路在吸血昆虫生殖过程中同样起着重要的作用。多项研究表明,氨基酸(amino acids, AAs)介导的雷帕霉素靶蛋白(target of rapamycin, ToR)信号通路以及胰岛素信号通路(insulin signaling pathway)可以调控昆虫Vg生成以及卵泡生长等生理学过程,是昆虫中重要的营养感受通路。
埃及伊蚊体外脂肪体培养实验表明,20E必须在某些特定氨基酸存在条件下才能激活Vg基因表达,培养基中添加氨基酸吸收抑制剂以及跨膜的氨基酸转运体被干扰后,可以显著降低Vg基因的表达量(Attardoetal., 2006)。AAs对Vg蛋白表达的影响主要是通过激活ToR营养信号通路来实现的。吸血后,血液以及代谢产生的AAs信号传至脂肪体后磷酸化ToR蛋白,进一步通过磷酸化级联反应激活核糖体S6蛋白激酶(S6K)以及失活转录抑制子4E结合蛋白(4E-binding protein, 4EBP),最终启动雌蚊Vg基因转录表达。此外,转录因子GATA是S6K下游底物,激活后可直接与Vg启动子上游元件结合,激活Vg表达(Parketal., 2006)。RNA干扰ToR以及添加雷帕霉素抑制剂后可使ToR信号通路失活,从而显著地降低埃及伊蚊的繁殖能力。同样地,ToR下游S6K被RNA干扰后,Vg表达下调,而转录抑制子4EBP被RNA干扰后,Vg表达上调(Roy and Raikhel, 2012; Royetal., 2018)。此外,在卵黄发育末期,ToR信号通路还可以被脂肪体自噬过程所抑制,终止Vg蛋白合成,促进脂肪体重塑,为第2次吸血产卵做准备 (Bryant and Raikhel, 2011)。
ToR信号通路可以通过胰岛素信号通路而激活,在埃及伊蚊脂肪体体外培养实验中,牛胰岛素添加可以激活脂肪体中胰岛素信号通路,并且在不添加AAs的情况下,胰岛素与20E可以促进Vg表达,ToR被RNA干扰后可以阻断胰岛素和20E介导的Vg表达。昆虫中胰岛素样肽(insulin-like peptides, ILPs)与膜受体结合后,将信号传递至胞内,磷酸化蛋白激酶B(protein kinase B)Akt蛋白,Akt通过失活ToR信号通路的负调控因子TSC1和TSC2(tuberous sclerosis complex 1/2)而激活ToR信号通路,调控Vg表达 (Smykal and Raikhel, 2015; Royetal., 2018)。在埃及伊蚊中存在8个ILPs,不同ILPs之间在结构和功能上有所差异,调控生殖的途径和分子机制也不尽相同。ILP3和ILP4具有不同的作用受体,但是都可以刺激卵巢产生蜕皮激素从而诱导脂肪体中产生Vg和其他的卵黄原蛋白 (Wenetal., 2010; Gulia-Nussetal., 2015)。采用CRISPR/Cas9基因编辑方法将ilp2,ilp4,ilp5,ilp6,ilp7和ilp8敲除后,虽然埃及伊蚊体内的贮存脂和糖原发生不同方式的改变,但是在这些蚊虫突变体中,卵巢均不能正常生长和发育 (Lingetal., 2017; Ling and Raikhel, 2018)。另外,在尖音库蚊中,胰岛素信号通路还可以通过促进JH的合成来刺激卵巢发育 (Sim and Denlinger, 2008)。在长角血蜱中敲低胰岛素信号通路中Akt的同源基因,可以抑制雌虫的吸血行为,对血液消化以及发育和繁殖相关基因的表达也有影响 (Umemiya-Shirafujietal., 2012)。
4 能量代谢在吸血昆虫生殖过程中的作用
吸血昆虫在生殖发育不同阶段需要极高的能量供给,包括吸血前期的觅食,吸血后中肠血液的消化吸收及营养卵巢发育成熟等。糖脂代谢与能量稳态密切相关,在致倦库蚊Culexquinquefasciatus的胚胎发育过程中,大约90%的能量来源于贮存脂 (Van Handel, 1993)。在埃及伊蚊卵黄发育前期,蚊虫体内贮存脂和糖原等碳水化合物逐渐积累,ATP含量增加,为吸血产卵贮存能量。蚊虫吸血后,贮存脂以及糖原等碳水化合物迅速分解,ATP含量降低,为卵巢的快速发育提供能量 (Houetal., 2015; Wang XLetal., 2017)。除此之外,脂肪酸代谢在其他物种中也被证实是卵的发育成熟过程中主要的能量来源 (Dunningetal., 2014)。
为了维持生存,多细胞动物在生长发育过程中必须进化出强大的能量代谢机制来维持代谢稳态以及应对发育、繁殖过程中不断变化的能量需求。近年来,关于吸血昆虫代谢机制的研究已经取得了一定进展,代谢机制的解析将为吸血昆虫的生殖控制提供重要的分子靶标。在蚊虫中,JH和20E可以分别通过其受体Met和EcR调控埃及伊蚊吸血前后糖脂分解代谢,确保蚊虫能够在不同发育时期快速调整能量代谢速率以满足自身及卵巢生长发育的能量需求 (Houetal., 2015; Wang XLetal., 2017)。阻断AA/ToR信号通路导致蚊虫体内脂积累,说明AA/ToR信号通路是脂分解代谢的正调控因子。核受体HNF4是激素(JH/20E)及AA/ToR营养信号通路下游脂代谢调控的直接作用因子。敲低HNF4后,蚊虫不能有效利用体内贮存脂 (Wang XLetal., 2017),从而影响卵的营养吸收。microRNA-277通过靶向ilp7和ilp8调控埃及伊蚊脂代谢,进而影响了卵巢发育 (Lingetal., 2017)。近期研究发现,JH和20E信号通路不仅可以调控ILPs蛋白表达,而且三者之间可以协同调控生殖周期中的代谢过程 (Ling and Raikhel, 2021)。另外,脂肪体组织中高表达的5-羟色胺受体Aa5HT2B在蚊虫生长以及代谢过程中起着关键作用,该受体基因被敲除后导致蚊虫体内糖脂代谢失调,虫体变小,严重延缓了卵巢的正常生长 (Ling and Raikhel, 2018)。尽管目前代谢机制的研究不够全面,但是随着分子生物学技术的不断革新,吸血昆虫更多能量代谢机制将逐渐被解析。
5 其他因素对吸血昆虫的生殖调控
除了上述因素外,脂动激素(adipokinetic hormone, AKH)信号通路、几丁质代谢(chitin metabolism)以及肠道微生物等都会直接或间接影响吸血昆虫的生殖过程。AKH在昆虫中具有胰高血糖素之称,不仅能够刺激分解代谢反应,而且能够抑制蛋白质、脂质和糖原的合成。虽然在大多数昆虫,例如东亚飞蝗和黄斑黑蟋蟀Gryllusbimaculatus中,AKH可以阻断Vg的生成以及卵的发生,但是在吸血昆虫采采蝇的生殖过程中,AKH是重要的正调控因子 (Gálikováetal., 2015)。几丁质是昆虫卵的重要组成成分,昆虫胚胎表皮的几丁质合成与沉积有利于胚胎正常发育,将几丁质合成酶基因进行RNA干扰后,长红锥蝽的产卵和羽化被显著影响 (Mansuretal., 2014; Souza-Ferreiraetal., 2014)。同样地,经几丁质合成抑制剂处理后,长红锥蝽的卵变小和活力降低,卵的形状和颜色也有明显变化 (Mansuretal., 2010)。在埃及伊蚊卵巢和卵壳中也有几丁质样组分存在,几丁质合成抑制剂能够抑制伊蚊卵的发育 (Moreiraetal., 2007)。因此,卵巢中几丁质或几丁质样组分有望成为控制吸血昆虫生殖的潜在靶标。吸血昆虫的中肠微生物种群对宿主的血液消化以及生殖发育具有重要影响,在蚊虫中,天然或者工程化的中肠微生物不仅可以有效阻断病原传递 (Gaoetal., 2020; Huangetal., 2020),而且自身的代谢物(如铁蛋白载体等)还可以降低冈比亚按蚊的生殖力以及吸血率 (Ganleyetal., 2020)。
目前为止,吸血昆虫生殖调控机制研究主要聚焦于雌虫,而对雄虫的研究相对较少。雄蚊对雌蚊的生殖发育起着重要作用,伊蚊性别决定染色体Y上的M因子Nix在雄性埃及伊蚊中突变后,雄蚊发生雌性化,包括精巢的卵巢化和副腺畸形以及外生殖器结构的变化,最终导致突变体无法与野生型雌蚊交配。而Nix在雌蚊体内异位表达会导致内外生殖器官的雄性化,将雌蚊转化为对人类无害的雄蚊 (Halletal., 2015; Liuetal., 2020)。通过外科手术去除雄性埃及伊蚊咽侧体减少JH合成进而导致雄蚊副腺发育受阻,不利于交配和精子转移以及精子成熟,进而影响雌蚊生殖 (Ramalingam and Craig, 1977)。除此之外,成虫间的交配行为伴随了激素传递,这也在卵子发生过程中起到了重要作用。研究表明,雄性蚊虫在交配时,将JH转移到雌蚊体内,激活雌蚊卵子发育并影响其生殖 (Cliftonetal., 2014)。在冈比亚按蚊交配时,雄蚊可传递20E到雌蚊中,雌蚊中的EcR与之结合后激活蛋白因子基因MISO(mating-inducedstimulatorofoogenesis)的转录,该因子能够与雌蚊中的20E共同作用激活卵黄生成相关的脂质转运因子的表达,从而引起脂滴积累,促进卵的发育 (Baldinietal., 2013)。因此雄虫发育机制的研究对于吸血昆虫生殖调控机制挖掘具有重要的意义。
微小RNA(microRNAs, miRNAs)在昆虫生殖过程中也扮演着重要的角色。以蚊虫研究为例,在埃及伊蚊不同发育时间点的脂肪体组织中,miRNAs的表达呈现出动态变化,这可能会影响不同靶基因表达,从而调控卵的发育(Zhangetal., 2017)。进一步研究发现,JH和20E信号通路可以调控部分miRNAs活性,以此来满足蚊虫的生殖需求(Aksoy and Raikhel, 2021; Heetal., 2021)。miR-275不仅在维持中肠微生物稳态中起着重要作用,而且通过影响中肠血液吸收、消化酶的产生以及中肠肌动蛋白骨架的组装等影响卵的发育(Zhaoetal., 2017)。中肠特异性表达的miR-1174可以通过靶向丝氨酸羟甲基转移酶(serine hydroxymethyltransferase, SHMT)基因影响糖的吸收、血液消化等生理学过程,进而影响卵的发育成熟和蚊虫存活 (Liuetal., 2014)。miR-309通过靶向Homeobox基因SIX4,调控卵巢的发育过程 (Zhangetal., 2016)。miR-277通过调控埃及伊蚊脂代谢稳态进一步影响卵巢发育(Lingetal., 2017)。miR-8还可以通过靶向Wingless信号通路来调控雌蚊的繁殖过程(Lucasetal., 2015)。无论在埃及伊蚊还是斯氏按蚊中,miR-989都被证明与雌蚊生殖密切相关(Jainetal., 2015; Zhangetal., 2017; Royetal., 2018)。随着测序技术发展、miRBase数据库的丰富以及miRNAs与靶基因之间新型作用模式不断涌现,吸血昆虫中与生殖相关的miRNAs逐渐被解析,而基于miRNA的原理去阻断蚊媒疾病传播的方法也将越来越多地被研发出来(Xuetal., 2021)。
6 小结与展望
吸血昆虫传播的疾病扩散速度快,分布范围广,危害性大。尽管目前针对部分传染病(例如疟疾和黄热病等)正在试验或者已经研制出疫苗,但是其对机体免疫力的保护并不持久。病原在传播过程中不断发生变异,使得疫苗研制变得非常困难。因此,深入探讨吸血昆虫生殖调控的分子机制,控制吸血昆虫生殖,不仅可以从根本上阻断虫媒疾病传播,而且能够减少化学药物滥用造成的环境污染。从长远来看,对吸血昆虫生殖调控机制的解析还能够为杀虫剂研发提供药物设计的靶标,具有十分重要的社会效益和战略意义。
虽然吸血昆虫生殖发育的调控机制经过数十年研究,取得了长足的进展,但是对其研究往往只聚焦于模式吸血昆虫,而对于其他吸血昆虫的涵盖面不够,比如印鼠客蚤Xenopsyllacheopis这一鼠疫媒介的研究尚是空白。同时为适应快速且高效的生殖活动,吸血昆虫自身能够不断进化出新的生殖调控机制。到目前为止,激素、营养信号以及miRNAs等对吸血昆虫生殖调控的机制已经逐渐明晰(图1),但是其他非编码RNA,例如长链非编码RNA(long non-coding RNA, lncRNA)、环状RNA(circular RNA, circRNA),以及DNA修饰、RNA修饰和组蛋白修饰等表观因素对生殖的调控研究仍涉及得非常少。随着非编码RNA、表观基因组学和表观蛋白质组学等测序技术以及基因编辑技术的飞速发展,表观遗传学修饰在吸血昆虫生殖过程中所扮演的角色将逐渐被揭示,最终通过对多种调控机制的综合分析,找到控制吸血昆虫生殖的最优靶标,从而为阻断虫媒传染病的传播做出贡献。
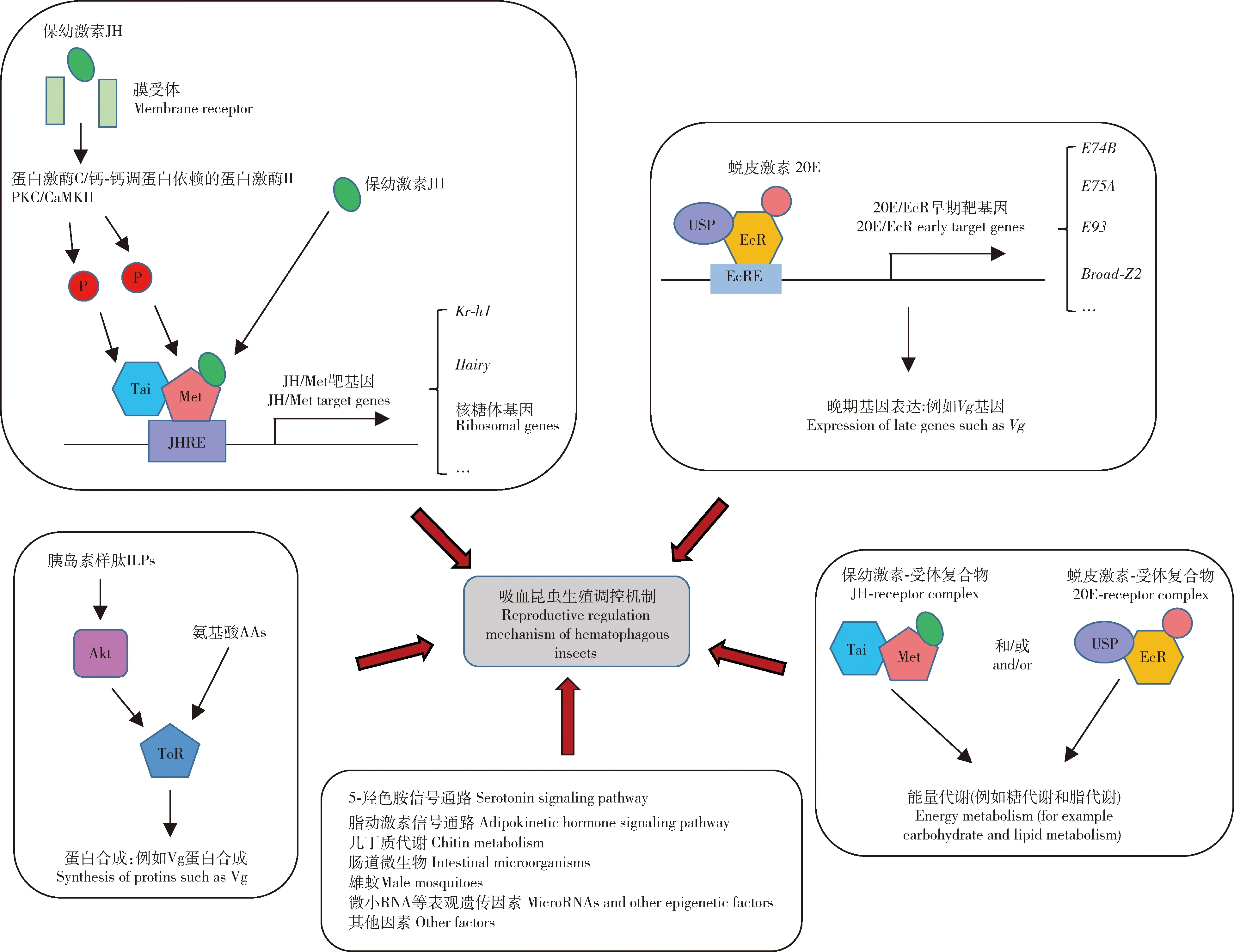
图1 吸血昆虫生殖调控的分子机制Fig.1 Molecular mechanism of reproductive regulation in hematophagous insects保幼激素(JH)入核后,结合到其受体复合物Met/Tai上,随后JH/Met/Tai复合物与下游靶基因启动子区的JH调控元件(JHRE)结合,直接调控其表达,例如Kr-h1、Hairy以及核糖体相关基因等。另外,JH还可以通过另一膜受体进入胞内,通过激活PKC/CaMKII信号通路将Met和Tai进行磷酸化,磷酸化的Met以及Tai进入核内后调控下游靶基因表达。同样地,20E入核后,与其受体复合物EcR/USP结合,20E/EcR/USP复合物通过与早期基因启动子区的EcR调控元件(EcRE)结合而直接激活早期基因应答,例如E74B, E75A, E93以及Broad-Z2等,这些早期基因编码的蛋白随后诱导卵黄原蛋白基因Vg等晚期基因的表达。胰岛素样肽(ILPs)介导的胰岛素信号通路以及氨基酸(AAs)等信号分子可以激活ToR信号通路,从而诱导Vg等蛋白合成。JH和20E信号通路可以协同调控糖脂等能量代谢过程。此外,5-羟色胺信号通路、脂动激素信号通路、几丁质代谢、肠道微生物、雄蚊以及微小RNA等表观遗传因素也会直接或间接调控吸血昆虫生殖。Juvenile hormone (JH) binds to its receptor complex Met/Tai in nucleus, and then the JH/Met/Tai complex binds to the JH regulatory element (JHRE) in the promoter region of the downstream target genes such as Kr-h1, Hairy and ribosome-related genes to directly regulate their expression.In addition, JH can enter the cell through an additional membrane receptor and phosphorylate Met and Tai by activating the PKC/CaMKII signaling pathway.The phosphorylated Met and Tai enter the nucleus and regulate downstream target gene expression.Similarly, 20E binds to its receptor complex EcR/USP in the nucleus and directly activates the early gene response by binding to the EcR regulatory element (EcRE) in the promoter region of the early genes, such as E74B, E75A, E93 and Broad-Z2.Subsequently, proteins encoded by these early genes induce the expression of late genes like vitellogenin gene (Vg).Insulin-like peptides (ILPs)-mediated insulin signaling pathways and amino acids (AAs) can activate ToR signaling pathway, thereby inducing the synthesis of proteins like Vg.JH and 20E signaling pathways can coordinately regulate energy metabolism processes such as carbohydrate and lipid metabolism.Besides, serotonin signaling pathway, adipokinetic hormone signaling pathway, chitin metabolism, intestinal microorganisms, male mosquitoes, microRNAs and other epigenetic factors also directly or indirectly regulate the reproduction of hematophagous insects.

