绿豆乙醇脱氢酶基因生物信息学分析及其在镉胁迫下的表达特性变化
程 斌, 张创娟, 杨 乐, 冷 艳, 李师翁
(兰州交通大学生物与制药工程学院, 甘肃 兰州 730070)
乙醇脱氢酶(ADH)是生物体内主要短链醇代谢的关键酶,广泛存在于所有生物细胞中,由多基因家族编码,主要分为3个亚家族:短链脱氢酶/还原酶,少于250个氨基酸残基;中链脱氢酶/还原酶,约含350个氨基酸残基;长链脱氢酶/还原酶,含385~900个氨基酸残基[1]。典型的ADH是锌结合酶,锌结合位点含206~340个氨基酸残基[2],其结构域包含底物结合或催化结构域和辅酶结合结构域,其中,底物结合或催化结构域为N末端的不规则β卷曲和一小段C末端区域,含35~164个氨基酸残基;而辅酶结合结构域则含有结合NAD的Rossmann折叠[3]。
植物的ADH基因属于一个小的多基因家族,如水稻(OryzasativaLinn.)[4]和玉米(ZeamaysLinn.)[5]等含有2或3个ADHs。ADHs基因可参与果实成熟过程,如番茄(LycopersiconesculentumMill.)ADH2基因参与果实成熟过程中的挥发性香气成分的代谢,过表达ADH2可以改善水果风味[6],且在甜瓜(CucumismeloLinn.)[7]和杧果(MangiferaindicaLinn.)[8]中也有相似的结果。ADHs基因还可参与植物激素调控,如白梨(PyrusbretschneideriRehd.)的ADH基因参与激素调节作用,且对脱落酸、吲哚乙酸和乙烯的调节模式不同[9]。在胁迫条件下,ADH基因能够通过调节活性氧(ROS)相关基因的表达水平保持细胞内ROS的稳定状态[10],同时,ADH基因也有助于植株积累更多的可溶性糖和胼胝质等物质,对植物细胞的渗透压起到调节作用[11-14]。Komatsu等[15]发现,水淹胁迫后大豆〔Glycinemax(Linn.) Merr.〕幼苗ADH2基因的表达显著增强,但ADH2基因的表达对渗透、低温和干旱等胁迫处理均不响应,表明ADH2基因是在大豆根中表达的对淹水响应的特异性基因。另外,低氧胁迫环境下ADH基因的表达增强,能提高绿豆的耐涝性[16]。上述研究结果均表明:ADH基因参与植物生长发育、有氧代谢及各种胁迫响应等多项生理生化过程[17,18]。
土壤Cd污染是严重的环境问题之一,不但影响作物的生长和产量,而且通过食物链危害人类健康。一些植物种类可通过根系从土壤中吸收重金属,并产生耐受性[19],因而可用于土壤重金属污染的修复。豆科(Fabaceae)植物的根瘤使其在土壤重金属污染修复方面具有独特优势[20]。因而,研究豆科植物对重金属耐受性的分子机制,特别是特定基因对重金属的响应特征,对了解植物对重金属的耐受机制,以及重金属污染土壤的植物修复机制都具有重要意义。
绿豆〔Vignaradiata(Linn.) R. Wilczek〕为种植较为广泛的豆科植物之一,为掌握绿豆对Cd胁迫的耐受性及其耐受机制,前期本课题组的研究人员运用转录组技术研究了Cd胁迫对绿豆根基因表达的影响[21]。为进一步揭示绿豆对Cd胁迫的分子响应机制,作者在前期研究工作的基础上,采用基因组学、转录组学和酶学等方法,鉴定并分析绿豆的ADHs基因及其编码的氨基酸序列特征,并对正常和Cd胁迫条件下绿豆不同部位ADHs基因表达特性以及ADH酶活性的变化进行比较分析,以期为植物ADHs基因的功能研究及应用提供科学资料。
1 材料和方法
1.1 材料
绿豆种子经自来水清洗后,用体积分数6%NaClO溶液浸泡15 min,并用无菌水清洗后,置于(25.0±0.5)℃恒温箱中浸种24 h;在塑料育苗盘中加入适量育苗基质〔V(珍珠岩)∶V(蛭石)=1∶1〕,每盘15个育苗格,每个育苗格的长、宽、高分别为9、8、7 cm。每个育苗格播种20粒绿豆种子,置于光照培养箱中培养5 d,培养条件为温度(25.0±1.0)℃、光照时间14 h·d-1、光照强度100 μmol·m-2·s-1。
1.2 方法
1.2.1 Cd胁迫处理和样品采集 Cd胁迫处理分为对照组和处理组,分别以Hoagland营养液和含100 μmol·L-1CdCl2·2H2O的Hoagland营养液为培养液,每组3个生物学重复,每个重复1盘。对照组和处理组每个育苗格均加入70 mL相应培养液,并在处理第5天分别补充70 mL相应培养液。
于处理的第1、第5和第9天,从对照组和处理组的育苗盘中分别取出80株绿豆幼苗植株,清洗并吸干表面水分后,分别剪取植株的根、茎和叶片,用液氮速冻后置于-80 ℃条件下保存,用于转录组分析。于处理的第1、第3、第5、第7和第9天,从对照组和处理组的育苗盘中分别取80株植株,清洗并吸干表面水分后,将根、茎和叶片分开,用于酶活性测定。
1.2.2ADH基因筛选、鉴定和蛋白特性分析 从NCBI数据库(https:∥www.ncbi.nlm.nih.gov/)下载绿豆全基因组及注释文件信息,筛选已注释的绿豆ADHs基因序列;从Ensembl Plants数据库(http:∥plants.ensembl.org/index.html)检索拟南芥〔Arabidopsisthaliana(Linn.) Heynh.〕ADHs基因序列;从NCBI数据库得到大豆基因组注释文件和蛋白序列文件,通过检索后筛选得到大豆ADHs基因序列。
用基于隐马尔可夫模型(HMMER)的工具(https:∥www.ebi.ac.uk/Tools/hmmer/search/hmmscan)对下载的绿豆基因组注释蛋白序列进行检索,设置e-value值为0.000 1,得到绿豆ADH蛋白的氨基酸序列;再利用Pfam数据库(http:∥pfam.xfam.org)进行蛋白结构域鉴定,确定所有获得的蛋白均含有ADH结构域。
使用ProtParam(http:∥web.expasy.org/protparam)分析ADHs蛋白理化性质,包括相对分子质量、等电点和氨基酸残基数等。使用MEME线上平台(http:∥meme-suite.org/tools/meme)进行蛋白motif分析,将鉴定的绿豆ADHs蛋白的氨基酸序列与拟南芥和大豆ADHs蛋白的氨基酸序列进行比对;使用MEGA 7.0软件基于邻接法(Neighbour-joining)构建系统发育树,并用Tbtools工具对结果进行可视化处理。
1.2.3 转录组测序 参照文献[21,22]的方法提取总RNA并制备cDNA文库。使用MJ-plant植物总RNA提取试剂盒(上海美吉生物医药科技股份有限公司)进行总RNA提取,并用NanoDrop 2000分光光度计(美国Thermo-Fisher公司)和安捷伦2100生物分析仪(美国Agilent公司)评估RNA的数量和质量。使用TruseqTMRNA样品制备试剂盒(美国Illumina公司)纯化mRNA,并用TruseqTMDNA文库制备试剂盒(美国Illumina公司)构建cDNA文库。用Illumina Novaseq 6000系统对构建的cDNA文库进行测序,测序工作由上海美吉生物医药科技有限公司完成。
参照文献[21]的方法分析测序数据和差异基因。对9个基因和1个内参基因进行qRT-PCR分析,并进行qRT-PCR验证,其结果与转录组测序数据的相关系数(r2)为0.925(P≤0.01),表明转录组数据与qRT-PCR数据结果高度一致。
基因相对表达量以TPM(transcripts per kilobase per million mapped reads)表示;用2-ΔΔCt法计算基因的表达量,并用Tbtools工具基于log2TPM绘制基因表达谱。
1.2.4 ADH酶活性分析 参照施海涛[23]的方法测定ADH酶活性。
1.3 数据处理和统计分析
采用EXCEL 2016软件进行数据统计,采用SPSS 21.0软件进行单因素方差分析和显著性检验(LSD检验,P<0.05),采用GraphPad Prism 9软件绘图。
2 结果和分析
2.1 绿豆ADHs基因的生物信息学分析
2.1.1 绿豆ADHs基因鉴定和结构特征 对获得的绿豆基因组注释文件进行检索,共鉴定得到15个ADHs基因,依次命名为VrADH1至VrADH15,基因序列长度为447~15 055 bp,GC含量为26.53%~39.08%。相比之下,绿豆ADHs基因数量多于拟南芥(8个,AtADH1至AtADH8),但少于同科的大豆(32个,GmADH1至GmADH32)。
对绿豆、大豆和拟南芥ADHs基因结构(图1)的比较结果表明:绿豆、大豆和拟南芥的ADHs基因均含有不同数量的内含子和外显子。在绿豆的VrADHs基因中,仅VrADH10包含2个内含子和2个外显子,其他VrADHs分别包含7~9个内含子和7~10个外显子。

: 非翻译区Untranslated regions; : 外显子Exons; —: 内含子Introns. Vr: 绿豆Vigna radiata (Linn.) R. Wilczek; At: 拟南芥Arabidopsis thaliana (Linn.) Heynh.; Gm: 大豆Glycine max (Linn.) Merr.
Arabidopsisthaliana(Linn.) Heynh., andGlycinemax(Linn.) Merr.
对绿豆、大豆和拟南芥的ADHs氨基酸序列中保守motif的比较结果(图2)表明:3个种类的ADHs共包含10个motif,且多数ADHs含有相似的motif。在绿豆的ADHs氨基酸序列中,VrADH2至VrADH9和VrADH11至VrADH15均含有10个motif,而VrADH1不包含motif5和motif7,VrADH10仅含有motif3。
染色体定位结果表明:在绿豆的15个VrADHs基因中,VrADH2和VrADH5无法定位到任何染色体上,其他13个VrADHs基因定位于8条染色体上。其中,VrADH3、VrADH4和VrADH14定位于6号染色体上,VrADH7、VrADH8和VrADH11定位于8号染色体上,VrADH10和VrADH12定位于9号染色体上,VrADH13、VrADH9、VrADH6、VrADH1和VrADH15分别定位于1、2、3、7和10号染色体上。

不同彩色框表示不同motif Different colored boxes indicate the different motifs. Vr: 绿豆Vigna radiata (Linn.) R. Wilczek; At: 拟南芥Arabidopsis thaliana (Linn.) Heynh.; Gm: 大豆Glycine max (Linn.) Merr.
2.1.2 绿豆VrADHs蛋白的理化性质 结果(表1)显示:绿豆VrADHs蛋白的理化性质存在一定的差异。在15个VrADHs中,VrADH2的氨基酸序列最长(包含444个氨基酸残基),相对分子质量最大(48 390);VrADH10的氨基酸序列最短(包含78个氨基酸残基),相对分子质量最小(8 840)。从氨基酸序列长度看,仅VrADH10属于短链脱氢酶,VrADH1、VrADH2、VrADH7、VrADH11、VrADH12和VrADH15属于长链脱氢酶,其余VrADHs均属于中链脱氢酶。15个VrADHs的氨基酸序列等电点为pI 4.83~pI 8.22,其中,仅VrADH1的等电点大于pI 7,为碱性蛋白;其他VrADHs的等电点均小于pI 7,为酸性蛋白。VrADH1、VrADH3、VrADH4、VrADH10、VrADH11和VrADH12的亲水性系数小于0,说明这6个VrADHs均为亲水性蛋白;其他9个VrADHs均为疏水性蛋白。

表1 绿豆VrADHs蛋白的理化性质
2.1.3 ADHs蛋白的系统发育分析 绿豆VrADHs蛋白与模式植物拟南芥和同科植物大豆ADHs蛋白的NJ系统发育树见图3。
由图3可见:除GmADH28外,54个ADHs分为3个分支,分支Ⅰ包含VrADH1、GmADH21、GmADH22、GmADH23、GmADH29和GmADH31;分支 Ⅱ 包含VrADH6和GmADH1;分支Ⅲ包含其余的46个ADHs。分支Ⅲ可进一步分为3个亚组,每个亚组均包含3种植物的ADHs。其中,亚组Ⅲ1包含VrADH14、VrADH15、AtADH4、AtADH6、AtADH7、AtADH8以及9个GmADHs;亚组Ⅲ2包含VrADH10、VrADH11、VrADH12、AtADH2、AtADH3以及6个GmADHs;亚组Ⅲ3包含VrADH2、VrADH3、VrADH4、VrADH5、VrADH7、VrADH8、VrADH9、VrADH13、AtADH1、AtADH5以及10个GmADHs。总体而言,绿豆与大豆的ADHs间具有更近的亲缘关系。

●: 绿豆Vigna radiata (Linn.) R. Wilczek; ▲: 拟南芥Arabidopsis thaliana (Linn.) Heynh; ■: 大豆Glycine max (Linn.) Merr. 分支上的数值表示自展支持率The values on the branches represent the bootstrap support rates.
2.1.4 ADHs蛋白结构域分析 绿豆、拟南芥和大豆的ADHs蛋白结构域见图4。由图4可见:ADHs蛋白具有3种结构域,分别为ADH_N、ADH_zinc_N和ADH_zinc_N_2,绿豆、拟南芥和大豆的ADHs蛋白的结构域存在差异,多数ADHs蛋白仅含ADH_N和ADH_zinc_N结构域,而含有3个结构域的ADHs仅占10.9%。
在绿豆的15个VrADHs蛋白中,仅VrADH10含有1个结构域(ADH_N结构域),其他14个VrADHs均含有ADH_N和ADH_zinc_N结构域,且VrADH1还含有ADH_zinc_N_2结构域。在大豆的32个GmADHs蛋白中,GmADH28不包含结构域,GmADH15和GmADH24仅含有ADH_N结构域,其他GmADHs均含有ADH_N和ADH_zinc_N结构域,且GmADH21、GmADH22、GmADH23、GmADH29和GmADH31还含有ADH_zinc_N_2结构域。而在拟南芥的8个AtADHs蛋白中,除AtADH5和AtADH5各自仅包含ADH_N和ADH_zinc_N 1个结构域外,其他6个AtADHs均含有ADH_N和ADH_zinc_N结构域,但AtADHs均不包含ADH_zinc_N_2结构域。

: ADH_N结构域ADH_N domain; : ADH_zinc_N结构域ADH_zinc_N domain; : ADH_zinc_N_2结构域ADH_zinc_N_2 domain. Vr: 绿豆Vigna radiata (Linn.) R. Wilczek; At: 拟南芥 Arabidopsis thaliana (Linn.) Heynh.; Gm: 大豆 Glycine max (Linn.) Merr.
2.2 Cd胁迫条件下绿豆幼苗VrADHs基因的表达量及ADH酶活性变化
2.2.1 正常条件下绿豆幼苗不同部位ADHs基因的表达谱 依据log2TPM绘制15个VrADHs基因在绿豆幼苗根、茎和叶片中的表达谱(图5),结果表明:在15个VrADHs基因中,VrADH7、VrADH8和VrADH10在幼苗的根、茎和叶片中均未表达,而其他12个VrADHs基因均有不同水平的表达,且相对表达量因生长时间不同而异,并表现出不同的变化趋势。
在幼苗根中,表达量最高的基因为VrADH1,其相对表达量(TPM值)在培养1、5和9 d分别达到282.95、164.21和161.47。在幼苗茎中,表达量最高的基因为VrADH3,其TPM值在培养1、5和9 d分别为4 523.37、229.39和148.28;VrADH6基因的相对表达量在培养9 d也达到较高水平,TPM值为199.25。在幼苗叶片中,相对表达量最高的基因为VrADH14,其TPM值在培养1、5和9 d分别为141.29、118.86和88.93。总体上,在15个VrADHs基因中,仅VrADH6基因在根、茎和叶片中表达量均较高,且在幼苗的不同生长时间该基因的相对表达量均维持在较高水平。
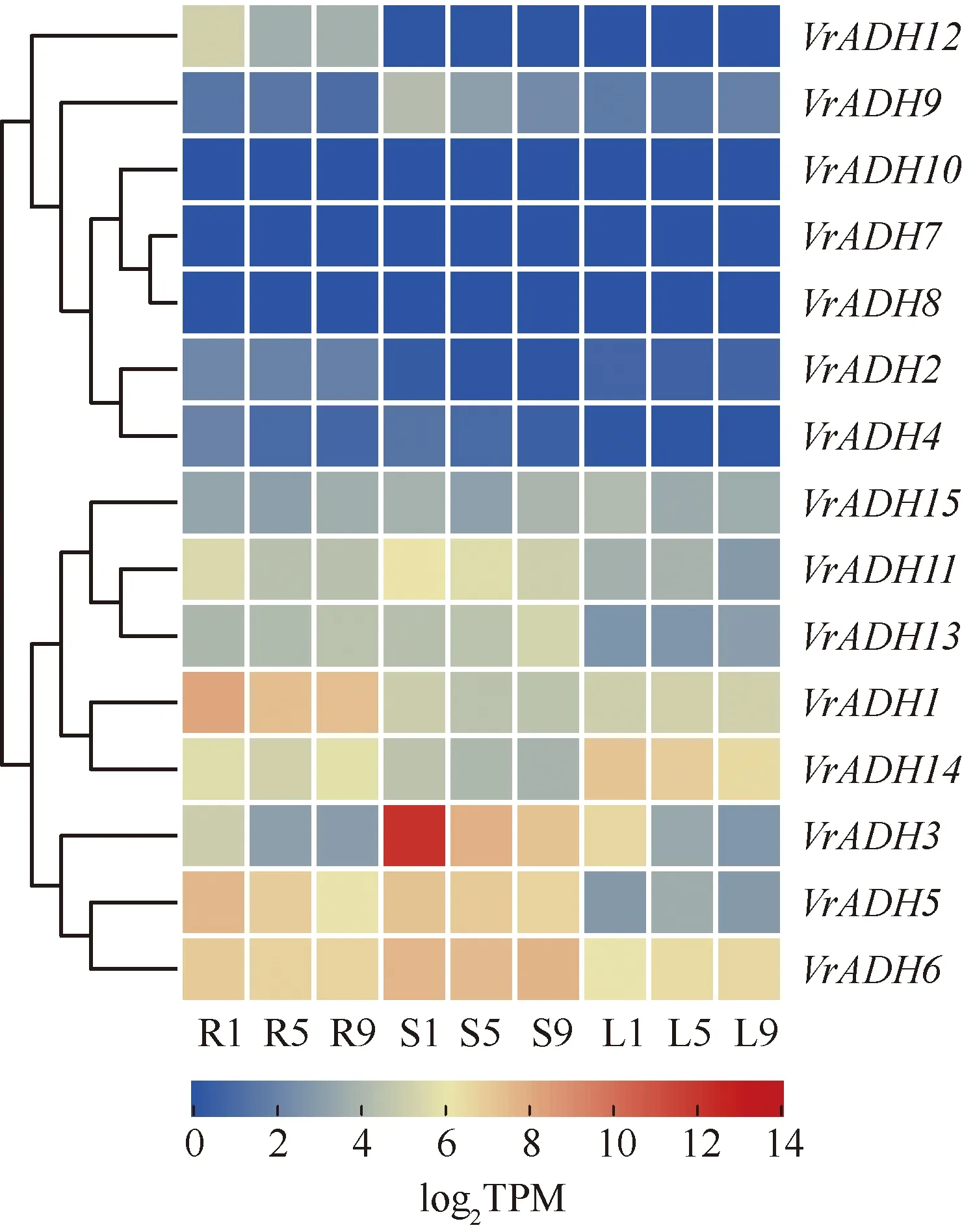
R1, R5, R9: 分别为培养1、5和9 d的幼苗根Seedling roots cultured for 1, 5 and 9 d, respectively; S1, S5, S9: 分别为培养1、5和9 d的幼苗茎Seedling stems cultured for 1, 5 and 9 d, respectively; L1, L5, L9: 分别为培养1、5和9 d的幼苗叶片Seedling leaves cultured for 1, 5 and 9 d, respectively.
此外,一些VrADHs基因的表达也表现出组织特异性。其中,VrADH12基因在根中低水平表达,VrADH2基因在根和叶片中低水平表达,VrADH4基因在根和茎中低水平表达。聚类分析结果表明:依据相对表达量可将15个基因分为2组,其中VrADH2、VrADH4、VrADH7、VrADH8、VrADH9、VrADH10和VrADH12基因聚为一组,这些基因在绿豆的根、茎和叶片中不表达或表达水平较低;其他8个基因聚为另一组,这些基因在绿豆的根、茎和叶片中均有不同水平的表达。
2.2.2 Cd胁迫条件下绿豆幼苗VrADHs基因的表达量变化 在100 μmol·L-1Cd胁迫下绿豆幼苗根、茎和叶片中VrADHs基因相对表达量的变化分别见表2、表3和表4。结果表明:在Cd胁迫和对照条件下,在15个VrADHs基因中,VrADH7、VrADH8和VrADH10基因在幼苗的根、茎和叶片中均未表达;Cd胁迫处理可明显影响绿豆幼苗根、茎和叶片中VrADHs基因的表达水平,且相对表达量因幼苗生长时间的不同而异;与对照相比,Cd胁迫条件下多数VrADHs基因在绿豆幼苗根、茎和叶片中的表达量上调。
由表2可见:Cd处理1 d,除VrADH1、VrADH9和VrADH12基因外,幼苗根中其他基因的表达水平均较对照上调;其中,VrADH2、VrADH4、VrADH5和VrADH13基因的相对表达量分别较对照提高了52.82、90.39、1.46和1.05倍,而VrADH1和VrADH12基因的相对表达量则分别较对照降低了55.44%和87.84%,差异均达显著(P<0.05)水平。Cd处理5 d,VrADH3、VrADH5、VrADH6、VrADH12和VrADH13基因的表达水平均较对照下调,而其他7个基因的表达水平均较对照上调;其中,VrADH4、VrADH14和VrADH15基因的相对表达量分别较对照提高了4.54、454.22和43.18倍,VrADH6和VrADH12基因的相对表达量分别较对照降低了29.39%和81.40%,差异均达显著水平。Cd处理9 d,VrADH1、VrADH2、VrADH3、VrADH6和VrADH12基因的表达水平均较对照下调,而其他7个基因的表达水平均较对照上调,其中,VrADH9、VrADH14和VrADH15基因的相对表达量分别较对照提高了4.45、16.68和2.70倍,VrADH12基因的相对表达量较对照降低了89.78%,差异均达显著水平。
由表3可见:Cd处理1 d,除VrADH1、VrADH11和VrADH15基因外,幼苗茎中其他基因的表达水平均较对照上调;其中,VrADH2、VrADH4、VrADH6和VrADH14基因的相对表达量分别较对照提高了0.88、1.15、0.31和0.42倍,差异均达显著水平;其他基因的相对表达量高于或低于对照,但均无显著差异。Cd处理5 d,仅VrADH11基因的表达水平较对照下调,其他基因的表达水平均较对照上调;其中,VrADH1、VrADH3、VrADH4、VrADH12、VrADH13和VrADH14基因的相对表达量分别较对照提高了1.01、2.91、7.32、19.00、0.39和6.65倍,差异均达显著水平。Cd处理9 d,仅VrADH6、VrADH13和VrADH15基因的表达水平较对照下调,其他基因的表达水平均较对照上调;其中,VrADH1、VrADH2、VrADH3、VrADH5、VrADH12和VrADH14基因的相对表达量分别较对照提高了1.21、3.63、1.00、1.94、23.00和12.04倍,差异均达显著水平。
由表4可见:在对照组中,叶片中VrADH12基因在处理1和5 d均不表达;在Cd处理组中,该基因在处理1 d也不表达,但在处理5和9 d低水平表达。Cd处理1 d,除VrADH2、VrADH11、VrADH14和VrADH15基因外,幼苗叶片中其他基因的表达水平均较对照上调;其中,VrADH2、VrADH14和VrADH15基因的相对表达量分别较对照降低了80.28%、30.95%和30.12%,差异均达显著水平。Cd处理5 d,VrADH2、VrADH6、VrADH9和VrADH15基因的表达水平均较对照下调,而其他基因的表达水平均较对照上调;其中,VrADH1、VrADH3和VrADH13基因的相对表达量分别较对照提高了1.18、39.16和0.50倍,VrADH2基因的相对表达量较对照降低了82.00%,差异均达显著水平。Cd处理9 d,VrADH2、VrADH4、VrADH6、VrADH9和VrADH14基因的表达水平均较对照下调,其他基因的表达水平均较对照上调;其中,VrADH1、VrADH3和VrADH11基因的相对表达量分别较对照提高了1.42、75.93和0.92倍,VrADH2基因的相对表达量较对照降低了79.41%,差异均达显著水平。

表2 Cd胁迫下绿豆幼苗根中VrADHs基因相对表达量的变化

表3 Cd胁迫下绿豆幼苗茎中VrADHs基因相对表达量的变化
表4 Cd胁迫下绿豆幼苗叶片中VrADHs基因相对表达量的变化
2.2.3 Cd胁迫条件下绿豆幼苗ADH酶活性变化经100 μmol·L-1Cd处理1~9 d绿豆幼苗根、茎和叶片中ADH酶活性的变化见图6。结果表明:在对照和Cd胁迫条件下,绿豆幼苗根和茎中的ADH酶活性随处理时间的延长总体呈下降趋势,且在对照条件下叶片中的ADH酶活性也随处理时间的延长总体呈下降趋势;但在Cd胁迫条件下,叶片的ADH酶活性则波动变化,且在处理3~9 d均高于处理1 d。
幼苗根中ADH酶活性在Cd处理1、3、5和7 d均较对照不同程度升高,但在Cd处理9 d接近对照水平;其中,Cd处理3和9 d ADH酶活性分别较对照升高了27.68%和89.50%,差异均达显著水平。

幼苗茎中ADH酶活性在Cd处理1 d略低于对照,但在Cd处理3、5、7和9 d则不同程度高于对照;其中,Cd处理3、5和9 d ADH酶活性分别较对照升高了48.60%、47.05%和65.30%,且在Cd处理5和9 d与对照差异显著。
幼苗叶片中ADH酶活性在Cd处理1 d显著低于对照,而在Cd处理3、5、7和9 d均不同程度高于对照;其中,Cd处理3和9 d ADH酶活性较对照分别升高了54.20%和75.90%,差异达显著水平。
3 讨论和结论
对比绿豆、拟南芥和大豆的ADHs基因,3种植物的ADHs基因结构相似度较高,且大部分基因编码的氨基酸序列具有相似的motif,如绿豆的VrADH1基因与大豆的GmADH21、GmADH22、GmADH23、GmADH29和GmADH31基因编码的氨基酸序列均包含8个相同的motif,且均缺少motif5和motif7。这一结果部分佐证了绿豆VrADHs基因与同科植物大豆的GmADHs基因具有相近的结构。不同植物的ADHs基因也存在一定差异,例如:绿豆的VrADH10基因编码的氨基酸序列仅包含motif3,大豆的GmADH28基因编码的氨基酸序列仅含motif1,GmADH26基因编码的氨基酸序列包含motif1、motif9、motif3和motif5,GmADH15和GmADH24基因编码的氨基酸序列则包含motif1和motif9。植物ADHs基因家族祖先的标准内含子数量为9个,分布在染色体上大致相同的位置[24],植物ADHs基因在进化过程中通过基因重复获得新的底物特异性[25],且其内含子的长度、数量和分布通常为该基因的进化奠定了基础。绿豆的VrADHs基因含有7~9个内含子,其内含子数量差异性可能与基因的串联排列和相互作用有关[26]。
绿豆不同ADHs蛋白的相对分子质量、等电点、亲水性系数等理化特征具有一定差异性,根据系统发育树可将绿豆、大豆和拟南芥的ADHs分为3个分支,绿豆的VrADH1和大豆的5个GmADHs聚为分支Ⅰ,绿豆的VrADH6和大豆的GmADH1聚为分支Ⅱ,绿豆和大豆的其余25个ADHs与拟南芥的所有ADHs聚为分支Ⅲ,这一方面表明非同源基因重复事件的发生[27],另一方面佐证了绿豆和大豆ADHs具有更近的亲缘关系。另外,前人通过聚类分析分别将小麦(TriticumaestivumLinn.)[28]和甜瓜[29]的ADHs聚为长链、中链和短链3类,与本研究结果有一定差异,可能与基因鉴定和筛选的方法不同有关。从绿豆VrADHs的氨基酸序列长度看,仅VrADH10属于短链脱氢酶,VrADH1、VrADH2、VrADH7、VrADH11、VrADH12和VrADH15属于长链脱氢酶,其余VrADHs属于中链脱氢酶;短链ADHs的辅酶结合区缺乏锌和半胱氨酸残基,且仅有少数短链ADHs的功能已知[30],因此,绿豆VrADH10的具体功能有待进一步研究。此外,绿豆的所有VrADHs都包含ADH_N结构域,且除VrADH10外,其他VrADHs还包含ADH_zinc_N结构域,说明多数ADHs具有基本相同的结构域,这一现象在其他植物的ADHs研究中得到证实[31]。此外,拟南芥的AtADHs中不存在ADH_zinc_N_2结构域,但绿豆的VrADH1和大豆的5个GmADHs中却存在此结构域,这一结果与“绿豆和大豆的ADHs具有更近的亲缘关系”相印证。
在绿豆的15个VrADHs基因中,12个基因在根、茎和叶片中有不同水平表达,且VrADH1、VrADH3、VrADH5、VrADH6和VrADH14基因在根、茎和叶片中的表达水平均较高,VrADH9、VrADH15、VrADH11和VrADH13基因表达水平较低,而VrADH7、VrADH8和VrADH10基因在正常和Cd胁迫条件下均不表达。VrADH7和VrADH8基因的表达产物是VrADH6基因的转录变体(transcript variant),主要存在于哺乳动物中[32];VrADH10基因与乙醇代谢调控和乙醛合成有关,且参与的代谢途径主要发生在酵母中,在高等植物中仅在水淹胁迫条件下表达[33,34]。这可能是3个基因在绿豆不同部位中不表达的主要原因。
ADHs参与植物的基本代谢过程[35],不同基因在植物的不同发育阶段和不同组织中具有各自的功能[29]。从表达水平看,Cd胁迫后绿豆根中VrADH2、VrADH4和VrADH14基因的表达水平较高,茎中VrADH3基因的表达水平较高,叶片中VrADH1、VrADH3和VrADH5基因的表达水平较高,表明Cd胁迫后VrADHs基因的表达具有组织特异性。Cd胁迫可导致绿豆根、茎和叶片中部分VrADHs基因的表达水平大幅升高。例如:Cd处理1 d,与对照相比,根中VrADH2、VrADH4、VrADH5和VrADH13基因以及茎中VrADH2、VrADH4、VrADH6和VrADH14基因的相对表达量显著升高,但叶片中ADHs基因的相对表达量无显著升高;Cd处理5 d,与对照相比,根中VrADH4、VrADH14和VrADH15基因以及叶片中VrADH1、VrADH3、VrADH5和VrADH13基因的相对表达量显著升高,茎中VrADH1、VrADH3、VrADH4、VrADH12、VrADH13和VrADH14基因的相对表达量也显著升高;Cd处理9 d,与对照相比,根中VrADH9、VrADH14和VrADH15基因以及叶片中VrADH1、VrADH3、VrADH5和VrADH11基因的相对表达量显著升高,茎中VrADH1、VrADH2、VrADH3、VrADH4、VrADH5、VrADH12和VrADH14基因的相对表达量也显著升高。此外,Cd胁迫也导致绿豆根、茎和叶片中部分VrADHs基因的表达水平降低。例如:Cd处理1、5和9 d,根中VrADH12基因和叶片中VrADH2基因的相对表达量均较对照显著降低。这些数据均说明在绿豆幼苗的不同器官及不同处理时间,各VrADHs基因对Cd胁迫的响应程度不同,说明ADHs基因的表达具有功能冗余性和表达多样性。
由ADHs酶活性分析结果可见:Cd胁迫导致绿豆根、茎和叶片中ADH酶活性升高或降低,在某些处理时间表现极显著。Cd处理1 d,根和茎中ADH酶活均无显著变化,而叶片中ADH酶活性则显著降低,可能与叶片中VrADH2、VrADH14和VrADH15基因的表达量降低有关;Cd处理3 d,根、茎和叶片中ADH酶活性升高,可能与VrADH2、VrADH4和VrADH5基因的表达量升高有关;Cd处理5和9 d,根、茎和叶片中均有2个以上VrADHs基因的表达量显著升高,根、茎和叶片中ADH酶活性也不同程度升高。显然,Cd胁迫导致绿豆幼苗根、茎和叶片中VrADHs基因表达水平的升高或降低,而不同器官中以及不同处理时间ADH酶活性也有升有降,这一现象进一步佐证了ADHs基因参与绿豆幼苗对Cd胁迫的响应。在Cd胁迫初期,绿豆幼苗进行有氧呼吸,体内尚未积累大量的乳酸和乙醇等代谢物质[35];但随胁迫时间的延长,为了维持机体基本的代谢活动,幼苗开始进行无氧呼吸,此时丙酮酸没有被完全氧化,并在产生乳酸和乙醇的同时释放少量能量,故绿豆幼苗的根、茎和叶片中相应的VrADHs基因高水平表达,进而使ADH酶活性升高,提升糖酵解途径的代谢活性,以减轻这些代谢产物对植物细胞的毒害作用[36,37]。
在绿豆幼苗的生长过程中以及在不同器官中,绿豆的15个VrADHs基因的表达特性均可呈现不同的变化规律,特别是经过Cd胁迫处理后,不同VrADHs基因的表达水平上调或下调,那么,在应对Cd胁迫的过程中,有哪些VrADHs基因起到关键作用,有哪些VrADHs基因对绿豆的ADH酶活性有显著调控作用,其规律性和响应机制如何,这些问题仍有待进一步研究。此外,本研究中有少部分VrADHs基因的相对表达量数据离散程度很大,对方差分析结果可能有一定的影响,导致部分数据的显著性检验结果不准确,但这部分数据并不影响本文的整体结果。
综合分析结果表明:绿豆基因组含有15个VrADHs基因,具备ADH家族基因的基本特征,其基因结构与拟南芥和大豆的ADHs基因结构相似;与拟南芥AtADHs的氨基酸序列相比,绿豆VrADHs与大豆GmADHs的氨基酸序列具有更近的亲缘关系。在绿豆的15个VrADHs基因中,有12个VrADHs基因可在根、茎和叶片中不同程度表达,但表达水平因生长时间而异;在Cd胁迫条件下,绿豆幼苗根、茎和叶片中12个VrADHs基因的表达水平上调或下调,但多数基因的表达水平较对照上调,且在不同处理时间幼苗根、茎和叶片中的ADH酶活性总体上也均高于对照,显示绿豆ADH酶活性的升高与某些VrADHs基因的表达水平上调有关,表明绿豆的某些VrADHs基因参与了绿豆对Cd胁迫的响应过程。

