miR-515-5p通过靶向TRIM31调控PI3K/AKT信号通路对结直肠癌细胞增殖、侵袭及迁移的影响
刘昌化,罗康宁,闫圣玉,尹 恺
0 引 言
结直肠癌(colorectal cancer,CRC)是全球第三大常见癌症,其发病率和死亡率都较高,大约15%的CRC患者发生转移,其平均生存时间不到3 年。在过去10年中,由于新的化疗药物和靶向治疗的发展,转移性CRC患者的临床治疗结果有所改善,但仍有大量患者治疗失败并出现癌转移[1-2]。因此,了解并探索CRC细胞增殖、转移机制,对CRC的精准治疗来说十分重要。微小RNA(microRNA,miRNA)在癌症生物学中具有重要意义,而且已证实miRNA在CRC的进展和转移中发挥作用[3]。MiR-515-5p已被发现在多种人类癌症中发挥抑制肿瘤作用,而且有报道称miR-515-5p与CRC患者的生存期显著相关,但其在CRC增殖、侵袭和迁移中的作用尚不清楚[4]。本研究检测CRC癌组织及细胞系中miR-515-5p表达情况,并通过双荧光素酶报告基因实验证实miR-515-5p与三结构域蛋白31(tripartite motif-containing protein 31,TRIM31)基因靶向调控关系,并进一步分析过表达miR-515-5p对HT-29细胞增殖、侵袭和迁移的影响及机制。
1 材料与方法
1.1 组织样本收集本院2017年5月至2019年3月期间接受CRC切除手术的81对CRC癌组织及癌旁组织,组织样本放于-80 ℃冰箱保存。
1.2细胞和主要试剂结肠上皮细胞NCM460及结肠直肠癌细胞系SW480、SW620、HCT116和HT-29均购自美国典型培养物保藏中心。胎牛血清购自以色列Biological Industries公司;RPMI-1640培养基和TRIzol购自美国Gibco公司;引物序列均由苏州金唯智公司合成;miR-515-5p mimic及其阴性对照(mimic NC)和TRIM31过表达质粒载体(pcDNA3.1-TRIM31)及其空白载体(Vector)由上海吉凯制药技术有限公司设计和构建;实时荧光定量聚合酶链反应试剂盒购自美国罗氏公司;反转录试剂盒购自日本Takara公司;BCA蛋白浓度测定试剂盒和CCK-8试剂盒购自上海碧云天生物技术有限公司;lipofectamine 2000 购自美国Thermo Fisher公司;荧光素酶报告系统购自美国Promega公司;GAPDH抗体购自英国Abcam公司;TRIM31抗体、PI3K(p110α)抗体、p-AKT(Ser473)抗体和Ak3抗体购自美国CST公司。
1.3细胞培养所有细胞加入含10%胎牛血清的RPMI-1640培养基,置于条件为37 ℃、5% CO2的培养箱中培养。
1.4细胞分组及转染将HT-29细胞分为空白对照组(blank组),mimic NC 组(转染mimic NC)或mimic NC+Vector组(共转染mimic NC和Vector质粒)、miR-515-5p mimic组(转染miR-515-5p mimic)、pcDNA3.1-TRIM31组(转染过表达质粒pcDNA3.1-TRIM31)和mimic+pcDNA3.1-TRIM31组(共转染miR-515-5p mimic和过表达质粒pcDNA3.1-TRIM31)。将HT-29细胞接种于6孔板中,每孔2.5×105个细胞,待细胞融合度达到85%时,按照 lipofectamine 2000试剂盒说明书进行转染操作。
1.5qRT-PCR检测采用TRIzol裂解液提取CRC组织及相应细胞中总RNA,然后使用逆转录酶和逆转录引物合成cDNA。配制qRT-PCR反应体系,进行PCR反应。引物序列如下:miR-515-5p上游引物5′-TTCTCCAAAAGAAAGCACTTT CTG-3′,下游引物5′-CTCGCTTCGGCAGCACA-3′;U6上游引物5′-CTCGCTTC GGCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′。TRIM31上游引物5′-CCAGAGTCAAACCGTGAGCG-3′,下游引物5′-GGCAACTTGGAGC CCGAA-3′;GAPDH上游引物5′-CTCTGCTCCTCCTGTTCGAC-3′,下游引物5′- GCGCCCA ATACGACCAAATC-3′。以U6为内参定量,计算miR-515-5p的相对表达量;以GADPH为内参定量,计算TRIM31 mRNA的相对表达量。
1.6双荧光素酶报告基因实验利用生物信息学软件Targetscan 7.1预测TRIM313′-UTR区域是否存在miR-515-5p的假定结合位点。根据假定结合位点序列,合成含有TRIM31野生型(WT)3′-UTR和突变型(MUT)3′UTR序列,并将两者分别构建到荧光素酶报告载体中,得到TRIM31-WT和TRIM31-MUT荧光素酶报告质粒。将miR-515-5p mimic 和mimic-NC分别与TRIM31-WT和TRIM31-MUT质粒转染至HT-29细胞中,培养48 h。后根据试剂盒说明书检测各组细胞中海肾和萤火虫荧光素酶活性,然后以海肾荧光素酶活性为标准进行定量。
1.7CCK-8实验将转染后各组HT-29细胞以每孔1×104个接种于96 孔板中,分别培养24、48 h。再向每孔加入10 μL的CCK-8溶液,接着孵育2 h。最后使用酶标仪检测每孔在450 nm波长处的A值,以A450值表示各组细胞增殖活性。
1.8细胞克隆形成实验将转染后各组HT-29细胞以每孔500个接种于6 孔板中,培养12 d。观察到细胞克隆后,用4%多聚甲醛固定15 min,1%结晶紫室温染色10 min,PBS洗涤。倒置晾干后,显微镜观察统计细胞克隆数量。
1.9Transwell迁移与侵袭实验迁移实验:将转染后各组HT-29细胞,用不含血清的RPMI-1640培养基将细胞调整至浓度为1×105个/mL的细胞悬液,向24孔Transwell小室的上层加入200 μL细胞悬液。随后,向小室下层加入500 μL含有10% FBS的RPMI-1640培养基,培养箱孵育24 h。小室从培养箱取出,吸净小室上下层的培养基,多聚甲醛固定,结晶紫染色,将小室中的膜取下来,用载玻片固定后,显微镜观察统计侵入细胞的数量。侵袭实验需提前将用不含血清的RPMI-1640培养基稀释的matrigel胶(1mg/mL)铺到小室上层底部,后续步骤同上述迁移实验。
1.10Western blot实验裂解各组细胞,提取总蛋白并进行定量。用10% SDS-PAGE将各组蛋白电泳分离,随后将蛋白移至PVDF膜。用5%脱脂奶粉将PVDF膜封闭2 h,加入TRIM31(1∶1000)、PI3K(p110α)(1∶1000)、AKT (1∶1000)、p-AKT(1∶1000)、GAPDH(1∶1000)一抗4 ℃过夜,再加入标记HRP的二抗(1∶10 000)室温反应1 h,最后滴加ECL放入显影仪中曝光。利用Image J软件对各组蛋白条带进行灰度定量分析。

2 结 果
2.1 CRC组织和CRC细胞系中miR-515-5p表达水平qRT-PCR结果显示,与癌旁组织比较,CRC癌组织中miR-515-5p表达水平明显降低(P<0.01);与结肠上皮细胞NCM460相比,CRC细胞株SW480、SW620、 HCT116和HT-29中miR-515-5p表达水平均明显降低 (P<0.01),见图1。其中HT-29细胞内miR-515-5p表达水平最低,选择其进行后续实验。

a:qRT-PCR检测CRC癌组织中miR-515-5p表达水平;b:qRT-PCR检测不同CRC细胞系中miR-515-5p表达水平
2.2miR-515-5p与TRIM31的靶向关系qRT-PCR结果显示,与blank组或mimic NC组比较,mimic组HT-29细胞中miR-515-5p表达水平显著上升(P<0.01),而TRIM31 mRNA表达水平显著降低(P<0.01)。同时,Western blot检测结果显示,与blank组或mimic NC组比较,mimic组HT-29细胞中TRIM31蛋白表达水平显著降低(P<0.01),见图2。生物信息学软件TargetScan 7.1预测结果显示,miR-515-5p与TRIM31基因3′-UTR区域存在结合位点,见图3a。进一步双荧光素酶报告基因实验结果证实,在共转染TRIM31-WT质粒的细胞中,与mimic-NC组比较,miR-515-5p mimic组细胞的相对荧光素酶活性明显降低(P<0.01),见图3b;而在共转染TRIM31-MUT质粒的细胞中,与mimic NC组比较,miR-515-5p mimic组细胞的相对荧光素酶活性无明显差异(P>0.05),见图3b。

1:balnk组;2:mimic NCr组;3:mimic组
2.3共转染后HT-29细胞中TRIM31蛋白表达水平Western blot检测结果显示,与blank组或mimic NC+Vector组比较,mimic组HT-29细胞中TRIM31蛋白表达水平显著降低(P<0.01),而pcDNA3.1-TRIM31组HT-29细胞中TRIM31蛋白表达水平显著升高(P<0.01)。与mimic组比较,mimic+pcDNA3.1-TRIM31组HT-29细胞中TRIM31蛋白表达水平显著升高(P<0.01),见图4。
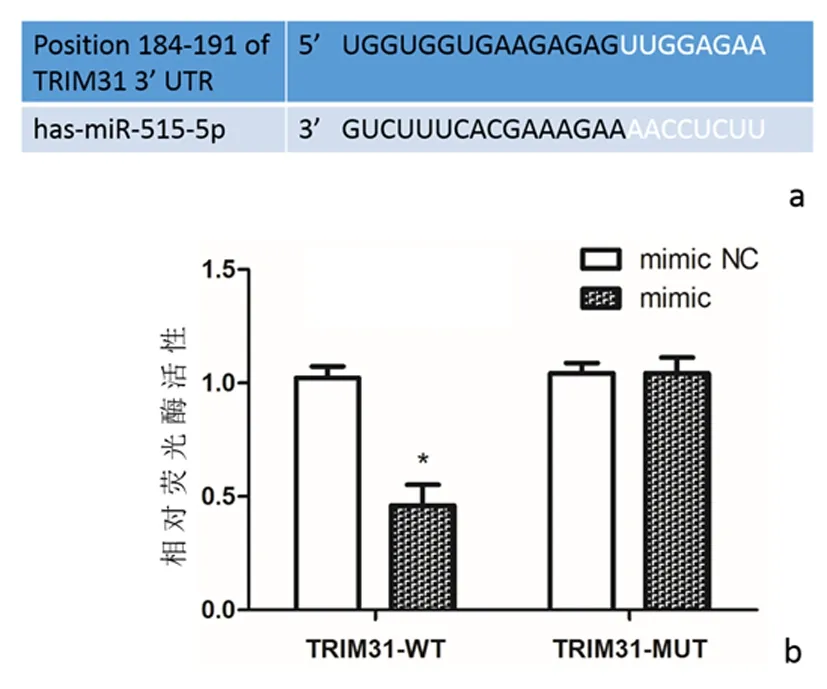
a:生物信息学预测;b:荧光素酶报告基因实验

1:balnk组;2:mimic NC+Vector组;3:mimic组;4:pcDNA3.1-TRIM31组;5:mimic+pcDNA3.1-TRIM31组
2.4miR-515-5p 过表达对HT-29细胞增殖的影响CCK-8检测结果显示,细胞培养24 h和48 h,与blank组或mimic NC+Vector组比较,mimic组HT-29细胞增殖活性均显著降低(P<0.01),pcDNA3.1-TRIM31组HT-29细胞增殖活性均显著升高(P<0.01);与mimic组比较,mimic+pcDNA3.1-TRIM31组HT-29细胞增殖活性均又显著升高(P<0.01),见图5。同时,平板克隆形成实验结果显示,与blank组细胞克隆数[(126.67±8.08)个/孔]或mimic NC+Vector组细胞克隆数[(123.33±6.51)个/孔]比较,mimic组HT-29细胞克隆数[(50.00±11.53)个/孔]明显降低(P<0.01),而pcDNA3.1-TRIM31组HT-29细胞克隆数[(197.33±20.21)个/孔]明显增加(P<0.01);与mimic组比较,mimic+pcDNA3.1-TRIM31组HT-29细胞克隆数[(152.33±7.64)个/孔]又明显增加(P<0.01)。

1:balnk组;2: mimic NC+Vector组;3:mimic组;4: pcDNA3.1-TRIM31组;5:mimic+pcDNA3.1-TRIM31组
2.5miR-515-5p 过表达对HT-29细胞迁移和侵袭的影响Transwell实验结果显示,与blank组或mimic NC+Vector组比较,mimic组HT-29细胞迁移和侵袭细胞数明显降低(P<0.01),而pcDNA3.1-TRIM31组HT-29细胞迁移和侵袭细胞数明显增加(P<0.01);与mimic组比较,mimic+pcDNA3.1-TRIM31组HT-29细胞迁移和侵袭细胞数又明显增加(P<0.01),见表1。
2.6过表达miR-515-5p通过靶向TRIM31调控PI3K/AKT信号通路Western blot 检测结果显示,与blank组或mimic NC+Vector组相比,mimic组HT-29细胞中PI3K(p110α)和p-AKT蛋白表达水平明显降低(P<0.01),pcDNA3.1-TRIM31组HT-29细胞中PI3K(p110α)和p-AKT蛋白表达水平明显升高(P<0.01)。与mimic组比较,mimic+pcDNA3.1-TRIM31组HT-29细胞中PI3K(p110α)和p-AKT蛋白表达水平明显升高(P<0.01)。而以上5组HT-29细胞之间AKT蛋白表达水平相互比较差异无统计学意义(P>0.05),见图6。

表 1 miR-515-5p 过表达对HT-29细胞迁移和侵袭的影响
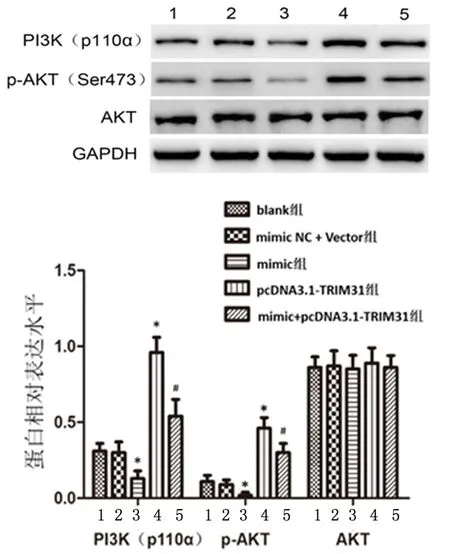
1:balnk组;2: mimic NC+Vector组;3:mimic组;4: pcDNA3.1-TRIM31组;5:mimic+pcDNA3.1-TRIM31组
3 讨 论
三结构域蛋白( tripartite motif-containing protein,TRIM)家族蛋白的成员,有一个共同的三联结构域,由一个RING域、一个或两个B-box域和一个卷曲螺旋域组成。一些TRIM家族蛋白在泛素介导的蛋白质降解途径中起到E3泛素连接酶的作用。TRIM31是TRIM蛋白家族的一员,也是一种E3泛素蛋白连接酶,可以通过促进其靶蛋白的降解而发挥作用,广泛参与细胞增殖、细胞周期调节以及免疫反应等生物过程[5-6]。TRIM31在癌症发展中发挥重要作用,例如,TRIM31在肺癌细胞中的表达较低,其过表达抑制了非小细胞肺癌细胞的生长[7];TRIM31被证明是miR-551b的靶基因,miR-551b靶向下调TRIM31促进了卵巢癌细胞的增殖和侵袭[8]。这些发现都表明TRIM31具有抑制肿瘤作用。然而,有研究发现TRIM31在肝细胞癌、神经胶质瘤、胆囊癌和胰腺癌等肿瘤中高表达并促进肿瘤细胞增殖、迁移和侵袭,TRIM31表现出肿瘤促进作用[9-12]。因此,在不同肿瘤中,TRIM31基因可表现为致癌基因或抑癌基因。
研究报道,miR-515-5p已被发现在非小细胞肺癌、乳腺癌、前列腺癌和胃癌等多种癌症中发挥抑制肿瘤作用[13-16]。例如,在非小细胞肺癌和乳腺癌中,miR-515-5p通过下调MARK4抑制细胞迁移[13];在前列腺癌中,miR-515-5p作为肿瘤抑制因子通过靶向TRIP13来调节细胞增殖、迁移和侵袭[15];在胃癌细胞中,miR-515-5p通过靶向 Wnt3抑制细胞增殖和侵袭[16]。此外,有报道miR-515-5p与CRC患者的生存期显著相关,但其在CRC增殖、侵袭和迁移中的作用尚不清楚[4]。本研究前期用qRT-PCR分析CRC临床样本组织和细胞系中miR-515-5p的相对表达水平。结果显示,与癌旁组织和结肠上皮细胞NCM460相比,CRC组织和CRC细胞系中miR-515-5p的表达水平明显降低。此外,通过向HT-29细胞转染miR-515-5p mimic,发现细胞内miR-515-5p表达量升高后,TRIM31基因在mRNA水平和蛋白水平表达都显著降低。通过生物信息学软件预测miR-515-5p与TRIM31基因3′-UTR区域存在碱基结合位点,并进一步通过双荧光素酶报告基因实验证实miR-515-5p靶向作用TRIM31。
本研究发现,过表达miR-515-5,HT-29细胞增殖、迁移和侵袭能力显著降低,而过表达TRIM31,HT-29细胞增殖、迁移和侵袭能力显著升高。共转染miR-515-5p mimic和pcDNA3.1-TRIM31后,发现可以明显逆转单一过表达miR-515-5导致的HT-29细胞增殖、迁移和侵袭能力明显降低。结果说明,过表达miR-515-5可以通过下调TRIM31从而导致HT-29细胞增殖、迁移和侵袭能力降低。
PI3K/AKT信号通路在CRC的发生发展具有重要作用,表现为其可以促进CRC细胞增殖,调控细胞周期,参与CRC血管形成的调控,促进CRC细胞侵袭等[17]。研究报道,白藜芦醇通过PI3K/AKT信号通路协同5-氟尿嘧啶对CRC细胞的抑制作用;莲房原花青素调控RAC1/PI3K/AKT信号途径抑制CRC细胞的增殖、迁移与侵袭;雷公藤甲素调节PI3K/AKT信号通路抑制CRC细胞增殖同时诱导其凋亡,并通过抑制PI3K/AKT信号通路活性抑制CRC裸鼠的肿瘤生长[18-20]。这些研究进一步表明,PI3K/AK信号通路对CRC细胞增殖、侵袭及迁移产生影响。此外研究报道,在胆囊癌细胞和胶质瘤细胞中,TRIM31可以通过PI3K/AKT信号通路促进肿瘤细胞的增殖和侵袭[11,21]。本研究进一步分析过表达miR-515-5p下调TRIM31是否通过PI3K/AKT信号通路抑制HT-29细胞增殖、迁移和侵袭。通过Western blot检测HT-29细胞中PI3K(p110α)和p-AKT蛋白表达的表达水平,结果发现过表达miR-515-5,HT-29细胞中PI3K和p-AKT蛋白表达水平显著降低,而过表达TRIM31,HT-29细胞中PI3K(p110α)和p-AKT蛋白表达水平显著升高。此外,过表达TRIM31可以明显逆转过表达miR-515-5导致的PI3K(p110α)和p-AKT蛋白表达水平降低。结果提示,过表达miR-515-5可能通过靶向TRIM31调控PI3K/AKT信号通路影响CRC细胞增殖、侵袭及迁移。
综上所述,在CRC临床样本组织和CRC细胞系中,miR-515-5p低表达。过表达miR-515-5可能靶向TRIM31通过PI3K/AKT信号通路抑制CRC细胞增殖、迁移和侵袭,这可能为CRC的治疗提供新思路。
——一道江苏高考题的奥秘解读和拓展

