榄香烯注射液的研究概况
郑国群 于 佳 吴明伟*
1.贵州省黎平县中医医院,贵州 黎平 557300;2.贵州省中医药大学第一附属医院,贵州 贵阳 550000
榄香烯注射液(Elemene injection)是我国自主研制的一种二类非细胞毒性抗肿瘤药物,其主要抗肿瘤活性物质榄香烯[1-2](Elemene)是从姜科植物温郁金(CurcumawenyujinY. H. Chen et C. Ling)、温莪术(CurcumaaromaticaSalisb.)中提取的一种具有抗肿瘤活性的倍半萜烯类化合物,主要以β-榄香烯、γ-榄香烯和δ-榄香烯的油状混合物形式存在。榄香烯注射液的原药材温莪术是姜科植物蓬莪术CurcumaphaeocaulisVal. 、广西莪术CurcumakwangsiensisS. G. Lee et C. F. Liang或温郁金CurcumawenyujinY. H. Chen et C. Ling的干燥根茎,味辛、苦,性温,既可入血分,又能入气分,具有破血行气、消积止痛之功效,为破血消癥之要药,用于瘀血经闭、食积腹胀、癥瘕痞块等,其中医、中药学应用首载于《药性论》:“治女子血气心痛,破痃癖冷气,以酒醋摩服。”温郁金是姜科植物蓬莪术CurcumaphaeocaulisVal. 、广西莪术CurcumakwangsiensisS. G. Lee et C. F. Liang、姜黄CurcumalongaL.或温郁金CurcumawenyujinY. H. Chen et C. Ling的干燥根茎的干燥块根,味辛、苦,性寒,具有活血行气、开郁止痛、凉血清心和利胆退黄之功效,可用于血瘀气滞之胸肋腹痛、热病神昏、癫痫等证,肝胆湿热证和肝郁化火、气火上逆,迫血旺行之吐血、衄血及妇女倒经等。《本草备要》中记载,郁金可行气、解郁、泄血、破淤,凉心热、散肝郁,治妇人经脉逆行。现代药理学研究表明,莪术和温郁金均具有较好的抗肿瘤、抗炎镇痛、抗病毒、抗早孕、抗菌、保肝、抗纤维组织增生、保护心血管系统、细胞毒等作用,为临床常用的活血化瘀类药物。使用温莪术和温郁金制备的榄香烯注射液主要成分为β-、γ-和δ-榄香烯是榄香烯的3种同分异构体,其中β-榄香烯分子式为C15H24[3-4](化学名为1-甲基-1-乙烯基-2,4-二异丙基环己烷,结构见图1),是抗肿瘤作用的主要活性物质。该药对许多肿瘤细胞都具有明显的抑杀作用,如肺癌细胞、肺腺癌细胞及直肠癌细胞等,亦可用于介入、腔内化疗及癌性胸腹水的治疗。自1994年投入市场之后,榄香烯注射液在多种肿瘤和癌症的临床治疗上获得了大量应用。
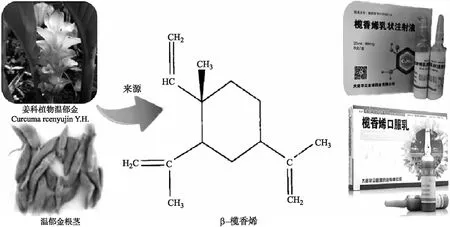
图1 β-榄香烯(1-甲基-1-乙烯基-2,4-二异丙基环己烷)(摘自文献[5])
1 榄香烯注射液作用机制研究进展
1.1 抑制肿瘤细胞增殖 肿瘤主要由肿瘤细胞组成,增长速度很快,生长旺盛,与整个机体不协调,能无限制地分裂和增殖,肿瘤细胞增殖周期包括增殖、非增殖和无增殖能力三个细胞群。增殖细胞群是指处于不断按指数分裂增殖的细胞,它们对肿瘤的生长、复制、播散和转移起决定性作用。因此,抑制肿瘤细胞的增殖可有效地控制肿瘤的发生发展,同时亦是治疗恶性肿瘤的重要手段或途径之一。曹阳等[6]研究发现榄香烯对肺癌细胞生长具有抑制作用,同时亦降低了bcl-2蛋白的表达和bcl-2mRNA水平以及上调p53蛋白的表达。表明榄香烯作用机制可能与上调抑癌基因p53与下调了癌基因bcl-2的表达有关,进而诱使肺癌细胞凋亡。龚敏等[7]研究发现榄香烯对HepG-2细胞增殖的抑制作用主要与其影响DNA拓扑异构酶(topoisomerase I, TOPO)的表达与活性有关,且呈现明显的时间和剂量依赖性。徐希等[8]研究证实了榄香烯对肿瘤细胞生长的抑制作用具有时效和量效关系,诱导Raji细胞的凋亡作用具有一定的浓度依赖性;同时亦发现了细胞周期中的G0/G1期细胞相对增多,而S期和G2/M期细胞均相对地减少,表明榄香烯可抑制肿瘤细胞的增殖,其作用机制是阻滞肿瘤细胞向S期和G2/M期进展,将其停滞在细胞周期中的G0/G1期。
朱廷准等[9]报道榄香烯对人胶质瘤细胞的增殖具有明显的抑制作用,证实了榄香烯抑制肿瘤细胞增殖的作用与阻滞肿瘤细胞的细胞周期有关,且其阻滞作用又与榄香烯上调细胞中 MKK3和 MKK6的磷酸化水平有关。再次证实了榄香烯对肿瘤细胞增殖具有明显的抑制作用。对MKK3/6信号通路的磷酸化激活,在抑制肿瘤细胞增殖过程中起着至关重要的作用,而抑制MKK3和MKK6的活性则可明显消除榄香烯的抗肿瘤作用。
1.2 诱导肿瘤细胞凋亡 细胞的凋亡异常是恶性肿瘤发生发展的主要机制之一,且易受一些基因和蛋白的表达影响。如:Survivin与Caspase-3特异性结合,一方面阻断细胞凋亡效应;另一方面可与细胞核内的细胞周期依赖性蛋白激酶4相结合,抑制p21基因活性,进而抑制细胞凋亡。邹丽娟等[10]研究发现β-榄香烯是通过对K562细胞的杀伤作用,从而导致其细胞凋亡,且其对肿瘤细胞的诱导凋亡作用呈现一定的时效和量效依赖性。李传刚等[11]研究发现榄香烯能够升高人膀胱癌BIU-18细胞内游离Ca2+浓度,并与药物浓度具有一定的依赖性关系。方宁等[12]研究发现β-榄香烯作用于HcaF细胞后可使钙库释放Ca2+,致细胞内游离Ca2+浓度升高;且在细胞凋亡初期,可使细胞质膜的生物学特性发生改变,如:细胞膜中的磷脂酰丝氨酸由内侧翻向外侧,使Ca2+迅速由细胞内向胞外转运,从而导致胞内Ca2+浓度降低。证实了β-榄香烯对HcaF细胞的诱导凋亡作用可能与Ca2+的浓度变化有关,在细胞凋亡早期质膜内Ca2+浓度出现先升高再降低的现象。黄富春等[13]报道β-榄香烯可明显诱导结肠癌LoVo细胞株凋亡,而且在细胞凋亡过程中细胞质内游离Ca2+浓度明显的升高,以细胞凋亡早期尤为明显。由此可见,β-榄香烯可通过影响细胞中Ca2+浓度而发挥其诱导细胞凋亡作用。
吉庆明[14]研究发现榄香烯对肿瘤细胞的诱导凋亡作用,主要与上调白血病K562细胞中PDCD5蛋白表达有关。丁华等[15]发现榄香烯对SHG-44细胞株亦有明显的促凋亡作用,其作用机制是阻滞SHG-44细胞株的增殖,将其细胞周期停滞在G2/M期,对G2/M期的阻滞作用和对肿瘤细胞的促凋亡作用均存在明显的剂量和时间依赖性。榄香烯可显著降低Bcl-2蛋白和增强Bax蛋白的水平表达。亦证实了榄香烯注射液对肿瘤细胞具有显著的抑制增殖作用和诱导其凋亡作用,其作用机制主要是阻滞细胞周期中G2/M期的发生发展,以及抑制Bcl-2蛋白表达。
周兴芹等[16]证实了榄香烯对肿瘤细胞的增殖具有明显抑制作用,将A549 细胞停滞在G2/M期,并可诱导细胞凋亡,同时增殖抑制作用对药物浓度和作用时间具有一定的依赖性。赵永顺等[17]研究指出榄香烯诱导U87细胞凋亡的作用机制是抑制其赖以生存的Raf/MEK/ERK通路,从而下调Raf/MEK/ERK通路下游信号癌基因Bcl-2表达,增加Bax/Bcl-2比值,启动线粒体凋亡程序,最终诱导U87细胞凋亡。
1.3 抑制肿瘤细胞远处转移 恶性肿瘤细胞发生浸润和远端转移是其发生发展的主要特征之一,转移过程由一系列连续和相互关联的步骤组成,包括:肿瘤细胞从原发肿瘤脱离并侵入邻近的健康组织、侵入血液和淋巴管,以及通过血流循环(循环肿瘤细胞)到达其他部位或身体组织中,在其特定的组织器官中生长发育而形成继发性肿瘤。肿瘤细胞的浸润和转移与其运动、黏附能力密切相关,肿瘤细胞只有先突破其周围的基底膜及细胞外间质,才能发生远端转移[18-20]。陈龙邦等[21]研究证实了β-榄香烯可明显抑制B16细胞运动和远处转移,其作用机制通过抑制B16细胞对纤维结合蛋白和粘连层蛋白两种基质的黏附,从而抑制肿瘤细胞运动和远处转移。冯利等[22]研究亦证实了榄香烯对肿瘤细胞的远处转移具有明显的抑制作用,通过对肿瘤细胞基底膜和细胞外间质屏障的保护,从而抑制其发生迁徙和转移。郑瑾等[23]通过划痕试验进一步证实了β-榄香烯可以降低肝癌细胞的侵袭、迁移能力。Fu X等[24]采用β-榄香烯联合紫杉醇治疗卵巢癌时,发现患者卵巢癌细胞的生长、迁移和侵袭受到明显地抑制,发现β-榄香烯联合紫杉醇可明显诱导SKOV3细胞凋亡、下调SKOV3细胞抗凋亡Bcl-2和Bcl-xl基因表达,上调促凋亡p53和Apaf1基因表达,以及在S期阻止SKOV3细胞周期并下调CDK1、细胞周期蛋白-B1、SKOV3细胞中MDR1、LRP和TS的p27基因表达和凋亡相关抗性基因表达。抑制磷酸化的STAT3和NF-κB表达,通过下调SKOV3细胞中的STAT-NF-κB信号通路来抑制迁移和侵袭。Cai B等[25]研究发现经β-榄香烯可显著增加膀胱癌细胞凋亡数,还可明显抑制膀胱癌细胞的侵袭和迁移,而且β-榄香烯还能上调PTEN和降低pAKT的表达而发挥其抗肿瘤作用。由此可见,β-榄香烯可通过抑制肿瘤细胞黏附和运动,阻止其向远端转移而发挥其抗肿瘤作用。
1.4 抑制肿瘤血管生成 肿瘤的血管生成是肿瘤发生、发展和远处转移的基本要素,大量新生的肿瘤血管作为“运输通道”,为癌细胞快速增殖提供了丰富的氧气和养料。肿瘤局部或癌周广泛存在的新生血管为癌细胞入血转移提供了“通道”,让游离癌细胞得以快速地随全身血液流动向远处播散。因此破坏或抑制肿瘤局部的新生血管,切断肿瘤细胞生长所需氧气及其他营养物质,是抗血管生成治疗的核心基础。陶磊等[26]研究发现,榄香烯可显著抑制喉癌细胞株Hep-2增殖和诱导其凋亡,通过抑制碱性纤维母细胞生长因子(basic fibroblast growth factor, bFGF)和血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达,而发挥其抗肿瘤血管生成作用。进一步研究证实,榄香烯主要是通过降低真核细胞翻译起始因子(eukaryotic initiationg factor, eIF)家族成员eIF4E、eIF4G、bFGF和VEGF的表达,从而减轻瘤体的体积和重量,同时其作用与药物浓度呈正相关。张志锋等[27]验证了榄香烯能够降低肿瘤VEGF的生成和VEGF受体(VEGF-1、VEGF-2)的表达,从而肿瘤血管生成。另外,周昆等[28]研究表明榄香烯对肿瘤血管和淋巴管转移的抑制作用,亦是通过抑制SPC-A-1生长的同时降低VEGFR-3和VEGF-C的表达水平而实现。因此,榄香烯抑制肿瘤血管生成的作用机制与其降低eLF家族成员中VEGF和bFGF的蛋白表达有关。
1.5 增强肿瘤对放化疗的敏感性 协同、增效作用放化疗在肿瘤治疗过程中发挥着非常重要的作用,但也有其不足之处。在杀伤肿瘤细胞的同时,也杀伤了正常组织细胞,限制了放化疗的治疗强度。因此,增强肿瘤对放化疗的敏感性,在不增加毒副作用的基础上提高放化疗疗效,是有效治疗肿瘤的重要手段之一。
1.5.1 协同作用 郝立宏等[29]研究发现榄香烯能明显增强阿霉素对CEM/ADM细胞的生长抑制和诱导凋亡作用,并且与药物浓度和作用时间具有一定的依赖性。王利等[30]研究表明β-榄香烯可降低多药耐药相关蛋白和多药耐药基因mdr-1基因编码的P-糖蛋白的表达,从而逆转肿瘤细胞的多药耐药性。Li Q Q等[31]发现β-榄香烯可明显增强肺癌A549和H460细胞株对顺铂的敏感性,从而促使其肿瘤细胞凋亡。β-榄香烯对肺癌细胞株的铂增敏作用主要与下调Bcl-2、IAPs蛋白和线粒体介导的内在凋亡途径有关。高金荣等[32]研究发现,低剂量榄香烯可诱导人卵巢癌HO-8910和人宫颈癌HeLa细胞对紫杉醇的反应性,并能显著增加紫杉醇的细胞毒作用,尤其是对紫杉醇极不敏感的HeLa细胞具有高选择性。Cao C等[33]通过研究在A549、A549/ADR和MRC-5细胞上评估NLC的体外细胞毒性(如图2所示),发现任何药物浓度中A549和A549/ADR细胞上,DOX/ELE Hyd NLC(阿霉素和β-榄香烯共载,pH敏感的纳米结构脂质载体)的细胞毒性均高于DOX/ELE NLC(DOX和ELE共同装载的NLC不包含pH敏感的Hyd)。DOX / ELE NLCs高于DOX/ELE INJ(DOX和ELE的注射液);DOX/ELE Hyd NLC比单药加载的DOX Hyd NLC和ELE Hyd NLC表现出更好的细胞抑制作用。含DOX的制剂对A549/ADR细胞的疗效低于A549细胞,而榄香烯则可以帮助该系统实现细胞毒性。当0.2﹤Fa(受影响细胞的分数)﹤0.8时,IC50值﹤1,DOX / ELE Hyd NLC具有显著协同作用。由此可知,榄香烯对化疗具有明显的协同抗癌作用。
1.5.2 增敏作用 佘军军等[34]采用6 Mev X线联合β-榄香烯乳剂对肾动脉灌注治疗时,发现肿瘤的放射增敏效应得以明显增强,亦延缓了肿瘤的生长和增强了对肿瘤细胞的诱导凋亡作用。进一步的研究证实了β-榄香烯可抑制和延缓肿瘤瘤体的生长,及其具有明显的放射增敏作用。榄香烯能增强放疗对DNA分子的损伤作用,主要是通过Caspase-3途径显著下调Bcl-2表达,并诱导肿瘤细胞凋亡而致其增敏作用[35]。吴大鹏等[36]研究证实了β-榄香烯乳具有诱导肿瘤细胞凋亡作用,并从蛋白水平上初步推测了β-榄香烯乳对肿瘤细胞的放疗增敏机制。
Jiang H等[37]研究证实了榄香烯的放射增敏作用与其上调肿瘤细胞p53及下调bcl-2的表达存在一定的相关性。张卓[38]研究发现低浓度的β-榄香烯对A549细胞即有一定的放射增敏作用,10 μg/mL和20 μg/mL β-榄香烯放射增敏比SERD0值为(1.54±0.20)和(1.63±0.32);SERDq值为(1.53±0.15)和(1.75±0.19),而且放射增敏比和放射增敏作用的强弱均与β-榄香烯的浓度呈正相关。同时发现β-榄香烯乳联合放疗对A549细胞周期的分布具有明显的影响,即阻滞G2/M期的发生和发展,从而导致细胞凋亡。G2/M期细胞比率和凋亡率亦与β-榄香烯的浓度呈正相关。证实了β-榄香烯对放疗的增敏作用主要是通过上调A549细胞p53和下调Bcl-2的基因表达而实现。研究表明,β-榄香烯乳联合放疗时,明显抑制了DNA双链损伤修复基因Ku70和DNA-PKcs的表达,进而增强A549细胞对放疗的敏感性。亦发现A549细胞DNA-PKcs、Ku70基因表达与p53表达呈显著负相关,而与Bcl-2表达显著正相关。由此可见,β-榄香烯可通过对DNA双链损伤修复和诱导细胞凋亡途径的影响,而明显增强其放射敏感性和诱导细胞凋亡作用。
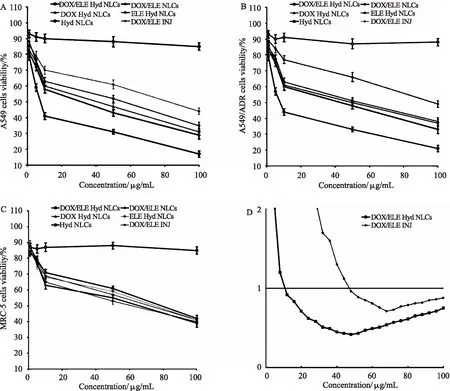
图2 对A549 (A)、A549/ADR细胞(B)和MRC-5细胞(C)进行NLCs体外细胞毒性评价(摘自文献[33])
1.6 逆转肿瘤细胞耐药 肿瘤细胞对化疗药物的耐受性是现今化疗失败的最主要原因之一,防止多药耐药(MDR)的发生,或逆转多药耐药是目前提高化疗疗效的重要途径之一。胡军等[39]研究发现β-榄香烯可诱导肿瘤细胞对阿霉素耐药性发生逆转,从而增强该耐药细胞对阿霉素的敏感性。Li X等[40]研究发现β-榄香烯对人卵巢癌细胞中顺铂耐药细胞株的增生具有明显的抑制作用,而且对人卵巢癌细胞具有高度的选择性;进一步研究发现β-榄香烯可明显增强对肿瘤细胞G2-M期的阻滞作用,从而增强顺铂对肿瘤耐铂药细胞株的增殖抑制作用。郝立宏等[41]发现β-榄香烯主要是通过抑制Bcl-2的表达而实现其逆转肿瘤细胞的MDR和诱导肿瘤细胞凋亡作用,同时β-榄香烯又可显著降低ADM对K562/ADM细胞的IC50。榄香烯能逆转K562/ADM细胞的MDR,可能是通过下调K562/ADM细胞的P-gp的表达而实现[42]。此外,杨爱珍等[43]发现人肺腺癌细胞株SPC-A1中对紫杉醇、多西他赛、长春瑞滨和阿霉素均高度耐药的细胞亚株SPC-A1/Tax 01,对榄香烯具有高度的敏感性,说明榄香烯对紫杉醇耐药的肿瘤细胞仍具有明显的抑杀作用。陈春美等[44]研究发现榄香烯对人脑胶质瘤U251/ADM细胞耐药性具有逆转作用,逆转机制可能与其抑制耐药基因mdr-1、MRP和GST-π的表达具有一定的相关性。Zhao Y F等[45]研究发现非小细胞肺癌细胞对分子靶向药吉非替尼的敏感性与p21蛋白的高表达有关。肿瘤细胞对吉非替尼耐药时,明显降低了PC9-ZD中p21的表达,而联用β-榄香烯可上调PC9-ZD中p21的表达,进而逆转肿瘤细胞对吉非替尼的耐药性。Deng M等[46]通过研究发现β-榄香烯能调节MMP-2/9表达和逆转上皮-间质转化,还可通过上调Cbl-b的表达,从而抑制EGFR-ERK/AKT通路,进而调节MMP-2/9的表达,同时β-榄香烯亦能通过抑制miR-1323表达而上调Cbl-b的表达。发现β-榄香烯处理后的裸鼠肺中转移性肿瘤结节的数量显着减少,证实了β-榄香烯可通过调节miR-1323/Cbl-b/EGFR信号转导轴来抑制MDR胃癌细胞的转移。由此可见,β-榄香烯对MDR癌细胞具有显著的抗转移作用。
1.7 激活抗肿瘤免疫、增强细胞免疫功能 机体免疫系统具有识别和通过免疫机制特异地清除“非己”细胞,抵御肿瘤发生发展的特性。肿瘤细胞可通过多种机制逃避机体免疫系统的识别和攻击,在机体内得以迅速地生存和发展,形成肿瘤。因此,通过激发机体抗肿瘤免疫应答和增强细胞的免疫原性,是有效治疗肿瘤的途径之一。肖立森等[47]通过MTT法检测和比较了β-榄香烯与5-FU、ADM、ADD、VCR、MTX、Vp-16、MMC等7种抗癌药物的敏感性,发现β-榄香烯对胰头癌、乳腺癌、食管癌、胃癌及大肠癌的体外细胞毒性与上述抗癌药物相似,证实了榄香烯可阻滞肿瘤细胞的有丝分裂,以及具有抑制肿瘤细胞生长代谢的作用,从而加速肿瘤细胞的凋亡。吴伟忠等[48]研究发现β-榄香烯可增强H22细胞的免疫原性,同时能够激发机体产生特异性抗肿瘤免疫,其抗肿瘤效应与肿瘤细胞膜上HSP70蛋白的表达介导有关。官成浓等[49]研究发现榄香烯联合化疗药物治疗扩散期胃癌时患者血常规和生化水平无明显变化,说明榄香烯对机体的免疫功能具有很好地保护作用,而且在机体抵抗肿瘤和抑制肿瘤的发生发展中起着非常重要的作用。张思奋等[50]研究发现榄香烯可显著提高经榄香烯灌注介入治疗的直肠癌患者外周T细胞亚群CD3、CD4及CD4/CD8比值。从而证实了榄香烯有提高患者免疫功能的作用。姚淑娟等[51]研究发现榄香烯可以促进化疗后荷瘤C57BL/6小鼠机体免疫功能的恢复和提高T细胞的转化能力,以促进机体产生白细胞介素-2(IL-2)和自然杀伤细胞(NK),从而激发机体产生特异性抗肿瘤免疫疗效。由此可见,榄香烯是一种良好的肿瘤疫苗。
1.8 榄香烯注射液在线粒体途径下的作用研究 线粒体是生物体细胞代谢和信号转导途径的重要场所,是对各种损伤最为敏感的细胞器之一,而肿瘤细胞的线粒体功能障碍是其重要的特征之一。可见,线粒体的功能在肿瘤的发生发展过程中起着决定性的作用。王茜莎等[52]研究发现δ-榄香烯能升高线粒体内的Bax蛋白水平,促使线粒体内cyto C和AIF释放入胞质,进而导致线粒体膜电位的降低。姚成才等[53]研究指出不同浓度榄香烯均可明显抑制A549/DDP细胞株的生长,并具有一定的浓度和时间依赖性,同时亦能逆转A549/DDP细胞株对铂的耐药性和提高肿瘤细胞对铂的敏感性。榄香烯与顺铂联合应用时,发现榄香烯能够明显降低A549/DDP细胞株的线粒体膜电位,亦能上调胞质中Cyto C、Caspase-3、Bad的蛋白表达,以及下调 Pro-caspase-3、Bcl-2的蛋白表达,增加ROS浓度,降低GSH/(GSSG+GSH)比值。进一步研究证实,在40 μg/mL浓度榄香烯中加入线粒体PTP抑制剂Cyclos-Porine A和Caspase-3抑制剂DEVD-CHO时,发现Caspase-3表达减低。Cyclos-Porine A能阻止PTP的通透性,DEVD-CHO能抑制Caspase-3的激活,从而抑制A549/DDP细胞凋亡。表明Cyto C释放、Caspase激活及Bcl-2蛋白低表达和Bad高表达可促使榄香烯逆转A549/DDP细胞的耐药性。由此可见,榄香烯逆转肿瘤细胞耐药性机制,可能与其损伤线粒体膜和诱导线粒体凋亡路径有关。
史亚博等[54]研究指出在线粒体相关途径下榄香烯对抑制肿瘤细胞生长增殖及迁徙转移、诱导肿瘤细胞凋亡、增强治疗敏感性及逆转耐药效应具有协同作用,而且都受到Survivin表达的影响。由此揣测,Survivin作为共同效应的作用靶点同时可能具有相应的特异性,Survivin对Cyto C、Caspase、线粒体膜电位亦可能有一定程度的影响。Survivin蛋白仅仅表达于肿瘤和胚胎组织,榄香烯对Survivin的抑制作用是否为其线粒体相关途径下抗肿瘤效应与其他药物的不同点尚需进一步明确。
1.9 榄香烯注射液作用的基因靶点研究 细胞发生癌变主要是由于细胞信号转导通路的失调而导致了细胞的无限增殖,肿瘤细胞内异常信号系统靶点的特异性研究,为肿瘤的治疗提供了又一途径。郑京胜等[55]通过网络药理学研究发现195个榄香烯注射液靶标基因与血栓症疾病靶标基因的交集基因,榄香烯注射液的靶点信息集主要富集在胃、肺结、直肠、卵巢和乳腺等组织中。榄香烯注射液交集靶基因的生物功能主要包括钾离子跨膜转运、类固醇激素介导的信号通路、蛋白质同源寡聚化及调节心房肌细胞膜复极化等,而交集靶基因主要作用于不对称突触、轴突末端和GABA-A受体复合物等。交集靶基因的分子功能主要是RNA聚合酶II转录因子活性、配体激活的序列特异性DNA结合和类固醇激素受体活性等。同时还发现榄香烯注射液的靶点主要富集在Caspase-3、Bcl-2和CDC42等信号通路,这些信号通路均已被证明参与肿瘤细胞的直接抑杀和诱导凋亡过程。榄香烯对肿瘤细胞的直接抑杀和诱导凋亡机制主要与Bcl家族成员有关,即下调Bcl-2、Bcl-X(L)等抗凋亡成员,上调Bax、Bak等促凋亡成员以及激活Caspase酶族,其中Caspase-3为榄香烯抗肿瘤过程中最为关键的Bcl成员。
2 改善患者生活质量
榄香烯辅助放化疗治疗恶性肿瘤具有显著的疗效,可有效降低或减弱放化疗引起的毒副反应,明显延长患者的生存期,从而提高患者的生活质量[56]。此外,榄香烯可参与到机体的免疫调节过程中,增强细胞的免疫功能和机体的抗肿瘤效果,同时还能降低或减少放化疗引起的骨髓抑制、胃肠道反应及神经毒性等毒副反应的发生率,使患者的生活质量得以大大的提高或改善。田锋奇等[57]研究证实了榄香烯对肿瘤脑转移患者具有非常显著的辅助治疗效果,有效改善化疗所致的白细胞减少,降低感染的发生率,从而提高肿瘤患者的生活质量。Jiang X等[58]通过系统评价和荟萃分析榄香烯注射液联合放疗在肺癌脑转移患者的治疗中,亦证实了榄香烯注射液能提高放疗的治疗效果,并且能显著降低患者骨髓抑制、白细胞减少的发生率和减轻患者放疗时引起的不良反应。Yao Y等[59]通过meta分析发现,动脉灌注榄香烯可以明显改善TACE患者的ORR和显著提高其生存期,榄香烯还可明显改善TACE患者不良反应的发生率和强度,如骨髓抑制、胃肠道反应(腹痛、恶心和呕吐等)、发烧或肝功能障碍(转氨酶升高)等。由此可见,榄香烯可增强放化疗的治疗效果,显著降低或减弱放化疗引起的毒副反应,明显延长患者的生存期,从而提高患者的生活质量。
3 讨论
榄香烯注射液是从姜科植物温郁金和温莪术中提取的一种具有抗肿瘤活性的化合物,其中医、中药学应用可见于《药性论》《本草备要》《本草经读》等著作。莪术和郁金具有活血行气、开郁止痛、凉血清心和利胆退黄之功效,可用于破血消癥以及治疗瘀血经闭、食积腹胀、癥瘕痞块等病症,为临床常用的活血化瘀类药物。此外,郁金属苦寒之药,而肿瘤多属阳,因此郁金不单具有清热解毒之功效,还能专攻抗癌,引诸药直达病所,以使攻伐消散之品专于病所而不伤正。从莪术和郁金中,可提取出榄香烯以制备抗肿瘤药物。1994年,我国上市了自主研发的榄香烯注射液,其具有疗效确切、副作用轻微等特点,属于二类非细胞毒性抗肿瘤新药。榄香烯注射液对肿瘤细胞具有直接或破坏作用,并诱导其凋亡,而且还具有抑制肿瘤血管生成、增强机体自身的免疫功能以及促进机体对肿瘤的免疫原性等作用,亦能增强恶性肿瘤对放化疗的敏感性,更能明显改善和提高患者的生活质量。现今临床中使用的抗肿瘤药物均有不同程度的细胞毒性作用,即在抑杀肿瘤细胞的同时,也能杀伤或损伤机体的某些正常的组织细胞或功能器官,尤其是杀伤人体中生长发育旺盛的血液、淋巴组织细胞等,严重破坏了机体的免疫防御系统,从而使化疗药物的剂量或使用受到一定的限制,以致肿瘤迅速地发生和发展。而榄香烯注射液的问世,因其低毒、价廉且高效等优点,为肿瘤的防治提供了一种全新的选择。
现今针对榄香烯注射液的抗肿瘤、抗癌效果,研究者们进行了大量的临床试验,对榄香烯药理、药效上的研究越来越精细,认识也越来越深入。但是榄香烯抗肿瘤作用的某些机制尚不甚明确,如在蛋白水平及线粒体等方向上还未能明确其相关作用机制,蛋白水平和线粒体等方向上具体的作用靶点和基因的相关研究亦较少。而且榄香烯注射液与免疫或化疗药物联合应用抗肿瘤治疗时的最佳搭配方案仍需要更进一步的深入研究。今后对于榄香烯注射液在分子水平和线粒体等方向上关于其作用靶点和相关基因学,以及榄香烯的最佳配伍方案的深入研究,将有助于为恶性肿瘤的治疗提供更为全面的理论依据,同时亦能为肿瘤患者的治疗制定出相应的最佳方案。

