黄瓜未授粉子房离体培养条件的优化及植株再生
曹冰东,付文苑,唐 兵,陶 莲,王青青,归俊娥,滕九翠,3,李魁印,邓 英,孟平红
(1.贵州大学农学院 贵阳 550025; 2.贵州省农业科学院园艺研究所 贵阳 550006;3.贵州大学生命科学学院 贵阳 550025; 4.贵州省安顺学院 贵州安顺 561000)
黄瓜(L.)是葫芦科作物中具有重要经济价值的蔬菜作物之一,在世界各地普遍种植。黄瓜为异花授粉作物,遗传基础狭窄,种质资源匮乏,杂种优势明显,在生产上几乎全部采用杂交一代品种,但纯化亲本至少需要5 代的连续自交和定向选择。利用单倍体育种可在1~2 年获得纯合的二倍体(Double Haploid,DH)株系,极大程度缩短了育种年限,提高了育种效率。同时,DH 系创制的群体材料能应用于抗病、抗虫、抗旱等性状的遗传图谱构建、分子标记筛选及基因定位等研究。
1976 年San首次通过未授粉子房培养获得大麦单倍体植株。随后,Metwally 等报道在10 个科植物中诱导出单倍体植株。目前,未授粉子房培养是黄瓜获得双单倍体的有效途径。Sorntip 等通过未授粉子房的诱导、分化和再生培养获得植株,其培养流程较繁琐且效率较低。Deng 等报道了一套诱导效率较高的黄瓜未授粉子房离体培养获得再生植株的技术体系,主要技术路线如下:子房4 ℃预冷4 d,MS+0.06 mg·LTDZ(噻苯隆)+蔗糖3%+琼脂7%培养基培养,33 ℃热激暗处理2 d 后转入25 ℃,光照16 h/黑暗8 h 条件下培养直接诱导植株再生,但试验过程中发现部分基因型不产胚或胚产量极低,最终不能获得再生植株。这类现象在南瓜、西葫芦等作物上也有报道,这说明提高胚状体的诱导率是获得再生植株的前提。苏贺楠等以高出胚的材料为媒介与低出胚的材料杂交,提高了胚状体诱导率。出胚能力具有加性效应,高出胚能力由显性核基因控制。不少国内外学者研究或总结了瓜类作物未授粉子房胚胎发生的影响因素,但是较系统、全面的研究并不多。笔者比较了不同基因型、播种季节、栽培方式、取材时期、子房发育时期、培养基附加不同浓度TDZ、不同梯度热激温度和不同梯度热激时间对黄瓜未授粉子房胚诱导和植株再生的影响;同时对再生植株的倍性水平、同质性,以及生根、驯化、移栽技术进行研究,以期建立适合多种基因型的高频胚诱导体系,为单倍体育种技术的推广应用奠定基础。
1 材料和方法
1.1 材料
参试材料为贵州省农业科学院园艺研究所提供的9 个黄瓜材料,材料信息详见表1。SG033、SG049、SG026 属于早、中熟品种,适应性广,强雌性,主蔓节瓜多,品质优良;SG002、SG035 属于早、中熟品种,强雄性,植株长势强,分枝少,叶色为深绿色,第一雄花节位3~6 节。试验于2020—2021年在贵州省园艺研究所蔬菜试验地及遗传育种实验室进行。
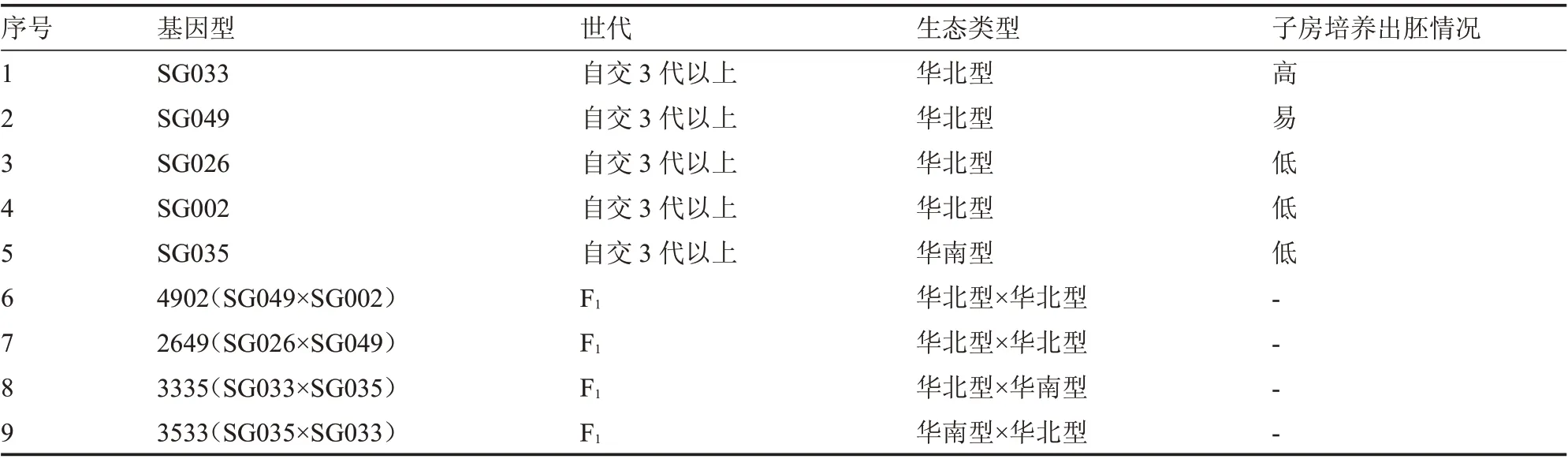
表1 黄瓜未授粉子房培养试验材料
噻苯隆(98%)、6-苄氨基腺嘌呤(99%)、α-萘乙酸(96%)、氢氧化钠、硝酸银浓缩液购自贵州明涵生物科技有限公司;DNAsecure Plant Kit 试剂盒、2×Talent qPCR PreMix 购自天根生化科技(北京)有限公司;甲醛溶液购自重庆江川工(集团)有限公司;30%Acr/Bis 制胶液、10×TBE 缓冲液(pH=8.3)购自酷来搏;过硫酸铵、四甲基乙二胺购自阿拉丁试剂;SSR 标记引物由武汉金开瑞生物工程有限公司合成。
1.2 试验设计
1.2.1 不同基因型对胚状体诱导的影响 参照Deng 等的方法对上述9 个基因型进行未授粉子房培养(稍加改进),75%酒精浸泡时间改为30~50 s,1%次氯酸钠溶液消毒15 min 左右。每个基因型3 次重复,每次重复接种90 个子房片(5 瓶,每瓶18 片)。
1.2.2 不同因素组合对胚状体诱导的影响 以易出胚基因型SG049 为试材,对播种季节、种植方式、取材时期、子房发育时期、培养基附加不同浓度TDZ、不同梯度热激温度和不同梯度热激时间等7因素(3 因素2 水平+4 因素4 水平)进行完全随机试验设计,共16 个处理,每个处理3 次重复,每重复接种90 个子房片(5 瓶,每瓶18 片)。播种季节:夏播时间为2020 年4 月19 日,5 月12 日定植,6月10 日开始取样;秋播时间为2020 年8 月1 日,8月15 日定植,9 月10 日开始取样。种植方式:塑料大棚、露地网室;取材时期:初花期(主蔓雌花开放少于15 朵)、盛花期(主蔓雌花开放15~35 朵之间)。子房发育时期:取开花前1 d(-2)、开花前6 h(-1)、开花当天(0)、开花后1 d(+1),其中开花当天及开花后1 d 的雌花需于开花前套袋防止授粉;不同热激温度处理子房:25、33、35、37 ℃,分别暗处理1、2、3、4 d;培养基中附加TDZ 质量浓度为:0.03、0.06、0.08、0.10 mg·L。以MS 培养基为基础培养基(4.43 g·LMS 粉+30 g·L蔗糖+7 g·L琼脂,pH=5.8~6.0)。
1.2.3 再生植株倍性鉴定 利用流式细胞仪(Partec,Münster,Germany)鉴定再生植株的倍性水平,参考Deng 等的方法进行试验,根据呈现的峰值判断再生植株的倍性。
1.2.4 SSR 分子标记分析 经倍性鉴定为二倍体的组培苗,随机选取6 株用于同质性检验。采用DNA secure Plant Kit 试剂盒提取DNA 基因组,用浓度为1%琼脂糖凝胶检测DNA 基因组的完整性。从55 对SSR 物(表2)中筛选具有多态性的标记用于再生植株同质性检验。扩增总体系为20 μL:模板DNA 1 μL,前引物和后引物各1 μL,Mix 10 μL,ddHO 7 μL。扩增程序在PCR 仪中进行:95 ℃预变性1 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,24 个循环;72 ℃延伸5min,最后4 ℃保存。扩增产物在7.2%聚丙烯酰胺电泳、银染、显色后进行分析。
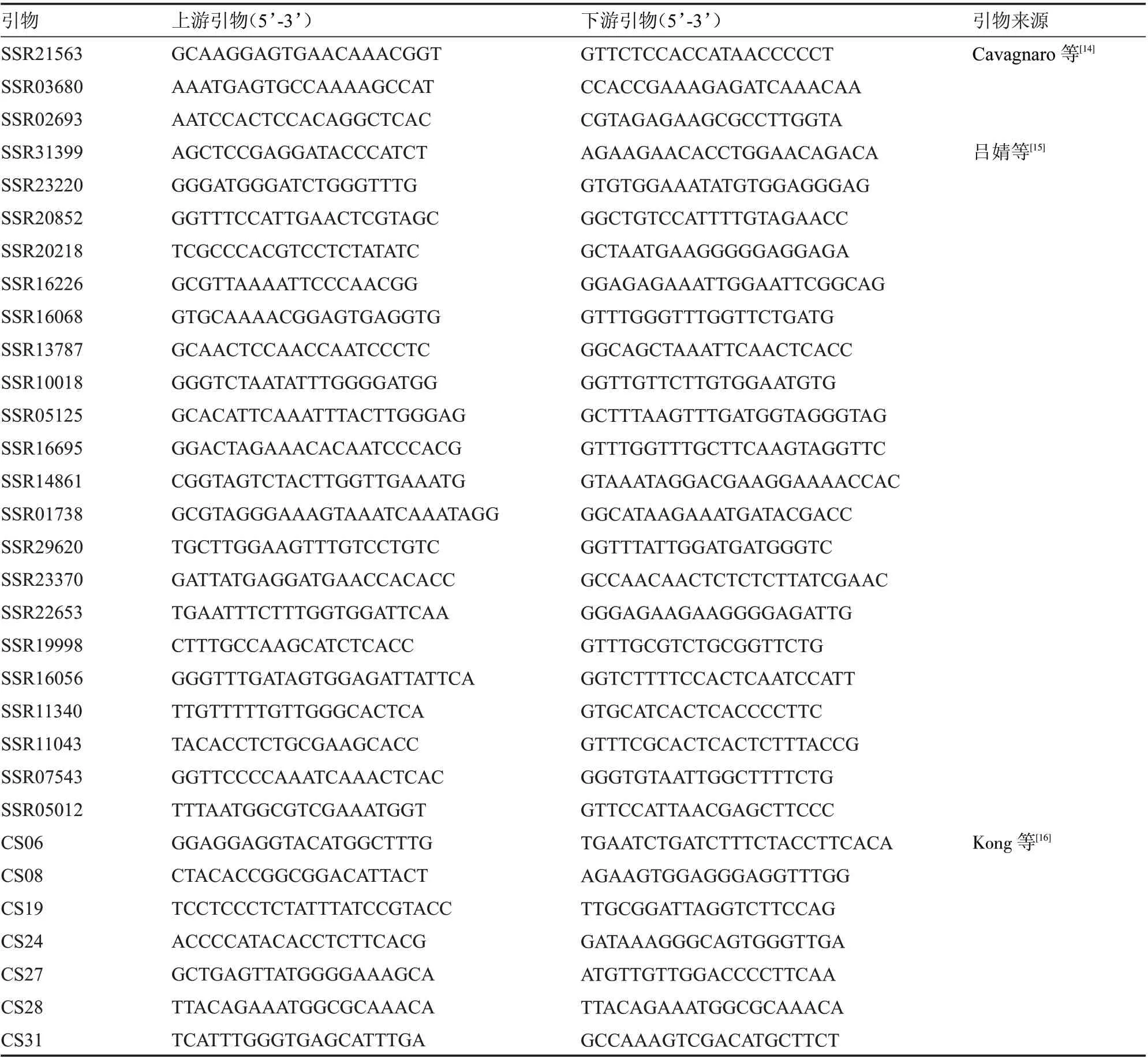
表2 SSR 标记引物的信息

续表2
1.2.5 生根、驯化及移植 每个基因型的再生植株扩繁80 株后进行生根及移栽试验。2649 的再生植株接种于R 培养基(1/2 MS+0.02 mg·LNAA)、S培养基(MS+0.02 mg·LNAA)进行生根诱导,筛选最佳生根培养基。3533、3335、4902 的再生植株接种于最佳生根培养基在相同条件下进行诱导生根。每个处理接4 瓶,每瓶接5 株,设3 次重复。当生根充分且植株叶片生长至4~7 片时,拧松瓶盖室内驯化1 d,再揭开瓶盖室内驯化1 d,将其移植于含泥炭+珍珠岩+蛭石(体积比3∶1∶1)混合基质的营养钵(直径12 cm,高9 cm)中,在人工气候箱内(昼夜温度25 ℃/18 ℃、光照度3500 lx,光照时间12 h)驯化14 d,将成活植株定植于温室大棚,常规肥水管理。驯化前10 d 隔天喷施1 次自制营养液(4.43 g·LMS+30 g·L蔗糖,pH=5.8)。
1.3 测定指标及方法
1.3.1 出胚率 以子房片表面产生明显胚状体结构时记为出胚;出胚率/%=出胚子房数/接种子房总数×100。
1.3.2 植株再生率 当胚状体诱导出具有茎、叶和芽的组织时记为植株再生;植株再生率/%=形成完整植株数/接种子房总数×100。
1.3.3 驯化成活率 营养钵中的植株生出新根和嫩芽时记为植株驯化成活;驯化成活率/%=驯化成活植株数/驯化植株总数×100。
1.3.4 定植成活率 定植于温室大棚的植株能正常生长时记为植株定植成活;定植成活率/%=定植成活植株数/定植植株总数×100。
1.4 数据分析
利用Microsoft Excel 2019 对数据进行处理和作图,用DPS 18.10 进行显著性(Duncan)分析,用Photoshop 2019 软件处理图片。
2 结果与分析
2.1 黄瓜子房培养形成再生植株的过程
黄瓜子房接种到培养基后35 ℃热激暗处理2 d,子房片表面颜色由绿变黄且胚珠开始膨大(图1-A~B),转入25 ℃光照培养室继续培养7 d,膨大的胚珠从组织中突出并继续发育(图1-C)。继续培养20 d,胚状体突破珠被(图1-D),发育成球形胚(图1-E)、心形胚(图1-F)、鱼雷形胚(图1-G)和子叶形胚(图1-H)。子叶形胚分化形成具有明显根和叶的组织(图1-I),切取小植株进行增殖培养(图1-J、K),形成具有茎、叶和芽的再生植株(图1-L)。这一过程需要4 个月左右。
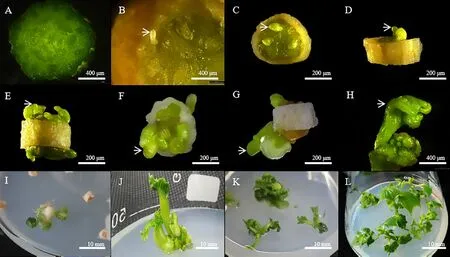
图1 黄瓜子房离体培养形成再生植株的过程
2.2 不同基因型对胚发生及植株再生的影响
2.2.1 不同基因型对出胚率的影响 由图2 可知,
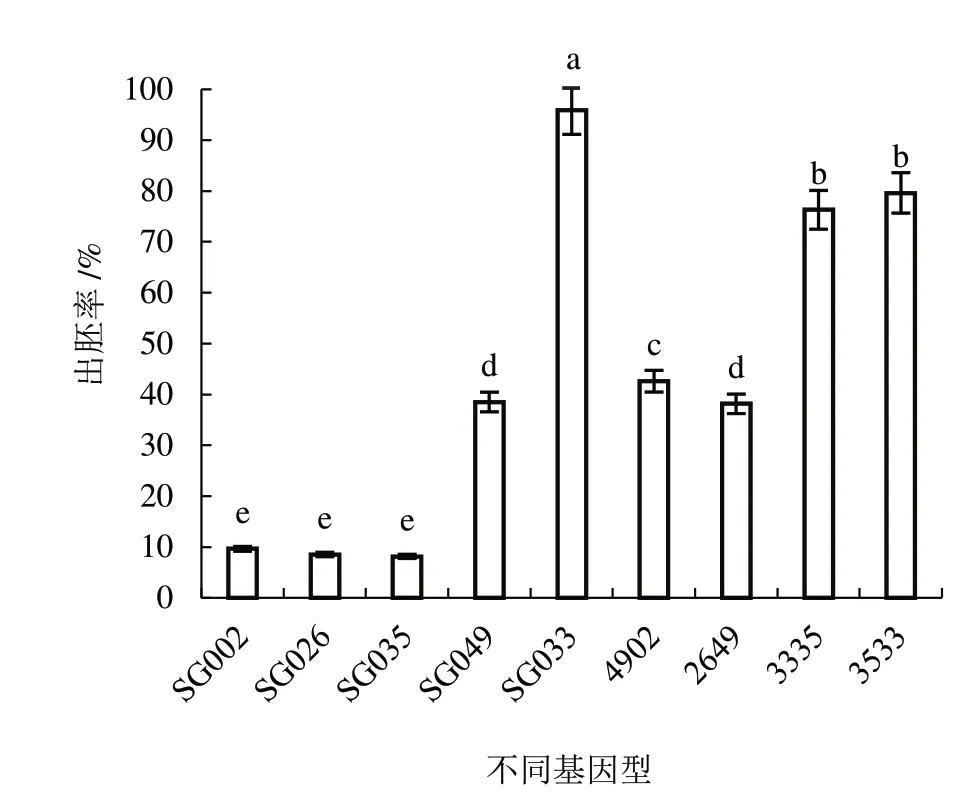
图2 不同基因型对出胚率的影响
9 个基因型的出胚率差异显著,其中,SG033 出胚率最高,为95.93%;SG035 出胚率最低,为8.15%。说明基因型是影响子房培养胚发生的主要因素。将低出胚材料SG035 与出胚能力强的基因型SG033正、反交,杂交种3533 和3335 的出胚率显著高于出胚率低的亲本材料。将低出胚材料与易出胚基因型杂交,杂交种4902 的出胚率显著高于易出胚亲本材料SG049。通过差异显著性分析,将9 份材料分为高出胚(≥50.00%)、易出胚(≥25.00%~50.00%)、中等出胚(≥10.00%~25.00%)和低出胚(<10.00%)的4 类基因型。
2.2.2 不同基因型对植株再生率的影响 由图3
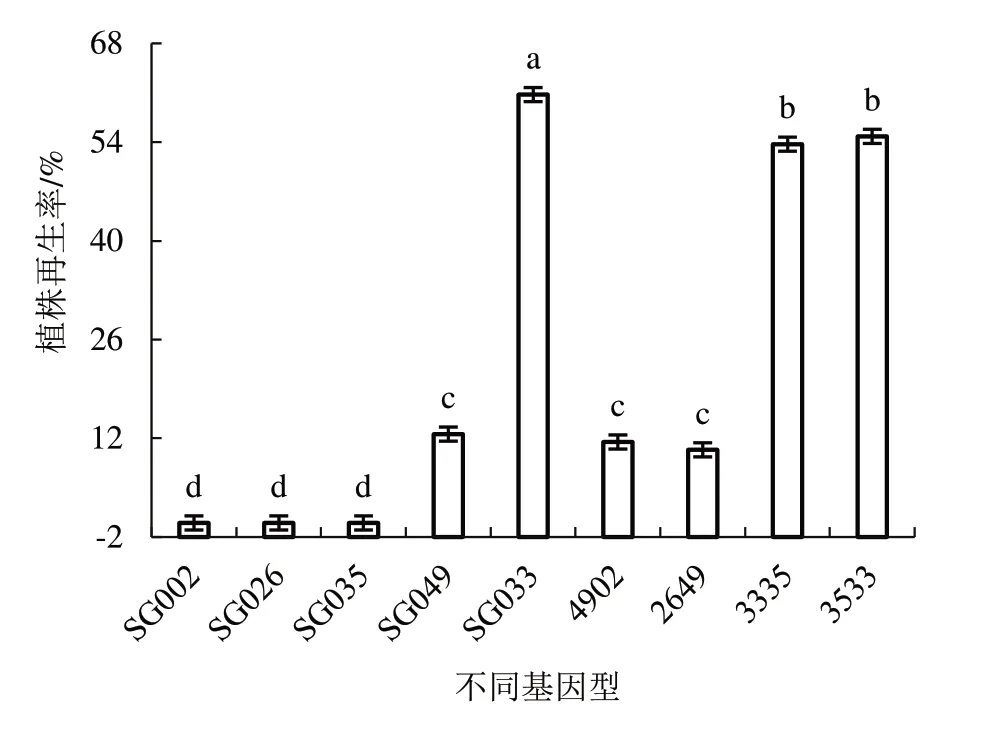
图3 不同基因型对植株再生率的影响
可知,供试的9 个黄瓜材料中仅3 个低出胚基因型不能诱导出苗。其中,高出胚基因型SG033 与其他基因型植株再生率差异显著,为60.74%;将其与低出胚基因型SG035 正、反交,杂交种3335、3533 植株再生率显著高于低出胚亲本材料,且2 个杂交种之间的植株再生率无明显差异,分别为53.70%、54.81%。易出胚基因型SG049 的植株再生率相对较低(12.59%),将其与低出胚基因型SG002、SG026杂交后,2 个杂交种的植株再生率介于双亲之间,并显著高于低出胚型亲本,但与高出胚型亲本无明显差异。
2.3 不同因素组合对胚状体诱导的影响
由表3 可知,16 个不同处理的出胚率有显著差异,其中,处理11(秋季播种、定植于塑料大棚、盛花期取样、开花前1 d 的未授粉子房、培养基中附加0.08 mg·LTDZ、35 ℃热激处理2 d)出胚率最高,为52.22%;其次是处理6、14、3,出胚率分别为39.26%、22.22%、21.48%;最差的处理为1、8、10、15,不能诱导出胚(开花后1 d 的子房);其他8 个处理的出胚率较低,在1.48%~11.85%之间。
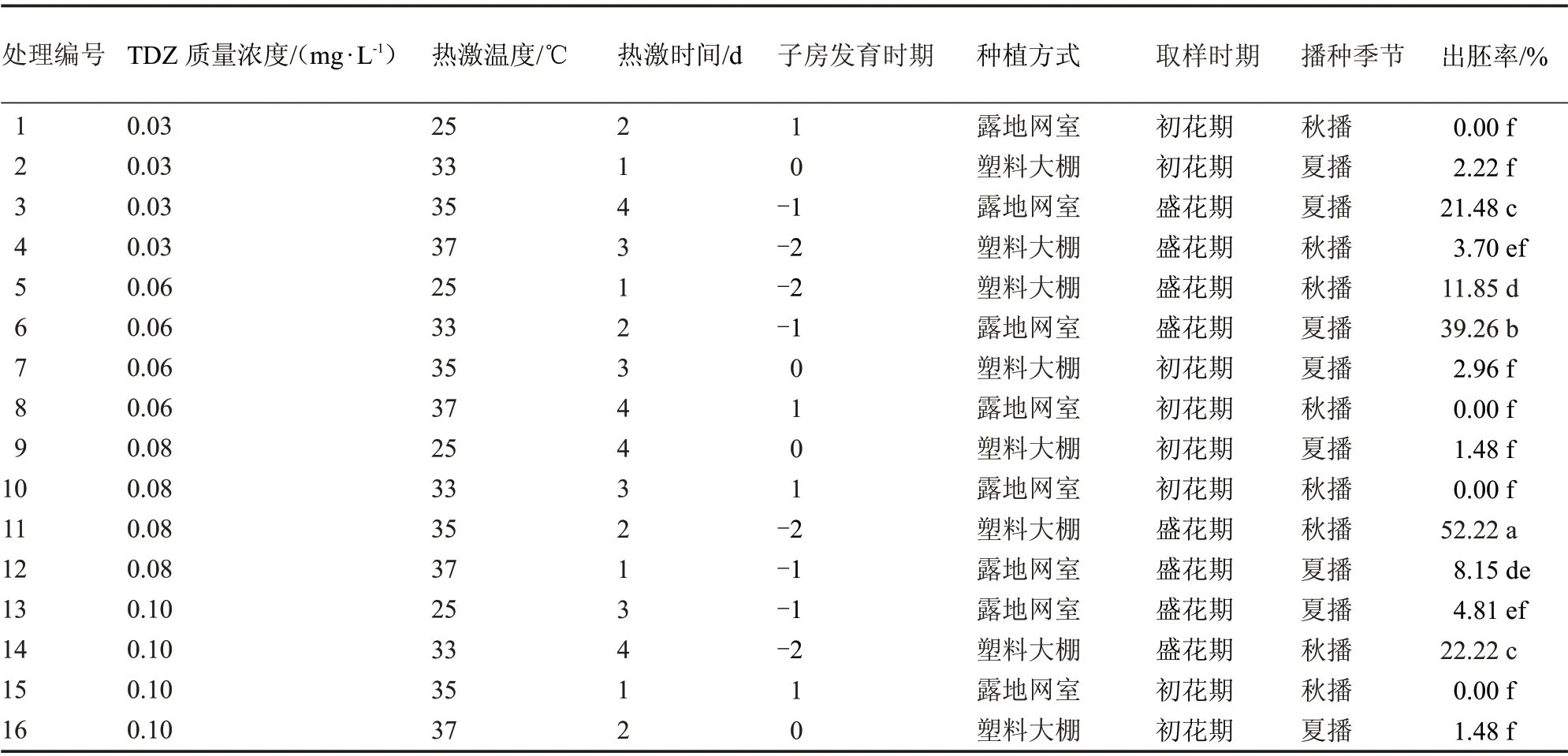
表3 不同因素组合对出胚率的影响
2.4 体系优化后的胚诱导率及植株再生率
2.4.1 体系优化后的胚诱导率 由图4 可知,对影响因素进行优化后选用处理11 进行子房培养,4 个基因型胚发生效果较好。其中易出胚基因型SG049、2649、4902 出胚率分别为52.96%、51.48%、73.70%,达到了诱导高频胚的效果。低出胚基因型SG002 出胚率为27.04%,达到了诱导易出胚基因型的效果。
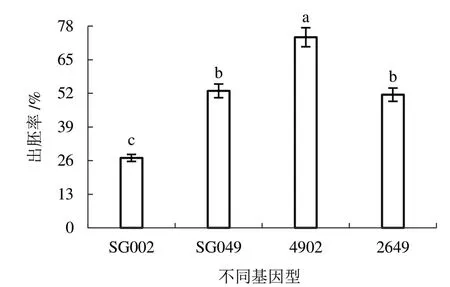
图4 体系优化后的黄瓜子房出胚率
2.4.2 体系优化后的植株再生率由图5 可知,对影响因素进行优化后选用处理11 进行子房培养,4 个基因型都能诱导出再生植株。其中,易出胚基因型SG049、2649、4902 植株再生率分别为25.93%、20.74%、33.70%,在原来的基础上分别增加了1.06、1.00、1.94 倍;且低出胚基因型SG002 植株再生率突破零,提升至5.93%。
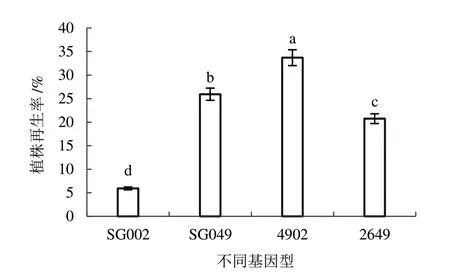
图5 体系优化后的黄瓜子房植株再生率
2.5 再生植株倍性鉴定
以二倍体黄瓜植株叶片为对照(图6-D),利用流式细胞仪鉴定来源于4902 和2649 的再生植株倍性。对照叶片DNA 在相对荧光强度200 处出现分离峰(图6-F),由此推断分离峰出现在相对荧光强度100 处的为单倍体(图6-E),分离峰出现在相对荧光强度300 处的为三倍体(图6-G)。测定结果显示,4902 的再生植株存在单倍体(图6-E)、二倍体(图6-F),2649 的再生植株存在二倍体(图6-F)、三倍体(图6-G)。除了再生植株相对核计数的差异外,还观察到不同的表型差异,单倍体再生植株的茎叶细小(图6-A),三倍体再生植株的茎叶片粗大(图6-C),二倍体再生植株表现为正常植株(图6-B)。
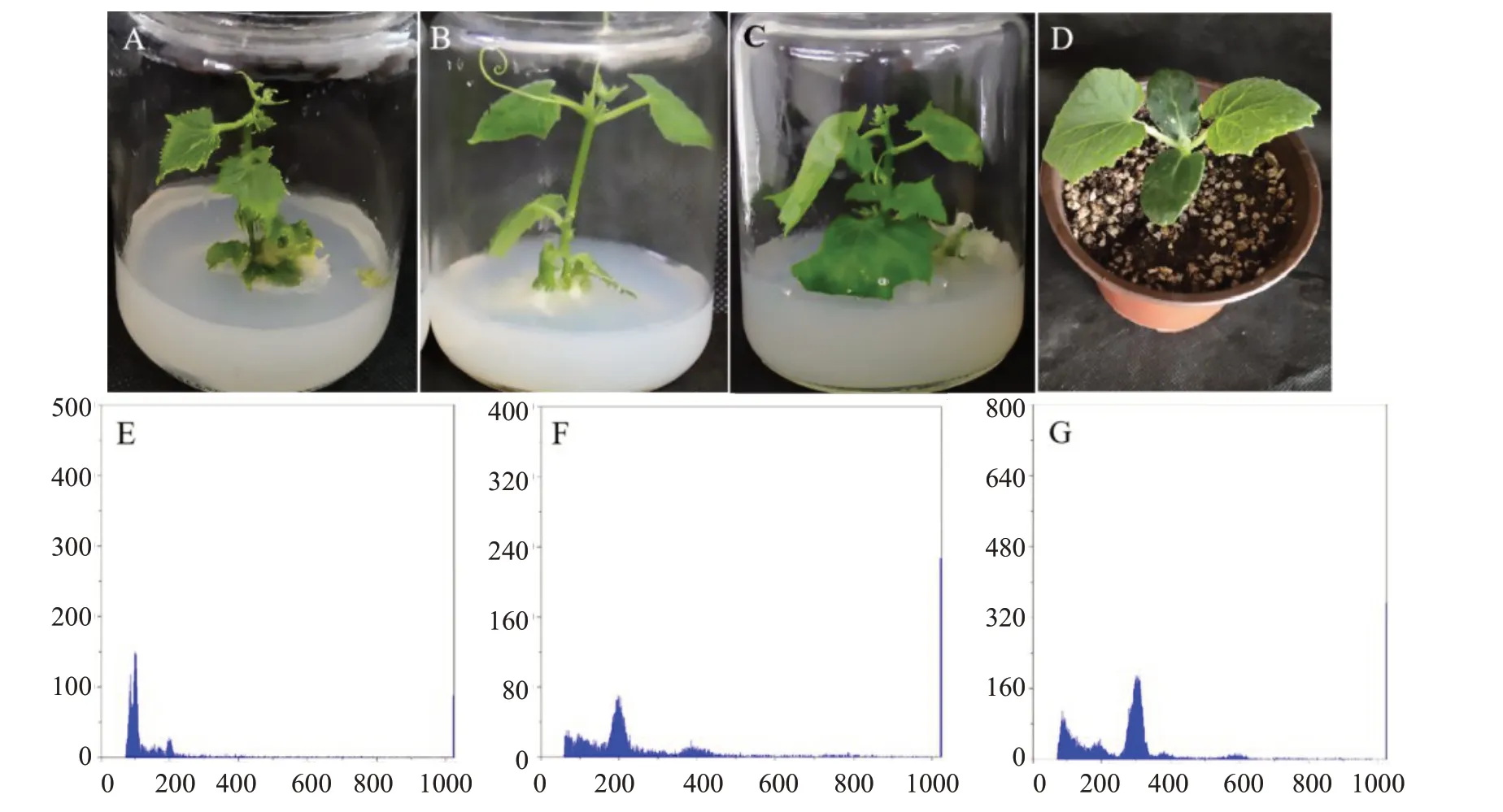
图6 黄瓜再生植株的表型及DNA 分布
2.6 再生植株同质性检验
利用SSR 对来源于杂交种2649、4902 的二倍体组培苗同质性进行检验,首先在55 对引物中筛选在供体植株及双亲中具有多态性的标记。由图7可知,引物CS24 在供体植株2649、母本SG026 和父本SG049 之间具有多态性,引物SSR21563 在供体植株4902、母本SG049 和父本SG002 之间具有多态性。PCR 产物电泳结果显示,2649 的6 株再生植株条带与父本一致,由此确定这6 株再生植株是由胚囊细胞发育而来的纯合双单倍体。4902 的6株再生植株条带与双亲不同,而与供体植株一致,由此确定这6 株再生植株是由体细胞发育而来的杂合二倍体。
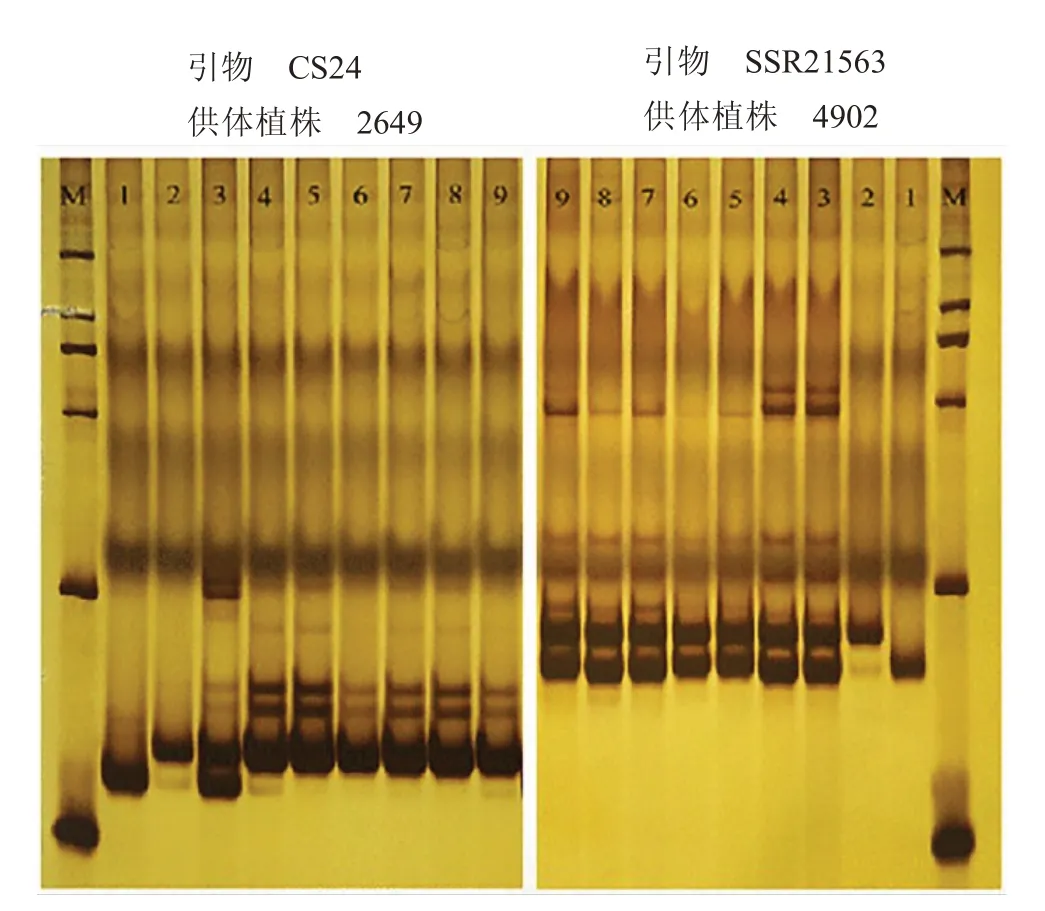
图7 多态性引物CS24 和SSR21563 的电泳条带
2.7 植株的生根、驯化及移栽
再生植株诱导生根3 周时,R 培养基中的植株生根快且根系较多(图8-A),而S 培养基中的植株生根慢且根系少(图8-B)。达到移栽水平的再生植株洗去根系表面培养基(图8-C~D),移栽于含混合基质的营养钵中,在人工气候箱内驯化14 d(图8-E),植株驯化成活率为71.67%~85.00%,将成活植株定植于温室大棚1 个月,植株定植成活率为95.83%~100%(图9)。

图8 再生植株生根及移栽情况
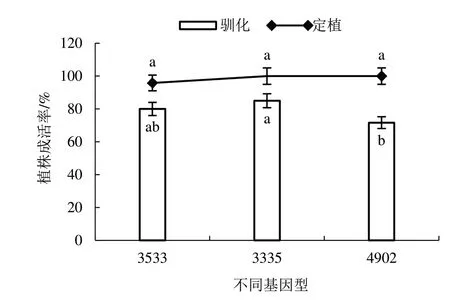
图9 再生植株驯化成活率和定植成活率
3 讨论与结论
基因型是影响雌核发育的关键因素,部分基因型较顽固,不能诱导出胚或出胚率极低,制约了未授粉子房培养技术在育种中的运用。本试验结果表明,利用高出胚基因型与低出胚基因型进行杂交,其杂交后代的胚胎发生能力显著提高,部分杂交种的出胚率优于出胚能力强的亲本基因型,推测黄瓜高出胚能力可以遗传并具有加性效应,这与苏贺楠等和伍健缤等的报道一致;供试的9 份材料中有6 份基因型获得再生植株,表明基因型是决定黄瓜未授粉子房诱导成功的主要因素。这种现象在芸薹属小孢子培养上也有类似报道。如果品种有满足育种需求的目标性状,但是材料不产胚或产胚量低,则可以通过与高胚胎发生能力的桥梁品种杂交,其杂交后代可能是既高出胚又满足育种目标的基因型,以实现快速纯化某些目标性状,这对黄瓜的回交育种具有重要意义。
雌核发育培养中的热激处理是一个重要的步骤,多数学者认为32~35 ℃热激处理2~5 d 对瓜类作物雌核发育起着积极作用;然而,Tantasawat等却认为35 ℃热激3 d 降低了黄瓜胚状体发生率。王璐等和刁卫平等培养黄瓜未授粉子房,在35 ℃热激条件下,启动雌核发育的最适TDZ 质量浓度分别为0.06、0.04 mg·L。TDZ 具有生长素和细胞分裂素的双重功效,能有效诱导外植体的一系列分化。在南瓜、西瓜未授粉子房诱导培养基中添加TDZ 诱导形成的胚状体畸形率较低,有利于成苗。因此,笔者只对TDZ 的处理效果进行了研究,发现子房培养的最优组合为处理11(秋季播种,定植于塑料大棚,盛花期取样,以开花前1 d 的未授粉子房为外植体,4 ℃预冷处理4 d,接种于诱导培养基MS+0.08 mg·LTDZ+30 g·L蔗糖+7 g·L琼脂,35 ℃热激暗处理2 d);该组合培养易出胚基因型的胚诱导效果达到了诱导高频胚的效果,且低出胚材料的植株再生率在Deng 等建立的培养体系中突破零提高到5.93%。
目前,雌核发育诱导技术还不能对单个卵细胞进行离体培养,由此获得的再生植株倍性不确定。因此,需要利用流式细胞仪、根尖染色体计数等手段鉴定再生植株的倍性。笔者在形态学观察的基础上,采用流式细胞仪对再生植株倍性进行鉴定,发现再生植株是由单倍体、二倍体(或双单倍体)及三倍体组成的混合群体,这与李玲等的研究结果相似。由于双单倍体与正常二倍体有着相同数量的核和染色体数目,难以用流式细胞仪和细胞遗传学来辨别二者,而利用SSR 分子标记能检测双单倍体和二倍体植株的同质性。SSR 标记已成功鉴定了梨、马铃薯、椰子等作物自发双单倍体的纯度,也成功用于黄瓜未授粉子房再生植株的同质性检验。笔者在本试验中发现,引物SSR21563、CS24 能区分再生二倍体组培苗的同质性。
综上所述,通过对黄瓜未授粉子房培养体系进行优化研究,获得了最佳培养体系——将低出胚材料与出胚能力强的材料杂交,秋季播种,定植于塑料大棚,盛花期取样,以开花前1 d 的未授粉子房为外植体,4 ℃预冷处理4 d,接种于诱导培养基MS+0.08 mg·LTDZ+30 g·L蔗糖+7 g·L琼脂,35 ℃热激暗处理2 d。

