具柄重楼的甾体皂苷类成分研究
田韵远,陆云阳,刘杨,胡晋铭,李天怡,汤海峰(空军军医大学药学系中药与天然药物学教研室,西安 710032)
中药重楼为百合科(Liliaceae)重楼属云南重楼Paris polyphyllaSmith var.yunnanensis或七叶一枝花ParispolyphyllaSmith var.chinensis的干燥根茎,具有清热解毒、消肿止痛和凉肝定惊的功效,常用于疔疮痈肿、咽喉肿痛、虫蛇咬伤、跌打损伤、惊风抽搐等证[1],是著名中成药云南白药胶囊、痛血康胶囊、热毒清片等的主要组成药材。重楼属多种植物在民间作为中药重楼使用,均富含甾体皂苷类成分。据2021年统计已从该属植物中发现176种甾体皂苷,其中异螺甾烷醇型82种、螺甾烷醇型38种、呋甾烷醇型29种、变型螺甾烷醇型12种、胆甾烷醇型8种和C25为非手性碳的其他类甾体皂苷7种[2]。药理研究发现,重楼的主要药效物质即为甾体皂苷,亦总称为重楼皂苷,具有抗肿瘤、抗菌、抗心肌缺血、抗氧化、免疫调节、止血和溶血等多方面药理和生物活性,现代临床上常用于炎症和肿瘤的治疗[3]。
具柄重楼(Paris fargesiiFranch.var.petiolate)属于南重楼组植物球药隔重楼的变种,主要分布于我国西南各省区,如江西、广西、贵州和四川,在陕西凤县、柞水县、镇坪县等地亦有分布,多生于海拔1150~2270 m阴湿的阔叶林下[4-6]。具柄重楼具有较高的药用价值,其根茎粗壮,在陕西多地与中药重楼同名等效使用,但其药效物质基础尚不甚清楚[7-8]。程虎印等[9]用HPLC法对陕产具柄重楼的化学成分进行分析,表明其含有重楼皂苷Ⅰ、Ⅱ、Ⅵ、Ⅶ等成分,总含量达到2015年版《中国药典》标准。但是,尚未见对具柄重楼化学成分分离鉴定的研究报道。本课题组长期从事重楼属植物化学成分和抗肿瘤活性的研究[10-11],明确具柄重楼的药效物质基础,为其开发利用提供理论依据,本文首次对具柄重楼根茎的化学成分进行研究,共分离鉴定了7个甾体皂苷1~7(见图1),均为首次从具柄重楼中发现。其中,化合物5~7为重楼属植物中少见的胆甾烷醇型甾体皂苷;化合物7的苷元具有6/6/6/5/5五环稠合胆甾烷骨架,具有这一新颖骨架的胆甾烷醇型甾体皂苷在天然界中较为罕见[12-13],亦是首次从本属植物中得到。
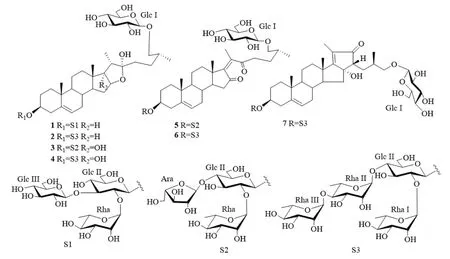
图1 化合物1~7的结构式Fig 1 Structures of compounds 1-7
1 材料
Quatrro Micro质谱仪(Micromass公司);Bruker AVANCE 800 型核磁共振波谱仪(Bruker公司);戴安P680高效液相色谱仪(P680系列单泵、UV-VS 检测器、CHROMELON工作站)[配YMC-Pack R&D ODS-A半制备色谱柱(20 mm×250 mm,5 μm)];Agilent GC-6820气相色谱仪[配HP-5 弹性石英毛细管柱(30 m×0.32 mm,0.25 μm),氢火焰离子化检测器];Sephadex LH-20凝胶(GE公司);柱色谱硅胶(100~200目、200~300目)、薄层色谱用硅胶H、预制硅胶板G(青岛海洋化工厂);ODS C18柱、氘代试剂、RP-18高效薄层预制板(Merck公司)。色谱纯甲醇(天津科密欧公司);对照品L-阿拉伯糖、L-鼠李糖(上海蓝季生物,纯度≥99%)和D-葡萄糖(Sigma公司,纯度≥99%);显色剂(20%硫酸/乙醇溶液);其他试剂均为分析纯。
药材于2019年9月采自陕西省安康市镇坪县,经空军军医大学药学系中药与天然药物学教研室汤海峰教授鉴定为具柄重楼[Paris fargesiiFranch.var.petiolate(Baker ex C.H.Wright) Wang et Tang]的根茎,药材标本(No.20190903)保存于该教研室标本室。
2 提取与分离
取干燥粉碎的药材1.89 kg用70%乙醇浸泡过夜,回流提取5次,每次2 h,减压回收溶剂得浸膏746.09 g。浸膏用适量的水分散后,以等体积石油醚萃取3次,再用等体积的水饱和正丁醇萃取5次,减压回收正丁醇层得总皂苷205.84 g。所得总皂苷经硅胶柱色谱分离,用V二氯甲烷∶V甲醇∶V水(100∶1∶0~63∶35∶5)为洗脱剂梯度洗脱,合并得到8个部分(Fr.1~Fr.8)。选取Fr.6(4.13 g),经Sephadex LH-20凝胶柱色谱(洗脱剂为甲醇)除去水溶性杂质得Fr.6-2(3.64 g),再经ODS反相硅胶柱色谱,以V甲醇∶V水(20∶80~80∶20)为洗脱剂梯度洗脱,分离得到5个组分Fr.6-2-1~Fr.6-2-5。Fr.6-2-2(518.2 mg)以20%乙腈为流动相,通过半制备HPLC(流速10 mL·min-1,检测波长206 nm;以下色谱条件均相同)分离得到化合物5(3.1 mg,tR=48.8 min)。Fr.6-2-3(2.7 g)以20%乙腈为流动相,通过半制备HPLC分离得到Fr.6-2-3-1~Fr.6-2-3-8和化合物3(98.5 mg,tR=51.8 min);Fr.6-2-3-2(138.0 mg)、Fr.6-2-3-6(43.8 mg)和Fr.6-2-3-8(496.9 mg)分别经过半制备HPLC分离纯化,以20%乙腈洗脱,各得到化合物4(12.1 mg,tR=32.2 min)、化合物6(8.0 mg,tR=42.5 min)和化合物7(28.0 mg,tR=21.8 min)。Fr.6-2-4(208.2 mg)以25%的乙腈为流动相,经过半制备HPLC分离纯化得到化合物1(11.4 mg,tR=9.4 min)和化合物2(4.5 mg,tR=48.1 min)。
3 结构鉴定
化合物1:白色无定形粉末,Liebermann-Burchard和Molish反应呈阳性,表明该化合物可能是皂苷类。ESI-MS显示其准分子离子峰m/z1087 [M+Na]+和1063 [M-H]-,提示其相对分子质量为1064,结合NMR数据推断其分子式为C51H84O23。化合物1的NMR谱显示δH0.91(s,H3-18),1.08(s,H3-19),1.36(d,J=7.2 Hz,H3-21)和1.00(d,J=6.4 Hz,H3-27)处的4个甲基氢信号,以及对应的碳信号δC17.0,19.9,17.0和18.0;δH5.35(br s)处的烯烃信号和对应的三取代烯烃碳信号δC122.4(C-6),141.2(C-5);以及1个典型的22-OH呋甾烷醇信号δC111.2(C-22),这表明化合物1的苷元具有呋甾烷醇的骨架[14]。在HMBC谱中,H-4(δH2.81)、H-7(δH1.90)与C-5、C-6分别存在远程相关信号,表明双键位于5(6)位。在NOESY谱中,H3-19β/H-1b(δH1.76)和H-1a(δH0.98)/H-3(δH3.97)的NOE相关峰表明3-OH是β构型[15]。通过H2-26化学位移值差δHa-δHb=3.96-3.64=0.32<0.48,可以确定C25为R构型[16]。苷元的13C-NMR(200 MHz,C5D5N)数据见表1。综合以上分析,并与文献对照[14]确定化合物1的苷元为(25R)-呋甾-5-烯-3β,22α,26-三醇。
取化合物1(1.5 mg)用2 mL 2 mol·L-1三氟乙酸水解,按文献方法[11,17]将所得单糖制备三甲基硅醚化L-半胱氨酸衍生物,以标准糖衍生物作对照,进行GC分析,表明化合物1的单糖组成为D-葡萄糖(Glc)和L-鼠李糖(Rha)(3∶1)。在1H-NMR谱(800 MHz,C5D5N)中显示4个糖基的端基氢信号δH4.84(d,J=8.0 Hz,Glc Ⅰ),4.97(d,J=7.2 Hz,Glc Ⅱ),5.14(d,J=8.0 Hz,Glc Ⅲ) 和6.41(br s,Rha)。在HSQC谱中可找到各端基氢所对应的端基碳信号δC105.4,100.4,105.1和102.7。由葡萄糖端基氢的耦合常数(J>7.0 Hz)可知葡萄糖形成的苷键为β构型;鼠李糖的端基氢信号为单峰,根据其C-5化学位移(δC70.1),可知其形成的苷键为α构型[18-19]。在HMBC谱中,Glc Ⅱ C-1与苷元C-3存在远程相关,说明Glc Ⅱ连接于苷元C-3位;Rha H-1与Glc Ⅱ C-2存在远程相关,Glc Ⅲ H-1与Glc Ⅱ C-3存在远程相关,表明Rha和Glc Ⅲ分别连接于Glc Ⅱ的2位和3位;Glc Ⅰ H-1与苷元C-26存在远程相关,说明Glc Ⅰ连接在苷元C-26位。糖基部分的13C-NMR数据见表2。将化合物1的波谱数据与已知化合物protogracillin[14]对照,基本一致,从而确定了化合物1的结构,为26-O-β-D-吡喃葡萄糖基-3β,22α,26-三羟基-(25R)-呋甾-5-烯-3-O-β-D-吡喃葡萄糖基-(1→3)-[α-L-吡喃鼠李糖基-(1→2)]-β-D-吡喃葡萄糖苷。
化合物2:白色无定形粉末,Liebermann-Burchard和Molish反应呈阳性,表明该化合物可能是皂苷类化合物。ESI-MS显示其准分子离子峰m/z1217 [M+Na]+和1193 [M-H]-,提示其相对分子质量为1194,结合NMR数据推断其分子式为C57H94O26。在化合物2的1H-NMR谱(800 MHz,C5D5N)高场区δH1.07,0.91,1.36和1.01处可见归属于苷元部分的4个甲基信号,在δH5.32处可见1个烯氢宽单峰信号。在化合物2的13C-NMR谱(200 MHz,C5D5N)中,可见1对烯碳信号δC122.3和141.3,1个半缩醛碳信号δC111.2。这些都是呋甾烷醇甾体皂苷元的特征信号。化合物2的苷元部分碳谱信息与化合物1一致,表明化合物2的苷元亦为(25R)-呋甾-5-烯-3β,22α,26-三醇。将化合物2按照与化合物1相同的方法酸水解后制备成单糖衍生物,通过GC分析表明其糖基为D-葡萄糖和L-鼠李糖(2∶3)。NMR谱中显示5个糖的端基氢和端基碳信号 [δH4.84(d,J=8.0 Hz,GlcⅠ),4.98(d,J=7.2 Hz,Glc Ⅱ),6.42(br s,Rha Ⅰ),5.87(br s,Rha Ⅱ),6.32(br s,Rha Ⅲ);δC105.4(GlcⅠ),100.8(Glc Ⅱ),102.7(Rha Ⅰ),102.7(Rha Ⅱ),103.8(Rha Ⅲ)]。通过HMBC谱分析,表明Glc Ⅱ与苷元的3位连接,Rha Ⅰ和Rha Ⅱ分别连接于Glc Ⅱ的2位和4位,Rha Ⅲ与Rha Ⅱ的4位连接,GlcⅠ与苷元的26位连接。因此确定化合物2的结构为26-O-β-D-吡喃葡萄糖基-3β,22α,26-三羟基-(25R)-呋甾-5-烯-3-O-α-L-吡喃鼠李糖基-(1→4)-α-L-吡喃鼠李糖基-(1→4)-[α-L-吡喃鼠李糖基-(1→2)]-β-D-吡喃葡萄糖苷,即已知化合物dichotomin,波谱数据与文献报道一致[20]。
化合物3:白色无定形粉末,Liebermann-Burchard和Molish反应呈阳性,表明该化合物可能是皂苷类化合物。ESI-MS 显示其准分子离子峰m/z1073 [M+Na]+和1049 [M-H]-,提示其相对分子质量为1050,结合NMR数据推断其分子式为C50H82O23。化合物3苷元部分的碳谱信号与化合物1的信号基本一致,不同之处在于化合物3的C-16和C-17信号分别向低场位移至δC90.9和91.4,表明化合物3的C-17位连有羟基,按照生源途径,该羟基应为α构型[10]。综上分析,确定化合物3的苷元为(25R)-呋甾-5-烯-3β,17α,22α,26-四醇。按与化合物1相同的方法对化合物3进行酸水解及衍生,经GC分析表明其糖基为D-葡萄糖、L-鼠李糖和L-阿拉伯糖(Ara)(2∶1∶1)。由阿拉伯糖C-1、C-2、C-4和C-5的化学位移值可知,该糖为呋喃型,且所形成的苷键为α构型[21]。通过2D NMR分析归属了化合物3的所有碳氢信号,重要的1H-NMR(800 MHz,C5D5N)信号如下:δH0.97(3H,s,H3-18),1.10(3H,s,H3-19),1.40(3H,d,J=7.2 Hz,H3-21),1.02(3H,d,J=6.4 Hz,H3-27),5.30(1H,br s,H-6),4.84(1H,d,J=8.0 Hz,GlcⅠ H-1),4.97(1H,d,J=8.0Hz,GlcⅡ H-1),6.28(1H,br s,Rha H-1),5.93(1H,br s,Ara H-1);苷元和糖基部分的13C-NMR(200 MHz,C5D5N)数据分别见表1和表2。根据HMBC谱分析,可确定苷元3位和26位的糖链分别为Ara(1→4)-[Rha(1→2)]-GlcⅡ-和GlcⅠ-。因此,鉴定化合物3的结构为26-O-β-D-吡喃葡萄糖基-3β,17α,22α,26-四羟基-(25R)-呋甾-5-烯-3-O-α-L-呋喃阿拉伯糖基-(1→4)-[α-L-吡喃鼠李糖基-(1→2)]-β-D-吡喃葡萄糖苷,即已知化合物parisyunnanoside A,波谱数据与文献报道一致[21-22]。
化合物4:白色无定形粉末,Liebermann-Burchard和Molish反应呈阳性,表明该化合物可能是皂苷类化合物。ESI-MS 显示其准分子离子峰m/z1233 [M+Na]+和1209 [M-H]-,提示其相对分子质量为1210,结合NMR数据推断其分子式为C57H94O27。与化合物3对照,发现两者苷元部分的碳谱数据一致,确定化合物4的苷元亦为(25R)-呋甾-5-烯-3β,17α,22α,26-四醇。按与化合物1相同的方法,对化合物4进行酸水解及衍生,经GC分析表明化合物4的单糖组成为D-葡萄糖和L-鼠李糖(2∶3)。通过2D NMR分析归属了化合物4的所有碳氢信号,重要的1H-NMR(800 MHz,C5D5N)信号如下:δH0.91(3H,s,H3-18),1.10(3H,s,H3-19),1.40(3H,d,J=7.2 Hz,H3-21),1.02(3H,d,J=6.4 Hz,H3-27),5.30(1H,br s,H-6),4.84(1H,d,J=7.2 Hz,GlcⅠ H-1),4.96(1H,d,J=7.2 Hz,GlcⅡ H-1),6.42(1H,br s,Rha Ⅰ H-1),5.86(1H,br s,Rha Ⅱ H-1),6.31(1H,br s,Rha Ⅲ H-1);13C-NMR(200 MHz,C5D5N)数据见表1和表2。化合物4的糖基部分碳谱数据与化合物2一致,通过HMBC谱分析进一步确认了其糖链结构。与文献[21]报道的化合物saponin Th的波谱数据进行对照,基本一致,从而确定了化合物4的结构,即26-O-β-D-吡喃葡萄糖基-3β,17α,22α,26-四羟基-(25R)-呋甾-5-烯-3-O-α-L-吡喃鼠李糖基-(1→4)-α-L-吡喃鼠李糖基-(1→4)-[α-L-吡喃鼠李糖基-(1→2)]-β-D-吡喃葡萄糖苷。

表1 化合物1~7苷元部分的13C-NMR数据(200 MHz,C5D5N) Tab 1 13C-NMR data of the aglycones of compounds 1-7 (200 MHz,C5D5N)
化合物5:白色无定形粉末,Liebermann-Burchard和Molish反应呈阳性,表明该化合物可能是皂苷类化合物。ESI-MS 显示其准分子离子峰m/z1053 [M+Na]+和1029 [M-H]-,提示其相对分子质量为1030,结合NMR数据推断其分子式为C50H78O22。1H-NMR谱(800 MHz,C5D5N)显示3个单峰甲基氢信号δH0.96(H3-18),1.08(H3-19),2.00(H3-21)和1个双峰甲基氢信号δH1.01(J=6.4 Hz,H3-27),以及1个烯氢信号δH5.30(br s)。在13C-NMR谱(200 MHz,C5D5N)中观察到对应的4个甲基碳信号δC17.2,19.8,16.2,17.9和2个三取代烯碳信号δC121.9,141.4。此外,碳谱中尚存在2个四取代烯碳信号δC143.1,146.2;2个季碳信号δC37.5,43.9和2个羰基碳信 号δC206.2,211.0。在HMBC谱中,H-4(δH2.82)和H-7(δH1.77)与C-5(δC141.4)和C-6(δC121.9)均存在远程相关信号;H3-18分别与C-12(δC36.5)、C-13(δC43.9)、C-14(δC50.9)和C-17(δC143.1)存在远程相关信号;H3-21分别与C-17、C-20(δC146.2)和C-22(δC211.0)存在远程相关信号;C-15(δC38.4)与C-14和C-16(δC206.2)存在远程相关信号。这些HMBC相关表明在化合物5的苷元中,2个双键分别位于5(6)和17(20)位,2个羰基分别位于16和22位。通过H2-26化学位移值差δHa-δHb=3.98-3.62=0.36<0.48,可以确定C25为R构型[14]。综合以上分析,并与文献对照[23],推定化合物5的苷元为(25R)-胆甾-5,17(20)-二烯-16,22-二酮-3β,26-二醇。将化合物5按照与化合物1相同的方法酸水解后制备成单糖衍生物,通过GC分析表明化合物5的单糖组成为D-葡萄糖、L-鼠李糖和L-阿拉伯糖(2∶1∶1)。化合物5的糖基部分碳谱数据与化合物3一致,通过HMBC谱分析进一步确认了其糖链结构。将化合物5的波谱数据与文献[23]报道数据对照,确定化合物5为已知化合物26-O-β-D-吡喃葡萄糖基-3β,26-二羟基-(25R)-胆甾-5,17(20)-二烯-16,22-二酮-3-O-α-L-呋喃阿拉伯糖基-(1→4)-[α-L-吡喃鼠李糖基-(1→2)]-β-D-吡喃葡萄糖苷。
化合物6:白色无定形粉末,Liebermann-Burchard和Molish反应呈阳性,表明该化合物可能是皂苷类化合物。ESI-MS 显示其准分子离子峰m/z1213 [M+Na]+和1189 [M-H]-,提示其相对分子质量为1190,结合NMR数据推断其分子式为C57H90O26。在化合物6的1H-NMR谱(800 MHz,C5D5N)高场区δH0.97,1.07,2.00和1.01处可见归属于苷元部分的4个甲基信号,在δH5.31处可见1个烯氢宽单峰信号。在化合物6的13C-NMR谱(200 MHz,C5D5N)中,可见两对烯碳信号分别位于δC121.9,141.4和143.1,146.2,2个羰基碳信号分别位于δC206.3和211.1。比较化合物6与化合物5苷元部分的碳信号,发现两者基本一致,表明化合物6的苷元亦为(25R)-胆甾-5,17(20)-二烯-16,22-二酮-3β,26-二醇[23]。将化合物6按照与化合物1相同的方法酸水解及衍生,通过GC分析表明化合物6的单糖组成为D-葡萄糖和L-鼠李糖(2∶3)。化合物6的糖基部分碳谱数据与化合物2和化合物4一致,通过HMBC谱分析进一步确认了其糖链结构。将化合物6的波谱数据与文献[12]报道的化合物parispseudoside C进行比较,基本一致,从而确定了其结构,即26-O-β-D-吡喃葡萄糖基-3β,26-二羟基-(25R)-胆甾-5,17(20)-二烯-16,22-二酮-3-O-α-L-吡喃鼠李糖基-(1→4)-α-L-吡喃鼠李糖基-(1→4)-[α-L-吡喃鼠李糖基-(1→2)]-β-D-吡喃葡萄糖苷。
化合物7:白色无定形粉末,Liebermann-Burchard和Molish鉴定反应呈阳性,表明该化合物可能属于皂苷类。ESI-MS显示其准分子离子峰m/z1213 [M+Na]+和1189 [M-H]-,提示其相对分子质量为1190,结合NMR数据推断其分子式为C57H90O26,对应于13个不饱和度。化合物7的NMR谱显示有4个甲基氢信号δH1.48(s,H3-18),1.10(s,H3-19),1.87(s,H3-21),1.14(d,J=6.4 Hz,H3-27)和对应的碳信号δC16.2,19.9,9.1,17.7;1个烯氢信号δH5.38(br s),一组三取代烯烃碳信号δC122.2(C-6),141.5(C-5),一组四取代烯烃碳信号δC182.7(C-17),128.8(C-20);1个羰基信号δC212.9(C-22);3个连氧碳信号δC77.1(C-26),78.5(C-3)和83.5(C-16)。1H-NMR(800 MHz,C5D5N)和13C-NMR(200 MHz,C5D5N)中显示有5个糖的端基氢信号:δH4.87(d,J=8.0 Hz,GlcⅠ H-1),5.00(d,J=7.2 Hz,GlcⅡ H-1),6.41(br s,Rha Ⅰ H-1),5.85(br s,Rha Ⅱ H-1)和6.30(br s,Rha Ⅲ H-1),以及对应的端基碳信号δC105.8,100.9,102.8,102.8和103.8。比较化合物7和化合物6的NMR谱,发现化合物7的结构中少了1个羰基和1个亚甲基,而多了1个连氧季碳(δC83.5)和1个次甲基(δH2.47,δC57.9),其他结构基本一致。化合物7的分子中1个羰基、2个双键和5个单糖基占了8个不饱和度,所剩下的5个不饱和度提示其苷元为五环结构,因此,推测化合物7可能是化合物6的23,16-醇醛缩合产物。1H-1H COSY和HMBC谱可证实这一推测。在1H-1H COSY谱中,存在H-26a(δH4.06)/H-25(δH2.53)、H-26b(δH3.75)/H-25、H-25/H-24a(δH2.40)、H-25/H-24b(δH1.99)、H-25/H3-27(δH1.14)和H-24b/H-23(δH2.47)相关峰,结合H-25/C-23(δC57.9)的HMBC相关,表明化合物7中多出的次甲基位于C-23位。在HMBC谱中,H3-21与C-17、C-20和C-22,H-23与C-16和C-22,H2-24与C-16和C-22的远程相关峰,表明化合物7苷元的E环为具有α,β-不饱和酮结构的环戊烷,双键位于17(20)位。在NOESY谱 中,H3-18/H-8、H-8/Hβ-15(δH2.00)和Hβ-15/H-23相关峰表明H-23为β构型;Hβ-15/H-23的NOE相关亦提示OH-16为α构型[12]。将化合物7按照化合物1相同的方法酸水解后制备成单糖衍生物,通过GC分析表明化合物7的糖基组成为D-葡萄糖和L-鼠李糖(2∶3)。通过2D NMR谱图分析,进一步确定化合物7的苷元3位和26位所连接的糖链结构与化合物6相同,糖基部分的13C-NMR数据见表2。对照文献,化合物7的波谱数据与已知化合物ypsiyunnoside A一致[12],从而确定了其结构,即26-O-β-D-吡喃葡萄糖基-3β,16α,26-三羟基-(23R,25R)-16,23-环胆甾-5,17(20)-二烯-22-酮-3-Oα-L-吡喃鼠李糖基-(1→4)-α-L-吡喃鼠李糖基-(1→4)-[α-L-吡喃鼠李糖基-(1→2)]-β-D-吡喃葡萄糖苷。皂苷化合物7的苷元为6/6/6/5/5五环稠合胆甾烷骨架,生源途径分析认为,可能是由parispseudoside C(皂苷化合物6)通过23,16-醇醛缩合而形成了皂苷化合物7中具有α,β-不饱和酮基团的环戊烷结构(E环)。具有这一新颖骨架的皂苷仅分别从云南丫蕊花[12]和吉林延龄草[13]中各报道了1个,这是首次在重楼属植物中发现。

表2 化合物1~7糖基部分的13C-NMR数据(200 MHz,C5D5N) Tab 2 13C-NMR data of the sugar moieties of compounds 1-7 (200 MHz,C5D5N)
4 结果与讨论
中药重楼的市场需求逐年增加,而重楼属植物生长周期长,自然更替缓慢,致使重楼资源紧缺[24-25]。具柄重楼在陕西具有一定的资源分布,且在陕西多地与中药重楼等效替用,但未见对其化学成分分离鉴定的报道[7-8],因此,有必要开展其化学成分的研究工作,为其作为中药重楼的替代基原植物提供科学依据。在预实验中,通过TLC与对照品比较,发现具柄重楼总皂苷的一个部分(Fr.6)不含有常见的重楼皂苷成分(如重楼皂苷Ⅰ、Ⅱ、Ⅵ、Ⅶ等),为了发现结构较为新颖的甾体皂苷类成分,以阐释具柄重楼化学成分的特征性,并希望能找到新结构的活性成分,本文前期对Fr.6进行了较为系统的分离鉴定。所报道的7个甾体皂苷成分包括4个呋甾烷醇类和3个胆甾烷醇类皂苷,这是首次对具柄重楼开展的化学研究,所有化合物均为首次从该植物中发现。胆甾烷醇类皂苷属于较为少见的甾体皂苷,在重楼属植物中亦较少发现。胆甾烷醇类皂苷化合物7的苷元具有罕见的骨架结构,具有这一新颖骨架的皂苷为首次从本属植物中得到。虽然有文献报道F环开环的甾体皂苷生物活性较弱或无[21,26],但亦有研究发现呋甾烷醇类皂苷拥有潜在的抗肿瘤细胞增殖和抗炎等生物活性[27-29],因此,值得对这些成分做进一步的活性筛选。此外,在对具柄重楼总皂苷其他部分的预实验中,已发现含有较大量的已知重楼皂苷活性成分,亦可能含有新的活性成分,将进一步对这些部分开展化学和药理活性研究,以明确具柄重楼治疗疾病的物质基础,为其开发和利用提供科学依据。

