大孔吸附树脂分离纯化巴豆中佛波醇
黄从波,高意,范杰平
(南昌大学化学工程系,江西 南昌 330031)
prostratin(12-deoxyphorbol-13-acetate)是一种非常复杂的二萜天然产物,也是一种极具代表性的佛波醇酯类化合物[1],在诱导潜在感染的细胞系和原代细胞的HIV表达方面表现出强大的体外活性,且无促肿瘤作用[2-5]。虽然prostratin及其类似物可以作为治疗HIV的药物,但是它们的获取难度极大[6]。Wender等[7]以佛波醇为前体,经五步反应,合成得到prostratin和其他类似化合物。
由于佛波醇是佛波醇酯类化合物的前体,因此具有巨大的药用潜力,吸引了众多学者的关注[8-9],其结构式如图1所示。尽管进行了40年的努力,但由于化学合成的复杂性和氧原子的特殊位置,所以从天然产物中分离获取佛波醇具备明显优势[10]。富含佛波醇酯的天然植物是获取佛波醇的主要来源,例如巴豆、麻疯树、大戟、下垂澳杨[11-12],其中巴豆中佛波醇酯的含量最高[13]。David以巴豆油为原料,将佛波醇酯在碱性条件下醇解得到佛波醇[14]。巴豆主要产自我国的福建、云南、广东、广西等省份,且产量较大[15],因此在我国以巴豆作为原料制备佛波醇,能为其工业化生产降低成本、缩短生产周期。
在已报道的研究中,佛波醇的纯化方法有两种:硅胶柱层析和制备色谱法,硅胶柱层析中大量使用乙醚、乙酸乙醇和石油醚等低沸点有机溶剂,这给工业生产带来较大安全隐患[16];而制备色谱法对设备要求高、生产成本昂贵。大孔树脂具有吸附性能好、选择性高、机械强度大、价格低廉、能够处理再生等优势,在目标组分的富集上有良好的效果,因而在制药工业的分离纯化领域应用广泛。本文以巴豆为原料,提取得到巴豆油,经醇解后得到佛波醇粗提液,再通过大孔树脂对粗提液进行纯化。实验结果表明,大孔吸附树脂取得了很好的分离效果,且回收率也比较高,所得的佛波醇样品具有较高的质量分数。
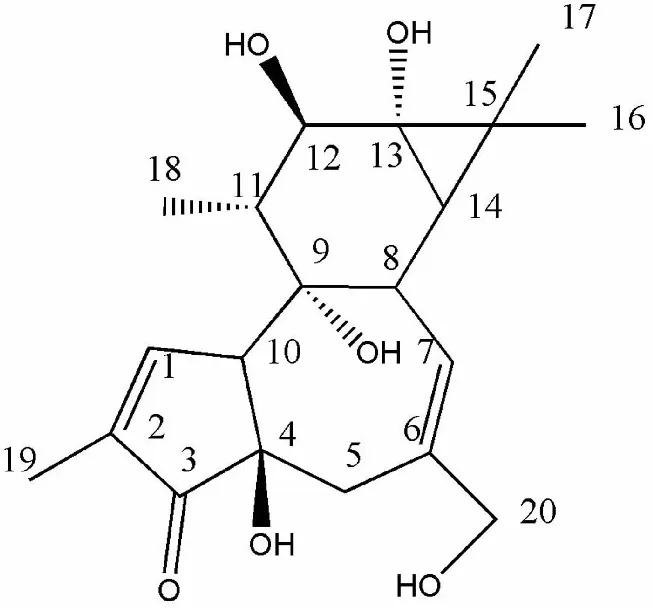
图1 佛波醇的结构式Fig.1 Structural formula of phorbol
1 实验部分
1.1 实验药品
巴豆购自江西樟树天齐堂中药饮片有限公司);佛波醇(质量分数≥98%)购自南京春秋生物技术有限公司;无水碳酸钾(分析纯)购自天津风船化学试剂有限公司;石油醚(分析纯)、无水乙醇(分析纯)、甲醇(色谱纯)均购自天津大茂化学试剂厂;甲醇(分析纯)、盐酸(分析纯)、氢氧化钠(分析纯)均购自西陇化工股份有限公司;NKA-Ⅱ型、ADS-800型、S-8型、ADS-7型、AB-8型、D101、ADS-17型大孔树脂均购自郑州和成新材料有限公司。
1.2 实验仪器
DFY-5L/40型低温恒温反应浴(巩义市予华仪器有限责任公司);BSA124S型电子分析天平(赛多利斯科学仪器有限公司);85-1A型磁力搅拌器(上海驰久有限公司);DDHZ-300型恒温振荡器(国华电器有限公司);RE-52型旋转蒸发仪(上海亚荣生化仪器厂);BT300-2J蠕动泵(兰格恒流泵有限公司);Agilent1260型高效液相色谱仪(安捷伦科技有限公司)。
1.3 佛波醇的定量分析
1.3.1 高效液相色谱(HPLC)条件
色谱柱:Amethyst C18-H(4.6 mm×250 mm,5 μm);流速:1 mL·min-1;进样量:10 μL;柱温:28 ℃;DAD紫外检测波长:234 nm[16];流动相:甲醇-水梯度洗脱,0~5 min甲醇与水比例为V(甲醇):V(水)=15:100,5~20 min逐渐上升到35:100,20~25 min逐渐上升到100:0,25~35 min保持100%甲醇等度洗脱,35~40 min逐渐下降到15:100,40~45 min维持15:100以平衡色谱柱。
1.3.2 标准曲线的测定
称取35 mg佛波醇标准品,倒入25 mL容量瓶中(1.4 mg·mL-1),加入少量甲醇,超声使其完全溶解,甲醇定容,摇匀静置。用1 mL移液枪分别量取1,2,3,4,5,6 mL标准溶液于10 mL容量瓶中。甲醇定容后取0.5~1 mL溶液过滤,HPLC分别测量峰面积。绘制质量浓度(y)对应峰面积(x)标准曲线,得到线性拟合方程:y=7031.9x,在0.14~0.84 mg·mL-1的佛波醇质量浓度范围内,拟合方程线性关系良好(R2=0.999 6)。
1.4 佛波醇酯的提取
将巴豆去壳,在粉碎机中粉碎,以石油醚作为溶剂从巴豆粉末中提取佛波醇酯,浸泡过夜后,抽滤,利用旋转蒸发仪在45 ℃挥干石油醚得到巴豆油,巴豆油于室温下保存即可[16-17]。
1.5 佛波醇酯的醇解
碱性甲醇的制备:称取45 g无水K2CO3倒入烧瓶中,并加入1 500 mL甲醇,开启冷凝水,在60 ℃下搅拌3 h,取出烧瓶后置于室温下冷却,抽滤,倒入锥形瓶中密封备用。
称取3 g巴豆油于双层反应釜中,接上恒温水浴接头,设置反应温度20 ℃,待温度稳定后倒入30 mL碱性甲醇溶液,充入氮气并用气球密封,反应完成后将醇解液倒入烧杯,利用1 mol·L-1的HCl-CH3OH调节pH为6.5~7,抽滤除去KCl沉淀,倒入容量瓶中定容,最后利用HPLC进行定量分析。
1.6 大孔树脂的预处理
将大孔树脂倒入烧杯中,倒入乙醇浸泡24 h,每隔一段时间搅拌一次,随后倒入玻璃层析柱中,用乙醇-水溶液梯度洗脱,再使用超纯水置换掉树脂内部的乙醇,当流出液加水不再浑浊或无乙醇气味为止[18]。
将醇洗过的树脂倒入烧杯中,用质量分数为5% NaOH溶液浸泡6 h,每隔一段时间搅拌一次,将树脂上柱,用超纯水洗脱至中性。
将碱性溶液处理过后的大孔树脂倒入烧杯,加质量分数5% HCl溶液浸泡6 h,每隔一段时间搅拌一次,上柱后用超纯水洗至中性。最后倒入烧杯中,并加入低浓度乙醇浸泡备用。
1.7 静态吸附实验
1.7.1 吸附过程
将树脂于50 ℃烘箱中烘干,分别称取1 g预处理过的干树脂于锥形瓶中,加入少量乙醇活化12 h,抽滤除去乙醇待用。将粗提液旋干,加入20%乙醇溶液使之溶解,并通过HPLC测定佛波醇的初始质量浓度,记为C0。将等量的醇解液和树脂加入到锥形瓶,密封置于恒温振荡器中(25 ℃,135 r·min-1)吸附12 h,取样测HPLC,分别计算各种型号树脂对粗提液中佛波醇的吸附Q:
式中:C0为粗提液中佛波醇的质量浓度,mg·mL-1;C为吸附完成后佛波醇在溶液中的质量浓度,mg·mL-1;V为溶液体积,mL;M为大孔树脂的干重,g。
1.7.2 解吸过程
吸附完成后,为考察各个大孔树脂的解吸性能,将树脂和粗提液抽滤除去溶液后倒入原锥形瓶,加等量纯乙醇密封,在恒温振荡器中(25 ℃,135 r·min-1)解吸12 h,测定溶液中的佛波醇的浓度,并计算各个型号树脂对佛波醇的解吸量Qd:
式中:Cd为解吸完成后溶液中佛波醇的质量浓度,mg·mL-1;Vd为溶液的体积,mL;Md为大孔树脂的干重,g。
1.7.3 静态吸附动力学实验
将预处理后的树脂于50 ℃烘箱中烘干,称取1 g预处理过的干树脂于锥形瓶中,加入少量乙醇浸泡活化12 h,抽滤除去乙醇待用。取30 mL佛波醇溶液(溶剂:16%乙醇,佛波醇质量浓度:1 mg·mL-1)加入到锥形瓶中,倒入1 g树脂后密封。将锥形瓶固定于恒温振荡器中,在25 ℃、156 r·min-1的转速下振荡,在不同的时间点测量溶液中佛波醇的浓度,并计算不同时间点的吸附量(Qt,mg·g-1)。
1.7.4 静态吸附热力学实验
将预处理过的树脂于50 ℃烘箱中烘干,分别称取1 g干树脂倒入7个锥形瓶中,配制(0.1~1 mg·mL-1)7个不同质量浓度的佛波醇溶液并加入锥形瓶中,防水膜封住玻璃塞和瓶口。将锥形瓶置于15,25,35 ℃恒温振荡器中,振荡12 h使其达到吸附平衡,最后,HPLC测溶液浓度,并计算不同初始浓度下的平衡吸附量Qe。
1.8 梯度洗脱
将佛波醇解液和少量树脂倒入梨形烧瓶,利用旋转蒸发仪在50 ℃下去除溶剂,密封备用。将预处理过的大孔树脂按一定的高径比装柱,洗耳球敲实,紧接着倒入旋干后的树脂。配制各个浓度的洗脱液(4%,8%,12%,16%,20%乙醇-水),蠕动泵加压洗脱。按照固定体积间隔收集馏分,分别取少量样品,并用HPLC测定溶液中佛波醇含量。
2 结果与讨论
2.1 大孔树脂的初步筛选
大孔树脂的初步筛选主要是根据树脂的吸附解吸性能,通常树脂对目标组分需有较大吸附量和较高的解吸率。因此,我们初步考察了7种大孔树脂对佛波醇的吸附解吸性能。
由表1可知,NKA-Ⅱ、ADS-800、ADS-7、D101对佛波醇的吸附量较大,也有较好的解吸率,故后续用于对佛波醇进行纯化试验。
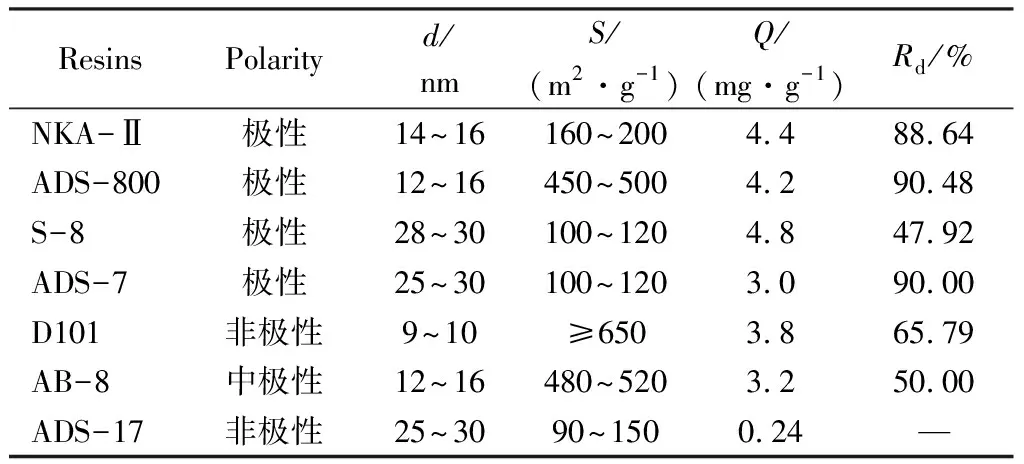
表1 7种大孔树脂结构参数Tab.1 Performance parameters of 7 kinds of macroporous adsorption resins
2.2 D101树脂吸附动力学考察
D101树脂吸附动力学曲线如图2所示,在80 min前吸附速率很快,D101树脂对佛波醇的吸附量呈快速上升的趋势;80 min后,吸附速率缓慢,在300 min左右达到平衡。这可以是因为前期溶液与大孔树脂间的浓度差较大,传质推动力大,且大孔树脂内外表面有大量的吸附位点,对佛波醇具有较强的吸附作用,使得前期的吸附速率很大。80 min后吸附速率缓慢的原因可能是液-固间浓度差减小,且此时起吸附作用的主要是一些小孔道内的吸附位点。为研究D101树脂对佛波醇的吸附机制,利用一级动力学和二级动力学方程进行拟合,一级动力学方程如下:
ln(Qe-Qt)=lnQt-k1t
二级动力学方程如下:
式中:Qt为时间t时的吸附量,mg·g-1;Qe,cal为拟合的平衡吸附量,mg·g-1;k1和k2分别为一级和二级动力学速率常数。
采用直线拟合的方法得到初始值,进而将实验数据进行动力学拟合,研究D101树脂对佛波醇的吸附机制,拟合结果如表2所示。
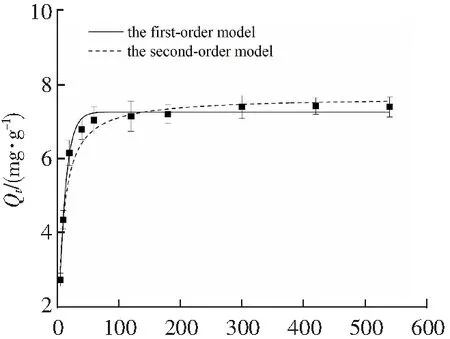
t/min图2 D101树脂吸附动力学、一级和二级模型拟合曲线Fig.2 Adsorption kinetic curve and fitting curves by the first-order kinetic equations and second-order kinetic equations for D101 resin

表2 D101树脂吸附佛波醇的动力学模型参数Tab.2 Kinetic model fitting parameters of phorbol adsorption on D101 resin
由表2可以看出,一级动力学与二级动力学对佛波醇吸附过程都具有很好的拟合效果,且一级动力学拟合曲线的相关系数大于二级动力学拟合曲线的相关系数。一级动力学主要是更符合物理吸附过程,而二级动力学则更符合化学吸附过程,因此可以证明D101树脂对佛波醇的吸附过程主要受物理吸附的影响。
2.3 D101树脂吸附热力学考察
等温吸附曲线如图3所示,由于传质推动力的差异,随着佛波醇质量浓度的增加,吸附量也呈上升趋势,且随着温度的增加,大孔树脂对佛波醇的吸附量下降,说明该吸附过程可能为放热过程,降低温度能够提高树脂吸附量。
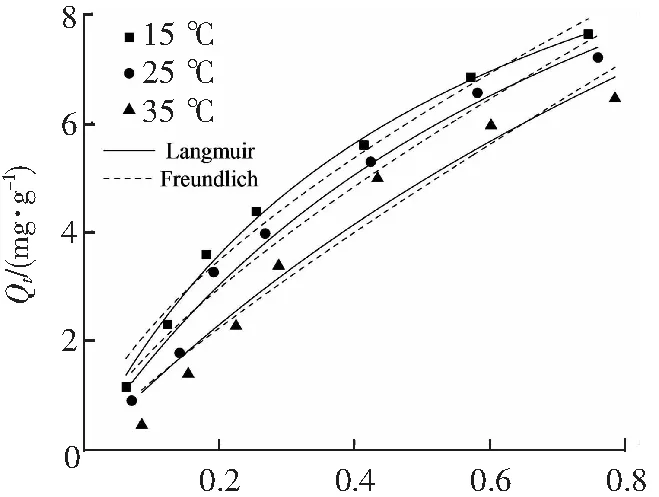
Ce/(mg·mL-1)图3 D101树脂的Langmuir和Freundlich等温吸附模型曲线Fig.3 Langmuir and Freundlich isotherm models fitting for D101 resin
进一步研究树脂对佛波醇的吸附机制,将吸附数据通过Langmuir方程拟合,方程如下:
式中:Ce为吸附平衡时吸附液中佛波醇的质量浓度,mg·mL-1;Qe为不同质量浓度下的平衡吸附量,mg·g-1;Qmax为理论上的最大吸附量,mg·g-1;KL为吸附平衡常数,mL·mg-1。
对数据也采用Freundlich方程进行拟合,方程如下:
式中:Ce为吸附平衡时吸附液中佛波醇的质量浓度,mg·mL-1;Qe为不同质量浓度下的平衡吸附量,mg·g-1;KF为平衡吸附常数;1/n为异质因子。
Langmuir和Freundlich拟合结果如表3所示。Freundlich方程中的1/n表示被吸附物与吸附剂的吸附强度,当0.1<1/n<1.0表示吸附良好,低于1.0时,吸附强度随着1/n越来越接近1而增大,而1/n>1.0则表明吸附能力差。由表3可以看出拟合曲线参数1/n均在0.1~1之间,表明该树脂对佛波醇具有良好的吸附能力。Langmuir模型的相关系数为0.994 5,0.983 2,0.962 2,拟合效果较好,按照Langmuir等温吸附模型的假定,该树脂对佛波醇的吸附是各处吸附能相同的单分子层等温吸附。
2.4 大孔树脂柱层析纯化工艺
2.4.1 极性大孔树脂柱层析
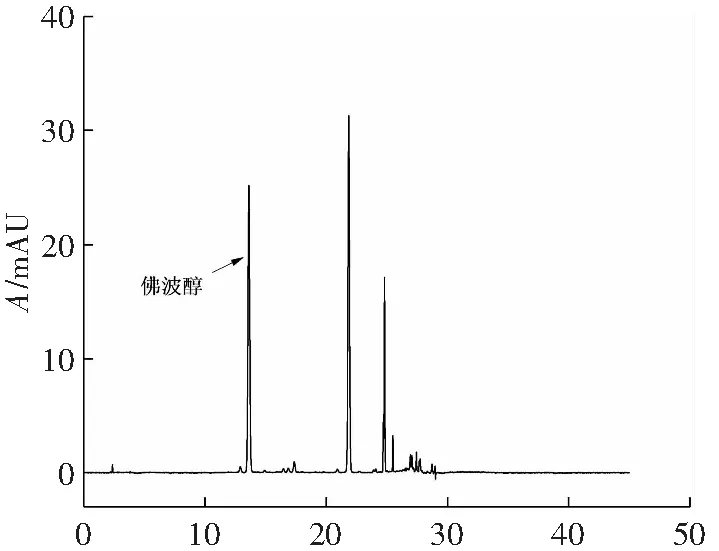
根据大孔树脂筛选的实验结果,先采用3种极性大孔树脂(NKA-Ⅱ、ADS-800、ADS-7)对佛波醇进行纯化。上样方式可采用静态吸附上样:取适量大孔树脂和佛波醇粗提液于烧杯中,保鲜膜密封,在恒温振荡器中静态吸附12 h;也可采用干法上样:将醇解液与大孔树脂混合后,用旋转蒸发仪除去溶剂(不完全旋干,以确保内腔含溶剂利于洗脱剂的进入)。上样完成后,将树脂边搅拌边倒入层析柱中,紧接着利用洗耳球将树脂柱敲紧至无明显孔洞(柱高18 cm,直径约3 cm)。设置蠕动泵流速为4 mL·min-1,洗脱方式采用乙醇-水梯度洗脱(纯水、10%~100%乙醇,步长为10%,每个浓度体积为两倍床层体积),每50 mL收集一次,取样测馏分中佛波醇的含量。3种极性大孔树脂的纯化效果均不理想,且增大洗脱液中水的比例也无法改善。纯化后的样品的色谱图如图4所示。
表3 D101树脂吸附佛波醇的Langmuir、Freundlich模型参数Tab.3 Langmuir and Freundlich model fitting parameters for phorbol adsorption on D101 resin
t/min(a) ADS-7大孔树脂纯化后样品液相色谱

t/min(b) NKA-Ⅱ大孔树脂纯化后样品液相色谱
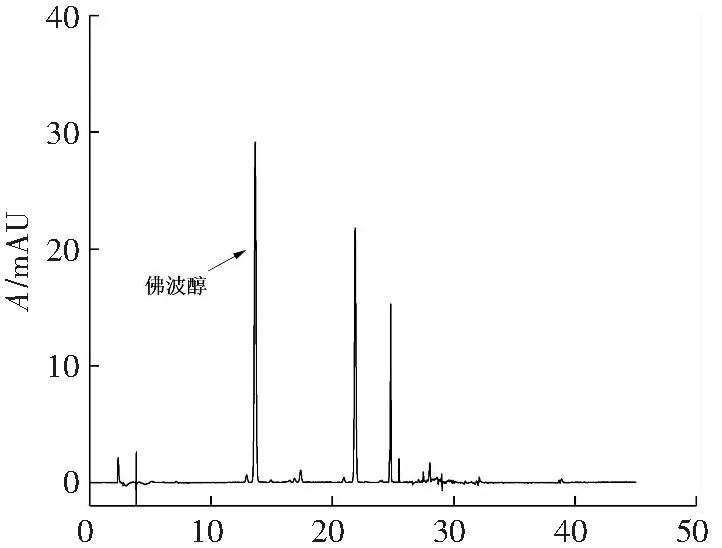
t/min(c) ADS-800大孔树脂纯化后样品液相色谱
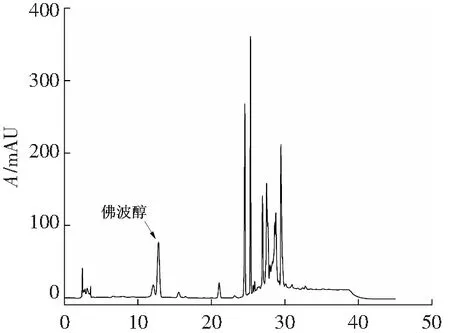
t/min(d) 粗佛波醇提取液液相色谱图4 粗佛波醇提取液和3种极性大孔树脂纯化后样品液相色谱Fig.4 Liquid chromatograms of crude phorbol extracts and samples after purification with three polar macroporous resins
2.4.2 D101树脂梯度洗脱
从静态吸附实验结果可以看出,D101大孔树脂对佛波醇也具有较好的吸附效果,且从粗提液的液相色谱图可以看出,粗提液存在很多弱极性杂质,也存在一部分强极性杂质,因此采用D101大孔树脂既能使佛波醇具有较长的保留时间,除去强极性杂质;又能保证佛波醇与弱极性杂质间有较大的分离度。
经试验发现,采用静态吸附上样、动态上样的方式达不到理想的效果。因此采用干法上样。将活化后的树脂装柱(边搅拌边倒入),用洗耳球将柱子(Φ30 mm)敲紧,乙醇-水梯度洗脱,洗脱程序为:250 mL(两倍床层体积)4%乙醇-水、250 mL 8%乙醇-水,250 mL 12%乙醇-水,350 mL 16%乙醇-水,250 mL 20%乙醇-水,250 mL 24%乙醇-水,每50 mL收集一次馏分,利用HPLC检测洗脱液中佛波醇的含量(md),并绘制以洗脱液体积(Vd)为横坐标的洗脱曲线(图5)。
由图5可知,佛波醇主要在12%,16%乙醇-水洗脱剂中富集,馏分液相结合色谱图(图6)可以看出,经洗脱后,佛波醇既能得到有效的富集,也能保证与杂质完全分离。最终实验收集650~1 000 mL部分的馏分,回收率为62.16%。
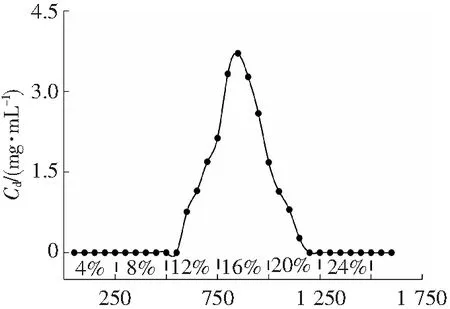
Vd/mL图5 D101树脂梯度洗脱曲线Fig.5 D101 resin gradient elution curve
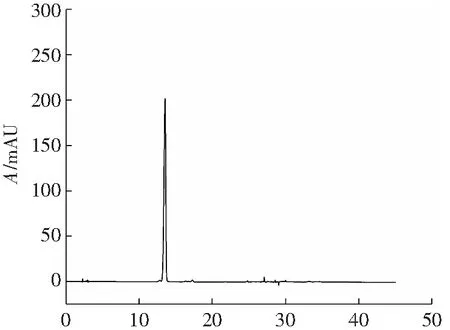
t/min图6 650~1 100 mL馏分液相色谱图Fig.6 HPLC of 650-1 100 mL fractions in the eluent
2.4.3 大孔树脂分离梯度洗脱工艺放大
为提高分离过程中的处理量,在固定高径比和流速的条件下,采用直径更大的层析柱(Φ45 mm)进行放大实验。梯度洗脱程序中各个浓度的洗脱剂体积对应床层体积比(1:3.38)增加,洗脱程序为:850 mL(两倍床层体积)4%乙醇-水、850 mL 8%乙醇-水、850 mL 12%乙醇-水、1350 mL 16%乙醇-水、850 mL 20%乙醇-水。
在固定高径比、流速,增大树脂用量和上样量的情况下,进行梯度洗脱,洗脱曲线和分离效果具有很高的重现性。
2.5 后处理
利用旋转蒸发仪在70 ℃下除去馏分中的溶剂,加入60 mL丙酮,搅拌,色素与杂质溶于丙酮,佛波醇在丙酮中的溶解度不大,会以沉淀的形式存在,抽滤得到的佛波醇固体放置在50 ℃烘箱中干燥6 h得到黄白色粉末样品,置于4~8 ℃冰箱中密封保存,以V(水):V(丙酮)=2:8混合溶液作为溶剂,45 ℃下加热将样品完全溶解,4 ℃下佛波醇冷却析出,抽滤,于50 ℃烘箱中干燥8 h,得到佛波醇产品(如图7所示),经HPLC分析,测得质量分数为91.08%。

图7 佛波醇产品照片Fig.7 Photography of phorbol product
3 结论
根据静态吸附解吸实验结果,选择NKA-Ⅱ、ADS-800、ADS-7、D101对佛波醇进行纯化。在实际分离过程中,NKA-Ⅱ、ADS-800、ADS-7大孔树脂柱层析分离效果不佳,而D101树脂能取得很好的分离效果。
根据动力学拟合结果表明,一级动力学拟合曲线的相关系数大于二级动力学拟合曲线的相关系数,证明D101树脂对佛波醇的吸附过程主要受物理吸附的影响。由Freundlich、Langmuir方程拟合曲线得出D101树脂对佛波醇具有良好的吸附能力,且D101树脂对佛波醇的吸附是各处吸附能相同的单分子层等温吸附。
实验中采用乙醇-水梯度洗脱方式、干法上样,对佛波醇粗品进行分离,取得了很好的分离效果,且回收率较高(62.16%),再经后处理,得到佛波醇产品,HPLC测得质量分数为91.08%。
本文采用大孔吸附树脂柱层析的方法,以乙醇-水为溶剂系统,通过梯度洗脱的方法可实现快速分离,得到纯度较高的佛波醇。与传统硅胶柱层析分离方法相比,本文的分离方法不使用低沸点有机溶剂,所以更加绿色安全。在后续的研究中,我们将进一步扩大分离规模,优化后续处理方法,希望得到纯度更高的产品。

