α-羟基-3,6-二烯化合物在APCI-TOF MS中脱羟基正离子[M-OH]+的机理研究
何 蕾,高元吉,2,赵丽娟
(1.四川师范大学化学与材料科学学院,四川 成都 610068;2.浙江大学化学系,浙江 杭州 310027)
α-羟基-3,6-二烯化合物可由1,3-二烯与醛、烯基锆试剂在镍催化下发生碳烯化三元偶联反应合成得到[1],其具有的1,4-二烯是天然产物中一类用途广泛的结构单元,可转变为结构多样的多烯,是多种生物活性分子中常用的结构单元,也可作为有机合成的关键中间体[2-3]。因此,研究具有1,4-二烯结构单元化合物的质谱行为,对该类化合物的合成和开发具有重要意义。
四极杆飞行时间高分辨质谱(QTOF-HRMS)具有分辨率高、灵敏度高、分析速度快等特点,可在短时间内快速获得化合物的结构信息,广泛应用于有机分析[4]。化合物的质谱裂解途径与其结构相关[5],研究化合物的质谱碎裂过程已成为鉴别化合物、指导合成与开发应用的重要手段。然而,仅根据质谱图推导裂解途径缺乏理论数据支撑,难以准确地分析化合物的质谱峰归属。随着量子化学的发展,有研究者[6-8]将密度泛函理论(DFT)应用于质谱气相离子分析中,以更准确地解析化合物的气相离子过程及机理。
目前,研究人员普遍用化合物质子化后再脱水消除的机理解释脱羟基正离子现象[9-11],尚未见通过DFT理论计算研究α-羟基-3,6-二烯化合物的质谱离子化过程中脱羟基及脱水竞争关系的报道。基于此,本工作以9种α-羟基-3,6-二烯化合物为例,根据其结构中脱羟基能否与临位有效形成芳香族-α-羟基-3,6-二烯化合物(Ⅰ)和脂肪族-α-羟基-3,6-二烯化合物(Ⅱ)2类共轭结构,利用大气压化学电离飞行时间质谱(APCI-TOF MS)技术,通过碰撞诱导解离(CID)对各化合物的离子峰进行串联质谱分析,并用DFT理论计算结果佐证其裂解过程,旨为α-羟基-3,6-二烯化合物的快速鉴定和谱图解析提供参考依据。
1 实验部分
1.1 主要仪器与装置
Xevo G2-XS Q-TOF高分辨质谱仪:美国Waters公司产品,配有ESI/APCI复合离子源和Masslynx 4.1软件。
1.2 主要材料与试剂
甲醇(色谱纯):美国Fisher公司产品;甲酸钠(0.5 mmol/L)和亮氨酸脑啡肽(50 μg/L):由Waters科技上海有限公司产品配制;1-对甲苯-十一烷-3,6-二烯-1-醇(Ⅰ-1)、1-(4-氰基-苯基)-十一烷-3,6-二烯-1-醇(Ⅰ-2)、1-(2-烯丙基氧基苯基)-十一烷-3,6-二烯-1-醇(Ⅰ-3)、1-(2-甲氧基苯基)-十一烷-3,6-二烯-1-醇(Ⅰ-4)、1-萘-十一烷-3,6-二烯-1-醇(Ⅰ-5)、1-(3-氯-苯基)-十一烷-3,6-二烯-1-醇(Ⅰ-6)、十四烷-6,9-二烯-4-醇(Ⅱ-1)、1-环己基十一烷-3,6-二烯-1-醇(Ⅱ-2)和1-苯基-十三烷-5,8-二烯-3-醇(Ⅱ-3)等9种α-羟基-3,6-二烯化合物:由四川师范大学陈斌副研究员提供,其化学结构示于图1,分别配制该类化合物的甲醇溶液(100 mg/L)。
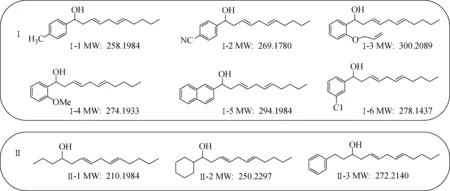
图1 α-羟基-3,6-二烯化合物及其类似物的化学结构Fig.1 Chemical structures of α-hydroxy-3,6-diene compounds and their analogues
1.3 质谱条件
APCI离子源,正离子检测模式;甲酸钠和亮氨酸脑啡肽作为校正液;毛细管电压3.0 kV;锥孔电压30 V;离子源温度120 ℃;脱溶剂温度400 ℃;电晕放电采取5.0 μA电流模式,质量采集范围m/z50~1 000;对获得的脱羟基离子进行10~30 V不同能量的CID解离;双通取代色谱柱,进样量1 μL,以100%甲醇作为流动相进入质谱仪分析。
1.4 DFT计算
使用密度泛函的B3LYP6-31++G(d,p)基组,分别优化9个α-羟基-3,6-二烯化合物通过Ⅰ、Ⅱ 2种途径得到的离子结构式,直至检测时无虚频,以获得精确、稳定的几何构型,并进行势能计算。使用Gaussview06软件分析计算结果。
2 结果与讨论
2.1 脱羟基特征离子及串联质谱
9个α-羟基-3,6-二烯化合物的质谱图示于图2,这些化合物具有良好的质谱响应,且均获得较强的去羟基离子峰。根据各物质的结构特征,按照是否有邻位共轭基团与—OH离去后的碳正离子形成共轭体系,可将α-羟基-3,6-二烯化合物分为Ⅰ、Ⅱ类。正离子模式下,Ⅰ类化合物侧链失去羟基负离子后所形成的碳正离子能够与苯环大π键形成稳定的p-π共轭体系,为[M-OH]+;Ⅱ类化合物—OH的α、β位没有能与之形成共轭体系的基团,由于—OH官能团的吸电子诱导效应,其在气相中形成脱水质子加合离子,为[M-H2O+H]+。然而,Ⅰ类化合物先发生脱水反应再与质子加合后形成的离子也可能与苯环共轭。因此,有必要对这2类化合物进行详细分析。
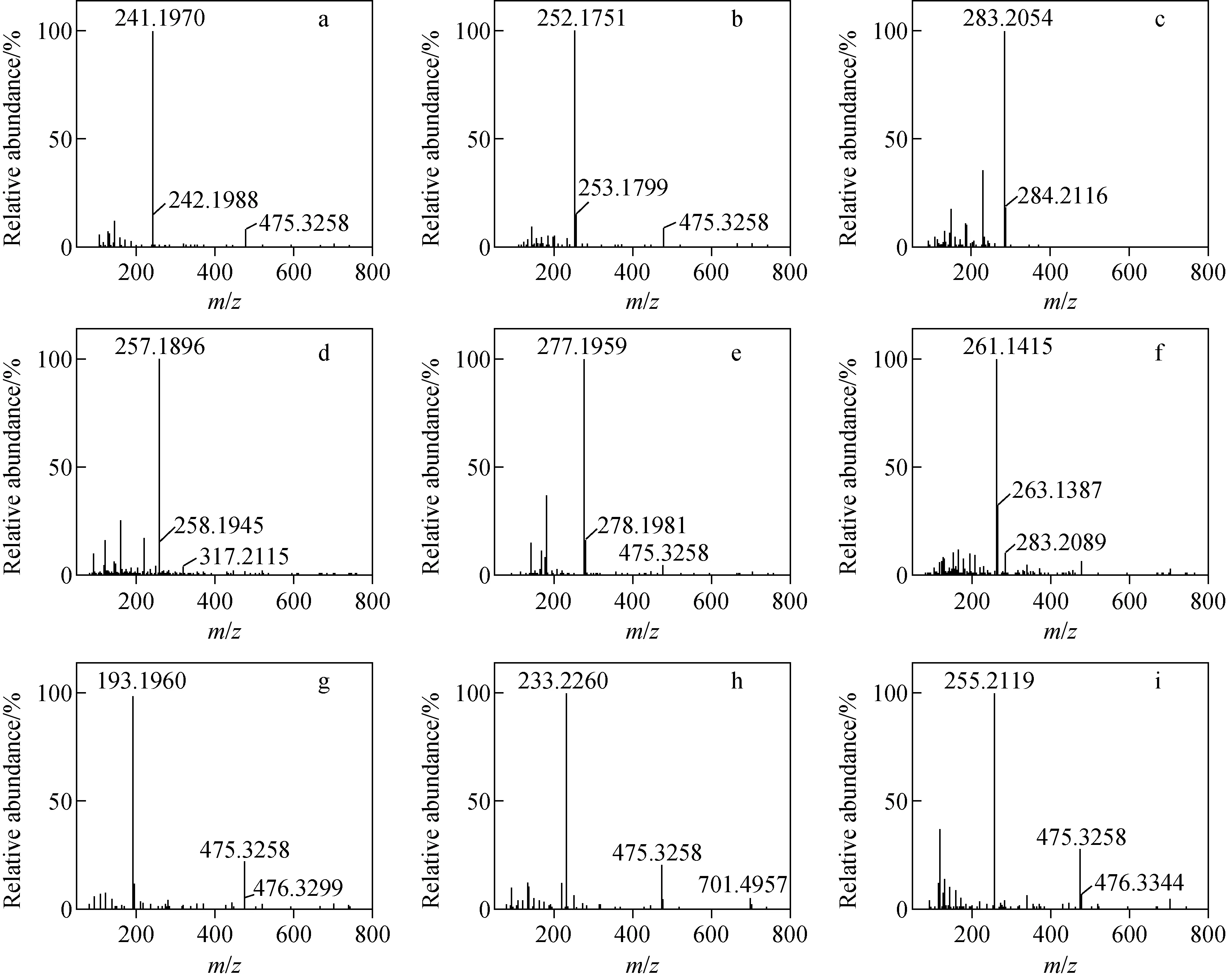
注:a.Ⅰ-1;b.Ⅰ-2;c.Ⅰ-3;d.Ⅰ-4;e.Ⅰ-5;f.Ⅰ-6;g.Ⅱ-1;h.Ⅱ-2;i.Ⅱ-3图2 α-羟基-3,6-二烯化合物及其类似物的APCI质谱图Fig.2 APCI mass spectra of α-hydroxy-3,6-diene compounds and their analogues
为进一步验证α-羟基-3,6-二烯化合物的质谱裂解途径,对9个化合物二级质谱所需的CID碰撞能量进行优化,结果列于表1,串联质谱图示于附图1(请登录《质谱学报》官网http:∥www.jcmss.com.cn下载,以下同)。

表1 9个α-羟基-3,6-二烯化合物在正离子模式下的质谱碎片信息Table 1 Mass spectrometric fragments of nine α-hydroxy-3,6-diene compounds in positive ion mode
2.1.1Ⅰ类α-羟基-3,6-二烯化合物的质谱裂解分析 以Ⅰ-1为例,该化合物在一级质谱中形成稳定的去羟基离子m/z241.197 0 [M-OH]+,通过施加15 V碰撞能量,得到m/z199.149 7、185.132 7、171.118 4等主要碎片离子。母离子丢失正丁烷后得到m/z199.149 7碎片离子,继续发生碳链断裂,丢失2个亚甲基后,碳正离子转移,随后碳链末端裂解形成m/z157.103 8、143.087 7碎片离子;碳正离子逐渐向苯环转移,开环裂解后得到m/z131.086 0、105.070 8碎片离子,其质谱裂解途径示于图3。其余Ⅰ类化合物的串联质谱及峰归属示于附图2~5。
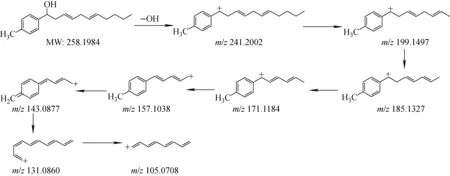
图3 化合物Ⅰ-1可能的裂解途径Fig.3 Proposed fragmentation pathways of compound Ⅰ-1
2.1.2Ⅱ类α-羟基-3,6-二烯化合物的质谱裂解分析 以化合物Ⅱ-3为例,—OH有吸电子诱导效应,会发生醇脱水反应,一级质谱形成离子m/z255.211 9[M-H2O+H]+,在15 V碰撞能量下依次经过3次碳链裂解得到m/z213.164 1、171.118 4、157.101 2碎片离子。接下来主要有2条裂解途径:1) 继续发生碳链裂解得到m/z117.118 4、91.055 4碎片离子,并且在碳链裂解过程中双键转移生成更稳定的中间体;2) 碳正离子转移至苯环发生开环裂解得到m/z131.086 0碎片离子,可能的裂解途径示于图4。其余Ⅱ类化合物详细的裂解途径示于附图6、7。
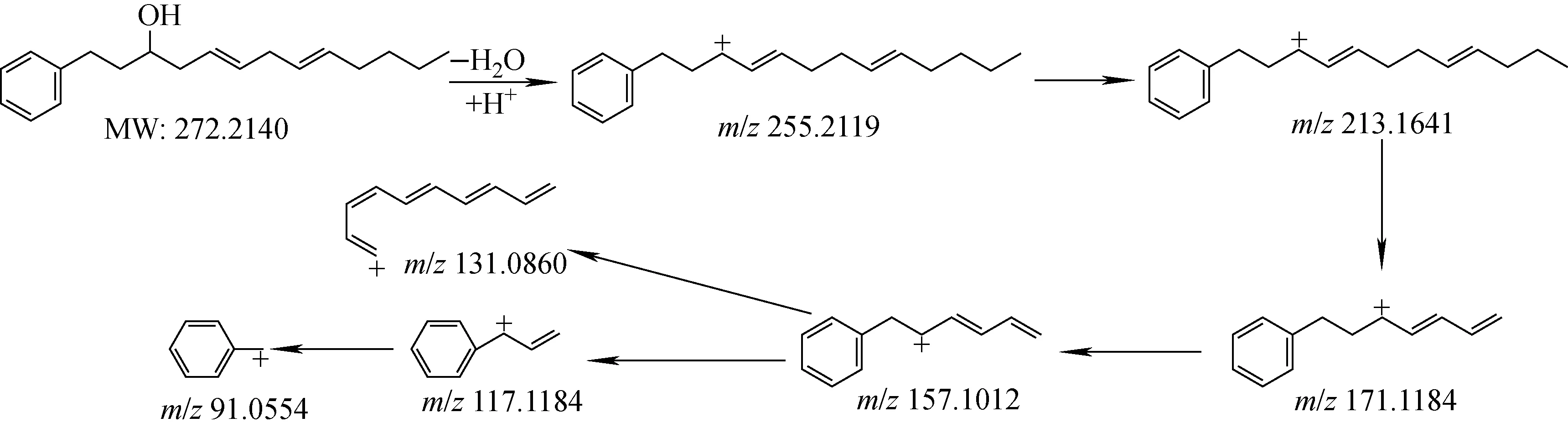
图4 化合物Ⅱ-3可能的裂解途径Fig.4 Proposed fragmentation pathways of compound Ⅱ-3
2.2 DFT势能计算
Ⅰ类物质失去—OH所形成的碳正离子能够与苯环形成共轭体系,以Ⅱ类方式脱水后加合质子也可形成共轭结构,倾向于Ⅱ类过程。基于此,对α-羟基-3,6-二烯化合物的质谱裂解途径进行系统的DFT计算,比较9个化合物Ⅰ、Ⅱ两类途径得到的碳正离子势能,各化合物的最低势能结构及势能值分别列于表2和示于附图8。结果表明,大多数化合物的推导是合理的,Ⅰ类化合物裂解得到离子的最优结构式能量低于Ⅱ方式(能量Ⅰ<Ⅱ),Ⅱ类化合物裂解得到离子的最优结构式能量更低(能量Ⅱ<Ⅰ),各化合物的最优离子结构详细DFT数据列于附表1。然而,经DFT精确计算后发现,Ⅰ-2、Ⅰ-5和Ⅰ-6化合物若按照Ⅰ方式形成[M-OH]+离子,该结构式能量大于Ⅱ方式得到的[M-H2O+H]+离子,因此,这3个化合物的最低势能离子对应Ⅱ类化合物途径。以化合物Ⅰ-2为例,其在一级质谱中形成的离子m/z252.178 4 [M-OH]+经30 V碰撞能量,Ⅰ过程碎片离子无法正确归属,Ⅱ过程形成的离子m/z252.178 4 [M-H2O+H]+具有更低的势能,串联质谱具有更合理的归属,示于图5。Ⅰ-2正确的裂解途径是在一级质谱下由于—OH的吸电子效应发生脱水反应后,正离子模式下质子化形成离子m/z252.178 4 [M-H2O+H]+,在30 V碰撞能量下,首先发生碳链断裂得到m/z208.114 0碎片离子,经2条途径分别得到m/z167.077 7、194.098 4碎片离子,但—CN较稳定,因此其裂解途径是先得到m/z194.089 4碎片离子,且碳正离子与苯环相连成环状结构,再失去—CN基团得到m/z167.077 7碎片离子。另一途径是末端碳正离子与含负电性的碳碳双键相连得到m/z180.082 3碎片离子,然后碳正离子向苯环转移并丢失碳得到m/z154.067 3碎片离子,最后发生—CN裂解和开环裂解分别得到m/z127.056 1、116.050 4碎片离子。同理,经DFT计算证明,化合物Ⅰ-5、Ⅰ-6先发生脱水反应,再质子化形成离子[M-H2O+H]+,然后在二级质谱中15 V碰撞能量下发生裂解,具体的裂解途径示于附图9、10。
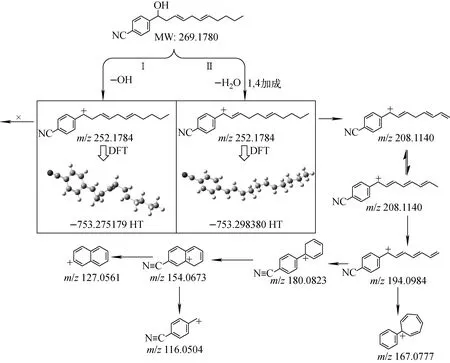
图5 化合物Ⅰ-2经Ⅰ、Ⅱ去羟基离子的二级质谱裂解途径和最佳的气相稳定结构Fig.5 MS/MS fragmentation pathways of compound Ⅰ-2 through Ⅰ and Ⅱ processes and optimized gas-phase lowest-energy structures
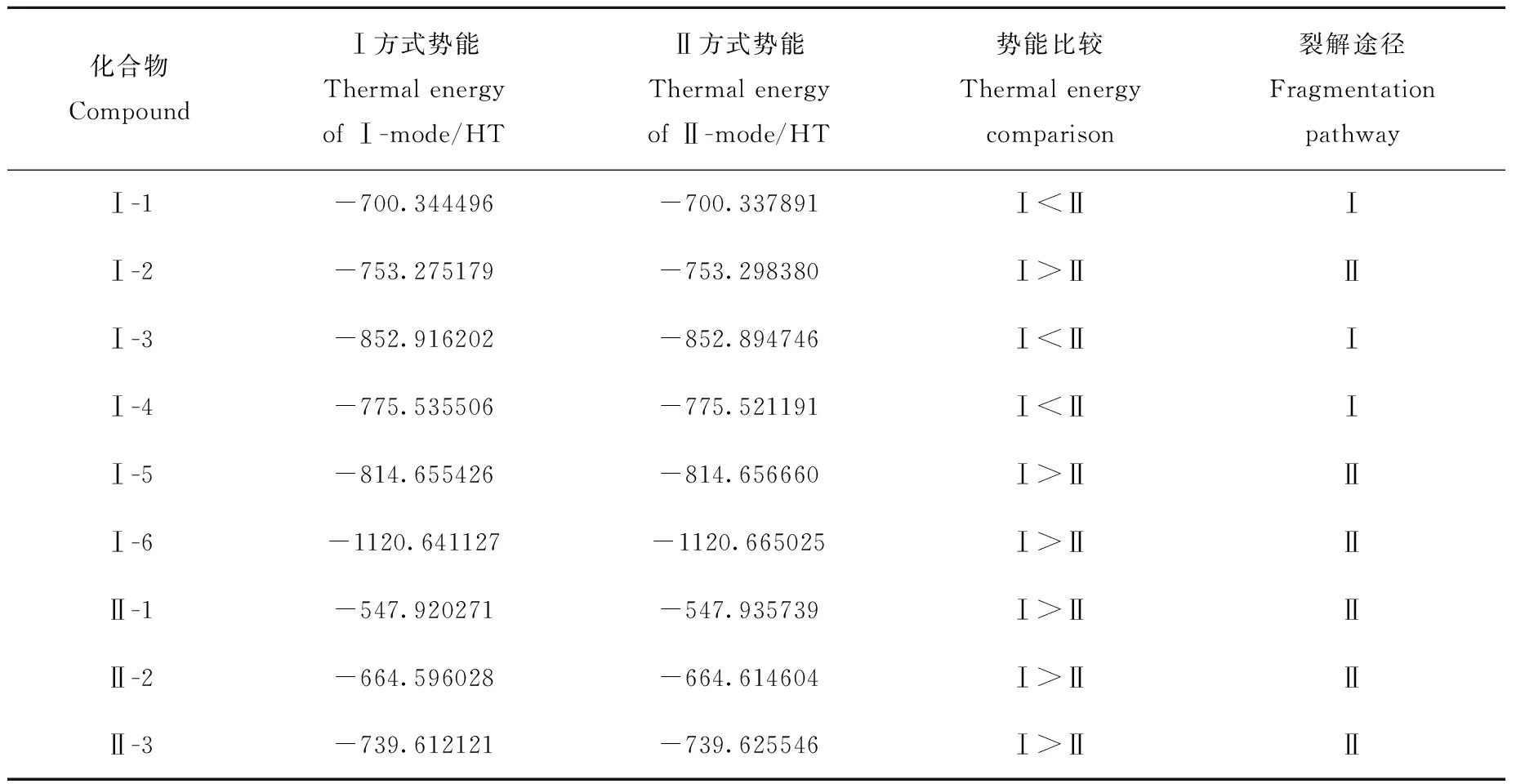
表2 9个α-羟基-3,6-二烯化合物Ⅰ、Ⅱ裂解方式势能比较Table 2 Thermal energy comparison of nine α-hydroxy-3,6-diene compounds during Ⅰ and Ⅱ fragmentation pathways
通过计算对比Ⅰ、Ⅱ两种裂解方式的键能,质谱裂解倾向于生成键能更低的离子,验证了对Ⅰ、Ⅱ类α-羟基-3,6-二烯化合物裂解途径的推导,从理论上解释了两类化合物质谱图的差异性。
3 结论
本工作采用APCI-TOF MS方法结合量子化学密度泛函理论计算,在正离子模式下对9个α-羟基-3,6-二烯化合物进行分类,并对其质谱裂解机理进行深入研究。结果表明,Ⅰ类易直接形成去羟基正离子,Ⅱ类易形成[M-H2O+H]+离子,质谱离子倾向于生成键能更低的气相稳定结构,简单的CID裂解推导对于大多数α-羟基-3,6-二烯化合物是适用的,但少数化合物存在不合理性,需要理论数据支撑。将质谱图与DFT理论计算相结合,从势能角度出发,可为进一步研究α-羟基-3,6-二烯化合物的质谱裂解及结构解析提供理论依据。
致谢:感谢四川师范大学陈斌副研究员提供的样品。
——《势能》

