基于酰胺化的化学标记技术在磷酸化多肽分析中的应用
邹伦妃,张启伟,肖 琛,熊 淼,郑 琦
(江汉大学光电化学材料与器件教育部重点实验室,湖北 武汉 430054)
蛋白质是生命活动的主要执行者,通常呈现多样化的翻译后修饰(PTMs),其中磷酸化修饰最为普遍。细胞通过激酶“写入”磷酸基与磷酸酶“擦除”磷酸基,可改变蛋白质的三维结构,以实现对其活性调节,进而调控生物的生长发育(增殖分化与凋亡等)[1]、信号转导[2-3]以及疾病的发生发展等[4-5]。在很长一段时间内,磷酸化蛋白质组学研究的重点在于突破分析技术障碍,以鉴定大量的磷酸化蛋白质以及定位磷酸基位点[6-7]。随着生物质谱技术的发展与成熟,蛋白质磷酸化研究由早期的定性分析逐步扩展到定量分析[8-13]。在生物体内,蛋白质磷酸化过程是短暂且动态变化的,通过定量分析掌握这些变化规律,将有助于了解磷酸化蛋白质在生命活动调控中的机理作用,进一步洞悉生命活动中信号转导及生物功能的实现机制。
蛋白质翻译后修饰的定量分析一般基于“自下而上”(bottom-up)的质谱方法,主要分为无标记定量技术[14]、以含有稳定同位素的多肽作为内标的绝对定量技术[15-16]、化学标记技术[17]。其中,化学标记技术是在提取蛋白质或多肽后再标记特定氨基酸,主要分为轻重同位素标记法和同整质量标签标记法。常见的轻重同位素标记试剂有同位素编码亲和标签(ICAT)[18-19]、甲醛[20],分别标记半胱氨酸、多肽N端与赖氨酸,将轻重同位素标记的样品混合后,可通过质谱分析不同样品中同一个蛋白质的相对丰度差异;以同位素标记相对和绝对定量(iTRAQ)技术[21]、串联质谱标签(TMT)技术[22]为代表的同整质量标签标记法是使用一组具有同整质量的试剂分别标记不同样品,通过观察样品混合后在二级质谱图中各报告基团的相对丰度,进而比较对应蛋白质的表达量差异。除此之外,有报道[10-11]通过去磷酸基后的加成反应特异性地标记磷酸化多肽,然而,因其反应条件较苛刻,使得该方法可能会破坏多肽结构。使用胺类试剂衍生羧基的化学标记法已应用于蛋白质的糖基化修饰研究[23]。该方法在高通量的磷酸化蛋白分析方面具有如下特点:1) 在蛋白质组学研究中常用的蛋白酶均可酶切目标物产生标记位点,具有广谱性;2) 轻重同位素标记的差异至少可达6 u,能有效避免多肽同位素峰重叠的风险;3) 标记过程操作简单且较温和,对磷酸化多肽无显著影响;4) 磷酸化多肽被标记后可适当增强TiO2的富集特异性以及质谱检测的灵敏度;5) 衍生试剂价廉易得。
本研究拟采用基于胺类试剂衍生羧基的化学标记法进行蛋白质的磷酸化修饰研究。使用二甲胺(d0-DMA)与氘代二甲胺(d6-DMA)分别衍生不同样品后,多肽被轻重同位素标记,然后通过TiO2磁颗粒富集和质谱检测完成磷酸化多肽的相对定量分析。
1 实验部分
1.1 主要仪器与装置
M5-TripleTOF 5600+微流液相色谱-四极杆飞行时间质谱(microLC-QTOF MS)联用仪:美国SCIEX公司产品,配有电喷雾离子源及PeakView 2.1数据处理系统;真空离心浓缩仪:德国Eppendorf公司产品;超纯水仪:英国ELGA公司产品。
1.2 主要材料与试剂
乙腈(ACN,LC-MS级):美国Thermo Fisher公司产品;甲酸(FA,LC-MS级)、10%氨水(HPLC级):美国FLUKA公司产品;牛血清酪蛋白、N-甲基吗啉、(3H-1,2,3-三唑并[4,5-b]吡啶-3-氧基)三-1-吡咯烷基六氟磷酸盐(PyAOP)、尿素、碳酸氢铵、二甲基亚砜(DMSO)、丙酮:美国Sigma-Aldrich公司产品;二硫苏糖醇(DTT)、碘乙酰胺(IAM)、胰蛋白酶(Tryspin)、重组赖氨酰内切酶(Lys-C):上海生工生物工程有限公司产品;三氟乙酸(TFA)、二甲胺盐酸盐、氘代二甲胺盐酸盐、乙醇、乙醇酸:上海阿拉丁生化科技有限公司产品;TiO2磁珠:厦门普睿迈格生物科技有限公司产品;C18固相萃取柱:深圳逗点生物技术有限公司产品。
1.3 实验条件
1.3.1色谱条件 C18色谱柱(3.0 μm×0.3 mm×150 mm),柱温40 ℃;流动相:2%ACN(含0.1%FA)(A)和98%ACN(含0.1%FA)(B);梯度洗脱:0~2 min(5%B),2~30 min(5%~38%B),30~38 min(38%~90%B),38~43 min(90%B),43~45 min(90%~5%B),45~60 min(5%B);流速6 μL/min;进样量5 μL。
1.3.2质谱条件 电喷雾电离源(ESI);正离子模式;离子源温度350 ℃;喷雾电压5 500 V;离子源气体GS1为110.32 kPa,GS2为124.11 kPa;气帘气(CUR)为206.85 kPa;一级质谱扫描范围m/z300~1 250;二级质谱扫描范围m/z100~1 500。
1.4 实验方法
1.4.1羧基的酰胺化 将酪蛋白溶解于8 mol/L尿素溶液中,用DTT和IAM处理以保持二硫键处于打开状态;用Lys-C和Trypsin混合酶酶切蛋白质标准品成多肽。酶切后的肽段用经2 mL H2O、2 mL 80%ACN(含0.1%TFA)、2 mL 0.1%TFA预处理的C18固相萃取柱脱盐,随后用1 mL 50%ACN(含0.1%TFA)洗脱。
将干燥后的样品溶于40 μL DMSO(含1 mol/L d0-DMA和0.5 mol/LN-甲基吗啉)中,再加入40 μL 50 mmol/L PyAOP溶液(溶于DMSO中),反应溶液于常温且黑暗处静置1 h,以酰胺化羧基[24]。
1.4.2磷酸化多肽的富集 用200 μL 80% ACN(含0.1%TFA)稀释衍生后的样品,向其中加入20 μL TiO2磁珠悬浮液并振荡1 h。用100 μL 30%丙酮(含0.1%TFA)和100 μL 50%ACN(含0.1%TFA)各洗涤磁珠2次,随后用200 μL 20%ACN(含5% NH4OH)洗脱多肽。未衍生样品的富集方法如下:干燥样品用上样缓冲液(1 mol/L乙醇酸溶于80%ACN和5%TFA中)溶解后与20 μL TiO2磁珠悬浮液混合;分别用100 μL上样缓冲液、100 μL 80%ACN(含0.1%TFA)、100 μL 10%ACN(含0.2%TFA)洗涤磁珠1、3、1次,随后用240 μL 1%NH4OH洗脱多肽。所有样品真空干燥后于-20 ℃储存备用。
1.4.3稳定同位素标记 将酪蛋白酶解后的多肽按照物质的量比1∶5、1∶2、1∶1、2∶1、5∶1分别用d0-DMA、d6-DMA标记。轻重标记的多肽在混合后经TiO2磁珠富集并真空干燥。
1.4.4数据分析 使用ProteinPilot(4.7版)和PeakView(2.1版)软件处理LC-MS采集的数据。
2 结果与讨论
2.1 衍生原理
DMA能够酰胺化羧基,可与酶切后肽段中的天冬氨酸R基团、谷氨酸R基团以及肽链C端发生反应,示于图1。多肽衍生后,每个位点可导致其分子质量增加27 u。一方面,羧基的酰胺化可编辑成一种氨基酸修饰,从而兼容常用的蛋白质鉴定软件;另一方面,使用d0-DMA和d6-DMA分别对多肽进行轻重标记时,每个衍生位点可产生6 u的分子质量差异,有效避免了轻重标记多肽的同位素峰重叠,为该方法应用于多肽的相对定量分析提供了保障。

图1 二甲胺衍生多肽的天冬氨酸残基、谷氨酸残基以及C-末端示意图Fig.1 Schematic diagrams of the aspartic acid residue, glutamic acid residue and C-terminal of the peptide derivatized by dimethylamine
2.2 衍生化处理的影响
在使用酰胺化羧基的化学标记法时,需要考虑2个问题:1) 衍生反应是否特异性地发生在羧基上;2) 羧基中性化将改变多肽的疏水性,这是否会对磷酸化多肽的检测与富集造成影响。以肽段VPQLEIVPNSAEER为例,其含有4个标记位点(除C端外,还有3个位于谷氨酸残基上),因此衍生前后的肽段分子质量应相差108 u。该肽段衍生前后的准分子离子([M+2H]2+)分别为m/z830.91、884.99,表明其成功地被二甲胺标记,示于图2a和2b。m/z830.91、884.99的MS/MS谱图中,产物离子b5、y1、y2、y3分别相差27、27、54、81 u,证实衍生反应发生在多肽C端以及谷氨酸残基上;高丰度的y6、y7等离子表明,磷酸化修饰没有因衍生反应而遭到破坏,示于图2c、2d。

注:a,c.衍生后;b,d.衍生前图2 二甲胺衍生VPQLEIVPNSAEER肽段前后的一级(a,b)与二级(c,d)质谱图Fig.2 MS (a, b) and MS/MS (c, d) spectra of peptide VPQLEIVPNSAEER before and after derivatized by dimethylamine
类似地,多肽TVDMESTEVFTK共有4个标记位点,其衍生前后的m/z相差54 u。二者的产物离子b3相差27 u,表明在天冬氨酸残基上发生了标记;丰富的y离子证实磷酸基团未在衍生反应时丢失,示于图3c、3d。二甲胺对磷酸化多肽的酰胺化作用具有高特异性,通常仅发生在羧基上,而对磷酸基无显著影响。另外,衍生化作用对多肽的二级碎裂模式影响不大,仅略微增加了产物离子的种类。
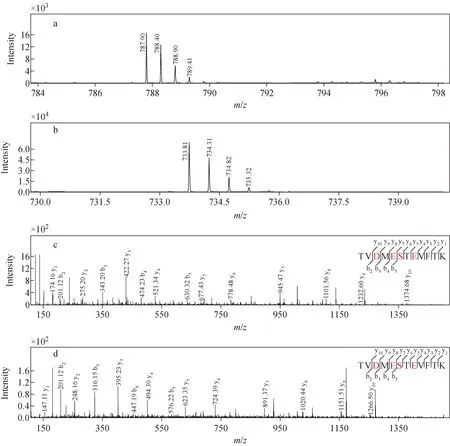
注:a,c.衍生后;b,d.衍生前图3 二甲胺衍生TVDMESTEVFTK肽段前后的一级(a,b)与二级(c,d)质谱图Fig.3 MS (a, b) and MS/MS (c, d) spectra of peptide TVDMESTEVFTK before and after derivatized by dimethylamine
金属氧化物(以TiO2为代表)亲和色谱法是富集生物样品中磷酸化多肽的常用方法[25],本研究以此为基础考察衍生化作用对富集过程的影响。使用商业化的TiO2磁珠分别处理衍生与未衍生casein酶解肽段后,通过microLC-QTOF MS鉴定其中的磷酸化多肽,结果列于表1。在衍生前后的样品中分别检测到7、8条目标肽;有6条肽段在衍生前后均被检测到,其中2条衍生肽段的峰强度明显高于未衍生肽段,多肽NTMEHVSSSEESIISQETYK的信号响应增加了60多倍;3条衍生肽段的信号响应降低了约50%,示于图4。有3条肽段衍生后比未衍生的信号响应增强,另有1条肽段只在衍生后被检测到,这些肽段衍生位点的数量在5~8之间,可能意味着达到一定数量的衍生位点有利于磷酸化多肽的检测,然而,过多的衍生位点会导致不完全衍生。因此,酶切蛋白质时应选择合适的蛋白酶使多肽的可衍生位点处于适当范围,从而提高磷酸化多肽的鉴定效率。

图4 衍生前后各肽段提取离子色谱图的峰面积对比Fig.4 Comparison of peak areas of each peptide before and after derivatization

表1 从衍生和未衍生样品中鉴定的磷酸化多肽Table 1 Phosphopeptides identified from derivatized and native samples

续表1
衍生化作用使多肽的质荷比向低质量端迁移,增加了高电荷离子的相对强度,示于附图1(请登录《质谱学报》网站www.jcmss.com.cn下载),这可能是其提高磷酸化多肽鉴定效率的原因之一。除此之外,还可能与中性化的羧基调节富集过程有关。在酸性环境下,TiO2的钛原子带有正电荷,为路易斯酸,可吸附阴离子;在碱性环境下则为路易斯碱。调节pH值能够控制钛原子结合磷酸根以富集磷酸化多肽,并在碱性环境下将其洗脱[26-27]。但同时,TiO2也会结合羧酸根,产生非特异性吸附。在二甲胺中性化多肽的羧基之后,非磷酸化多肽的负电性消失,由此可能提高TiO2对磷酸化多肽的富集特异性。总之,虽然衍生化作用导致一些磷酸化多肽的信号强度降低了约50%,但仍提高了此类多肽的鉴定效率。
此外,多肽衍生后比衍生前的半峰宽略有增加,这可能是由于多肽衍生后的疏水性更强,在反相色谱柱中的洗脱时间延长。综上,基于酰胺化的化学标记法并不干扰磷酸化多肽的鉴定,且对羧基数量较多的多肽有更好的检测效果,展现了较高的应用价值。
2.3 稳定同位素标记
本实验分别用d0-DMA与d6-DMA标记casein酶解肽段,将轻重标记的样品按照物质的量比1∶1混合,使用TiO2磁珠富集后进行LC-MS检测。混合样品中肽段TVDMESTEVFTK的质谱图示于图5。因该多肽含有4个标记位点,故轻重标记对应的准分子离子([M+2H]2+)分别为m/z787.90、799.98,分子质量相差24 u。由图3b、3c可知,产物离子b3、b4只包含1个衍生位点,因而其轻重标记应相差6 u,示于图5b、5c。类似地,离子y5、y6的轻重标记相差12 u,y8相差18 u。由此可见,磷酸化多肽的各个衍生位点分别被d0-DMA、d6-DMA成功标记。

注:a.同位素标记肽的一级质谱图;b.d0-DMA标记肽的二级质谱图;c.d6-DMA标记肽的二级质谱图图5 肽段TVDMESTEVFTK的同位素标记Fig.5 Isotopic labeling of peptide VDMESTEVFTK
2.4 相对定量范围和准确度
为评价基于稳定同位素标记的方法用于磷酸化多肽相对定量分析的可行性,本研究分别使用d0-DMA、d6-DMA衍生一系列样品,并以物质的量比5∶1、2∶1、1∶1、1∶2、1∶5混合,每种比例进行3次重复实验。轻重标记肽段VPQLEIVPNSAEER的质谱图示于图6a,各样品的相对峰强度与物质的量比的理论值较吻合。5条多肽的相对定量分析结果示于图6b。以提取离子色谱图的峰面积作为定量依据,除多肽DIGSESTEDQAMEDIK在理论轻重物质的量比5∶1时的误差较大外,其他多肽在各比例下产生的误差均小于20%,表明该方法具有良好的相对定量范围和准确度,可高通量地比较不同生物样品中磷酸化多肽的差异化表达水平。相较于其他化学标记方法,基于羧基酰胺化的稳定同位素标记法具有价格低廉、不干扰磷酸化多肽的检测分析、无同位素峰重叠风险等优势,而且可以使用不同蛋白酶酶切以调节肽段衍生位点的数量。

注:虚线为理论物质的量比图6 不同物质的量比混合样品中肽段VPQLEIVPNSAEER的一级质谱图(a)和系列物质的量比不同肽段的轻重标记(b)Fig.6 Mass spectra of peptide VPQLEIVPNSAEER from mixed samples with a series of mole ratio (a) and peptides with different molar ratios derivatized by light and heavy label (b)
2.5 自缩合反应的影响
对于C-末端是赖氨酸残基的多肽,在衍生过程中可能因自缩合而形成七元环内酰胺,这是造成P2与P5肽在衍生后强度降低的原因之一。可以通过在酶切过程中使用其他蛋白酶,如Glu-C等,以避免多肽的C-末端包含赖氨酸残基。
3 结论
本文将基于羧基胺化的标记方法应用于磷酸化多肽的研究中。通过二甲胺与氘代二甲胺衍生天冬氨酸残基、谷氨酸残基和肽链C-端的羧基,实现了对磷酸化多肽的同时定性与相对定量分析。该方法不仅具有较好的可靠性与重复性,而且在一定程度上增强了磷酸化多肽的鉴定效率。基于羧基胺化的标记方法有望应用于磷酸化蛋白的相对定量分析,在发现生物标志物方面显现了较大的应用潜力。

