细胞外囊泡通过促进M1 型巨噬细胞活化加重NASH 进展
万志平 杨小安 邓洪
目前,非酒精性脂肪性肝病(NAFLD)是世界上慢性肝病的最常见原因,影响着全球近25%的人口。NAFLD 是指排除酒精和其他明确的肝损害所致的、以弥漫性肝细胞大泡性脂肪变性为主要特征的临床病理综合征。其疾病谱包括单纯性肝脏脂肪变性(NAFL)、非酒精性脂肪性肝炎(NASH)、肝硬化以及肝细胞癌。NASH 的病理表现有肝细胞脂肪变性、气球样变,巨噬细胞活化浸润等。肝脏中的巨噬细胞群由肝巨噬细胞和单核细胞衍生的浸润性巨噬细胞组成,它们根据接收到的信号分化为M1 型或M2 型巨噬细胞,表达相应的分子标志物,以调节肝脏炎症反应。肝细胞脂肪变性是NAFLD 的早期事件也是NASH 发生及进展的前提条件,而巨噬细胞的活化与NASH 的发生和发展密切相关。目前巨噬细胞活化的机制仍未完全阐明。近年细胞外囊泡(EV)引起了研究人员的广泛关注。EV 是一种微小的膜囊泡,具有脂质双层膜结构,直径为30~150 nm。绝大多数细胞都能分泌EV,而且来自不同细胞类型的EV 可以将特征性蛋白质、脂质和核酸转运到受体细胞,从而发挥不同的生物学效应。细胞间的通信除旁分泌途径外,还可以由EV 介导,因此不能忽视EV 在NASH 发生、发展中的作用。本文探讨由脂肪变性肝细胞分泌的EV对巨噬细胞活化的影响,为深入理解EV 在NASH发生、发展中的作用提供理论基础。
材料与方法
一、NASH 动物模型的构建
10 只6~7 周龄(体质量180~200 g)的雄性Sprague-Dawley(SD)大鼠购自广州中医药大学,饲养于温度可控的无病原体环境中,光照/黑暗循环12 h,能自由获取食物和水。经过1 周的适应性喂养后,SD 大鼠按体质量匹配分为常规饮食组(Control 组,n = 5)和高脂肪高胆固醇(HFHCD)饮食组(HFHCD 组,n = 5),分别予常规饲料和HFHCD 饲料喂养。24 周后Control 组和HFHCD组大鼠禁食过夜,施以安乐死后收集它们的肝脏,并储存在-80 ℃冰箱。所有的动物实验均经过中山大学实验动物伦理委员会的批准(批件号:IACUC-AEWC-F2008032),并符合《动物研究:体内实验报告(ARRIVE)指南》以及美国国立卫生研究院的实验动物护理和使用指南。
二、细胞模型的构建
人肝癌细胞系(HepG2 细胞)培养在含有10%胎牛血清的DMEM 培养基中。当HepG2 细胞生长密度达到80%时,将细胞铺至6 孔板,分别添加不同浓度的棕榈酸(PA)。按PA 含量分为6 组,即0 mmol/L 组、0.1 mmol/L 组、0.2 mmol/L组、0.3 mmol/L 组、0.4 mmol/L 组和0.5 mmol/L 组。24 h 后用油红O 染色剂(Servicebio)染色观察细胞内脂滴沉积的情况。对于细胞活力检测,则将细胞铺至96 孔板,24 h 后用CCK-8 检测试剂盒(TargetMol)检测6 组细胞的活力。
人单核巨噬细胞(THP-1 细胞)培养在含有10%胎牛血清的RPMI-1640 培养基中,在THP-1细胞生长密度达到80%时,将原培养基更换为含有100 ng/mL 的佛波酯中,24 h 后THP-1 将会贴壁成为M0 型巨噬细胞。
三、大鼠肝组织病理和免疫荧光染色
HFHCD 组和Control 组大鼠肝组织经石蜡包埋后制作3~5 μm 厚的石蜡切片,然后将石蜡切片脱水并用HE(Servicebio)或 Masson(Servicebio)染色剂染色。油红O 染色为从-80℃冰箱取出肝组织制备冰冻切片,随后用油红O 染色剂(Servicebio)染色并用苏木素复染。免疫荧光染色为冰冻切片在进行封闭后,与抗CD68(1∶50,Proteintech)和CD86(1∶50,Santa Cruz)的抗体在4℃下孵育过夜,然后与荧光标记的二抗(1∶500,Invitrogen)在室温下孵育60 min。最后,切片用4′, 6-二脒基-2-苯基吲哚(DAPI)染色剂核染,再滴入抗猝灭剂进行封片后镜检拍照。
四、EV 分离与鉴定
根据既往文献[12-13]报道的方法,从HepG2细胞培养液中分离EV :将培养液以300×g 离心10 min 和2000×g 离心20 min 以去除细胞和细胞碎片,然后再以10 000×g 离心30 min 去除大囊泡,最后将培养液以100 000×g 超速离心70 min后沉淀EV,并在磷酸盐缓冲液(PBS)中洗涤纯化EV。通过透射电子显微镜(JEM-1200EX)和纳米粒子跟踪分析(NanoSight NS300)鉴定分离的EV。将经PA 干预Hep2 细胞培养液中分离的EV设为PA组,未经PA 干预Hep2 细胞培养液中分离的EV 设为Con组。
五、蛋白质提取和蛋白免疫印迹法检测
使用含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA 缓冲液(Thermo Fisher Scientific)从细胞及分离的EV 中提取总蛋白(以细胞裂解液为对照),然后对样品进行凝胶电泳后,转移至聚偏二氟乙烯膜(PVDF)膜上,分别在抗CD63(1∶1000,Immunoway)、CD81 (1∶1000,Immunoway) 和TSG101(1∶1000,Immunoway)的抗体中4 ℃孵育过夜。然后加入辣根过氧化物酶(HRP)偶联的二抗(1∶10 000,Abcam)常温孵育60 min 后,使用化学发光检测系统观察蛋白质条带。
六、EV 摄取实验
用红色荧光染料PKH26 标记脂肪变性肝细胞分泌的EV 后,将其添加至M0 型巨噬细胞的培养基,6 h 后弃上清,PBS 洗涤之后用DAPI 染核,然后在倒置荧光显微镜下观察EV 被M0 型巨噬细胞摄取的情况。
七、EV 干预实验
用BCA 试剂盒检测提取的EV 浓度,然后将EV 添加至M0 型巨噬细胞培养基,使其工作浓度为50 μg/mL。并在干预48 h 后收集细胞,用定量逆转录PCR(RT-qPCR)和流式细胞术检测M1 型巨噬细胞标志物的表达。
八、细胞共培养实验
将脂肪变性肝细胞(PA 干预后的HepG2 细胞)与M0 型巨噬细胞在Transwell 小室中共培养,同时加或不加EV 抑制剂GW4869(PA+GW4869组或PA 组),并设未经PA 干预的对照组(Con 组及Con+GW4869 组)。在48 h 后收集巨噬细胞,检测相关指标的表达。
九、RNA 提取和RT-qPCR 检测
使用TRIzol RNA 抽提试剂(Invitrogen)用于提取细胞RNA。应用PrimeScriptRT Master Mix 逆转录试剂盒(TaKaRa)将RNA 逆转录为模板DNA 后,再使用TB Green Premix Ex Taq Ⅱ试剂盒(TaKaRa) 进行RT-qPCR 反应, 反应体系的配制以及反应流程均参照试剂盒说明书。采用2法分析计算目的基因的相对表达水平。所用基因的引物序列如下:IL-1β 正向5′-ATGATGGCTTATTACAGTGGCAA-3′、反向5′-GT CGGAGATTCGTAGCTGGA-3′,产物长度131 bp;IL-18正向5′-TCTTCATTGACCAAGGAAATCGG-3′、反向5′-TCCGGGGTGCATTATCTCTAC-3′,产物长度75 bp;TNF-α 正向5′-AGCCCATGTTGTAGCAAACC-3′、反向5′-TGAGGTACAGGCCCTCTGAT-3′,产物长度134 bp;β-actin 正向5′-TGTGGATCGGTGGCTCCA TCCT-3′、反向5′-AAACGCAGCTCAGTAACAGTCC GC-3′,产物长度137 bp。
十、流式细胞术检测
巨噬细胞在室温下在黑暗中用 PE 偶联的抗CD86(eBiosciences)染色30 min。 随后用含有2%胎牛血清的PBS 洗涤并重悬细胞,最后通过流式细胞仪分析CD86细胞的比例。原始数据通过CytExpert 软件进行分析。
十一、统计学处理

结 果
一、NASH 动物模型中M1 型巨噬细胞标志物表达升高
用HFHCD 饲料喂养SD 大鼠24 周后,大鼠肝组织出现了明显的脂肪堆积、肝细胞气球样变,并可见部分纤维化,表明NASH 动物模型构建成功,见图1A~C。大鼠肝组织免疫荧光染色可见HFHCD 组CD68CD86细胞数较Control 组增多(t = 2.990,P = 0.017),表明NASH 肝脏内M1 型巨噬细胞发生活化,见图1D、E。
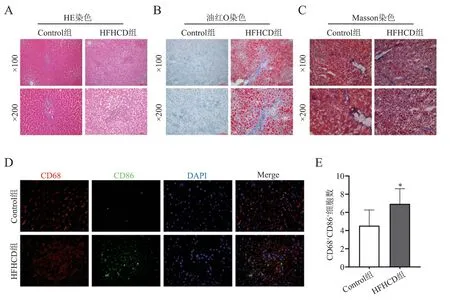
图1 NASH 动物模型中M1 型巨噬细胞标志物的表达
二、脂肪变性肝细胞通过分泌EV 促进M1 型巨噬细胞活化
分别用0~0.5 mmol/L 的PA 干预HepG2 细胞24 h 后进行油红O 染色,结果显示0.3 mmol/L 以上的PA 可使HepG2 细胞发生明显脂肪变性,即成功构建了脂肪变性肝细胞模型,见图2A。由于高浓度的PA 干预会导致细胞活力下降,通过分别测定0~0.5 mmol/L PA 干预后的HepG2 细胞活力(结果依次为100.0%、95.8%、93.4%、90.6%、86.8%和81.7%),表明0.3 mmol/L 最为合适(不低于90%),见图2B。将脂肪变性肝细胞与M0 型巨噬细胞共培养,同时加或不加GW4869,RTqPCR 结果可见PA 组M1 型巨噬细胞标志物IL-1β(q = 10.360,P < 0.001)、IL-18(q = 6.441,P =0.008)较Con 组升高,而PA+GW4869 组的M1 型巨噬细胞标志物与Con+GW4869 组间比较差异均无统计学意义(P 均> 0.05),见图2C。通过流式细胞术可见PA 组CD86细胞比例较Con 组升高(q= 4.428,P = 0.038),而PA+GW4869 组CD86细胞比例与Con+GW4869 组比较差异无统计学意义(P > 0.05),表明脂肪变性肝细胞能通过分泌EV促进M1 型巨噬细胞活化,而EV 抑制剂可阻断这种促进作用,见图2D、E。
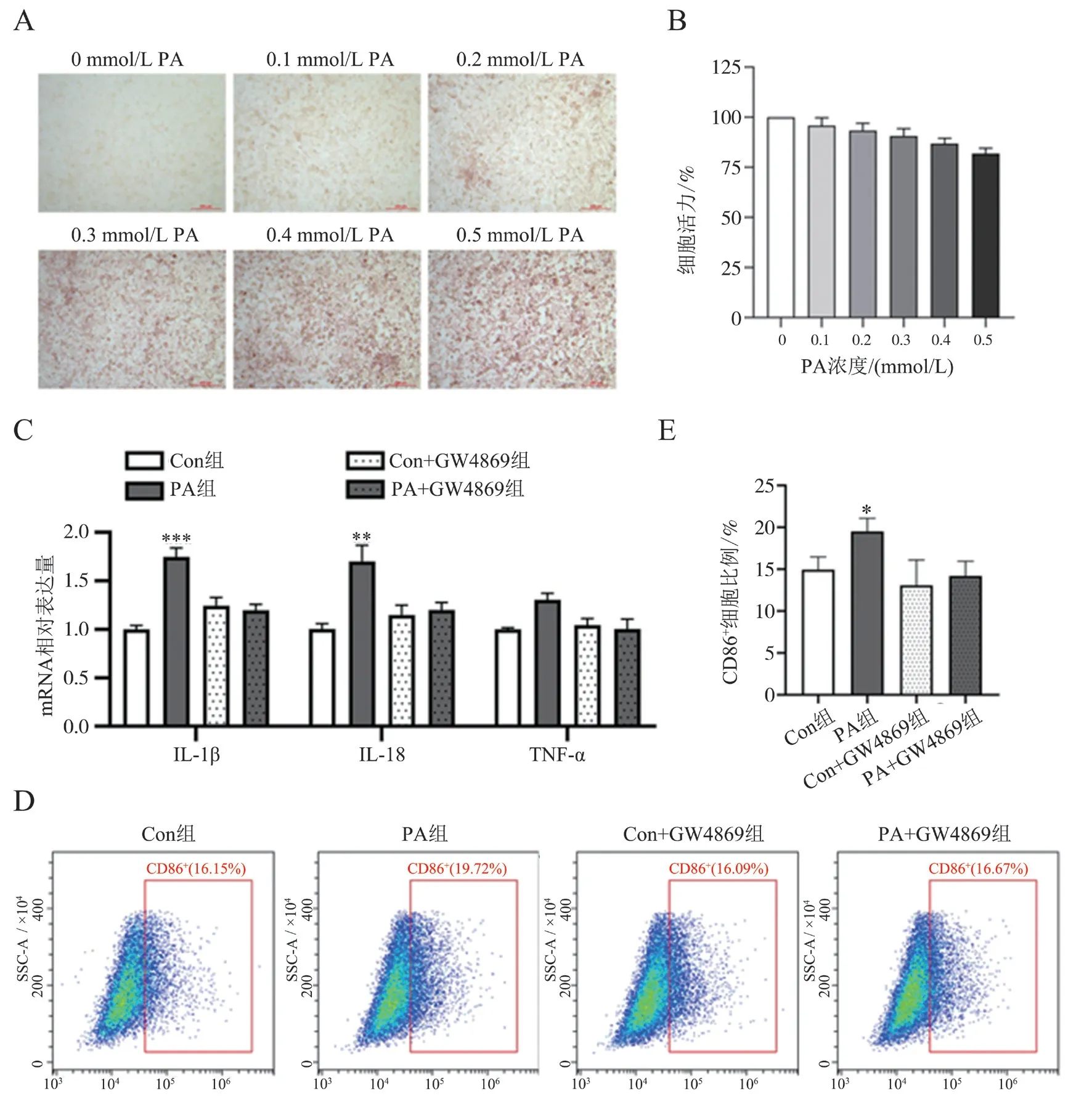
图2 脂肪变性肝细胞分泌的EV 对M1 型巨噬细胞活化的影响
三、脂肪变性肝细胞分泌的EV 特征
用0.3 mmol/L PA 干预HepG2 细胞24 h 后,收集细胞上清,提取EV 进行鉴定。电镜观察可见Con组与PA组的EV 均呈典型的茶托杯状囊泡结构,见图3A。粒径分析结果显示2 组的EV 大小主要为30~150 nm,但PA组EV 的直径稍大于Con组(t = 7.631,P = 0.003),且浓度也高于Con组,见图3B、C。另外,蛋白免疫印迹法显示2 组提取物均表达EV 的标志物CD63、CD81 和TSG101,表明脂肪变性肝细胞的上清液存在EV,并且能够被提取,见图3D。

图3 脂肪变性肝细胞分泌的EV 特征
四、脂肪变性肝细胞来源的EV 促进M1 型巨噬细胞活化
用红色荧光染料PKH26 标记EV,并添加至M0 型巨噬细胞培养基后,在荧光显微镜可观察到红色信号出现在M0 型巨噬细胞内,表明M0 型巨噬细胞可成功吸收脂肪变性肝细胞来源的EV,见图4A。进一步RT-qPCR 结果可见PA组M1 型巨噬细胞标志物IL-1β(t = 21.280,P < 0.001)、IL-18(t = 13.830,P < 0.001)、TNF-α(t =20.840,P < 0.001)均高于Con组,见图4B。流式细胞术检测可见PA组CD86细胞比例高于Con组(t = 46.680,P < 0.001),表明脂肪变性肝细胞分泌的EV 能促进M1 型巨噬细胞活化,见图4C、D。

图4 脂肪变性肝细胞来源的EV 对M1 型巨噬细胞活化的影响
讨 论
随着人们生活方式和饮食结构的改变,NAFLD 患病率明显升高,已成为严重威胁人类健康的公共卫生问题。NASH 是NAFLD 启动向严重肝损害进展的关键环节,但目前仍然缺乏有效的药物治疗NASH,如何预防NASH 发生并寻找潜在治疗靶点是临床关注的热点。尽管从NAFL 发展为NASH 的潜在机制尚不明确,但越来越多的研究表明,巨噬细胞的活化是NASH 发生和发展的重要事件。在NAFLD 进展过程中,肝细胞的脂肪变性往往早于巨噬细胞的活化,脂肪变性肝细胞的分泌物质可能会促进巨噬细胞的活化。
近年来,越来越多的研究发现EV 可以作为细胞间的通信媒介,在疾病的发生、发展过程中发挥极其重要的作用。作为细胞间的通信媒介,EV 可以有效保护mRNA、蛋白质、脂质等生物活性物质并将其转移到受体细胞中发挥其生物学功能。已有研究者发现EV 可作为NAFLD 肝脏内多种细胞间交流的重要媒介。例如巨噬细胞可将具有抗纤维化作用的EV 转移到肝实质细胞内,抑制 NAFLD 相关的纤维化。脂毒性肝细胞释放的EV 可以促进肝星状细胞的活化和增殖,从而加速代谢相关性脂肪肝疾病的进展。
本研究在HFHCD 饮食构建的NASH 动物模型中发现,HFHCD 组大鼠肝脏内肝细胞发生脂肪变性,M1 型巨噬细胞的标志物表达上升。进一步构建脂肪变性肝细胞模型并分离鉴定其分泌的EV,然后通过共培养实验模拟肝内环境,证实脂肪变性肝细胞分泌的EV 可以促进M1 型巨噬细胞的活化。而在施以EV 抑制剂之后,这种促进作用则会受到阻断。
综上所述,脂肪变性肝细胞在NASH 进展中的炎症反应,部分是其分泌的EV 导致的。脂肪变性肝细胞分泌的EV 被肝巨噬细胞摄取之后,释放其中的促炎物质,导致M1 型巨噬细胞活化。而活化的M1 型巨噬细胞分泌各种促炎因子,加重NASH 的炎症反应,甚至会刺激静止的肝星状细胞转变为活化的肝星状细胞,从而导致纤维化的发生,推动了NASH 的进展。本研究进一步说明脂肪变性肝细胞分泌的EV 在促进M1 型巨噬细胞活化加重NASH 进展的潜在机制,为预防NASH 发生提供理论基础。

