Toll样受体对T细胞功能及代谢的影响*
白自然 林 倩 余雨迪 叶小康 杨 晨 李 霞 王 冠
(大连医科大学基础医学院免疫教研室,大连 116044)
Toll 样受体(Toll-like receptors,TLRs)属于模式识别受体(pattern recognition receptor,PRR)家族,可识别多种病原体相关分子模式(pathogenassociated molecular patterns,PAMP)和损伤相关分 子 模 式(damage-related molecular patterns,DAMP),是固有免疫与适应性免疫之间的桥梁[1]。TLR 家族成员不仅可以促进病原体的清除,且能参与癌症及自身免疫病等疾病的发生发展[2]。最初认为TLR 主要由抗原提呈细胞(antigen presenting cells,APC),如巨噬细胞、树突状细胞(dendritic cells,DC)等表达,而在这些细胞中TLR 与其配体的相互作用将间接导致适应性免疫细胞尤其是T细胞的激活。以往的研究主要阐述了TLR 在固有免疫细胞中的功能及作用机制,对其在适应性免疫细胞中的功能研究较少,然而近几年的研究发现,不同的T细胞亚群在发育和激活阶段也表达TLR,它们可以共刺激分子的形式直接调控T细胞的功能。
T 细胞在适应性免疫应答中发挥重要的作用,它们通过分泌细胞因子或直接杀伤靶细胞发挥免疫学功能,其发育、分化及功能的异常与多种疾病有关。而越来越多的研究报道,能量代谢驱动机体和细胞的功能,且已证明T细胞代谢的改变与其功能密切相关[3]。而TLR 也被报道可以直接调节不同细胞的代谢,本综述主要探讨TLR信号在T细胞代谢及功能的直接调控作用,此外还探讨了T细胞中TLR信号的活化如何参与疾病的发生发展,为T细胞介导的疾病预防与免疫治疗提供新策略。
1 TLR家族及其信号通路
1.1 TLR结构及分布
Toll最初是在果蝇体内发现的调节果蝇背腹部体轴发育的必需蛋白质,后来人们发现该蛋白质具有受体功能,能识别入侵的病原体,介导果蝇天然免疫反应。1997年,Medzhitov等[4]首次发现与果蝇同源的人Toll 蛋白,其能够激活核因子κB(nuclear factor κB,NF-κB 信号,称之为Toll 样受体,目前在人类和小鼠中已经鉴定出13 种TLR,为TLR1~TLR13。TLR家族是一类典型的PRR,均为Ⅰ型跨膜蛋白,由富含亮氨酸重复序列的胞外区、包含单个α 螺旋的跨膜区以及带有Toll 的胞质区Toll-白介素-1 受体结构域(Toll/ⅠL-1R resistance,TⅠR)组成[5]。TLR 广泛分布在包括DC、巨噬细胞、单核细胞、T细胞、中性粒细胞、肥大细胞等多种免疫细胞以及一些内皮细胞和成纤维细胞中[6],可分布于细胞表面和细胞内,其中TLR1、TLR2、TLR4、TLR5、TLR6、TLR10、TLR11 和TLR12 在细胞表面大量表达,主要识别微生物膜分子,例如脂质、脂蛋白、脂肽等。而TLR3、TLR7、TLR8、TLR9、TLR13 位于胞质区室,如内质网、核内体、溶酶体中,可以识别微生物核酸[7]。这些TLR 家族分子识别相应配体,激活下游信号转导通路,触发免疫反应,诱导细胞因子、趋化因子产生,在固有免疫及适应性免疫应答中发挥重要的作用。
1.2 TLR信号通路
当PAMP 和DAMP 与相应的TLR 结合,可通过髓样分化因子88(myeloid differentiation factor 88,MyD88)依赖或非依赖途径进行信号转导。除TLR3外,TLR家族其他成员诱导的炎症反应都依赖于MyD88。MyD88 激活ⅠL-1 受体相关激酶(ⅠL-1 receptor-associated kinase,ⅠRAK)和肿瘤坏死因子受体相关因子6 (tumor necrosis factor receptor-associated factor 6, TRAF6), 形 成MyD88-ⅠRAKs-TRAF6 复合物,接着激活ⅠκB 激酶(ⅠκB kinase,ⅠKK)复合体并导致丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和NF-κB的激活,从而诱导炎症细胞因子和趋化因子的产生[8]。而MyD88 非依赖途径通过激活Toll 样受体相关干扰素接头分子(Toll/ⅠL-1R domaincontaining adaptor-inducing ⅠFN-beta, TRⅠF) 和TRⅠF 相 关 接 头 分 子(TRⅠF associated connector molecules,TRAM),导致ⅠKK/TANK 结合激酶1(TANK-binding kinase 1,TBK1)的募集,再激活NF-κB及MAPK信号通路,诱导细胞因子产生[6]。
2 TLR对T细胞功能及代谢的影响
2.1 T细胞中TLR的表达
目前有关TLR 的研究大多数都集中于其在APC 中的作用:TLR 激活可增强APC 的抗原提呈作用,上调共刺激分子表达,通过先天免疫系统间接调控T细胞应答[9]。但越来越多的研究证明,T细胞本身也表达TLR。研究发现,小鼠初始CD4+T 细胞表达TLR3、TLR4、TLR5 和TLR9 的mRNA[10]。Fukata 等[11]通过流式细胞术在小鼠CD4+CD45RbhighT 细 胞 上 检 测 到TLR2、TLR3、TLR4 和TLR9 蛋 白;Cottalorda 等[12]在 小 鼠CD8+T 细 胞 上 也 检 测 到TLR1、TLR2、TLR6、TLR7 和TLR9 的表达。此外,在高度纯化的人CD4+T 细胞和CD8+T 细胞中也检测到TLR1、TLR2、TLR3、TLR4、TLR5、TLR7、TLR9 和TLR10 的基因及蛋白质表达[13-14],并且发现CD4+T 细胞比CD8+T 细胞表达更高水平的TLR1、TLR4 和TLR9, 而CD8+T 表 达 更 高 水 平 的TLR3[14]。这些现象提示,T细胞上的TLR信号可能直接调控T细胞的免疫功能。
有趣的是,T细胞上TLR的表达也受到T细胞抗原受体(T cell antigen receptor,TCR)激活的调节。研究报道,小鼠的naïve T细胞表达TLR2,但只有在抗CD3 抗体激活后才可以检测到细胞表面的TLR2蛋白[15]。也有研究发现,小鼠细胞毒性T淋 巴 细 胞(cytotoxic T lymphocytes,CTL) 的TLR2 基因表达水平要明显高于静息状态下的CD8+T 细 胞[16],活 化 后 的 小 鼠 初 始CD4+T 细 胞TLR3 和TLR9 基 因 表 达 水 平 也 明 显 上 调[10]。Komai-Koma 等[13]的研究中也发现,人CD4+T 细胞也只有在激活状态下,才可在细胞表面检测到TLR2和TLR4表达。这些研究结果提示,TLR在T细胞中的表达可能与其活化状态有关。
在某些炎症及自身免疫病中,T 细胞异常活化,而在这类患者的T细胞也发现TLR表达明显上调(表1,2)。与健康对照组相比,肾小球肾炎患者T细胞上TLR2表达上调[17]。慢性丙型肝炎患者调节性T细胞(regulatory T cells,Treg)中表达更高水平的TLR2[18]。毒性弥漫性甲状腺肿患者外周血CD4+TLR2/4+、CD8+TLR2/4+T细胞的比例明显高于正常对照组,并发现CD8+T 细胞上TLR2、TLR4 表达明显上调[19]。多发性硬化症(multiple sclerosis,MS) 患 者 的CD4+T 和CD8+T 细 胞 上TLR2、TLR4和TLR9表达更高[20]。急慢性肝衰竭患者CD4+T 和CD8+T 细胞中TLR4 表达明显增加,并与疾病相关实验室指标血清总胆红素、直接胆红素等呈正相关[21]。这些现象提示,T 细胞上TLR的异常表达可能通过调控T细胞活化从而参与某些炎症及自身免疫病等疾病的发生发展。
2.2 TLR激活对T细胞功能的影响
TLR 在不同T 细胞上的差异表达及TLR 信号的激活会影响T细胞的功能(表1,图1)。大量的研究证实,T细胞中TLR信号可作为共刺激分子直接参与T细胞活化。Salerno等[22]研究表明,与单独的抗CD3抗体刺激相比,TLR2配体的刺激有效提高了分泌ⅠFN-γ 的T 细胞百分比,并且发现TLR2 配体刺激后,细胞因子生成水平与抗CD28抗体刺激可达到相似水平,提示TLR2可以起到与CD28 信号相同的共刺激作用。在另一项研究中发现,TLR2的激活还可以增强小鼠CD8+T细胞的增殖与存活,上调CD25表达,并增强CD8+T细胞的效应功能[12]。TLR2 信号也可调节记忆CD8+T 细胞的增殖以及ⅠFN-γ 产生[23]。TLR2 配体刺激的CD4+T 细胞,显著增强了ⅠFN-γ、ⅠL-2 和肿瘤坏死因 子α (tumor necrosis factor α,TNF-α) 的 产生[13]。此外,TLR2 激活还可增强Th17(T helper cells 17)细胞分化,促进Th17细胞增殖以及ⅠL-17产 生[24]。人CD4+T 细 胞 中TLR3 信 号 可 诱 导ⅠL-17A和ⅠL-21产生[23]。TLR3和TLR9配体刺激均可增强CD4+T 细胞的存活[10]。在没有APC 的情况下,由脂多糖(lipopolysaccharide,LPS)激活的CD4+CD25+Treg 细胞中TLR4 信号可以直接诱导Treg 细胞激活,上调细胞表面活化标记物CD69、CD44、CD38表达[25]。TLR4激活也可增强CD4+T细胞的增殖和体外存活率[26],还能诱导人类T 细胞黏附于纤连蛋白[27]。TLR5、TLR7和TLR8的配体刺激人CD4+T 细胞,可上调ⅠFN-γ 水平[28]。在抗CD3抗体存在下,TLR7信号的激活能促进小鼠脾脏高度纯化的CD8+T 细胞中CD25、CD44、CD69 以及转录因子T-bet 和Eomes 的表达[29]。另外也有研究报道,一些TLR 信号的激活也可以抑制不同T 细胞的应答,TLR7 配体显著抑制了人类及小鼠Th17细胞的分化,并降低了产生ⅠL-17的细胞数量和 ⅠL-17 mRNA 表达水平[24]。TLR8 信号激活可以直接逆转Treg 细胞的抑制功能[30]。以上研究表明,T细胞中TLR信号可以直接调节T细胞活化、分化及功能,这可能会通过调控T细胞介导的免疫应答,影响多种疾病的发生与发展(表2)。
研究发现,在实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)模型中,CD4+T 细胞中TLR2 的缺失可显著改善EAE 发 病[31]。在 慢 性 丙 型 肝 炎 中,TLR2 配 体(Pam3Csk4)的刺激增强Treg细胞的抑制功能,但降低Treg与Th17细胞的比例[18]。然而,在另一项研究中发现,Pam3Csk4 的刺激可下调Foxp3+Treg细胞的抑制功能,同时增强肿瘤特异性细胞毒性T淋巴细胞的细胞毒性来恢复重症联合免疫缺陷(severe combined immunodeficiency,SCⅠD)小鼠的抗肿瘤免疫反应,使SCⅠD 小鼠的肿瘤得以缓解[32]。TLR2、TLR4 和TLR9 配体可直接诱导MS患 者CD4+T 和CD8+T 细 胞 产 生ⅠL-1β、ⅠL-6 和ⅠL-17等细胞因子,并且Pam3Csk4激活的MS患者CD4+T细胞产生的ⅠL-17和粒细胞巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)水平与疾病活动直接相关[20]。TLR2 和TLR4 配体可促进视神经脊髓炎谱系障碍(neuromyelitis optic spectrum disorder,NMOSD)患者CD4+T 细胞的增殖以及炎性细胞因子ⅠL-6、ⅠL-17、ⅠL-21的产生,并诱导患者Th17,滤泡辅助性T细胞(follicular helper T cells,Tfh)与Treg细胞 亚 群 的 失 衡[33]。TLR3 配 体Poly (Ⅰ∶C) 和TLR9 配体CpG 可以激活Th1 细胞的免疫应答,并能调控抗肿瘤活性[24]。综上所述,TLR 信号直接影响了T细胞的激活、分化及发挥效应功能,研究不同T细胞亚群中TLR信号通路的功能与调控作用将能更好地了解T细胞介导的疾病发病机制,并可为临床治疗提供新的策略与靶点。
2.3 TLR激活对T细胞代谢的影响
越来越多的证据表明,能量代谢指导免疫细胞的分化发育及功能,T细胞代谢与功能之间存在紧密的联系。静息状态下的T 细胞通常依赖葡萄糖、脂质和氨基酸的氧化产生ATP,以维持其正常的生理活动[34]。活化后,T 细胞迅速增殖并发挥效应功能,为满足其快速的能量需求,其糖酵解与谷氨酰胺氧化增加,中间代谢产物也可为细胞快速增殖提供所需的生物合成原料[34]。研究发现,T 细胞代谢的改变与许多疾病有关,类风湿关节炎(rheumatoid arthritis,RA)患者CD4+T 细胞缺乏6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶3 (6-phosphofructo-2-kinase/fructose-2, 6-bisphosphatase 3,PFKFB3),使葡萄糖代谢趋向戊糖磷酸途径,这种代谢的转变与关节炎的严重程度有关[35]。Ho等[36]研究表明,葡萄糖缺乏会抑制肿瘤中CD4+T细胞的抗肿瘤效应。这些结果表明,T细胞代谢可能通过影响其效应功能,参与疾病的发生发展。
近年来有很多研究探讨了TLR 信号对巨噬细胞和DC代谢的影响,但表达在T细胞上的TLR是否能够调节以及如何调节不同T细胞亚群的代谢仍在研究中。本文总结了近年来有关TLR 信号直接调控T 细胞代谢的研究(表1)。研究发现,用TLR1/TLR2 配体刺激Treg 细胞,可以促进其增殖并增强PⅠ3K-AKT-mTORC1信号转导,通过上调葡萄糖转运蛋白1(glucose transporter 1,Glut1)和己糖激酶2(hexokinase 2,HK2)的表达,增强其糖酵解[37]。也有研究报道,激活TLR2信号可上调CD8+T 细胞中生物能量代谢相关基因的表达,增强糖酵解和谷氨酰胺代谢,从而直接激活CD8+T细 胞[38]。TLR2 和TLR7 信 号 的 激 活 会 促 进 鼠CD8+T 细 胞 产 生ⅠFN-γ,可 以 激 活PⅠ3K-AKTmTOR 信号,这种作用依赖线粒体呼吸提供能量,而不是糖酵解[39]。抗CD3 抗体刺激CD8+T 细胞,可以使mTOR磷酸化增强,同时TLR7信号的激活能够进一步上调CD8+T细胞中mTOR和Akt的水平以及糖酵解相关基因的表达,并可增加乳酸的生成[29]。最近的研究表明,人Treg 中TLR8 信号的激活通过下调Glut 以及调控糖酵解的关键酶表达,抑制Treg 细胞摄取葡萄糖和糖酵解,从而逆转Treg 细胞的抑制功能[40]。此外,在黑色素瘤过继性T 细胞治疗模型中,TLR8 信号介导的Treg 细胞糖代谢以及功能的改变可以增强体内的抗肿瘤免疫[40]。
T细胞的代谢可直接影响其活化及发挥功能,关于T 细胞代谢的分子调控机制仍需进一步探索,研究人员发现TLR 信号可以直接调控T 细胞代谢[29,37-40],但目前都集中于其对T细胞糖代谢的调节。进一步研究TLR信号对不同T细胞糖、脂、氨基酸代谢调控及具体分子机制将为肿瘤、自身免疫病等疾病的预防与治疗提供有效的分子靶标。
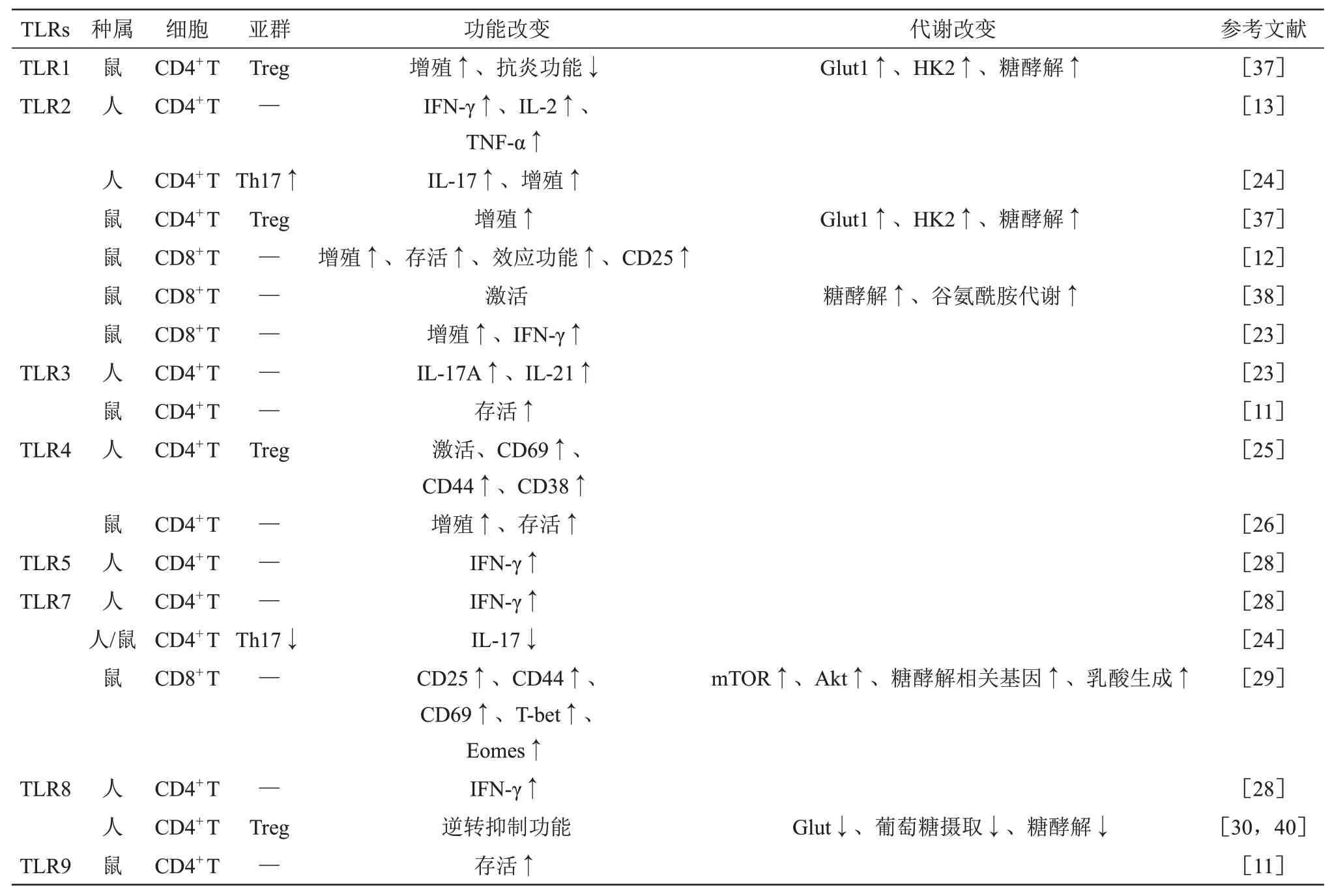
Table 1 Effects of activation of TLRs on T cell function and metabolism表1 TLRs激活对T细胞功能及代谢的影响
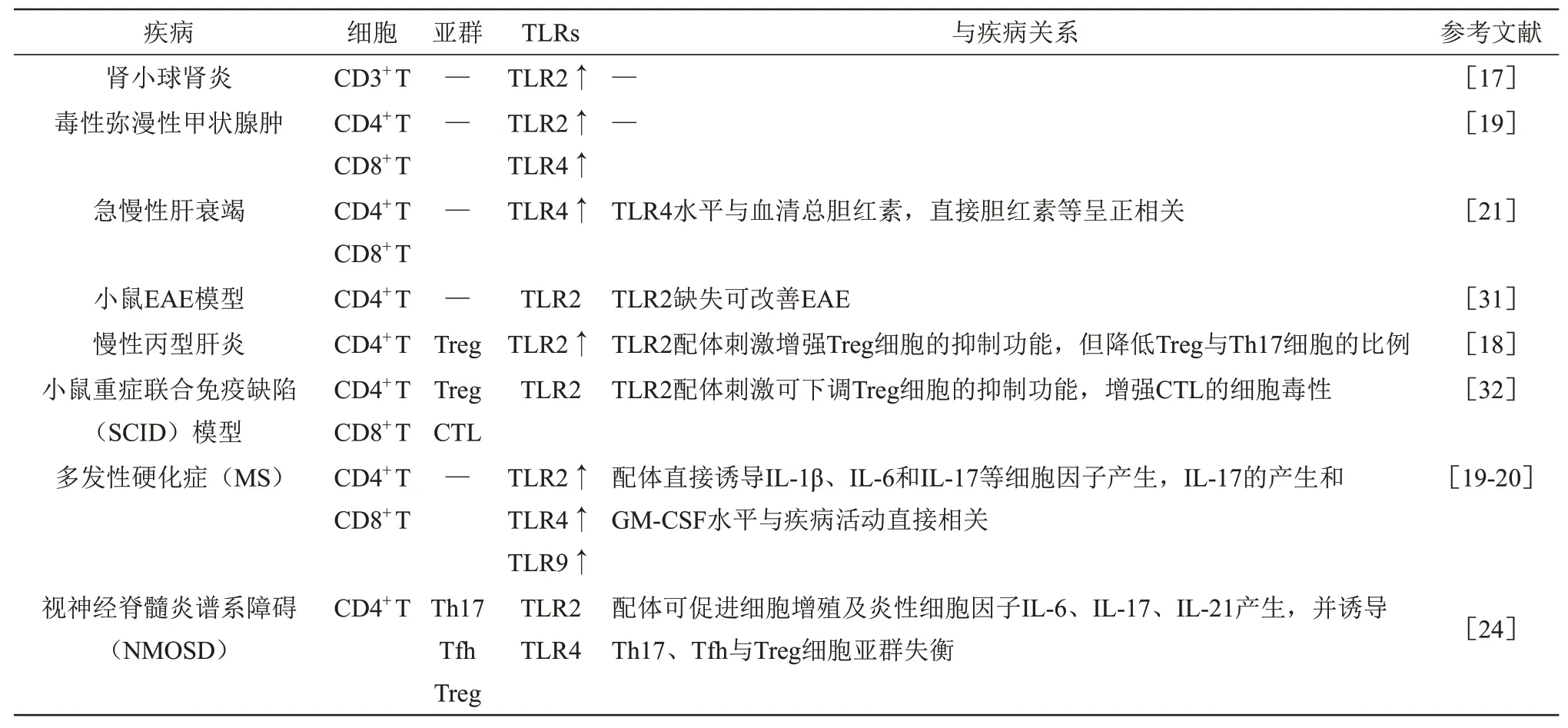
Table 2 Relationship between differential expression of TLRs on T cells and disease表2 T细胞上TLRs的差异表达与疾病的关系

Fig.1 The effect of TLR signal on T cell function and metabolism图1 TLR信号对T细胞功能及代谢的影响
3 总结与展望
TLR在炎症、自身免疫病以及肿瘤相关免疫细胞中广泛表达,并参与疾病的发生发展。长期以来,对TLR 的研究都集中于其对固有免疫细胞的多种作用,包括上调共刺激分子表达及促进炎性细胞因子的产生,从而间接调控T细胞应答。越来越多的证据表明,TLR 配体也可以直接作用于T 细胞,TLR可充当T细胞的共刺激受体,增强细胞因子产生,促进细胞的增殖与存活。另外,TLR还可以通过调控T细胞的代谢从而影响其效应功能,并与很多疾病密切相关。深入了解TLR在T细胞功能及代谢中的调控作用,有助于为癌症及自身免疫病等疾病提供新的治疗策略。