塔克拉玛干沙漠来源链霉菌Streptomyces sp.90次级代谢产物的研究
卢覃培 刘少伟 胡辛欣 游学甫 孙承航,,*
(1 中国医学科学院 北京协和医学院 医药生物技术研究所,微生物化学研究室,北京 100050;2 广西医科大学药学院,广西生物活性分子研究与评价重点实验室,南宁 530021;3 中国医学科学院 北京协和医学院 医药生物技术研究所,抗感染药物研究北京市重点实验室,北京 100050)
自青霉素和链霉素被用于临床以来,抗生素对感染性疾病的治疗和人类寿命的延长起到至关重要的作用。而放线菌是抗生素重要来源,今天使用的大多数抗生素仍是由放线菌产生,其中又有约75%是由链霉菌产生[1-2]。这些抗生素涵盖了目前临床上使用的几乎所有重要药物类别,如四环素类、大环内酯类、氨基糖苷类、糖肽类等[2]。几十年来,由于对普通生境较易分离到的放线菌资源进行反复筛选与挖掘,导致目前从普通生境中发现新抗生素的几率大大降低,因此,抗生素发现的重点逐渐转向了以往难以到达或很少被探索的特殊生态环境(简称特境)如沙漠、深海、极地等,以期从栖息在这些特境的放线菌中找到具有重要生物活性的新型次级代谢产物。
沙漠具有日照持久、高温干旱、蒸发强烈、紫外线辐射强、寡营养等特征,作为典型的特境,已成为抗生素研发的一个热点,十几年来,成果不断,如从南美洲阿塔卡马沙漠来源链霉菌中分离得到了具有显著抗菌活性的大环内酯类化合物chaxalactins A~C和安莎霉素类化合物chaxamycins A~D;从撒哈拉沙漠土壤链霉菌中分离得到具有羟肟酸结构的化合物2-amino-N-(2-amino-3-phenylpropanoyl)-N-hydroxy-3-phenylpropanamide,该化合物对革兰阳性菌和阴性菌、丝状真菌等均表现出一定的抗菌活性等[3-8]。
塔克拉玛干沙漠位于我国新疆南部塔里木盆地中心,是我国最大的沙漠,同时亦是世界第二大流动沙漠,本课题组对其进行了一系列的放线菌资源勘探、抗菌活性筛选、活性物质分离与鉴定等研究工作,已发现了一系列有药用价值的菌株及其活性化合物[9-18]。为进一步探索塔克拉玛干沙漠来源产生的抗菌活性物质,本文对一株塔克拉玛干沙漠土壤来源链霉菌Streptomycessp.90产生的次级代谢产物进行研究,共分离得到6个化合物,通过波谱学方法对化合物进行了结构解析,分别鉴定为collismycin A(1)、collismycin B(2)、pyrisulfoxin A(3)、SF2738C(4)、SF2738D(5)和SF2738F(6)(图1),并对其中主要活性化合物1的抗菌活性和稳定性进行考察。
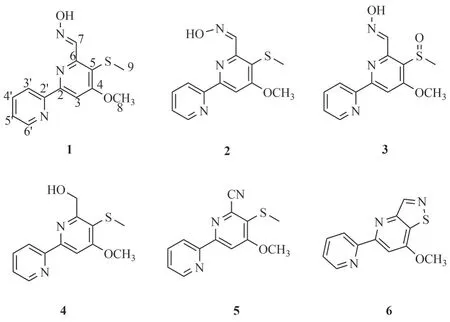
图1 化合物1~6的结构式Fig.1 Chemical structures of compounds 1~6
1 材料与方法
1.1 仪器、材料及试剂
超净工作台(YT-CJ-1ND,北京亚泰科隆仪器有限公司);高压蒸汽灭菌锅(SQ810C,雅马拓科技贸易(上海)有限公司);恒温培养箱(ZDP-2120)及摇床(ZHWY-211C,上海智城分析仪器制造公司);离心机(Centrifuge 1-14、K-14、4-16KS,德国Sigma公司);PCR扩增仪(Veriti 96 well Thermal Cycler,美国Thermofisher);旋转蒸发仪(N-1100,东京理化器械株式会社);电子天平(YP5002,上海越平科学仪器有限公司);电子分析天平(BT 124S,赛多利斯科学仪器(北京)有限公司);十万分之一电子分析天平(AB265-S,瑞士Mettler Toledo);液相(LC-20AT)及液相-质谱联用仪(LCMS-2020,岛津企业管理(中国)有限公司);核磁共振仪[Bruker AV Ⅲ-600 NMR instrument,布鲁克(北京)科技有限公司];快速制备液相色谱[Biotage Isolera One,拜泰齐贸易(上海)有限公司];多点接种器(MIT-P,日本东京佐久间公司)。
培养基原料及琼脂(北京鼎国昌盛生物技术有限公司);合成培养基(美国BD公司);PCR试剂(北京全式金生物技术有限公司);Chelex-100树脂(美国Bio-Rad公司);中压制备柱[Yamazen Ultra Pack Columns(26 mm×300 mm,5 μm),日本山善株式会社];半制备柱[Agilent ZORBAX SB-C18column(9.4 mm×250 mm,5 μm,安捷伦科技(中国)有限公司];分析柱[Agilent ZORBAX SB-C18column(4.6 mm×150 mm,5 μm,安捷伦科技(中国)有限公司]。
色谱纯甲醇和乙腈(迪马科技有限公司);其余分析纯试剂如无水乙醇、乙酸乙酯和甲醇等试剂均为北京市通广精细化工公司。
1.2 菌株来源
链霉菌Streptomycessp.90(Genbank No.MT705175) 分离自塔克拉玛干沙漠阿和公路沿线土壤样品,菌株保存于中国医学科学院医药生物技术研究所微生物化学室。
活性测试的检定菌由抗感染药物研究北京市重点实验室提供,详细信息见表1;所有检定菌均保存于中国医学科学院医药生物技术研究所抗感染药物研究北京市重点实验室。
1.3 培养基
纯化培养基为ISP2 固体培养基(葡萄糖4.0 g,酵母浸粉4.0 g,麦芽浸粉10.0 g,琼脂15.0 g,蒸馏水1000 mL,pH 7.2~7.4);发酵培养基为ISP2液体培养基;活性测试检定菌的培养基为Mueller-Hinton(MH)培养基。
1.4 菌株发酵
冻存的菌株Streptomycessp.90接种于ISP2纯化培养基,28℃下恒温培养7~10 d,用无菌竹签刮取少量新鲜菌体接种于含100 mL ISP2液体培养基的500 mL锥形瓶中,在28℃,180 r/min条件下培养2 d左右,形成种子液,转接于含1 L ISP2液体培养基的5 L锥形瓶中继续发酵5~7 d即可收获,共收集发酵液18 L。
1.5 提取与分离
将发酵完成的发酵液4300 r/min离心20 min后,取上清液用等体积的乙酸乙酯萃取3次,减压浓缩至干,共得到有机萃取物2.3 g。萃取物用中压制备液相色谱分离,甲醇-水梯度洗脱(10:90,30:70,50:50,70:30,90:10,100:0,V/V),经活性检测和LCMS-2020分析后合并,共得到6个馏分(Fr.90a1~Fr.90a6);活性馏分Fr.90a3进行凝胶LH-20色谱柱分离,甲醇洗脱,得到41个馏分,再通过活性和LCMS-2020检测合并得到活性馏分(Fr.90a3a,Fr.90a3e~h),馏分Fr.90a3f、Fr.90a3g、Fr.90a3h通过高压液相制备,65%甲醇等度洗脱制备,累积得到化合物1(3.0 mg)和2(1.3 mg);馏分Fr.90a3e通过制备液相,65%甲醇等度洗脱,制备得到化合物3(1.6 mg)。另外,对馏分Fr.90a4,以相同的分离方法得到化合物4(1.8 mg),5(1.3 mg)和6(1.4 mg)。
1.6 抗菌活性测试
1.6.1 活性跟踪测试
参照文献[16],采用琼脂-纸片扩散法,以碳青霉烯类耐药的鲍曼不动杆菌为检定菌,37℃静置培养12~24 h,观察和测量抑菌圈,开展次级代谢产物活性追踪。
1.6.2 化合物1的MIC测定
参照CLSI指南[19],用琼脂二倍稀释法测定化合物1的抗菌活性。阳性对照药物为左氧氟沙星,化合物1分别溶于DMSO中,随后用冷却至50℃左右的MH培养基梯度稀释,制备成含待测化合物的琼脂平板。化合物1的终浓度为0.125~128 μg/mL。检测菌株在MH肉汤中静置培养24 h,然后稀释到约108CFU/mL,随之再稀释100倍,制备成106CFU/mL的菌悬液,备用。用MIT-P多点接种仪(37个接种针)将待测菌悬液接种至制备好的琼脂平板上,37℃孵育18 h后观察结果,无菌生长的平皿中所含药物的最小浓度即为最低抑菌浓度(MIC)。
1.7 化合物稳定性考察
化合物1用甲醇溶解后,在光照,22℃恒温的环境中,采用LC-MS监测在不同时间段下,考察光照对化合物1稳定性的影响;此外,采用锡纸包住化合物1液,隔绝光照的条件下,置于恒温28℃培养箱中,采用LC-MS监测在不同时间段下,考察温度对化合物1稳定性的影响。分析条件:分析柱,53%甲醇等度洗脱,检测波长:240 nm,流速:1.0 mL/min。
2 结果
2.1 结构鉴定
化合物1:白色无定形粉末,溶于氯仿、二氯甲烷和甲醇;ESI-MSm/z276[M+H]+;1H NMR(600 MHz,CD3OD) δH: 8.02(s,H-3),8.94(s,H-7),4.11(s,H3-8),2.39(s,H3-9),8.54(d,J=7.8 Hz,H-3'),7.92(td,J=7.2,1.8 Hz,H-4'),7.46(dd,J=7.2,4.8 Hz,H-5'),8.65(d,J= 4.8 Hz,H-6');13C NMR(150 MHz,CD3OD) δC: 158.3(C-2),104.9(C-3),168.9(C-4),123.5(C-5),154.1(C-6),148.8(C-7),56.9(C-8),18.3(C-9),156.6(C-2'),123.4(C-3'),138.7(C-4'),125.8(C-5'),150.0(C-6')。经查阅文献,该化合物的波谱数据与文献报道的collismycin A(SF2738A)[20-21]一致,故鉴定化合物1为collismycin A(SF2738A)。
化合物2:白色无定形粉末,溶于氯仿、二氯甲烷和甲醇;ESI-MSm/z276[M+H]+,提示该化合物可能为化合物1异构体;1H NMR(600 MHz,CDCl3)δH: 8.16(s,H-3),8.70(s,H-7),4.17(s,H3-8),2.42(s,H3-9),8.13(d,J=7.8 Hz,H-3'),7.89(td,J=7.2,1.2 Hz,H-4'),7.40(m,H-5'),8.72(d,J=4.2,1.8 Hz,H-6');13C NMR(150 MHz,CDCl3) δC: 156.9(C-2),104.9(C-3),168.2(C-4),121.1(C-5),140.2(C-7),56.7(C-8),18.4(C-9),121.1(C-3'),137.5(C-4'),124.9(C-5'),149.4(C-6'),C-6和C-2',无明显信号。经查阅文献,该化合物的波谱数据与文献报道的collismycin B(SF2738B)[20-21]一致,故鉴定化合物2为collismycin B(SF2738B)。
化合物3:白色无定形粉末,溶于氯仿、二氯甲烷和甲醇;ESI-MSm/z292[M+H]+;1H NMR(600 MHz,CDCl3) δH: 8.11(s,H-3),8.87(br s,H-7),4.14(s,H3-8),3.07(s,H3-9),8.50(br s,H-3'),7.86(t,J=7.8 Hz,H-4'),7.34(t,J=6.0 Hz,H-5'),8.65(br s,H-6');13C NMR(150 MHz,CDCl3) δC: 159.8(C-2),104.5(C-3),165.8(C-4),150.8(C-6),147.6(C-7),56.8(C-8),39.4(C-9),154.4(C-2'),122.2(C-3'),137.4(C-4'),125.1(C-5'),149.2(C-6'),C-5,无明显信号。经查阅文献,该化合物的波谱数据与文献报道的pyrisulfoxin A[22]一致,故鉴定化合物3为pyrisulfoxin A。
化合物4:白色无定形粉末,溶于氯仿、二氯甲烷和甲醇;ESI-MS:m/z263[M+H]+;1H NMR(600 MHz,CDCl3) δH: 7.99(s,H-3),4.95(s,H2-7),4.12(s,H3-8),2.36(s,H3-9),8.42(d,J=7.8 Hz,H-3'),7.84(t,J=7.8 Hz,H-4'),7.34(dd,J=7.8,4.8 Hz,H-5'),8.66(d,J=4.8 Hz,H-6');13C NMR(150 MHz,CDCl3) δC: 160.6(C-2),102.9(C-3),167.4(C-4),117.8(C-5),155.0(C-6),62.7(C-7),56.5(C-8),17.6(C-9),155.5(C-2'),121.3(C-3'),137.2(C-4'),124.4(C-5'),149.3(C-6')。经查阅文献,该化合物的波谱数据与文献报道的SF2738C[21]一致,故鉴定该化合物为SF2738C。
化合物5:白色无定形粉末,溶于氯仿、二氯甲烷和甲醇;ESI-MSm/z258[M+H]+;1H NMR(600 MHz,CDCl3) δH: 8.19(s,H-3),4.14(s,H3-8),2.54(s,H3-9),8.47(d,J=7.8 Hz,H-3'),7.85(td,J=7.8,1.8 Hz,H-4'),7.37(dd,J=7.8,6.0 Hz,H-5'),8.66(d,J=4.8 Hz,H-6');13C NMR(150 MHz,CDCl3) δC:158.6(C-2),105.8(C-3),167.1(C-4),127.4(C-5),137.4(C-6),116.6(C-7),56.8(C-8),18.1(C-9),153.9(C-2'),121.9(C-3'),137.4(C-4'),125.0(C-5'),149.2(C-6')。经查阅文献,该化合物的波谱数据与文献报道的SF2738D[21]一致,故鉴定该化合物为SF2738D。
化合物6:白色无定形粉末,溶于氯仿、二氯甲烷和甲醇;ESI-MSm/z244[M+H]+;1H NMR(600 MHz,CDCl3) δH: 8.10(s,H-3),9.13(s,H-7),4.14(s,H3-8),8.56(d,J=7.8 Hz,H-3'),7.88(t,J=7.8 Hz,H-4'),7.38(br s,H-5'),8.72(br s,H-6');13C NMR(150 MHz,CDCl3) δC: 159.0(C-2),99.7(C-3),160.4(C-4),136.4(C-5),154.1(C-6),156.2(C-7),56.2(C-8),155.5(C-2'),121.6(C-3'),137.1(C-4'),124.3(C-5'),149.0(C-6')。经查阅文献,发现该化合物的波谱数据与文献报道的SF2738F[21]一致,故鉴定该化合物为SF2738F。
2.2 化合物生物活性测试
采用纸片琼脂扩散法测试,发现化合物1具有较为明显的抑菌圈,因此,采用琼脂稀释法测定化合物1对37株常见的革兰阳性菌和革兰阴性菌的抗菌活性。结果如表1所示,化合物1 对甲氧林敏感和耐药的表皮葡萄球菌均表现出较明显的抑制作用,MIC值在8~16 μg/mL之间;对某些甲氧西林耐药的金黄色葡萄球菌活性表现出一定抑制作用,MIC在32~64 μg/mL;此外,化合物1对革兰阴性菌表现出一定的抑制作用,对碳青霉烯类耐药的鲍曼不动杆菌的MIC值为64 μg/mL,对铜绿假单胞菌的MIC值为64~128 μg/mL。
2.3 化合物稳定性考察
在分离过程中发现化合物1较不稳定,因此,研究者对化合物1的稳定性进行考察。首先考察光照条件下,不同时间,化合物1的稳定性。如图2所示,在光照条件下,1 h后,化合物1会部分转变为化合物2,说明化合物1对光照不稳定。其次,研究者还考察了温度对化合物1稳定性的影响。结果如图3所示,在隔绝光照、恒温28℃环境下,化合物1溶液放置72 h,没有发生变化,说明化合物1隔绝光照在28℃下稳定性良好。
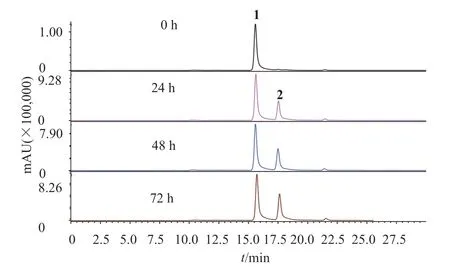
图2 光照对化合物1稳定性的影响Fig.2 The effect of light on the stability of compound 1
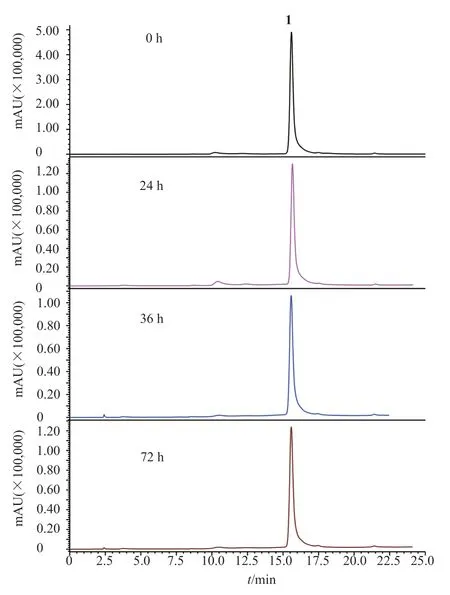
图3 温度(28℃)对化合物1稳定性的影响Fig.3 The effect of temperature(28℃) on the stability of compound 1
3 讨论与结论
本文对塔克拉玛干沙漠来源链霉菌Streptomycessp.90的次级代谢产物进行了研究,共分离得到6个化合物,化合物1~6均属于联吡啶类化合物,除了化合物3是1999年报道外,其余化合物均在1993年报道过[21],其中1具有弱抗细菌和抗真菌活性,而2显示出比1更弱的抗菌活性,4~6没有抗菌活性,这和本文实验结果相吻合;此外,化合物1和2有良好的抗肿瘤作用,而且1在腹腔注射给药剂量为100 mg/kg时,并没有显示出急性毒性。在文献中,化合物3仅报道了其具有抗肿瘤作用,而未见其抗菌活性相关报道[22]。文献检索发现,这类联吡啶化合物的抗菌作用机制还尚未报道。
化合物1和2是C=N双键的顺反异构体,分析它们的抗菌活性构效关系,化合物1活性强于化合物2,说明肟基的顺反异构对活性影响较大。稳定性方面,化合物1在光照条件下会逐渐转变为化合物2,这与之前文献报道的联吡啶类化合物在光照条件下不稳定是一致的[23],原因可能为肟基双键上的羟基通过顺反异构,可与旁边的N原子形成分子内氢键。此外,有报道称化合物1还可以通过与地塞米松-糖皮质激素受体的结合而发挥抗炎作用[20];这类化合物还报道了具有氧化应激抑制作用而成为神经保护剂,并已申请了专利[24];某些联吡啶类化合物虽然没有抑菌活性,但具有抑制细菌群体感应活性[23],说明这类化合物具有作为新型抑菌剂的潜力。
本研究是笔者长期对塔克拉玛干沙漠药用资源微生物勘探的结果之一,尽管化合物1抗革兰阴性菌的活性总体较弱,但其对碳青霉烯类耐药的鲍曼不动杆菌的MIC值为64 μg/mL为首次报道。如果进一步开展结构修饰,有望在化合物1的结构基础上,获得具有更强抗碳青霉烯类耐药的鲍曼不动杆菌的化合物。前期本课题组从塔克拉玛干沙漠来源微生物中还发现了玄奘米星及和田霉素系列新抗生素,和田霉素系列新抗生素[25-28]是沙漠来源芽胞杆菌产生的,体外对耐药金黄色葡萄球菌具有强活性的异香豆素类抗生素。玄奘米星是体内外对耐万古霉素粪肠球菌活性极强的硫肽类抗生素,它也是首个含4糖单元,目前分子量最大的硫肽类抗生素。结合本论文发现的系列联吡啶类化合物的研究结果,预示塔克拉玛干沙漠特境是开展新抗生素研发的理想特境。

