As3+胁迫下Bacillus sp.ZJS3菌株的生理生化响应特性
袁存霞 李艳楠 张肖冲 杨瑞 刘建利,3 李靖宇,3
(1.北方民族大学生物科学与工程学院,银川 750021;2.宁夏特殊生境微生物资源开发与利用重点实验室,银川 750021;3.国家民委黄河流域农牧交错区生态保护重点实验室,银川 750021)
快速的工业化进程导致重金属污染物大量排放到生态环境中,对人类、动物、植物和微生物造成严重的危害,其危害程度取决于重金属在环境、食品和生物体中的浓度和化学形态[1]。砷(arsenic,As)作为痕量类金属元素,在自然环境中存在形式主要有无机形态砷酸盐(As5+)、亚砷酸盐(As3+),有机形态包括一甲基砷酸、二甲基砷酸、三甲基砷酸[2],其中As3+的毒性和迁移能力比As5+更强,前者的毒性是后者的100倍。砷在土壤中可与铁、磷、硫和硅等元素相互作用通过植物进入食物链,作为磷酸盐的结构类似物,砷酸盐和亚砷酸盐分别通过抑制氧化磷酸化和对半胱氨酸残基的巯基的亲和力来发挥毒性作用,对人具有高度致癌性[3-4]。由于自然环境的变化和人类活动的影响导致局部区域砷污染严重[5]。目前,对土壤砷污染的修复中微生物修复可通过自身的代谢对重金属进行积累,将高毒性的重金属转化为低毒性或无毒性的或对重金属进行吸附等方式[6],减少重金属对土壤的污染的同时也具有节能环保的优势。
在自然界中对砷离子具有耐受性的微生物很多,其中包括芽孢杆菌属(Bacillus)、鞘氨醇单胞菌属(Sphingomonas)[4]、尖孢镰刀菌(Fusarium oxysporum)和棘孢木霉(Trichoderma asperellum)[7]等,这些微生物可通过亚砷酸盐氧化、砷酸盐还原、亚砷酸盐甲基化、亚砷酸盐的外排、生物积累和吸附等耐受机制来适应砷的胁迫[8]。微生物对砷的耐受机制与其在质粒或染色体上的基因编码或调控密切相关。其体内砷相关基因主要分为抗性基因或新陈代谢基因[9]。砷氧化是将高毒性的As3+氧化为低毒性的As5+。微生物As3+氧化是微氧土壤和沉积物中砷固定化的重要地球化学过程,加速了砷浓度的衰减,并显著控制了微氧条件下砷的行为,降低砷的迁移率,提高砷的固定效率[10]。砷还原的作用机理可以通过操纵子编码的蛋白参与As3+解毒或者在还原过程中充当最终的电子受体[11-12]。此外,微生物可分泌多糖、蛋白质、核酸和脂质组成胞外聚合物(EPS)等,通过-COOH、-NH2、-CH2、-OH和-C=O等官能团的离子交换、氧化还原、络合以及分子间的相互作用来吸附重金属[13-14]。有研究表明,蜡样芽孢杆菌(Bacillus cereus)、巨大芽孢杆菌(Bacillus megaterium)、短小芽孢杆菌(Bacillus pumilus)在24 h时对砷的吸附率分别为(16.8±4.2)mg/g、(15.4±3.1)mg/g、(9.4±0.6)mg/g[15]。微生物对砷吸附能力的强弱与砷的转化率有关[16]。
本研究选择实验室先前从生物土壤结皮(biological soil crusts,BSCs)中筛选得到的对多种重金属具有耐受性的Bacillus sp.ZJS3进行研究,探究Bacillus sp.ZJS3对As3+的耐受机制,以期为砷污染的治理提供优势菌株和理论基础。
1 材料与方法
1.1 材料
试验材料是采集自腾格里沙漠东南缘地区生物土壤结皮(藻结皮和藓结皮),于-80℃冰箱保存的菌种。
LB培养基:胰蛋白胨10 g、氯化钠10 g、酵母浸粉5 g。
硫酸溶液:在75 mL水中加入25 mL浓硫酸。
抗坏血酸溶液:将1 g抗坏血酸和0.5 g亚硫酸钠溶于100 mL蒸馏水中。
1.2 方法
1.2.1 菌株砷耐受范围及其生长曲线测定 从-80℃冰箱取出保存菌种的甘油管,用接种环挑取菌落接种到LB琼脂斜面培养基上,在30℃培养箱培养形成菌落,用无菌水冲洗斜面培养基,配制成200 mL菌悬液,培养24 h。查阅文献[17]确定菌株ZJS3对砷的最低耐受浓度为100 mg/L,吸取0.2 mL菌悬液采用涂布法接种在不同As3+浓度梯度的LB固体培养基上,在30℃恒温条件下培养2 d,观察菌落是否生长,进一步确定As3+菌株最高耐受浓度。
选取As3+的浓度梯度为0 mg/L、100 mg/L、140mg/L、180 mg/L、220 mg/L、260 mg/L、300 mg/L,配制成LB液体培养基。将菌悬液以5%的接种量接种到培养基中,每个处理3个重复,在恒温30℃、转速150 r/min恒温摇床培养24 h,每2 h用微量分光光度计测定其OD600,以空白LB液体培养基为对照。
1.2.2 菌株最适生长条件的单因素实验 控制As3+的浓度为最低耐受浓度100 mg/L。pH影响实验过程中,控制培养基pH分别为4.0、6.0、7.0、8.0、10.0,转速为150 r/min,温度为30℃;转速影响实验过程中,控制转速分别为50 r/min、100 r/min、150 r/min、200 r/min、250 r/min,pH为7.0,温度为30℃;温度影响实验过程中,控制培养温度分别为20℃、25℃、30℃、35℃、40℃,转速为150 r/min,pH为7.0。配制成液体培养基,将菌悬液以5%的接种量接种到培养基中,每个处理3个重复,在恒温30℃、转速150 r/min恒温摇床培养24 h,用微量分光光度计测定其OD600,以空白LB液体培养基为对照。
1.2.3 As3+和Na+共同处理下菌株的生长 设置As3+浓 度 为 100 mg/L、130 mg/L、160 mg/L、190 mg/L、220 mg/L、250 mg/L、280 mg/L、300 mg/L(分别标记为As1-As8),及不同质量分数的氯化钠1%、2%、3%、4%、5%、6%、7%、8%(分别标记为Na1-Na8),分别加入到锥形瓶中,配制成液体培养基,将菌悬液以5%的接种量接种到培养基中,每个处理3个重复,在恒温30℃、转速200 r/min恒温摇床培养24 h,用微量分光光度计测定其OD600,以空白LB液体培养基为对照。
1.2.4 菌株的氧化还原特性测定
1.2.4.1 定性硝酸银(AgNO3)染色实验[18]根据菌株最低耐受浓度100 mg/L和最高耐受浓度300 mg/L,配制液体培养基进行培养,以空白LB液体培养基为对照,将培养好的菌液和对照吸取到10 mL EP管中,向EP管中滴加0.1 mol/L AgNO3溶液,观察其颜色的变化(Ag+与As3+反应形成黄色沉淀,与As5+反应形成深棕色沉淀)。
1.2.4.2 砷钼蓝法[19]测定砷含量及价态 选取As3+浓度为100 mg/L和300 mg/L,配制成液体培养基进行培养,将培养好的菌液分别移取10 mL经100 mg/L及300 mg/L砷胁迫的菌液于200 mL容量瓶用蒸馏水稀释至刻度。
As5+含量的测定(处理一):分别量取稀释后的菌液1 mL、2 mL、3 mL、4 mL、5 mL,加2 mL硫酸溶液,加2 mL钼酸铵(30 g/L)溶液,加1 mL抗坏血酸溶液。
总砷含量的测定(处理二):分别量取稀释后的菌液1 mL、2 mL、3 mL、4 mL、5 mL,加2 mL硫酸溶液,滴加高锰酸钾溶液(0.01 mol/L),使溶液滴定至微红色,加2 mL钼酸铵溶液,加1 mL抗坏血酸溶液。
将上述两个处理在沸水浴中放置10 min,取出冷却,用水定容至50 mL容量瓶中,摇匀。使用紫外分光光度计在OD620处,以蒸馏水为对照,测定溶液的吸光度,每个处理3个重复。
As3+含量的测定:总砷含量减去As5+含量剩余的即为As3+的含量。
1.2.5 活性氧(ROS)、抗氧化酶活性和丙二醛含量测定 培养As3+(140 mg/L、260 mg/L)处理和不加As3+处理的菌株。用血球计数板计算出稀释1 mL菌株的数量,控制菌体数量一样,用索莱宝(Solarbio)科技有限公司研发的活性氧(ROS)检测试剂盒、丙二醛(MDA)含量检测试剂盒和抗氧化酶活检测试剂盒测定菌株的酶活性及含量。每个处理3个重复,均用Varioskan LUX多功能酶标仪(美国赛默飞)测定。
1.2.6 生物扫描电镜(SEM)观察 根据ZJS3对As3+的耐受范围,选取0 mg/L、140 mg/L和260 mg/L三个浓度梯度进行培养,将ZJS3及As3+胁迫的培养物,3 000 r/min离心后弃培养基,收集菌体沉淀于管底(黄豆大小),用磷酸缓冲液洗1-2次,弃掉上清液,沿管壁缓慢加入4℃预冷的固定液,然后放入4℃冰箱保存12 h以上,将样品送至杭州研趣信息技术有限公司进行扫描电镜拍摄(SU8010)。
1.2.7 EPS中蛋白质和多糖测定 通过加热法提取 EPS[20]。培养含 As3+量 0 mg/L、100 mg/L、180 mg/L、220 mg/L的菌液,吸取10 mL菌液,放到温度为80℃水浴锅中保温10 min左右。冷却后用高速冷冻离心机(TGL 16MB)以9 000 r/min常温离心20 min,吸取上清液,用0.22 μm微孔滤膜过滤,备用。
1.2.7.1 采用苯酚-硫酸法测定多糖含量[21]制作标准曲线:准确称取标准葡萄糖20 mg于500 mL容量瓶中,加水至刻度,分别吸取0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL、0.7 mL、0.8 mL、0.9 mL各以水补至2 mL,然后加入1.0 mL的6%苯酚和5.0 mL浓硫酸,静置10 min,摇匀,室温放置20 min以后测定OD490,以2.0 mL的dH2O按同样操作为空白,纵坐标为吸光值,横坐标为多糖含量,得标准曲线。
样品多糖含量测定:准确吸取样品溶液2.0 mL按上述步骤同样操作,测吸光值,按照标准曲线计算多糖含量。
1.2.7.2 考马斯亮蓝法测定蛋白质含量[21]制作标准曲线:准确吸取标准蛋白质溶液0 mL、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL, 加 入 NaCl溶液补至1 mL,加入考马斯亮蓝试剂5 mL,摇匀,反应5-10 min后,于OD595测定吸光值,以1 mL的NaCl溶液按同样显色操作作为空白,纵坐标为吸光值,横坐标为蛋白质含量,得标准曲线。
样品蛋白含量测定:准确吸取样品溶液1.0 mL按上述步骤同样操作,测吸光值,按照标准曲线计算蛋白质含量。
1.2.8 菌株的吸附特性 测定pH对菌株As3+吸附率的影响时,设置pH为4.0、6.0、7.0、8.0、10.0,保持加菌量为5%,As3+浓度为最低胁迫浓度;测定加菌量对菌株As3+吸附率的影响时,设置加菌量为1%、3%、5%、7%、10%,保持pH为最佳pH(即7.0),As3+浓度为最低胁迫浓度;测定As3+浓度对菌株As3+吸附率的影响时,设置As3+浓度梯度为 100 mg/L、140 mg/L、180 mg/L、260 mg/L、300 mg/L,保持加菌量为5%,pH为最佳pH(即7.0)。将菌液培养24 h后13 000 r/min,常温离心10 min取上清液过滤,用于测定剩余As3+浓度。As3+的吸附率R和吸附量qe计算分别见式(1)和式(2)。

式中,c0为处理前水中原有As3+浓度(mg/L);ce为处理后水中剩余As3+浓度(mg/L);V为溶液体积(mL);m为菌株质量(g)。
2 结果
2.1 菌株Bacillus sp.ZJS3的砷耐受范围和生长曲线
对菌株Bacillus sp.ZJS3进行不同As3+浓度梯度的培养,最终得到该菌株对于As3+的耐受浓度范围100-300 mg/L。菌株Bacillus sp.ZJS3在不同As3+浓度胁迫下的生长曲线如图1所示。与对照组相比,由于受到砷的胁迫,菌株的生长数量始终比对照组低,且随着砷浓度梯度的增大,菌株的生长数量也随着浓度的增大呈梯度降低的趋势。砷浓度为100 mg/L,菌株在10 h时生长数量达到一定值后,开始下降;在16 h时,菌株的数量出现回升且持续增长。砷浓度为140 mg/L,菌株在12 h时生长数量达到最大值。砷浓度为180 mg/L、220 mg/L,菌株在14 h和16 h时生长数量达到最大值。砷浓度为260 mg/L和300 mg/L,菌株在24 h内数量未达到最大值。

图1 菌株Bacillus sp.ZJS3在不同As3+浓度胁迫下的生长曲线Fig.1 Growth curve of strain Bacillus sp.ZJS3 under stress of different As3+ concentrations
2.2 菌株Bacillus sp.ZJS3较适宜生长条件的确定
pH值、转速、温度对菌株Bacillus sp.ZJS3生长的影响如图2。pH=7.0时,菌株生长的浓度显著高于其他pH值下菌株的生长浓度,因此在As3+胁迫下Bacillus sp.ZJS3更适合在中性条件下生长且弱碱性条件下生长较好。随着转速的增加,菌株浓度先下降后升高,在转速为200 r/min和250 r/min时,菌株的浓度达到最高且差异不显著,所以在As3+胁迫下Bacillus sp.ZJS3转速为200 r/min时生长较好。随着温度值的上升,菌株浓度呈现先上升后下降趋势,在温度为30℃时菌株生长浓度显著高于其余温度下菌株的生长浓度,说明在As3+胁迫下Bacillus sp.ZJS3在30℃条件下生长较好。

图2 不同条件对As3+胁迫Bacillus sp.ZJS3生长的影响Fig.2 Effects of different conditions on the growth of Bacillus sp.ZJS3 under As3+ stress
2.3 As3+和Na+共同处理下菌株Bacillus sp.ZJS3的生长
在 Na+(1%-8%)与 As3+(100 mg/L、130 mg/L、160 mg/L、190 mg/L、220 mg/L、250 mg/L、280 mg/L、300 mg/L编号为As1-As8)的共同胁迫下,低浓度的As3+和Na+胁迫下菌株的生长数量与对照组相比无显著性差异,并且随着Na+浓度的增加,菌株的生长数量逐渐降低。在As3+浓度为3(160 mg/L)和4(190 mg/L)时,与低浓度的Na+(1%-3%)共同胁迫下,菌株的生长数量与对照组相比差异显著,对菌株的生长有明显的促进作用;在高浓度As3+和Na+的胁迫下,对菌株生长产生明显的抑制作用(图3)。所以,在一定浓度As3+胁迫下,适当的增加Na+的浓度,可以促进菌株Bacillus sp.ZJS3生长。
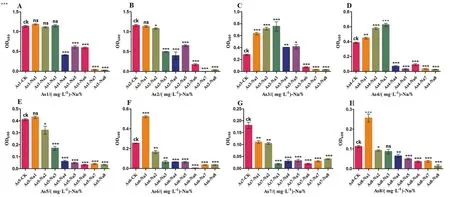
图3 As3+和Na+共同胁迫下Bacillus sp.ZJS3的生长Fig.3 Growth of Bacillus sp.ZJS3 under the combined stress of As3+ and Na+
2.4 菌株Bacillus sp.ZJS3的氧化还原特性
图4中5个EP管中最左边为对照组(不加菌),右边4个均为样本组(加菌)。向砷浓度为100 mg/L和300 mg/L的EP管中滴加硝酸银,观察到溶液逐渐由黄色变为深棕色,说明溶液中含有As5+。

图4 定性硝酸银(AgNO3)染色Fig.4 Qualitative silver nitrate(AgNO3)staining
砷钼蓝法测定溶液中不同价态砷含量的结果表明,随着时间的增加As3+含量逐渐降低,而As5+含量逐渐升高(图5)。A、B是在100 mg/L As3+胁迫下24 h和48 h测得的溶液中As3+、As5+和总砷的含量;C、D是在300 mg/L As3+胁迫下24 h和48 h测得的溶液中As3+、As5+和总砷的含量。硝酸银(AgNO3)染色和砷钼蓝法测定结果表明菌株Bacillus sp.ZJS3具有氧化还原的能力。

图5 砷钼蓝法测定砷含量Fig.5 Determination of arsenic content by arseno-molybdenum blue method
2.5 活性氧(ROS)、抗氧化酶活和MDA含量测定
ROS为氧的正常代谢的天然副产物,主要来源于氧的自由基和非自由基。Bacillus sp.ZJS3胞内ROS的含量在高浓度As3+的胁迫逐渐降低,在较低浓度下ROS含量可能会升高(图6)。细胞内的抗氧化酶可以有效的避免细胞内活性氧和过氧化氢等对细胞的影响。随着As3+浓度的增加,与对照组相比,过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)的活性和MDA整体呈现上升趋势,MDA含量的升高证明了细胞膜发生了脂质过氧化(图7)。

图6 As3+胁迫下Bacillus sp.ZJS3胞内的ROS含量Fig.6 Content of ROS in Bacillus sp.ZJS3 cell under As3+stress

图7 As3+胁迫对Bacillus sp.ZJS3的抗氧化酶活及MDA含量的影响Fig.7 Effects of As3+ stress on the antioxidant enzyme activity and MDA content of Bacillus sp.ZJS3
2.6 生物扫描电镜(SEM)
在未受砷胁迫时,ZJS3的形态呈现粗短状,且细胞表面附着褶皱(图8-A)。随着砷胁迫程度的增强,ZJS3细胞表面的物质逐渐增多,菌体表面变得略光滑,菌体形状呈现变长的状态,且表面出现一层颗粒状的物质(图8-B、C)。可能是由于砷代谢过程中,某个基因的表达导致细胞膜表面变长,也可能是有砷吸附在细胞膜的表面,因此需要对Bacillus sp.ZJS3对砷的耐受机制需要进一步研究确定。

图8 不同As3+浓度胁迫下Bacillus sp.ZJS3的扫描电镜图Fig.8 SEM of Bacillus sp.ZJS3 under different As3+ stress
2.7 菌株Bacillus sp.ZJS3 EPS的蛋白质和多糖测定
在0 mg/L、100 mg/L、180 mg/L、220 mg/L的砷浓度的胁迫下菌体胞外多糖的含量随着砷浓度的增加显著增大,这说明可溶性多糖可能螯合砷离子,阻止砷离子靠近细胞减少砷离子对菌株的危害(图9-A);而菌体胞内蛋白质的含量随着砷离子浓度的增加先升高后降低,低浓度的砷胁迫可以诱导细胞合成大量的蛋白质来抵抗砷胁迫,随着砷浓度的增加,对细胞合成蛋白质产生抑制作用,导致蛋白质的含量下降(图9-B)。

图9 As3+胁迫下菌株Bacillus sp.ZJS3 EPS中多糖和蛋白质的含量Fig.9 Contents of polysaccharides and proteins in EPS of Bacillus sp.ZJS3 under As3+ stress
2.8 菌株的吸附特性
在pH=7.0时,吸附率达到最高25.00%,吸附量为3.23 mg/g(图10-A);在砷浓度为100 mg/L、pH=6.0、接菌量为1%时,菌株的吸附率为23.63%,吸附量为3.06 mg/g;pH=6.0,接菌量为5%时,随着砷离子浓度的增加,菌株的吸附率先升高后降低(图10-B);在砷浓度为100 mg/L、接菌量为5%时,Bacillus sp.ZJS3对As3+的吸附率随着pH的升高先上升后降低(图10-C)。因此,影响ZJS3吸附率的最适pH值为7。

图10 不同条件下ZJS3对As3+的吸附率Fig.10 Adsorption rates of As3+ by ZJS3 under different conditions
3 讨论
谷氨酸棒杆菌MTCC 2745[22]能够在砷浓度为1 000 mg/L的培养基中生长,菌株Bacillus sp.ZJS3对As3+的最高耐受浓度与的谷氨酸棒杆菌MTCC 2745耐受浓度相比,菌株Bacillus sp.ZJS3的耐受浓度较低。芽孢杆菌具有较厚的细胞壁,可以通过自身的耐盐基因的调节增强耐盐性,不会因脱水而死亡[23]。有关研究表明,与单独砷相比,砷和盐共同处理下植物的叶、茎和根中砷的积累减少,在高砷胁迫条件下,盐提高了As的耐性指数[24]。结果表明,在低浓度的As3+和Na+共同处理的条件下,与对照组相比,菌株生长的更好,可能是由于低浓度的盐,减少了砷离子在菌株体内的积累,提高了砷离子的耐性,所以低浓度的盐胁迫可以缓解As3+对Bacillus sp.ZJS3菌体的毒害。细菌在长期的砷环境下生存,逐渐进化形成某种机制来减少砷离子对菌株的毒害,以便修复环境中的砷污染,砷污染的修复一般有As3+氧化、As5+还原、砷的甲基化、吸附和沉淀等方式[25]。本研究中筛选到的Bacillus sp.ZJS3是一种As3+氧化细菌,根据单因素实验结果,比较适宜的培养条件pH为7.0、转速为200 r/min、温度为30℃。在24 h内低浓度砷胁迫下,生长浓度是先升高后降低再升高。刚开始升高是由于多糖螯合As3+,菌体产生大量蛋白质来抵抗砷胁迫,减少了As3+对菌体的毒害作用[26],但多糖只能螯合部分As3+,随着浓度的增大,As3+对菌株产生毒害作用加剧,Bacillus sp.ZJS3可以将As3+氧化为As5+,降低了砷离子的毒性,菌株生长浓度再次升高。
为探究该菌体是否对砷离子具有吸附特性,本研究对含有As3+和含有不同浓度的As3+的菌液拍摄了生物扫描电镜(SEM),与对照组相比,As3+处理过得菌体变长,且随着As3+浓度越高菌体表面出现颗粒状的物质逐渐增多。通过吸附率的测定,该菌株具有一定的吸附特性,但对砷离子的吸附率较低。相对于吸附率较高的菌株A4[17],其菌体表面褶皱明显增多,且团粒结构变大,与该菌株形态有所差别,可能是由于菌株的将As3+氧化成As5+毒性变低且吸附率较低的原因。由于细胞吸附金属离子主要靠静电吸引、离子交换和表面络合的方式进行吸附,当浓度达到一定值时,吸附位点饱和,吸附率会逐渐降低[27]。本研究中pH影响吸附率实验表明,较低的pH值,会促进细胞壁与水合氢离子结合,占据吸附活性位点,增加细胞表面的静电斥力,阻止金属离子与细胞壁结合[28];较高的pH,会使细胞的生长和活性都受到影响,pH越高,溶液中会产生沉淀覆盖在细胞表面,吸附作用受到抑制。
微生物在重金属或其他极端条件的胁迫下,会诱导细胞产生大量的ROS(单线态氧、超氧阴离子、过氧化氢和羟基自由基),但过量的ROS会对细胞的结构产生危害作用,可以通过SOD、CAT、POD共同作用来改变酶的活性来调节体内活性氧自由基的平衡,促进抗氧化酶的活性升高[29]。MDA含量是反映机体抗氧化潜在能力的重要参数。本研究中ROS含量随着As3+浓度升高而降低,与大肠杆菌MG1655所测得的结果一致[30],但大肠杆菌MG1655是由于Mn-SOD酶在抗重金属胁迫中起重要作用,本研究中可能是由于SOD、CAT、POD对活性氧的有效去除或者自由基通过脂质过氧化反应形成了MDA,导致细胞内MDA含量升高,有关代谢通路的分析,还需要进一步研究。
4 结论
本研究筛选到的菌株对As3+具有一定的耐受性且有较低的吸附性,能把As3+氧化成As5+,可以减少对土壤的危害,为低浓度As3+土壤污染微生物治理提供理论基础。

