刺激响应型纳米酶及其原位催化增强肿瘤治疗
梁家玮, 孙婉莹, 罗刘睿麒, 蒋邦平, 沈星灿*
(1.广西师范大学 化学与药学学院, 广西 桂林 541004; 2.药用资源化学与药物分子工程教育部重点实验室(广西师范大学),广西 桂林 541004; 3.省部共建药用资源化学与药物分子工程国家重点实验室(广西师范大学), 广西 桂林 541004)
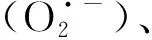
化学动力学治疗(chemodynamic therapy, CDT)是利用肿瘤微环境(tumor microenvironment, TME)的内源性化学刺激引发纳米酶等的催化反应,在肿瘤细胞和组织中原位产生ROS,以实现特异性杀死肿瘤的治疗方法[7-8]。通过近红外光、超声波、X射线等外源性刺激,可能同时触发纳米酶体系的光动力治疗、光热治疗、声动力治疗以及放射治疗,增强化学动力学治疗效果[9-10]。近年研究发现,肿瘤细胞免疫原性死亡能激活肿瘤免疫系统,有效抑制恶性肿瘤的复发和转移[11]。其中以ROS为特征的肿瘤催化免疫治疗(catalytic cancer immunotherapy)受到关注[12]。本工作综述刺激响应型纳米酶在肿瘤微环境原位产生ROS,用于化学动力学治疗,并协同光动力治疗、光热治疗、声动力治疗、放射治疗以及免疫治疗,实现高效精准治疗肿瘤的研究进展。
1 纳米酶原位催化治疗肿瘤
1.1 改变肿瘤微环境pH值、过氧化氢浓度,增强纳米酶催化治疗肿瘤
正常组织和血液pH为7.43,纳米酶催化产生ROS的反应,最佳催化pH值偏酸性[13]。降低肿瘤微环境的pH值,是提高纳米酶催化反应效率的有效途径(见图1(1))[14]。Sun等[15]通过在纳米酶体系中引入外源性酸来调节肿瘤微环境pH值,报道了一种负载二氯乙酸(dichloroacetic acid, DCA)与金属有机骨架(metal-organic frameworks, MOF-Fe2+)的MD@Lip脂质体,其作为一种类芬顿反应的纳米酶催化剂,具有酸度调节、生成过氧化氢的双重放大特性,能促进肿瘤细胞氧化应激反应,达到治疗肿瘤的目的。
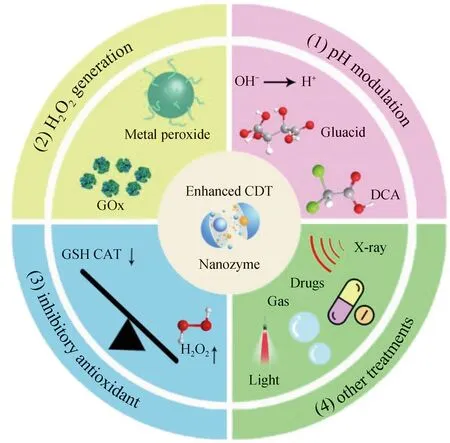
图1 刺激响应型纳米酶及其原位催化增强肿瘤治疗示意Fig.1 Schematic illustration of the stimulus-responsive nanozymes and their in situ catalytic enhancement of tumor therapy
恶性肿瘤细胞的快速增殖需要营养物质作为支撑,因此大量的葡萄糖分子被运输并累积在肿瘤微环境中。而葡萄糖氧化酶(glucose oxidase, GOx)可催化葡萄糖氧化为葡萄糖酸和过氧化氢(见图1(2)),使肿瘤微环境中的酸度升高[16]。此外,虽然肿瘤细胞中内源性过氧化氢浓度比正常细胞高,但受内源性抗氧化防御机制影响,导致肿瘤细胞内源性过氧化氢浓度不足,限制了纳米酶介导的催化治疗效果[17]。因此,将葡萄糖氧化酶与人工纳米酶的催化反应串联,构建复合杂化纳米酶体系,实现在肿瘤细胞内的级联反应,调节肿瘤细胞微环境pH值和过氧化氢浓度,可以有效提高肿瘤治疗效果[18]。例如:Huo等[19]将葡萄糖氧化酶、Fe3O4纳米酶负载到生物可降解的树枝状介孔二氧化硅(dendritic mesoporous silica nanoparticles, DMSNs)上,构建新型GOD-Fe3O4@DMSNs复合纳米酶。该复合纳米酶中的天然葡萄糖氧化酶有效催化葡萄糖氧化为葡萄糖酸和过氧化氢,为人工Fe3O4纳米酶的类芬顿反应(Fenton)提供催化底物,提高肿瘤治疗所需羟基自由基的生成效率。Fu等[20]以聚乙二醇(polyethylene glycol, PEG)修饰葡萄糖氧化酶为模板,负载抗癌药物阿霉素(doxorubicin, DOX),构建了一种可降解的多功能铜掺杂磷酸钙复合纳米酶(PGC-DOX)。该杂化纳米酶能通过葡萄糖氧化酶催化葡萄糖,产生葡萄糖酸和过氧化氢,所释放Cu2+与肿瘤细胞内源性谷胱甘肽反应被还原成Cu+。Cu2+/Cu+通过芬顿反应催化过氧化氢,生成治疗所需的羟基自由基,增强化学动力治疗肿瘤的效果。此外,该杂化纳米酶体系中的阿霉素不仅能用于化疗,而且其固有的红色荧光可用于荧光成像实时监测药物在体内释放情况,实现成像指导的高效协同肿瘤治疗。
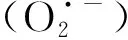
1.2 消耗肿瘤细胞微环境还原性分子,抑制过氧化氢酶活性,增强纳米酶催化治疗肿瘤效果
肿瘤细胞相对于正常细胞具有更高浓度内源性谷胱甘肽,表现出还原性微环境,使其逃避氧化损伤[25]。生命必需的微量金属离子常具有多价态的特点。一些高价态的金属离子在肿瘤微环境中与谷胱甘肽反应,被还原成低价的金属离子,可用于设计智能响应型金属基纳米酶体系。在该还原过程中,由于谷胱甘肽被消耗,有助于肿瘤细胞积累ROS,增强肿瘤细胞内氧化应激,提升肿瘤的治疗效果子(见图1(3))。如He等[26]开发一种由二茂铁(ferrocene, Fc)、顺铂前药(Pt4+)及共轭聚合物纳米粒子(CPNPs)组成的纳米放大器CPNP-Fc/Pt。CPNP-Fc/Pt在细胞内与谷胱甘肽反应,还原并释放出Pt2+,在肿瘤细胞内与烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NADPH)、类超氧化物歧化酶发生级联反应,将氧分子转化为过氧化氢;Fc与过氧化氢反应后,通过芬顿反应转化为Fc+。与游离金属离子不同,Fc+中的Fe3+可以被胞内的NAD(P)H辅酶还原为Fe2+,从而实现Fc的再生。该体系在肿瘤细胞内可以自供给过氧化氢和高效再生Fc,有效地增强催化生成ROS,并通过消耗还原性分子谷胱甘肽,减少ROS消耗,达到高效治疗肿瘤的目的。
Lin等[27]构建了Cu2+掺杂的碳基纳米酶(Cu-cys CBNPs),当纳米酶进入细胞后,释放出的Cu2+与谷胱甘肽发生氧化还原反应生成Cu+,在肿瘤细胞内催化过氧化氢反应产生毒性羟基自由基。此外,Cu2+的还原消耗谷胱甘肽,减少ROS的损耗。
Wu等[28]采用枝晶介孔二氧化硅纳米颗粒(DMSNs)为纳米体系,将Fe3O4纳米粒、Mn2+和谷氨酰胺酶抑制剂(telaglenastat,CB-839)集成到介孔二氧化硅中,构筑刺激响应型杂化纳米酶。其中,谷氨酰胺酶抑制剂可以有效地抑制内源性谷胱甘肽合成,从源头降低谷胱甘肽的产生。另外,Fe2+和Mn2+能发挥芬顿、类芬顿的催化作用,催化过氧化氢产生羟基自由基治疗肿瘤。同时,体系中Fe3+与谷胱甘肽发生氧化还原反应,消耗谷胱甘肽。因此,该纳米酶降低了肿瘤微环境内还原性谷胱甘肽的含量,增强了ROS介导的肿瘤催化治疗。
过氧化氢酶是细胞内天然酶,会催化过氧化氢分解。通过抑制过氧化氢酶的活性,能减少细胞自身消耗过氧化氢。例如:Sang等[29]将小分子抑制剂3-氨基-1,2,4-三唑(3-amino-1,2,4-triazole, 3-AT)和聚乙二醇(PEG)复合于沸石咪唑骨架的有机框架材料(zeolitic imidazole framework-67, ZIF-67)中,制备复合的PZIF67-AT杂化纳米酶体系,该体系具有类超氧化物歧化酶活性,可将超氧阴离子催化转化为过氧化氢。同时,在肿瘤微环境微酸性条件下可释放小分子抑制剂3-氨基-1,2,4-三唑,抑制过氧化氢酶的活性,减少细胞本身损耗过氧化氢,积累的高浓度过氧化氢在杂化酶的催化下,产生羟基自由基,从而增强肿瘤催化治疗。
2 协同增效纳米酶催化治疗的多模态治疗
在肿瘤微环境,纳米酶通过内源性刺激响应触发化学动力学治疗,进一步结合外源性刺激响应所致的光疗、放射治疗、声动力治疗等,可实现多功能协同增效肿瘤治疗(见图1(4))[30-32]。更令人感兴趣的是,近年来新兴的癌症免疫疗法(immunotherapy)[33],是减少肿瘤的转移和复发的有效治疗模式[34]。
光热治疗(photothermal therapy, PTT)与化学动力学治疗相结合时,产生的热量不但能有效杀死肿瘤细胞,还能提升ROS产生速率,增强化学动力学治疗的效果。例如:本课题组[35]采用单宁酸(tannic acid, TA)组装偏钒酸铵(NH4VO3),构建生物相容性好、水溶性佳的多酚-钒氧纳米片(TA@VOXNSS)。在TA@VOXNSS体系中,由于单宁酸的还原作用,将部分V5+还原成V4+,使TA@VOXNSS具有优良的类过氧化物酶活性,催化过氧化氢产生羟基自由基,诱导肿瘤细胞死亡。此外,TA@VOXNSS具有近红外响应的光热治疗功能,温度上升进一步加速纳米酶催化产生羟基自由基,实现化学动力学治疗与光治疗肿瘤的协同增效。Liu等[36]在硅酸锰(MnSiO3nanospheres,MSN)上负载过氧化钙(CaO2)纳米粒以及光敏分子吲哚菁绿(indocyanine green, ICG),并在其表面包覆相变材料月桂酸(lauric acid, LA),构建热响应的MSNS@CaO2-ICG@LA复合纳米酶体系。在近红外光照下,通过吲哚菁绿的光热效应,使月桂酸相变熔化,将CaO2暴露于水中,释放O2和过氧化氢,分别增强了吲哚菁绿介导的光动力治疗和Mn2+介导的化学动力学治疗,从而使光动力治疗与化学动力学治疗相结合,协同作用于癌症治疗。
放射治疗(radiation therapy, RT),是一种利用X射线电离辐射,引发癌细胞原位ROS累积,诱导DNA双链断裂的肿瘤治疗模式[37]。实验证明,低剂量的放射治疗与化学动力学治疗相结合,可降低副作用,显著抑制肿瘤转移。Chen等[38]开发一种低剂量辐射下,载运纳米FeGA的可注射水凝胶体系,在近红外光照射下,纳米FeGA光热性质使水凝胶溶解,释放出的Fe2+能催化细胞内的过氧化氢产生羟基自由基,对肿瘤细胞线粒体造成损伤,增加辐射敏感性,实现催化治疗与放射治疗的协同增效,显著抑制肿瘤增殖,减少炎症等副作用。
声动力治疗(sonodynamic therapy, SDT)利用组织中具有更强穿透深度的超声波激活声敏剂,在肿瘤原位产生ROS,实现肿瘤治疗[39]。Wang等[40]将转换发光纳米颗粒(upconversion nanoparticles, UCNPs)和铁锆卟啉金属有机骨架[PCN-224(Fe)]结合制备一种复合纳米酶(UPFB)。该体系的Fe3+可以和谷胱甘肽进行反应,减少ROS的消耗;还原得到的Fe2+可以催化过氧化氢生成羟基自由基,用于化学动力学治疗。此外,纳米酶可以在超声波的激活下启动声动力治疗,有效提高ROS的水平,实现化学动力学和声动力的协同增效肿瘤治疗。
免疫原性细胞死亡(immunogenic cell death, ICD)是一种肿瘤细胞受到外界刺激发生死亡的同时,由非免疫原性转变为免疫原性,并在机体内激发抗肿瘤免疫效应的独特细胞死亡方式[41]。近年来,大量研究表明,ROS在调控死亡癌细胞的免疫原性中起着至关重要的作用[42-43]。由ROS氧化应激诱导的免疫原性细胞死亡,可增加不同损伤相关分子、促炎细胞因子的释放[11,44],激活体内免疫响应,可用于原发和远端转移性肿瘤的消除和抑制。光免疫治疗(photoimmunotherapy, PIT)是在光治疗的基础上结合免疫治疗,但免疫抑制肿瘤微环境的乏氧情况会极大限制其治疗效果[45]。本课题组[46]针对这一问题,提出人工金属蛋白纳米类似物的新概念,基于卵清蛋白(ovalbumin, OVA)、“光疗纳米酶”RuO2,构建了金属蛋白纳米类似物RuO2@OVA NAs,具有光热/光动力学性能,能原位催化肿瘤微环境中过表达的H2O2产生O2,缓解肿瘤乏氧,加强光动力治疗并逆转肿瘤免疫抑制微环境。此外,还能激活抗肿瘤免疫应答,结合细胞毒性T淋巴细胞相关蛋白4检查点阻断,有效消除原发肿瘤,并抑制远端肿瘤生长。
3 结语与展望
微环境内源性刺激型纳米酶能在肿瘤细胞原位催化反应,实现肿瘤精准治疗,结合外源性刺激,实现协同增效多模态高效治疗肿瘤。由纳米酶催化治疗所导致免疫原性死亡,逆转免疫抑制微环境,激活免疫响应,是当前肿瘤精准治疗的前沿热点。但围绕纳米酶的精准高效治疗肿瘤,仍有一些问题亟待解决:1)纳米酶表面修饰,提高其催化活性[47]。传统纳米酶难以达到令人满意的肿瘤治疗效果,因此,通过离子表面改性或功能化的方式,增加纳米酶反应活性位点与底物的接触面积,或修饰与反应底物带相反电荷的材料到纳米酶表面,可以提升纳米酶的催化活性。2)简化纳米酶的设计,提高级联反应的效率。纳米酶体系结构和组成复杂,合成繁琐,不利于临床医学转变。因此,如何设计和构筑结构简单、组成稳定、高效响应肿瘤内源性和外源性刺激的纳米酶体系,备受研究者关注。3)提高纳米酶的递送效率。虽然纳米酶可以有效催化产生ROS抑制肿瘤,但由于纳米载体自身传递效率严重不足,最终到达肿瘤部位的极少(低于1%)[48]。因此,提高纳米酶对肿瘤的靶向递送效率,实现纳米酶在肿瘤内精准高效地释放,亟待研究。4)提高纳米酶的生物安全性。在临床转化方面,纳米酶体系的生物安全性是重要指标之一。因此,应该通过系统的生物实验,严格评估体系的毒副作用,筛选出具有高生物相容性和高生物降解性的纳米酶体系,是纳米酶迈向临床应用的必经之路。

