豌豆ACE抑制肽对诱导损伤的EA.hy.926细胞的保护作用
张 烁 郑喜群 刘晓兰 王俊彤
高血压是引发冠心病、中风和终末期肾病的主要危险因素[1-2]。据WHO统计,世界成人高血压患病率约30%,中国高血压患病率为17.5%左右[3]。血管紧张素转换酶(Angiotensin Converting Enzyme,ACE;EC 3.4.15.1)是一种锌离子金属羧肽酶,能够催化血管紧张素Ⅰ转化为血管紧张素Ⅱ,而血管紧张素Ⅱ具有收缩血管的作用,导致血压升高。因此通过抑制血管紧张素转换酶或阻断血管紧张素(AT1)受体来调节肾素—血管紧张素系统是现阶段治疗高血压的主要方式[4]。现在已有很多的降压药物,如卡托普利、依那普利等,但长期使用这些合成抑制剂会对人体健康产生负面影响[5-6]。近年来,研究[7-8]发现食物中的活性肽能够通过抑制ACE来降低高血压患者的血压。活性肽分子量小,易于被人体消化吸收,因此可将食物蛋白质发展成为食源性ACE抑制肽辅助治疗高血压。
豌豆(PisumsativumL.)不仅蛋白含量高(约25%),还含有丰富的氨基酸。此外,豌豆蛋白的生物价和功效比均高于大豆蛋白。因此,豌豆蛋白是一种优质的植物蛋白[9],可用于制备活性肽。研究拟以豌豆蛋白为原料,采用双酶协同酶解法制备豌豆蛋白源ACE抑制肽,以ACE抑制率为指标优化工艺条件,并在最佳工艺条件下探究豌豆肽对诱导损伤的EA.hy.926细胞的保护作用,以期为开发豌豆肽辅助降血压产品提供理论支撑。
1 材料与方法
1.1 材料与试剂
豌豆蛋白粉(蛋白质含量为76.07%):山东健源生物工程股份有限公司;
风味蛋白酶(10 030.42 U/mL)、碱性蛋白酶(246 532.55 U/mL)、复合蛋白酶(321 769.71 U/mL):南宁东恒华道生物技术有限公司;
α-淀粉酶:3 700 U/g,北京奥博星生物技术责任有限公司;
血管紧张素转化酶(ACE,1 UNIT)、马尿酰组氨酰亮氨酸(HHL)、二甲基亚砜(DMSO):美国 Sigma公司;
EA.hy.926细胞:中国科学院上海生科院细胞库;
血管紧张素-Ⅱ(Ang-Ⅱ):北京酷来博科技有限公司;
DMEM高糖液体培养基、0.25%胰蛋白酶-EDTA、台盼蓝染色液(0.4%):美国Gibco公司;
青毒素、链霉素:Solarbio公司;
胎牛血清(FBS):杭州四季青生物工程材料有限公司;
NO试剂盒、BCA蛋白质浓度测定试剂盒、丙二醛(MDA)测定试剂盒及超氧化物歧化酶(SOD)活性测定试剂盒:南京建成生物工程研究所;
内皮素(ET-1)试剂盒:上海酶联生物科技有限公司;
其他试剂为国产分析纯试剂。
1.2 仪器与设备
pH计:FE28型,梅特勒—托利多(上海)仪器设备有限公司;
智能磁力搅拌器:ZNCL-GS型,予华仪器有限责任公司;
紫外可见分光光度计:2J1-0013型,日本HITACHI公司;
酶联免疫检测仪:Cf72-8YW型,珀金埃尔默仪器有限公司。
1.3 试验方法
1.3.1 豌豆肽的制备及理化指标测定 制备质量浓度为100 mg/mL的豌豆蛋白悬浮液,按m酶∶m豌豆蛋白=1.5∶100分别添加Alcalase碱性蛋白酶(简写为A)、Flavourzyme风味蛋白酶(简写为F)和Protamex复合蛋白酶(简写为P)中的2种酶,协同酶解,得豌豆肽溶液,反应总时长为6 h,酶解反应过程中每30 min取样,灭酶、4 500 r/min离心15 min,取其上清液测定水解度、可溶蛋白含量。
(1) 水解度的测定:在豌豆肽水解过程中加入1 mol/L的NaOH保持最适pH并记录消耗的体积[10],根据式(1)计算水解度。
(1)
式中:
H——水解度,%;
VNaOH——反应中消耗的碱体积,mL;
NNaOH——反应中维持 pH 稳定时碱当量浓度,mol/L;
α——α-氨基酸解离度;
Mp——反应体系中的蛋白总量,g;
htot——1 g蛋白中肽键的克当量数,7.8。
(2) 可溶蛋白含量的测定:采用Folin-酚法[11]。
1.3.2 ACE抑制率的测定 根据Cushamn等[12]的方法有所修改,反应在2 mL的 PE 管中进行,取10 μL的样品水解液,依次加入5 mmol/L HHL溶液40 μL、去离子水50 μL,混匀,37 ℃水浴锅中预热10 min,加入10 μL ACE并继续水浴30 min。结束后向管中加入140 μL 1 mol/L HCl和750 μL乙酸乙酯(-20 ℃)使反应停止,涡旋振荡30 s,3 500 r/min离心5 min,取出500 μL酯层,置于80 ℃烘箱中烘干30 min,加入200 μL的去离子水震荡30 s,得样品组溶液,测定280 nm处的OD值。对照组不加ACE,其余步骤同上。空白组用去离子水代替水解液,并在反应开始前加入1 mol/L HCl 140 μL,其余步骤同样品组。
按式(2)计算ACE抑制率。
(2)
式中:
WACE——ACE抑制率,%;
O1——对照组OD值;
O2——样品组OD值;
O3——空白组OD值。
1.3.3 酶解条件优化 将豌豆肽的蛋白质量浓度稀释至2 mg/mL,测定双酶不同酶解时间以及双酶添加顺序下豌豆蛋白水解物的ACE抑制率。双酶协同酶解最长时间为6 h。分步酶解时间形式为“(2+4、3+3、4+2) h”(例“A 2 h+P 4 h”指先用碱性蛋白酶酶解2 h再加入复合蛋白酶继续酶解4 h),酶解过程中每隔1 h进行取样测定。
1.3.4 豌豆肽分子量对ACE抑制率的影响 采用优化后的最佳条件酶解豌豆蛋白,得到的蛋白水解物4 500 r/min 离心15 min,取上清液。依次选用10,8,5,2.5 kDa的超滤膜进行截留超滤,超滤后的各组分进行冷冻干燥,测定蛋白质量浓度,再配制成蛋白质量浓度为1 mg/mL的溶液,测定其ACE抑制活性。
1.3.5 豌豆肽分子量对氨基酸组成的影响 超滤后的不同分子量豌豆肽的氨基酸组分测定按GB/T 18246—2000执行。
1.3.6 细胞试验 先将EA.hy.926细胞接种于DMEM完全培养基中,再将培养基放在37 ℃、5% CO2的恒温培养箱中常规培养,当细胞密度达到80%左右时加入胰酶消化1 min,1 300 r/min离心10 min进行重悬,传代培养。将对数生长期的EA.hy.926细胞分为空白组、模型组、豌豆肽低剂量组(50 μg/mL)、豌豆肽中剂量组(100 μg/mL)、豌豆肽高剂量组(200 μg/mL)和阳性对照组(1.75 μg/mL卡托普利)。空白组仅加入DMEM完全培养基,模型组加入DMEM完全培养基同步化后加入2.221 μmol/L Ang-Ⅱ溶液刺激12 h,样品组加入相应浓度的样品干预24 h后,加入2.221 μmol/L Ang-Ⅱ溶液刺激12 h。
1.3.7 细胞内相关含量水平的测定 按1.3.6方法培养细胞,待细胞单层生长面积达到80%后用胰酶消化并加入完全培养基终止,在1 300 r/min条件下离心10 min后进行超声破碎,得到细胞匀浆及其上清液,按照试剂盒的说明进行内皮素(ET-1)ELISA、MDA含量、SOD活力以及NO含量的测定。
1.4 数据处理
采用Origin 2021与SPSS软件进行数据统计,所有试验均设3次以上平行,测定数据以平均数±标准差表示。图表中*表示与模型组相比差异显著P<0.05,**表示与模型组相比差异极显著P<0.01;#表示与空白组相比差异显著P<0.05,##表示与空白组相比差异显著P<0.01。
2 结果与讨论
2.1 酶解条件优化
由表1可知,蛋白酶酶解时间对ACE抑制活性影响较大,A酶解2 h的ACE抑制活性基本上优于A酶解3 h 和4 h的,在此基础上,随着P酶解时间的延长,ACE抑制活性呈先升高后降低的趋势。在A酶解2 h后P酶解2 h条件下,制备的水解物ACE抑制活性最高,为(96.49±3.45)%;在P酶解3 h后F酶解1 h条件下,酶解效果最好,ACE抑制率为(88.59±4.84)%;A酶解2 h后用F进一步酶解,随着F酶解时间的延长,ACE抑制活性呈先升高后下降的趋势,其中以F酶解2 h时效果最好,ACE抑制活性为(89.13±3.26)%。综上,酶的添加顺序及酶解时间对ACE抑制活性有重要的影响。

表1 双酶酶解条件对ACE抑制率的影响Table 1 Effects of double-enzymolysis conditions on ACE inhibition rate
选择ACE抑制率较高的酶解条件A 2 h+P 2 h、P 3 h+F 1 h、A 2 h+F 2 h制备豌豆肽并测定水解度和可溶蛋白含量。由表2可知,A 2 h+P 2 h条件下水解度最高,可溶蛋白含量最低,说明酶解效果最好,可能是因为碱性蛋白酶酶解一定时间后蛋白分子结构舒展,暴露更多的肽键,有利于后期加入的酶对蛋白进一步酶解,此结果与徐珍珍等[13]采用双酶制备高活性的大米蛋白肽的结果一致。因此,最佳酶解条件为底物质量浓度100 mg/mL,酶底质量比1.5∶100,碱性蛋白酶先酶解2 h再复合蛋白酶酶解2 h,此条件下水解物的IC50值为1.141 mg/mL,与已报道的其他食源性ACE抑制肽相比,如α-乳白蛋白肽(IC50为3 130 μmol/L)、刺参蛋白肽(IC50为0.8 mg/mL)、大米蛋白肽(IC50为1.571 mg/mL)[14-16], 豌豆蛋白的双酶酶解产物具有较强的 ACE抑制活性, 表明豌豆蛋白是制备ACE 抑制肽的良好植物蛋白来源。
2.2 酶解液超滤分级
由表3可知,经超滤分级后各组分多肽的ACE抑制活性有较明显的差异,其中,<2.5 kDa的豌豆肽组分ACE抑制率效果最好,为63.020%,8~10 kDa组分的ACE抑制率最低,可能是由于多肽有很强的表面活性,容易吸附在超滤膜表面,导致未超滤组分的蛋白质回收率和生物活性降低,与贾聪等[17]研究结论芝麻中ACE高活性抑制肽分子质量集中在3 kDa以下相似。王晓杰等[18]研究也表明玉米ACE抑制肽的分子质量主要集中在6 kDa以下。综上,相对于大分子多肽,小分子多肽的ACE抑制活性更好。
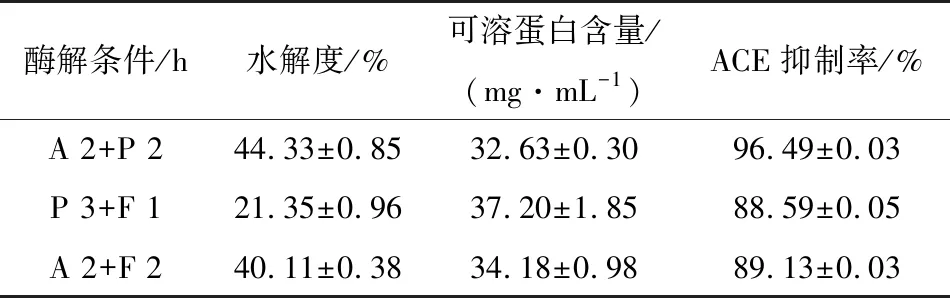
表2 双酶协同酶解的酶解效率与ACE抑制活性的影响Table 2 The effect of double-enzyme synergistic hydrolysis on enzymolysis efficiency and ACE inhibitory activity
2.3 氨基酸组成分析
由表4可知,不同分子量组分的豌豆肽氨基酸组成有差异,个别氨基酸因含量较低在不同分子量组分中未检测出来。豌豆肽的必需氨基酸占氨基酸总量的30.57%,其中含量较高的为脯氨酸和谷氨酸,其次为天冬氨酸和精氨酸。有研究[19-20]表明,ACE抑制活性与谷氨酸、天冬氨酸等氨基酸的存在以及氨基酸占比有关。
分子量<2.5 kDa的豌豆ACE抑制肽的必需氨基酸含量最高,达到41.14%,其中含量较多的是苯丙氨酸、精氨酸、脯氨酸、亮氨酸和酪氨酸,它们属于ACE抑制肽的C-活动区域,能有效降低人机体的血压[21]。因此,由豌豆蛋白制备的ACE抑制肽氨基酸组成均衡,营养价值较高。此外,豌豆ACE抑制肽序列中独特位置处的非极性氨基酸(如Trp和Arg)可以通过阻止底物与活性位点的结合降低ACE活性[22]。<2.5 kDa肽段的氨基酸中必需氨基酸与非必需氨基酸的比值从超滤前的44.03%上升到了69.89%,疏水性氨基酸占比从超滤前的24.88%上升到了37.23%,由此证明了影响ACE抑制活性的因素不仅与分子量有关,也与氨基酸组成相关。
2.4 ACE抑制肽对Ang-Ⅱ诱导损伤的EA.hy.926细胞的影响
2.4.1 ET-1水平 内皮素(Endothelin-1,ET-1)参与大部分心血管疾病的发病过程,存于内皮细胞中[23]。ET-1可以有效地降低一氧化氮合酶水平,从而降低NO水平,维持内皮细胞功能的稳态平衡[24]。采用豌豆肽和Captopril对 EA.hy 926 进行处理,用Ang-Ⅱ溶液进行诱导刺激并培养48 h,细胞分泌的ET-1含量如图1所示。
由图1可知,模型组的ET-1含量明显高于空白组,说明在Ang-Ⅱ的刺激下细胞功能发生了变化,释放炎症因子,而豌豆肽剂量组的ET-1含量随着质量浓度的升高逐渐下降,当豌豆肽的质量浓度为200 μg/mL时,ET-1含量达到最低,为62.69 pg/mL(P<0.01),与李保宏等[25]的研究结果一致。综上,豌豆肽对EA.hy926细胞分泌ET-1有一定的抑制能力,且多肽浓度越高,抑制效果越好。

表3 豌豆蛋白酶解液超滤分级结果Table 3 Results of ultrafiltration classification of pea protease hydrolysate

表4 不同分子量豌豆肽的氨基酸组成与含量对比Table 4 Comparison of amino acid composition and content of pea peptides with different molecular weights g/100 g

图1 豌豆肽浓度对损伤细胞ET-1含量的影响Figure 1 The effects of different concentrations of pea peptides on the ET-1 content in damaged cells
2.4.2 MDA和SOD水平 由表5可知,模型组的MDA含量比空白组的高,经Captopril和低、中、高剂量豌豆肽处理后,损伤细胞中MDA含量明显下降,说明损伤细胞的脂质过氧化程度得到改善;随着豌豆肽浓度升高,MDA含量逐渐下降,在200 μg/mL时,MDA含量最低且优于Captopril组;低剂量豌豆肽对损伤细胞的SOD含量无明显影响,而Captopril组、豌豆肽中剂量组和高剂量组的SOD含量高于模型组,说明中高剂量豌豆肽可以增加细胞清除自由基的能力,此结果与郭耀东等[26]的研究结果一致。因此豌豆肽可以改善Ang-Ⅱ诱导损伤的EA.hy.926细胞的氧化应激损伤,维持机体氧化还原的平衡。
2.4.3 NO水平 由图2可知,模型组上清中的NO含量明显下降,而NO生成减少可导致内皮细胞损伤,说明在Ang-Ⅱ的刺激下细胞血管功能出现障碍。与模型组相比,Captopril组和低、中、高剂量豌豆肽组可以增加NO的生成,且呈浓度依赖性。有研究[27]表明,增加血管壁NO含量有利于改善内皮功能。综上,豌豆肽抑制了Ang-Ⅱ致内皮细胞损伤的作用。

表5 豌豆肽对损伤细胞MDA和SOD的影响Table 5 Effect of pea peptides on MDA and SOD in damaged cells

图2 不同浓度的豌豆肽对损伤细胞NO含量的影响Figure 2 The effect of different concentrations of pea peptides on the NO content in damaged cells
3 结论
以豌豆蛋白为原料,利用碱性蛋白酶与复合蛋白酶两步酶解法制备豌豆蛋白源ACE抑制肽,在碱性蛋白酶酶解2 h后复合蛋白酶酶解2 h,酶底质量比1.5∶100,底物质量浓度100 mg/mL的条件下制得的豌豆肽ACE抑制活性最好,IC50值为1.141 mg/mL。小于2.5 kDa的豌豆ACE抑制肽能缓解Ang-Ⅱ对EA.hy.926细胞的损伤,显著降低ET-1、MDA含量,增加SOD和NO含量水平。因此,豌豆ACE抑制肽对Ang-Ⅱ引起的EA.hy.926细胞损伤具有一定的保护作用。下一步将深入研究ACE抑制肽降血压作用的分子生物学机制。

