shRNA干扰Keap1对缺氧肝细胞功能的影响
刘 静
肝纤维化是一个长期的慢性肝损伤过程,其发病机制尚未阐明。氧化应激是指机体或细胞内的氧自由基过度产生和抗氧化功能相对减弱导致两者之间平衡破坏,继而引起组织或细胞损伤的一种状态[1]。氧化应激在肝纤维化中充当重要角色[2]。许多致肝损伤因素都伴不同程度的氧化应激产生,而Kelch样ECH联合蛋白1(Keap1)-核因子2相关因子2(Nrf2)信号通路在抵御机体氧化应激过程中起关键作用。在氧化应激等状态下,Nrf2与Keap1解离,使Nrf2转移入核,启动下游抗氧化保护性基因的表达,保护机体和细胞免受氧化应激的损伤[3],其中Keap1负性调节Nrf2[4]。本文拟通过构建Keap1 shRNA干扰质粒,探讨Keap1下调后对缺氧肝细胞功能的影响,为临床肝纤维化的防治提供新的靶点。
1 材料与方法
1.1 细胞培养小鼠肝细胞AML12购自上海中科院细胞库,使用含10%胎牛血清的DMEM-F12培养基,常氧培养在37 ℃、5%CO2和95%空气饱和湿度培养箱中;缺氧培养在1%O2、5%CO2和94%N2培养箱中。
1.2 质粒载体的构建及转染由上海吉玛公司合成4条Keap1 shRNA干扰质粒序列(Plvx/GFP/puro-Keap1-1781、1894、1934、2097)和1条对照shNC序列。将AML12肝细胞接种于6孔板,培养至70%~80%融合度时,用Lipofectamine 2000分别将4条干扰序列及对照序列转染至AML12肝细胞,36 h后在荧光显微镜下观察绿色荧光蛋白的表达。
1.3 qRT-PCR检测基因表达转染36 h提取细胞RNA,逆转录成cDNA,并取1 μL cDNA进行PCR反应,反应条件:95 ℃ 30 s、95 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s,合计40个循环。采用2-ΔΔCt法计算mRNA相对表达量,筛选出干扰效率最高的质粒序列。
1.4 Keap1 shRNA稳转染细胞株筛选将shRNA干扰效率最高的质粒序列Keap1 shRNA-1781转染至AML12肝细胞中,加入1.2 μg/mL嘌呤霉素筛选相应的干扰Keap1的稳转细胞株。
1.5 Western blot检测Keap1、Nrf2、COL3A1、TGF-β1、VEGF-A、IGF-1蛋白表达将筛选出的稳转细胞株作为Keap1 shRNA组,与对照组肝细胞缺氧处理不同时间,加入RIPA蛋白裂解液裂解细胞,4 ℃ 12 000g离心10 min,BCA蛋白定量试剂盒进行定量后,取20 μg蛋白进行SDS-PAGE凝胶电泳分离,后转移至PVDF膜上,5%脱脂牛奶37 ℃封闭1 h,加入相应的抗体4 ℃过夜。加入HRP标记的羊抗兔二抗37 ℃孵育1 h,TBST洗膜3次,每次5 min,ECL显色。以GAPDH作为对照内参。
1.6 ELISA法测定COL3A1的分泌收集Keap1 shRNA组与对照组肝细胞缺氧培养上清液,根据ELISA试剂盒说明书,测定450 nm波长处的吸光度值,根据标准曲线计算COL3A1浓度。
1.7 WST-1检测肝细胞活性转染Keap1 shRNA后的肝细胞与对照组肝细胞培养在96孔板中,缺氧处理0、6、12、24、48 h。参考说明书,每孔加入10 μL WST-1溶液37 ℃培养4 h,用酶标仪测定450 nm处的吸光度值。细胞活力(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%,空白组为具有WST-1溶液而没有细胞。
1.8 丙酮酸激酶(PK)活性的测定转染Keap1 shRNA的肝细胞与对照组肝细胞进行缺氧培养,收集细胞,加入提取液超声破碎,8 000g4 ℃离心10 min,取上清,置冰上待测。
1.9 ATP含量测定收集缺氧培养后的Keap1 shRNA组与对照组肝细胞,加入酸性提取液,超声破碎细胞,8 000g4 ℃离心10 min;取上清,再加入等体积的碱性提取液中和,8 000g4 ℃离心10 min,取上清,置冰上待测。
1.10 统计学分析所有数据均用均数±标准差(mean±SD)表示,采用SPSS 13.0软件进行统计学分析,以P<0.05为差异有统计学意义。
2 结果
2.1 Keap1 shRNA干扰质粒的构建本组以Keap1基因第1781、1894、1934、2097位点为干扰点,将shRNA序列与质粒载体Plvx/GFP/puro连接,构建4种Keap1基因的shRNA质粒载体,基因测序结果证实插入序列正确(表1)。

表1 Keap1基因的4个shRNA靶点序列
2.2 qRT-PCR检测结果qRT-PCR检测结果显示:Keap1 shRNA-1781、1894、1934、2097的相对表达量分别为0.38±0.16、0.42±0.14、0.62±0.18、0.50±0.13,4组重组质粒与对照组相比差异均有统计学意义(P<0.05)。其中Keap1 shRNA-1781差异最显著,且表达量最低,干扰效果最好(图1A)。Keap1 shNC组相对表达量为0.88±0.17,与对照组相比差异无统计学意义(P>0.05)。
2.3 Keap1 shRNA稳转染细胞株建立将Keap1 shRNA-1781转染至肝细胞36 h后,加入嘌呤霉素,使用荧光显微镜观察细胞荧光,转染效率超过80%,成功筛选出稳转细胞株(图1B)。

图1 Keap1 shRNA质粒构建筛选:A.qRT-PCR检测肝细胞中Keap1 shRNA-1781、1894、1934、2097各序列Keap1 mRNA的表达:与对照组相比,*P<0.05,**P<0.01;B.Keap1 shRNA-1781稳转肝细胞株荧光显微镜观察
2.4 Western blot检测不同缺氧时间点蛋白表达取转染Keap1 shRNA后的肝细胞,分别缺氧处理0、6、12、24、48 h,结果显示缺氧能够增强Nrf2、COL3A1、TGF-β1、VEGF-A、IGF-1蛋白的表达水平,并且Keap1 shRNA能够增强Nrf2表达;与Keap1 shNC组相比,Keap1 shRNA组促肝纤维化相关因子COL3A1、TGF-β1、VEGF-A、IGF-1的表达下降,且12 h Keap1 shRNA干扰效果最好(图2)。

图2 Keap1 shRNA转染后缺氧培养0、6、12、24、48 h,Western blot检测Keap1、Nrf2、COL3A1、TGF-β1、VEGF-A和IGF-1蛋白水平表达:与同一缺氧时间点的shNC组比较,*P<0.05,**P<0.01;与常氧下shNC组相比,#P<0.05,##P<0.01;N.常氧;H.缺氧
2.5 ELISA检测转染Keap1 shRNA对缺氧肝细胞COL3A1分泌的影响转染Keap1 shRNA后,Keap1 shRNA组肝细胞COL3A1的分泌较对照组降低(1.14±0.10vs1.89±0.14)(P=0.002,图3),并且缺氧能增强肝细胞COL3A1的分泌。

图3 Keap1 shRNA转染肝细胞后缺氧处理,通过ELISA测定上清中COL3A1的表达:与缺氧shNC相比,**P<0.01;与常氧shNC组相比,##P<0.01
2.6 WST-1检测缺氧肝细胞的活性在不同缺氧时间点,与Keap1 shNC组相比,Keap1 shRNA组细胞活性上升(6 h: Keap1 shRNA 1.18±0.16vsKeap1 shNC 0.96±0.13;12 h:Keap1 shRNA 1.05±0.14vsKeap1 shNC 0.77±0.10,P=0.048;24 h: Keap1 shRNA 0.90±0.12vsKeap1 shNC 0.66±0.09,P=0.045;48 h: Keap1 shRNA 0.61±0.08vsKeap1 shNC 0.43±0.06,P=0.032,图4)。

图4 Keap1 shRNA转染肝细胞后,WST-1法检测缺氧处理不同时间细胞的活性:与同一时间点的shNC组相比,*P<0.05
2.7 缺氧肝细胞能量代谢检测缺氧导致无氧糖酵解相关酶PK活性和ATP含量下降,而与对照组相比,Keap1 shRNA转染后的缺氧肝细胞PK活性(Keap1 shRNA 307.30±43.27vsKeap1 shNC 214.23±36.02)(P=0.045)以及ATP含量均提高(Keap1 shRNA 0.45±0.06vsKeap1 shNC 0.31±0.04)(P=0.041,图5)。
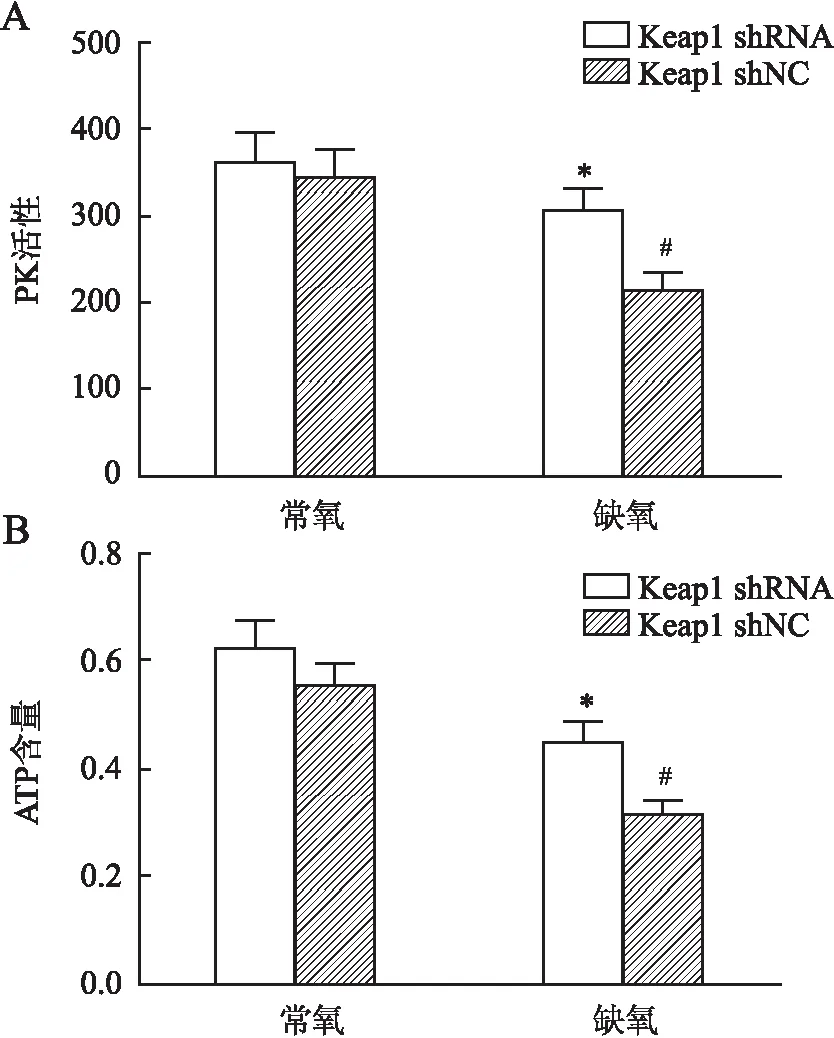
图5 Keap1 shRNA转染肝细胞后,缺氧处理PK活性(A)及ATP的含量(B):与缺氧shNC组相比,*P<0.05;与常氧shNC组相比,#P<0.05
3 讨论
肝纤维化是一个多种因素引起慢性肝损伤的修复过程。近年,缺氧及缺氧引起的氧化应激与肝纤维化的关系日益受到关注,抑制氧化应激导致的肝损伤已成为防治肝纤维化的新策略。Keap1作为细胞内的氧化应激感受器,抑制Keap1表达可提高细胞对氧化应激损伤的耐受力,有文献报道Keap1基因敲除的小鼠通过增强Nrf2的表达,使肝脏免于氧化应激损伤[5],因此Keap1基因是应对氧化应激的潜在靶点。
以往对肝纤维化的防治研究主要聚焦于肝星状细胞,由于其在肝内细胞群体中占比较小,又处于基质包绕的微环境中,药物吸收困难,故治疗效果并不理想;而肝细胞最易受到氧化应激的损伤[6]。因此,本实验选择肝细胞作为主要的研究靶点。
RNA干扰(RNA interference, RNAi)已广泛应用于生物学的各个领域,与siRNA相比,shRNA干扰效果稳定且持久。本实验根据Keap1基因构建shRNA干扰载体,转染肝细胞,取得较好的干扰效果,并筛选Keap1 shRNA-1781为最佳干扰序列。
Nrf2作为细胞内重要的转录因子,在防治肝纤维化中起重要作用[7]。Xu等[8]报道敲除Nrf2基因的小鼠能够加重CCl4导致的肝纤维化损伤。另一项研究表明金丝桃苷[9]通过上调Nrf2,增强下游一些抗氧化基因的表达,减轻CCl4导致的肝纤维化损伤。最近研究报道扶正化瘀胶囊通过激活Nrf2-Keap1-Are信号通路实现抗肝纤维化[10],表明Nrf2是肝纤维化治疗的潜在靶点[11-13]。本组研究显示Keap1基因下调后,Nrf2表达上升。
在肝纤维化中以Ⅰ和Ⅲ型胶原为主的细胞外基质过度沉积,是导致肝纤维化发生的重要原因。肝细胞单独合成胶原的能力虽然是肝星状细胞的一半,然而在肝内细胞中,肝细胞的数目约是肝星状细胞的20倍,一旦肝细胞合成胶原的数量有所增加,将会导致大量的胶原合成。据文献报道,在CCl4诱导的肝纤维化模型中,大部分的胶原都是由肝细胞合成的[14]。同时损伤肝细胞合成的胶原也促进肝星状细胞的激活,进一步加重肝纤维化。本组结果显示Keap1 shRNA能较好地抑制缺氧肝细胞Ⅲ型胶原的合成和分泌。TGF-β1、VEGF和IGF-1参与肝纤维化的发生、发展,Keap1 shRNA作用于缺氧肝细胞后,Nrf2表达上调,进而抑制促纤维化因子TGF-β1、VEGF和IGF-1的表达,Oh等[15]的研究显示Nrf2激活能够通过抑制TGF-β1来抑制肝纤维化。
缺氧影响细胞的活性,然而转染Keap1 shRNA后肝细胞对缺氧微环境产生一定的耐受力,使肝细胞活性上升。有研究报道[16]Nrf2缺失或Keap1基因敲除能够降低肝细胞活性。另外,研究发现Nrf2通过上调糖酵解关键基因调控乳腺癌细胞中的代谢重编程。本实验显示Keap1下调能够加强无氧酵解关键酶PK的活性,提高缺氧肝细胞的ATP水平,进一步证实干扰Keap1后,可能通过增强Nrf2表达产生抗缺氧效应,从而缓解缺氧肝细胞的能量代谢障碍。然而,与缺氧耐受有关的许多基因都受缺氧诱导因子-1调节,其中包括促红细胞生成素和无氧糖酵解相关的酶等。Keap1是否通过影响缺氧诱导因子的表达调节缺氧耐受,还有待进一步探讨。
总之,本实验成功构建Keap1 shRNA稳转染肝细胞株,Keap1下调后能够降低促纤维化因子的表达,提升缺氧条件下的肝细胞能量代谢。然而,肝纤维化发生机制复杂多样,本课题组后续将进一步观察Keap1-Nrf2信号通路在肝纤维化中的调控作用,为预防和治疗肝纤维化提供新的思路和途径。
——一道江苏高考题的奥秘解读和拓展

