ER弱阳性HER-2阴性乳腺癌的临床病理特点及预后分析
严珊珊,王永南,唐 璜,郭玉娟
临床医师常将免疫组化检查ER阳性肿瘤细胞>10%为ER阳性乳腺癌,作为内分泌治疗的适应症[1]。2010年ASCO/CAP将ER阳性乳腺癌判断标准改为ER阳性肿瘤细胞≥1%,2020年ASCO/CAP将ER阳性肿瘤细胞1%~10%称为ER弱阳性乳腺癌[2]。ER阳性判断标准的改变是将ER弱阳性乳腺癌纳入内分泌治疗的适应症,然而有一些研究结果显示此类患者对内分泌治疗无效[3]。因此,本文着重探讨ER弱阳性HER-2阴性乳腺癌患者的临床病理特征和预后,从而为患者治疗方案的制定提供参考。
1 材料与方法
1.1 临床资料收集2013年1月~2019年12月广东省妇幼保健院收治的乳腺癌病例,患者均为女性。纳入标准:(1)均经病理诊断为浸润性乳腺癌,有完善的ER、PR及HER-2免疫组化检测,且HER-2阴性;(2)未行新辅助治疗;(3)已行手术治疗,且临床分期为cT1-3N0-1M0。排除标准:(1)未按治疗规范完成术后辅助化疗、放疗等治疗;(2)既往患有乳腺癌或其它部位恶性肿瘤;(3)妊娠期乳腺癌和双侧乳腺癌。合计纳入1 444例符合标准的乳腺癌,患者年龄21~89岁,中位年龄47岁。所有患者术后均按规范治疗后,辅以放、化疗等。
1.2 试剂ER、PR及HER-2抗体及通用型二抗,均购自Roche公司。FISH探针由北京金菩嘉公司提供。
1.3 免疫组化检测ER和PR的表达标本常规取材,置于10%中性福尔马林固定,石蜡包埋,4 μm厚切片。免疫组化检测采用标准化的全自动染色方法(Ventana系统),每张切片均设有阳性及阴性对照。每张切片均由两名高年资病理医师采用双盲法判读。ER、PR结果判读参考相关指南[4]。ER和PR阳性为整张切片中≥1%的肿瘤细胞核着色,阴性为<1%的肿瘤细胞核着色,当ER肿瘤细胞核着色1%~10%时定义为ER弱阳性。
1.4 免疫组化及FISH检测HER-2的表达HER-2免疫组化检测方法同上,判读标准参考相关文献[5-7],其中HER-2 3+为阳性,1+/0为阴性,而2+则行FISH检测。FISH检测若基因拷贝数扩增则为阳性,反之为阴性。
1.5 随访采取门诊复查或电话随访,末次随访时间为2021年5月1日,随访率100%。
1.6 统计学分析采用SPSS 26.0软件进行统计学分析。应用χ2检验比较临床病理特征及治疗方式的差异,用Kaplan-Meier生存曲线进行单因素生存分析,Log-rank检验分析生存曲线的差异,用Cox回归模型进行多因素生存分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组乳腺癌的临床病理特征乳腺癌分组:ER弱阳性HER-2阴性乳腺癌172例,三阴型乳腺癌(triple negative breast cancer, TNBC)138例,ER>10%且HER-2阴性乳腺癌1 134例。三组乳腺癌患者在年龄、是否绝经、肿瘤直径及腋窝淋巴结转移状态等的差异,均无统计学意义(P>0.05);而组织学分级差异有统计学意义(χ2=140.933,P<0.01),但ER弱阳性HER-2阴性组和TNBC组的组织学分级差异无统计学意义(χ2=2.983,P=0.084,表1)。
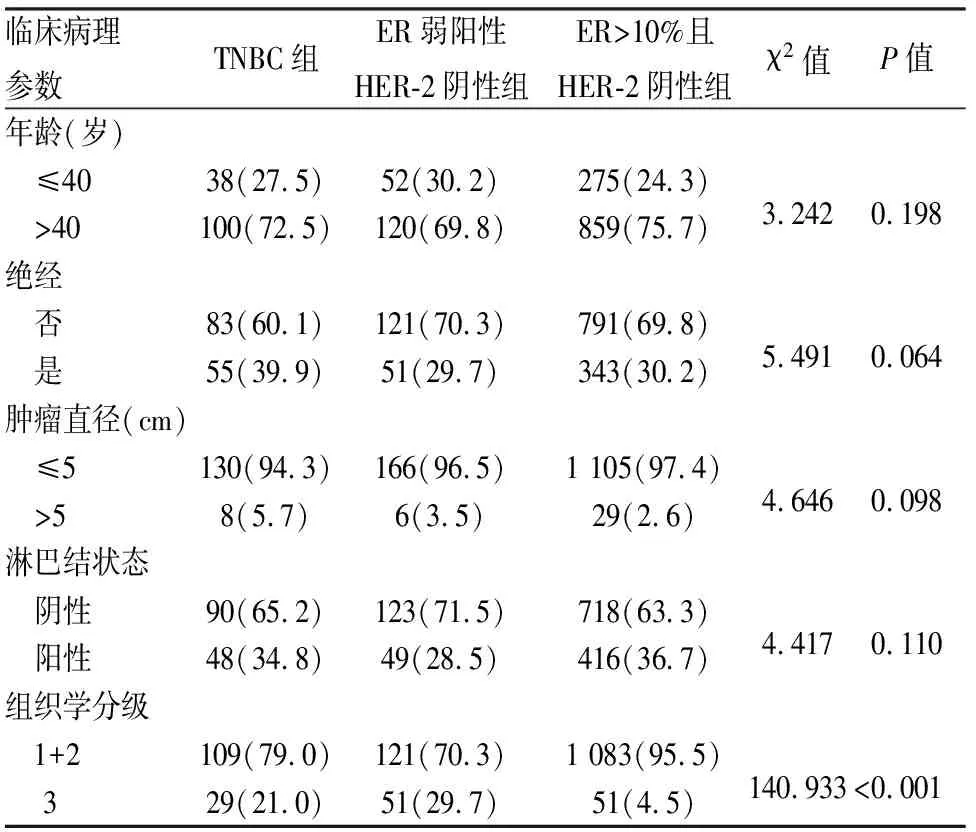
表1 各组乳腺癌的临床病理特征[n(%)]
2.2 各组乳腺癌的治疗特征三组乳腺癌患者在手术方式和放疗差异无统计学意义(P>0.05),而在是否化疗、化疗方案以及内分泌治疗差异有统计学意义(P<0.05)。ER弱阳性HER-2阴性组和TNBC组在是否辅助化疗(χ2=3.091,P=0.079)及辅助化疗方案(χ2=2.855,P=0.240)差异无统计学意义。ER弱阳性HER-2阴性组接受内分泌治疗的比例高于TNBC组(χ2=26.649,P<0.001),低于ER>10%且HER-2阴性组(χ2=1 050.420,P<0.001,表2)。
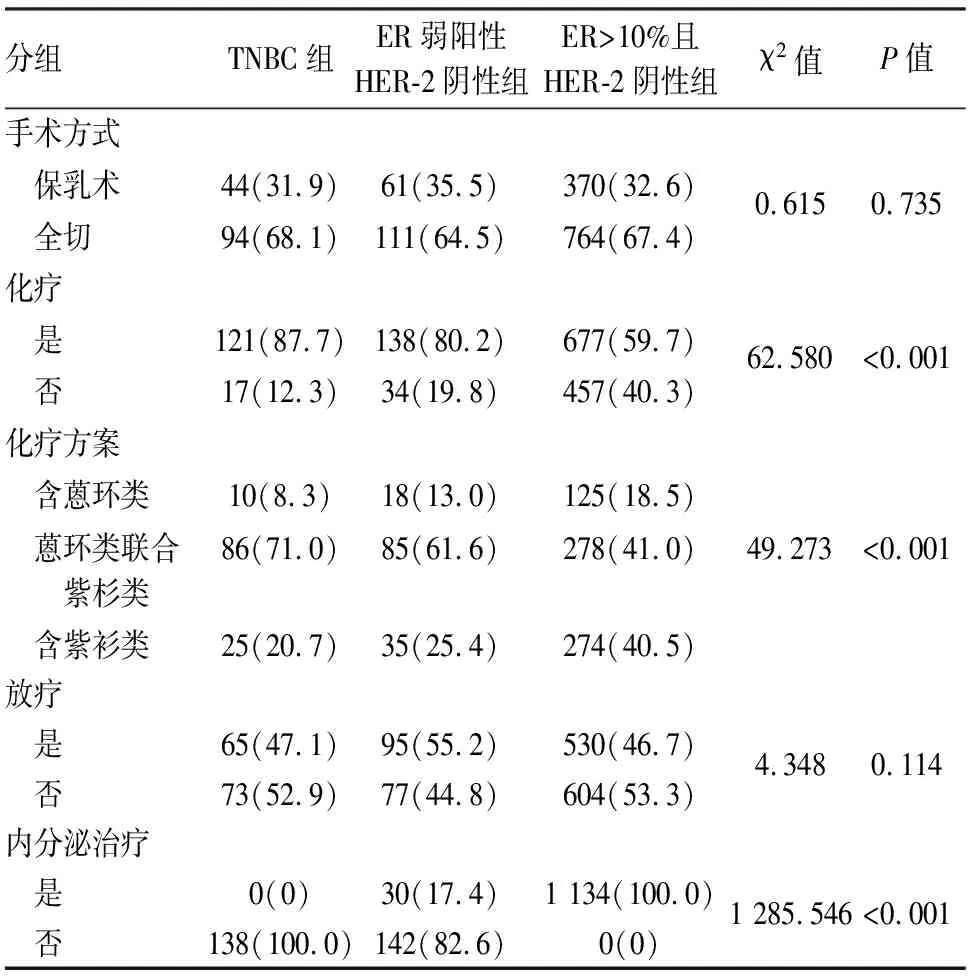
表2 各组乳腺癌的治疗特征[n(%)]
2.3 各组乳腺癌患者的预后本组1 444例乳腺癌患者随访时间12~96个月,中位随访时间52个月,无瘤生存率(disease-free survival, DFS)为94.9%,总生存率(overall survival, OS)为99.3%。其中TNBC组DFS为92.0%,OS为98.6%;ER弱阳性HER-2阴性组DFS为90.7%,OS为97.7%;ER>10%且HER-2阴性组DFS为95.9%,OS为99.6%。三组间的DFS(χ2=8.525,P=0.014)和OS(χ2=8.838,P=0.015)差异有统计学意义(图1),ER>10%且HER-2阴性组患者的预后最好;而ER弱阳性HER-2阴性组和TNBC组间的DFS(χ2=0.200,P=0.655)及OS(χ2=0.481,P=0.483)差异无统计学意义。ER弱阳性HER-2阴性组有16例复发转移,4例患者死亡;TNBC组有11例复发转移,2例患者死亡;ER>10%且HER-2阴性组有47例复发转移,4例患者死亡。
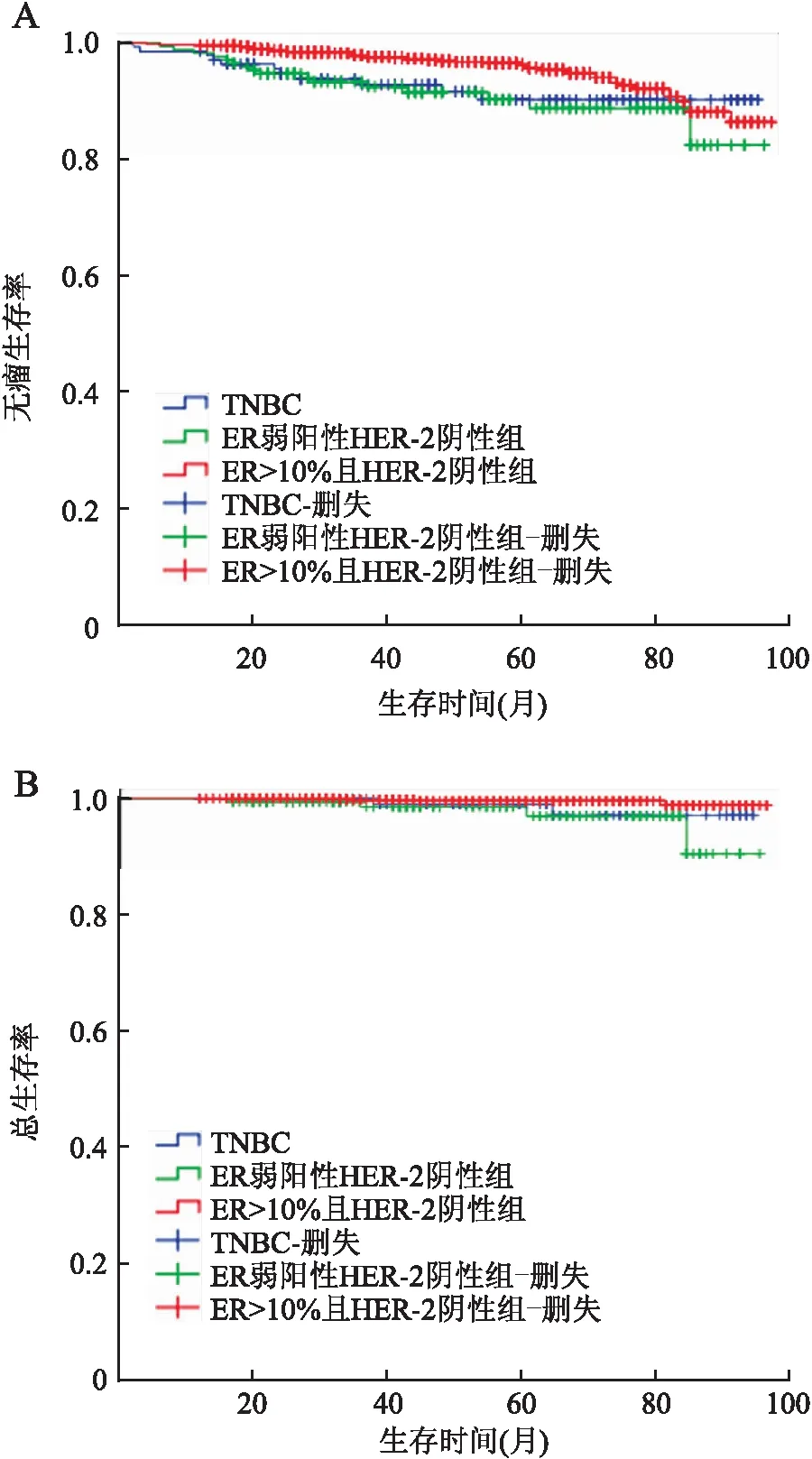
图1 Kaplan-Meier生存曲线比较ER弱阳性HER-2阴性组、TNBC组以及ER>10%且HER-2阴性组的DFS(A)和OS(B)的差异
2.4 ER弱阳性HER-2阴性乳腺癌的预后相关因素分析单因素生存分析发现:ER弱阳性HER-2阴性乳腺癌患者的预后与年龄、是否绝经、肿瘤直径、腋窝淋巴结状态、组织学分级、手术方式、化疗、化疗方案、放疗及内分泌治疗均无明显相关性(P>0.05,表3)。进一步将这些因素纳入多因素生存分析发现:上述参数均不能作为其预后的独立影响因素(P>0.05,表4)。
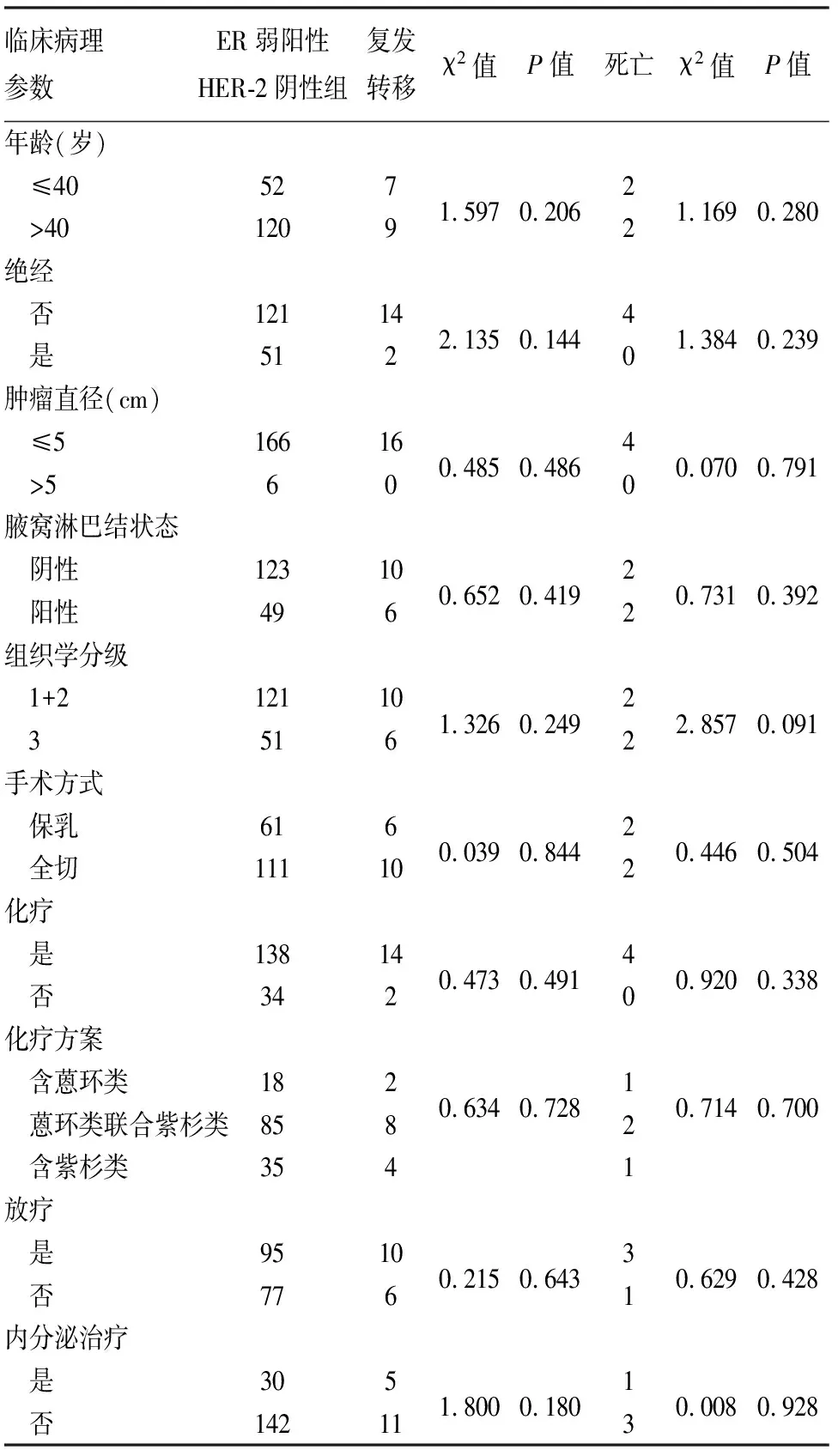
表3 ER弱阳性HER-2阴性乳腺癌患者预后的单因素分析
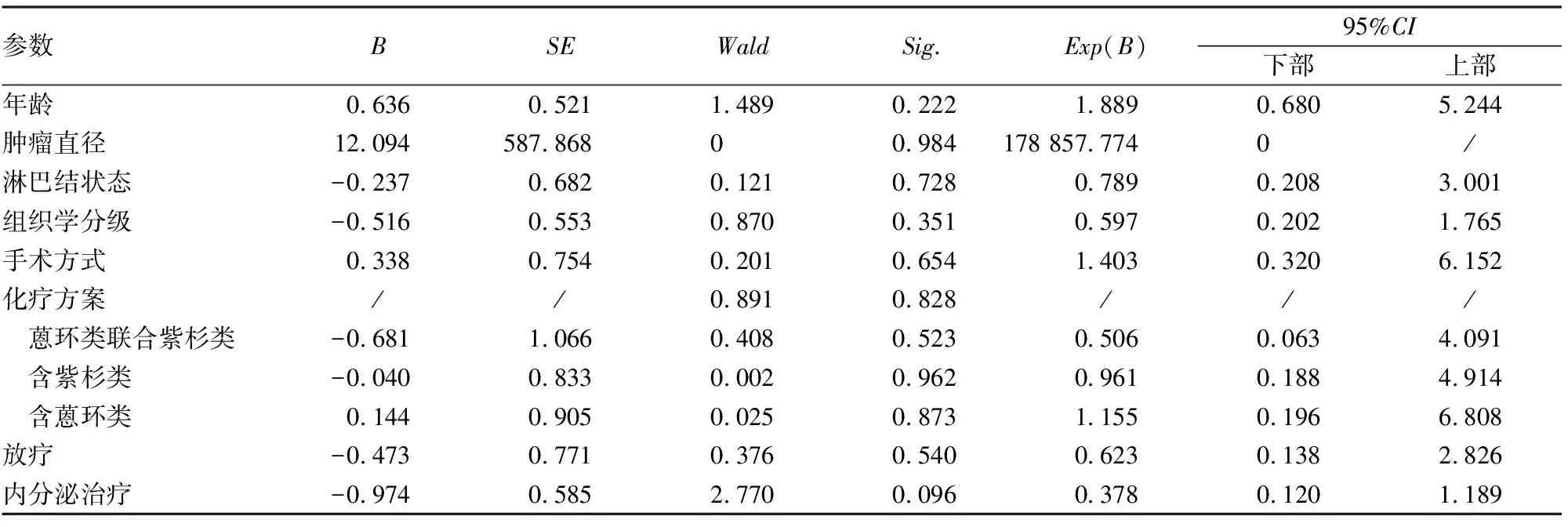
表4 ER弱阳性HER-2阴性乳腺癌患者预后的多因素分析
3 讨论
2010年ASCO/CAP将ER≥1%判读为阳性,接受内分泌治疗的乳腺癌患者相比之前增加约2%。有研究显示ER弱阳性HER-2阴性乳腺癌患者即使接受了内分泌治疗,其预后仍与TNBC相似,未能从内分泌治疗中获益[8]。然而,仍有一些研究表明ER弱阳性乳腺癌可能从辅助内分泌治疗中获益[9-10]。因此,ER弱阳性乳腺癌是否需行内分泌治疗仍存在争议。
2010年以前,临床上大部分以免疫组化ER≤10%判读为ER阴性,当免疫组化ER和PR均≤10%且HER-2阴性时,通常会将其归为TNBC。与其它乳腺癌亚型相比,TNBC易发生复发和远处转移,是最难治疗、预后最差、病死率最高的乳腺癌,早期TNBC治疗的主要手段是手术、放疗和化疗。一些研究表明,ER弱阳性乳腺癌与ER阴性乳腺癌有相似的临床病理特征[11-12]。本实验也发现ER弱阳性HER-2阴性乳腺癌与TNBC在患者年龄、肿瘤大小、腋窝淋巴结转移状态、组织学分级等临床病理特征无明显差异,并且两者在预后也类似,而ER>10%且HER-2阴性患者的组织学分级及预后,优于ER弱阳性HER-2阴性患者,提示ER弱阳性,HER-2阴性乳腺癌与TNBC在临床病理特征及预后有相似性。有学者曾通过基因表达模型将48%的ER弱阳性乳腺癌归为ER阴性组,DNA甲基化研究进一步证明ER弱阳性HER-2阴性乳腺癌与TNBC具有高度相似的DNA甲基化模式[13-14]。甚至一些研究指出,ER弱阳性HER-2阴性乳腺癌和TNBC具有相似的遗传性特征[15]。上述研究从临床病理特点、预后、基因表达以及遗传学等均证实ER弱阳性HER-2阴性乳腺癌与TNBC具有相似的特征。在局部治疗方面(如手术方式、放疗),TNBC和ER弱阳性HER-2阴性乳腺癌患者无明显差异。在全身系统治疗方面,TNBC和ER弱阳性HER-2阴性患者组接受的化疗方案相似。Fujii等[16]将3 055例Ⅱ期或Ⅲ期HER-2阴性原发性乳腺癌患者纳入新辅助化疗研究,发现ER弱阳性HER-2阴性乳腺癌患者在病理完全缓解和预后与TNBC类似,并建议将此类乳腺癌归入TNBC可能更具有临床意义。Oncotype Dx复发评分(RS)通常用于指导早期ER阳性乳腺癌辅助治疗的决策,ER弱阳性乳腺癌经Oncotype Dx检测后其复发风险与ER阴性乳腺癌类似,有研究显示此类患者在内分泌治疗中获益较小[17-19]。本组ER弱阳性HER-2阴性乳腺癌有少部分患者(17.4%)接受了内分泌治疗,但内分泌治疗未能改善其预后,也可能与本组接受内分泌治疗的ER弱阳性HER-2阴性乳腺癌病例数较少有关。尽管近期一些研究显示ER弱阳性乳腺癌可能从内分泌治疗中获益,但在2021年圣加仑共识中,仍无明确的建议推荐内分泌治疗ER阳性的阈值[20-21]。
总之,ER弱阳性HER-2阴性乳腺癌的临床病理特点与TNBC无明显差异,两者化疗方案类似,尽管该类型患者接受内分泌治疗的比例比TNBC高,但预后仍与TNBC相似,预后低于ER>10%且HER-2阴性乳腺癌。目前,内分泌治疗在ER弱阳性乳腺癌中的应用还需要进一步分析。

